1、病例资料:患者男性,50岁。患者1个月余前无明显诱因出现乏力、纳差,伴间断畏寒、怕冷,大便不成形,约2-3次/天,伴粘液,无脓血,偶咳嗽,患者未重视,未积极治疗。后患者感乏力、纳差进行性加重,仍有畏寒、寒战,遂来就诊。查体:消瘦,贫血貌,神志清楚,精神差。左颈部可扪及多个肿大淋巴结。胸部CT提示:双侧锁骨上窝、纵膈内及双侧腋窝内淋巴结增大增多,增强后呈均匀强化。临床考虑淋巴瘤,行左颈部淋巴结切除活检。
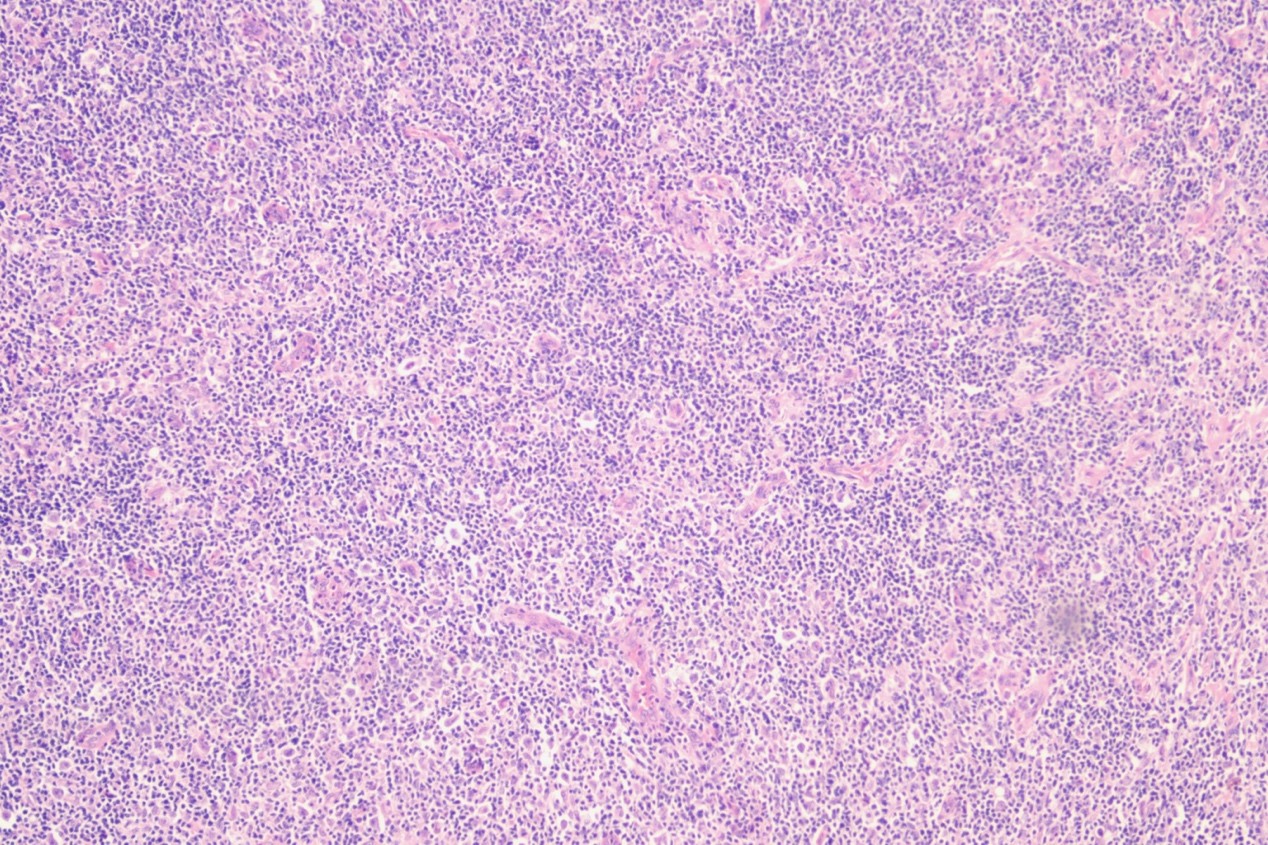
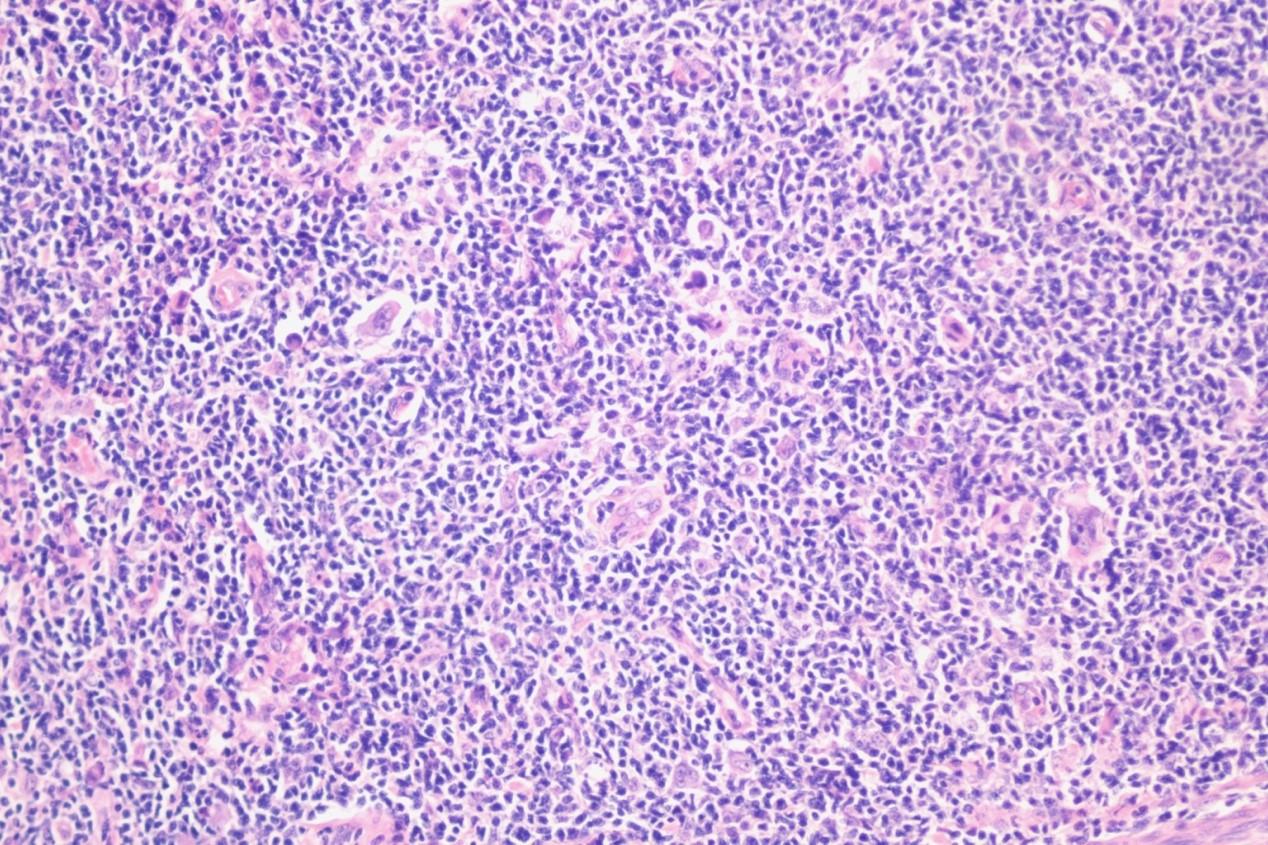
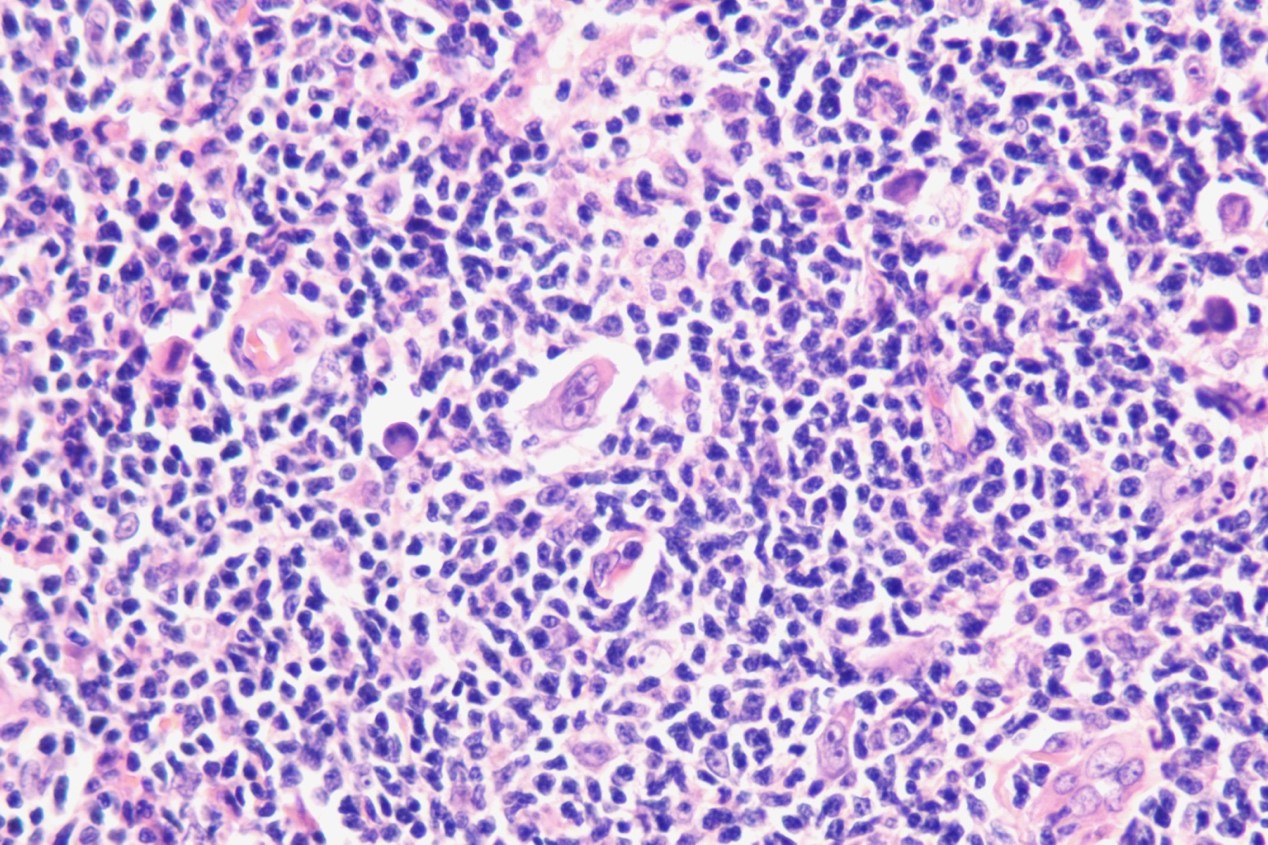
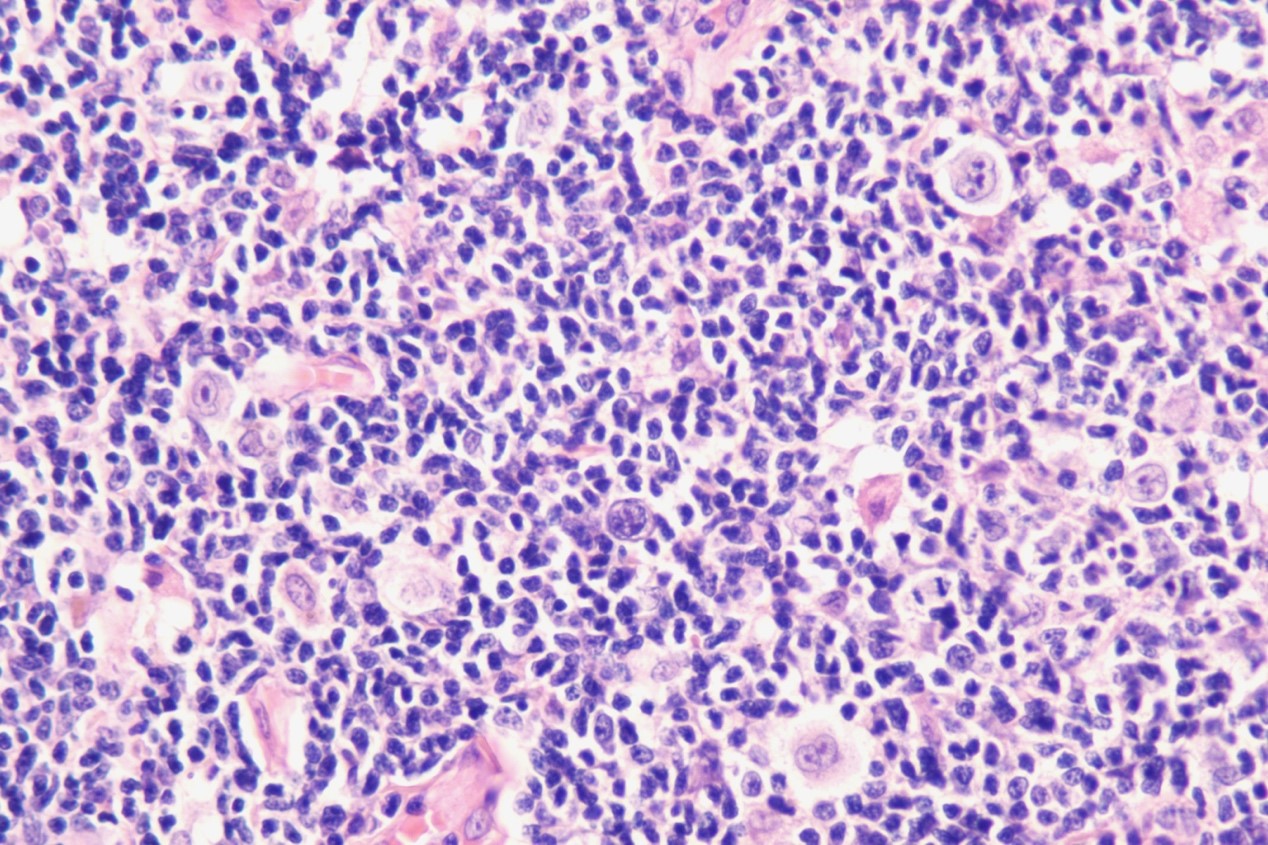
病理诊断:<左侧颈部淋巴结>富于淋巴细胞型经典型霍奇金淋巴瘤(LRCHL)。免疫组化: CD30、CD15、Mum-1、EBER阳性,PAX-5弱阳,Ki-67(+60%),CD20、CD3、CD5、Bcl-2、Bc1-6、CD10、TDT、Cyclin D1、C-myc、ALK、CD38、CD19、CD23均为阴性。
2、讨论:霍奇金淋巴瘤(HL)是儿童和成人患者中最容易治愈的癌症之一。原发疾病预后良好,估计5年生存率超过98%,然而,由于复发或难治性疾病和治疗方案的后期效应,长期总生存率仍然很低。目前美国癌症协会的统计报告显示,目前所有HL患者的5年相对生存率约为87%。
Thomas Hodgkin在1832年首次描述HL,特征是无痛性淋巴结肿大。1856年,Samuel Wilks注意到脾肿大也是常见症状。最后,Carl Sternberg和Dorothy Reed描述了独特的多核细胞,现在以他们的名字命名(Reed-Sternberg[RS]细胞)。他们推翻了传统观念,即霍奇金淋巴瘤仅仅是结核病的一种形式。
流行病学:HL有时被错误地归类为主要是成年恶性肿瘤。这可能部分是由于其双峰年龄分布,其中包括青少年和年轻人(15-35岁)的发病率高峰和老年人(55岁以上)的发病率高峰。平均诊断年龄39岁。HL在婴儿、幼儿和青春期前患者中非常罕见,但它仍然是15-19岁年龄组中最常见的儿童癌症。在美国,HL约占儿童癌症总数的7%,占儿童癌症死亡的1%。
风险因素和病因:HL没有明确的病因,但有许多危险因素可能使个体易患恶性肿瘤。例如,免疫缺陷、EB病毒和家族史。
临床表现和症状:无痛性淋巴结病是HL最常见的初始表现,约80%的儿科患者可见。HL伴发的淋巴结通常坚硬且呈橡胶状,最常见于颈椎、锁骨上和/或腋窝区域,偶尔也出现在腹股沟区域。除淋巴结病变外,近75%被诊断为HL的儿童还会出现纵隔肿块。纵隔肿块可以出现在任何年龄,但在12岁以上的儿童中更为常见。纵隔肿块患者可能伴有呼吸困难或吞咽困难。这些患者有快速呼吸衰竭和/或失代偿的风险,也有上腔静脉综合征的风险。
B症状也常见,包括疲劳、发热、盗汗、厌食和/或体重减轻(诊断前6个月内体重减轻≥10%)。
HL的病理生理学和分子生物学:HL是一种复杂的多因素淋巴源性恶性肿瘤,约占所有淋巴瘤诊断的15%,主要涉及B细胞(尽管1-2%的病例涉及T细胞)。这些淋巴细胞起源于淋巴结的生发中心,该疾病的特征是存在独特的、单核的霍奇金细胞和巨大的、多核的RS细胞(统称为HRS细胞),在广泛和复杂的炎症背景中很少见。虽然霍奇金细胞和RS细胞都是异常淋巴细胞,但它们的形态外观不同,并且都对HL具有高度特异性。RS细胞通过不完全的细胞分裂和再融合从霍奇金细胞不断发育而来。尽管HRS细胞是CHL的标志,其特征是不能表达B细胞特异性基因,尤其是免疫球蛋白(Ig)重链基因,因此不能产生抗体。多种机制(如EBV感染)激活抗凋亡核因子κB(NF-κB)转录因子信号通路,激活该通路可防止缺陷淋巴细胞凋亡,促进RS细胞增殖。
CHL的HRS细胞表现出不同类型造血细胞标记物的复杂共表达,包括B细胞转录因子PAX5的表达。遗传分析研究证实,HRS细胞是转化的B细胞,因为它们具有B细胞特有的Ig重链和轻链V基因重排,以及与生发中心(GC)经历的B细胞相关的体细胞突变。此外,IgV基因破坏性突变的检测表明HRS细胞来源于凋亡前的GCB细胞。值得注意的是,一小部分CHL病例可能归因于T细胞起源。HRS细胞表达CD30标记物,并表现出与正常CD30+ B细胞相似的关键特征,包括突变的IgV基因、类别转换和MYC的表达。虽然凋亡前GCB细胞向HRS细胞的转化过程尚不清楚,但逃避程序性细胞死亡似乎是一个至关重要的早期事件。有趣的是,突变削弱BCR表达的病例通常与EBV感染有关。此外,EBV感染的HRS细胞表现出较低的突变负荷,表明病毒基因表达替代了癌基因和抑癌基因突变,支持EBV在EBV+CHL中的致病作用。HRS细胞中B细胞程序的下调涉及多种因素,包括转录因子失调、免疫逃避和表观遗传沉默。值得注意的是,CHL缺乏明确的遗传病变,遗传改变的组合可能导致这种疾病的独特性。HRS细胞依赖于几种信号通路的异常组成活性,包括NF-κB、JAK/STAT和PI3K/AKT, NF-κB通路的高组成活性对HRS细胞存活至关重要。CHL病例中最常见的突变涉及这些信号通路的调节因子,包括NF-κB因子REL、TNFAIP3、SOCS1和STAT6。多种受体,如CD30和CD40,通过NF-κB传递促生存和促增殖信号,这表明它们可能参与HRS细胞信号传导。
HL的分类:WHO根据形态学和免疫组织化学特征将HL分为CHL和NLPHL两大类。虽然CHL的基本描述自上个世纪以来没有太大变化,但有关病因和发病机制的知识在过去几年中呈指数增长。生物学的见解使人们认识到灰色地带的范围不断扩大,从而导致诊断陷阱,这一直是病理学界讨论的主题。这些见解为重新定义CHL的边界铺平了道路,同时影响了其流行病学,因为以前诊断为CHL的病例现在可能被不同地分类。因此,以前报告的信息需要根据不断变化的诊断标准进行重新评估。此外,应该注意的是,仅根据形态学,HL可能是迄今为止最容易诊断的淋巴瘤类型,但同样容易误诊。
第三版WHO《造血和淋巴组织肿瘤分类》将结节性淋巴细胞为主型霍奇金淋巴瘤(NLPHL)定为是一种独立的临床病理实体。尽管CHL,尤其是LRCHL与NLPHL之间存在相似之处,但有大量临床病理、病因和发病机制方面的证据表明,NLPHL是一种不同于CHL的肿瘤。第五版WHO《造血和淋巴组织肿瘤分类》提出这些差异可能足以考虑将NLPHL从霍奇金淋巴瘤的母类别中移除,并将其归类为“成熟B细胞肿瘤”。然而,从短期来看,为了避免在临床实践、临床试验以及临床和流行病学研究方面的不必要混淆,最好继续使用原有的名称。新提出的名称在过渡期内被接受作为同义词使用,直到将来可以引入新的术语。
CHL是更常见的类型(占HL病例的90-95%),通常表现为急性、侵袭性疾病。恶性HRS细胞的存在是CHL的标志,肿瘤细胞表达CD15、CD30,不表达CD45。根据结构、细胞表面标记物、霍奇金细胞和RS细胞的百分比或密度以及背景炎症浸润的数量,将CHL进一步分为4个组织学亚型,包括结节硬化型HL(NSCHL)、混合细胞型HL(MCCHL)、淋巴细胞丰富型HL(LRCHL)和淋巴细胞消减型HL(LDCHL)。
LRCHL是少见的亚型,常见为外周淋巴结,纵隔很少受累。有两种生长模式:结节型和弥漫型。在结节型病例中,结节涵盖了大部分受累组织,使间质区受到挤压,无纤维化。结节由小B淋巴细胞组成,可能包含相对较小或退化的生发中心,通常位于中心外。HRS细胞主要位于结节内,但始终位于生发中心之外。一部分HRS细胞可能类似LP细胞。嗜酸性粒细胞和/或中性粒细胞在结节中不存在,如果存在,则位于间质区,数量较少。在弥漫型病例中,细胞背景中的小淋巴细胞可能与含有或不含上皮样特征的组织细胞混合。这种亚型很容易与NLPHL混淆。在过去,大约30%最初被诊断为NLPHL的病例后来被发现是LRCHL。在进行这种区分时,显示典型的经典HRS细胞免疫表型的证据是必不可少的。在极少数情况下,小淋巴细胞淋巴瘤可能会出现散在的典型的HRS细胞,与LRCHL相似。
鉴别诊断:(1)纵隔灰区淋巴瘤(MGZL):在第四版WHO《血液和淋巴组织肿瘤分类》中,引入了“纵隔灰色区域淋巴瘤”(MGZL)的术语,但未进行正式定义,该组淋巴瘤被认为是无法分类的,具有DLBCL和CHL之间的重叠特征。通过基因组学特征和临床病理学研究,人们阐明了CHL和原发纵隔B细胞淋巴瘤之间的连续生物学谱系,MGZL位于两者之间。这一概念现在为MGZL的定义、CHL的重新定义以及两者之间的边界提供了依据。然而,应该认识到,该谱系是一个连续的谱系,有许多灰色地带。定义标准不可避免地具有任意性,当新的、客观的证据出现时,可能会发生变化。当MGZL表现出CHL样形态时,在NSCHL和MGZL之间划出明确的界限是一项极具挑战性的工作。到目前为止,还没有一致且被普遍接受的MGZL诊断标准,这进一步增加了诊断的难度。在MGZL中,常见弥漫纤维性间质,肿瘤的不同区域表现出不一样的细胞形态,如有的区域类似于CHL,有的区域类似弥漫大B细胞淋巴瘤,坏死易见。通常表达CD20、PAX5、CD19、CD79a、OCT2和BOB1,CD30的表达是异质性的,通常不表达CD15,EBER阳性在纵隔中极为罕见。(2)原发纵隔大B细胞淋巴瘤(PMBL):极少数情况下PMBL形态学可呈多形性或RS细胞样表现,多见于青年人,PMBL免疫组织化学弥漫表达CD20、CD79a和LCA,且常同时阳性,而LRCHL中未见三者同时阳性,少数病例CD79a仅局部阳性或弱阳性。(3)免疫缺陷相关的B细胞淋巴组织增殖性疾病:极少数情况下,它可能与LRCHL形态相似,甚至有相同的免疫表型。所以,当肿瘤细胞EB病毒阳性时,临床免疫缺陷病史是这二者鉴别的关键。(4)外周T细胞淋巴瘤,非特指型:肿瘤细胞呈弥漫增生,常混有炎性背景细胞,有时可见很多HRS样细胞,且表达CD30,但肿瘤细胞大小呈一谱系,同时表达CD3等T细胞抗原,一般不表达CD15,PAX-5阴性,分子检测有克隆性TCR基因重组。(5)传染性单核细胞增多症:好发于15-25岁,淋巴结结构部分消失,常有坏死,可见残留反应性滤泡,增生的副皮质区或滤泡间区由大小不等的反应性细胞组成,常有浆细胞分化,有时可见大量免疫母细胞,或有局部散在HRS样细胞。HRS样细胞可弱表达CD30,但CD15阴性。EBER检测可见大量阳性细胞,多为小细胞或大小不等细胞,血清学检测可证实新近EBV感染。
病例图片:
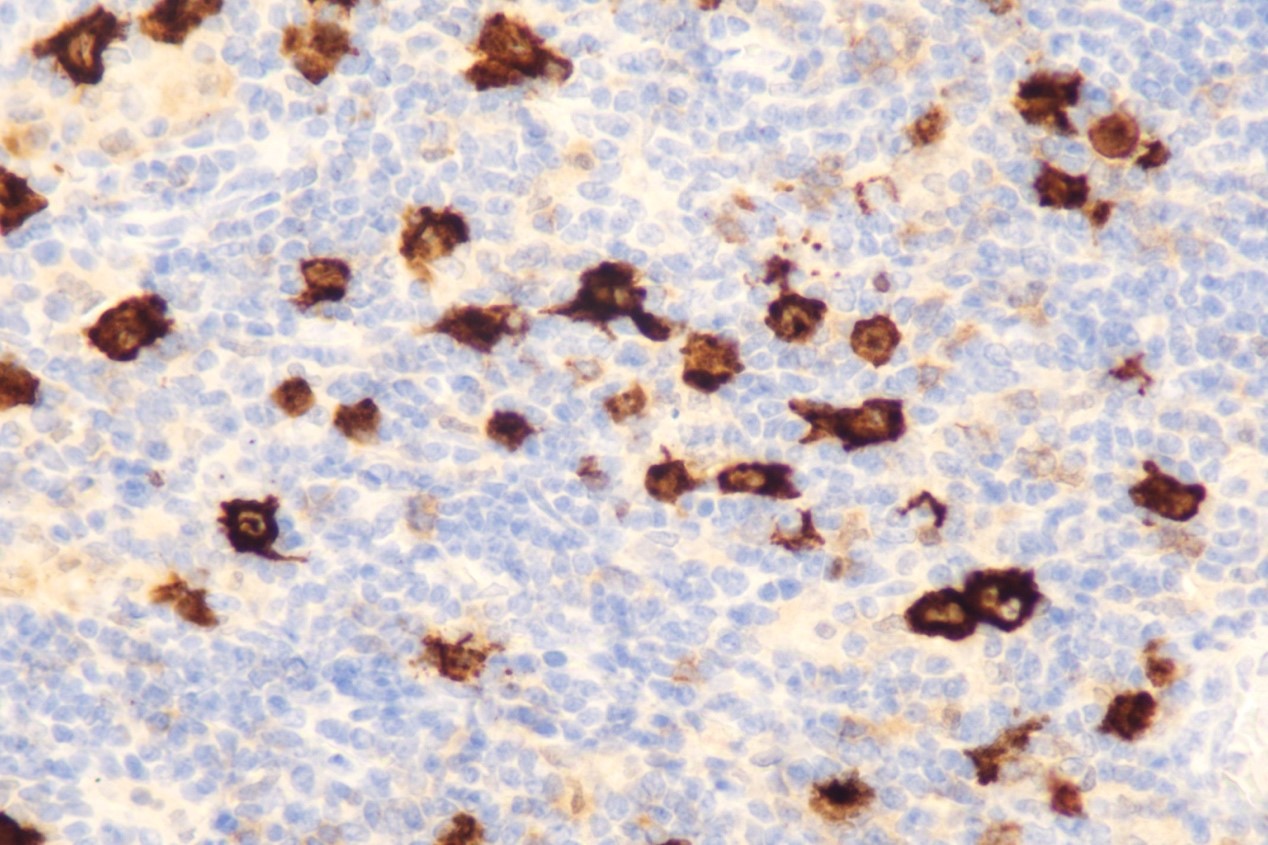 免疫组化:CD30(+)
免疫组化:CD30(+)
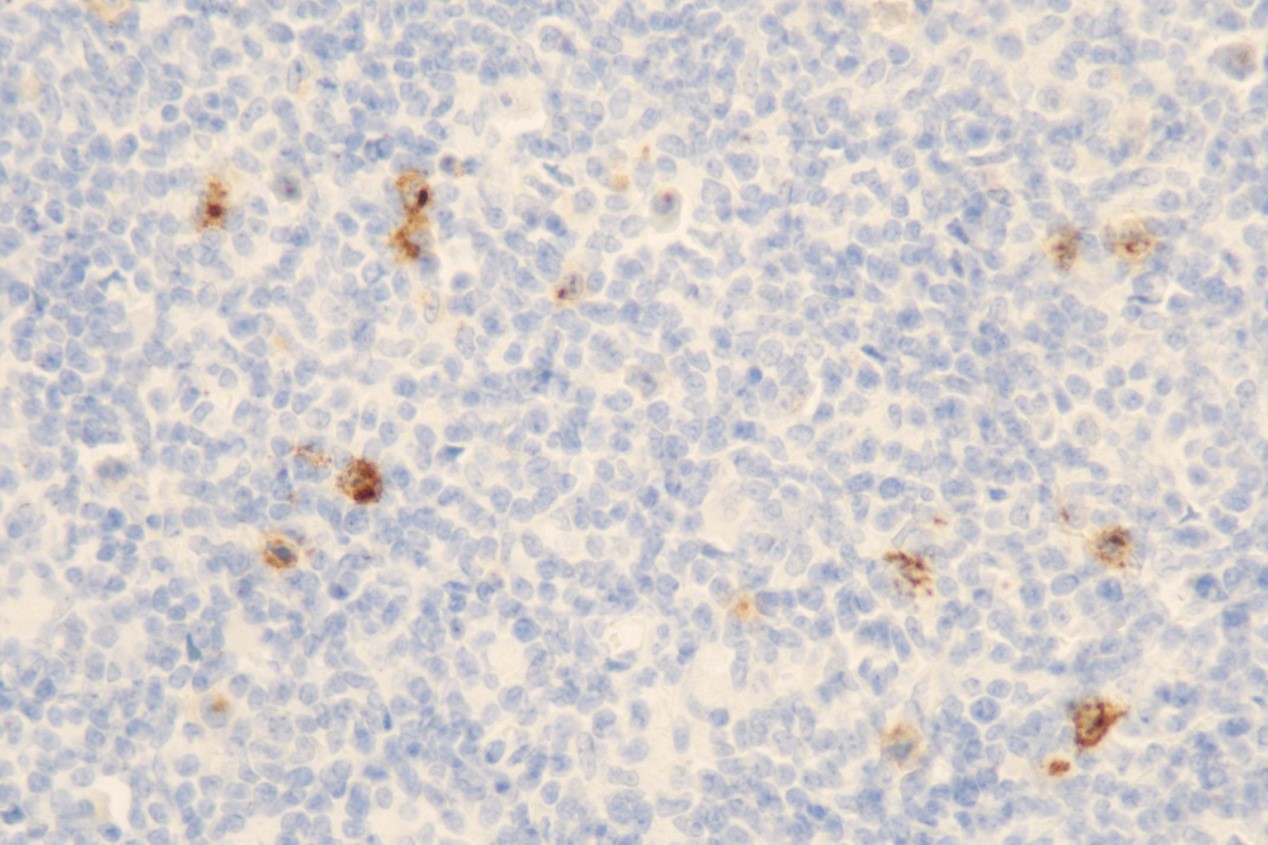 免疫组化:CD15(灶+)
免疫组化:CD15(灶+)
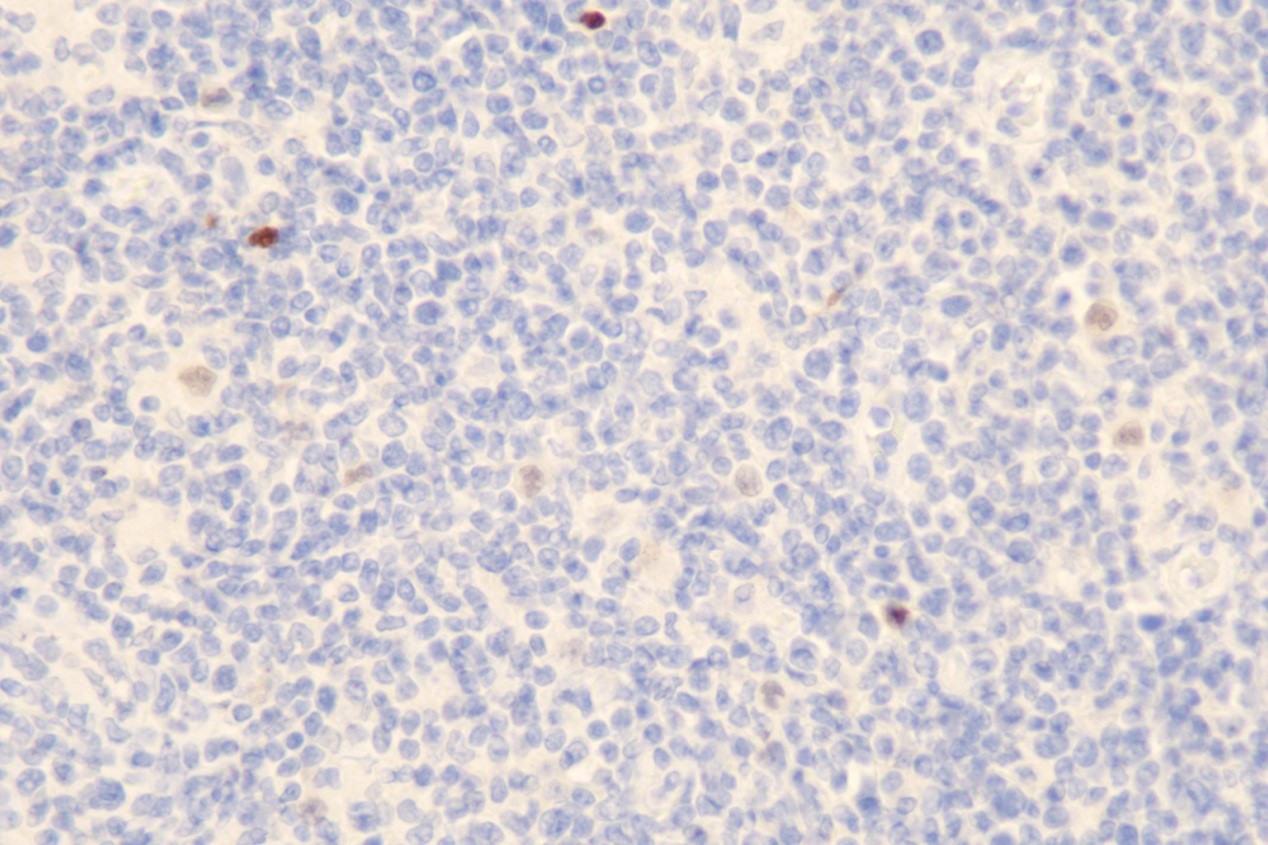 免疫组化:PAX-5(弱+)
免疫组化:PAX-5(弱+)
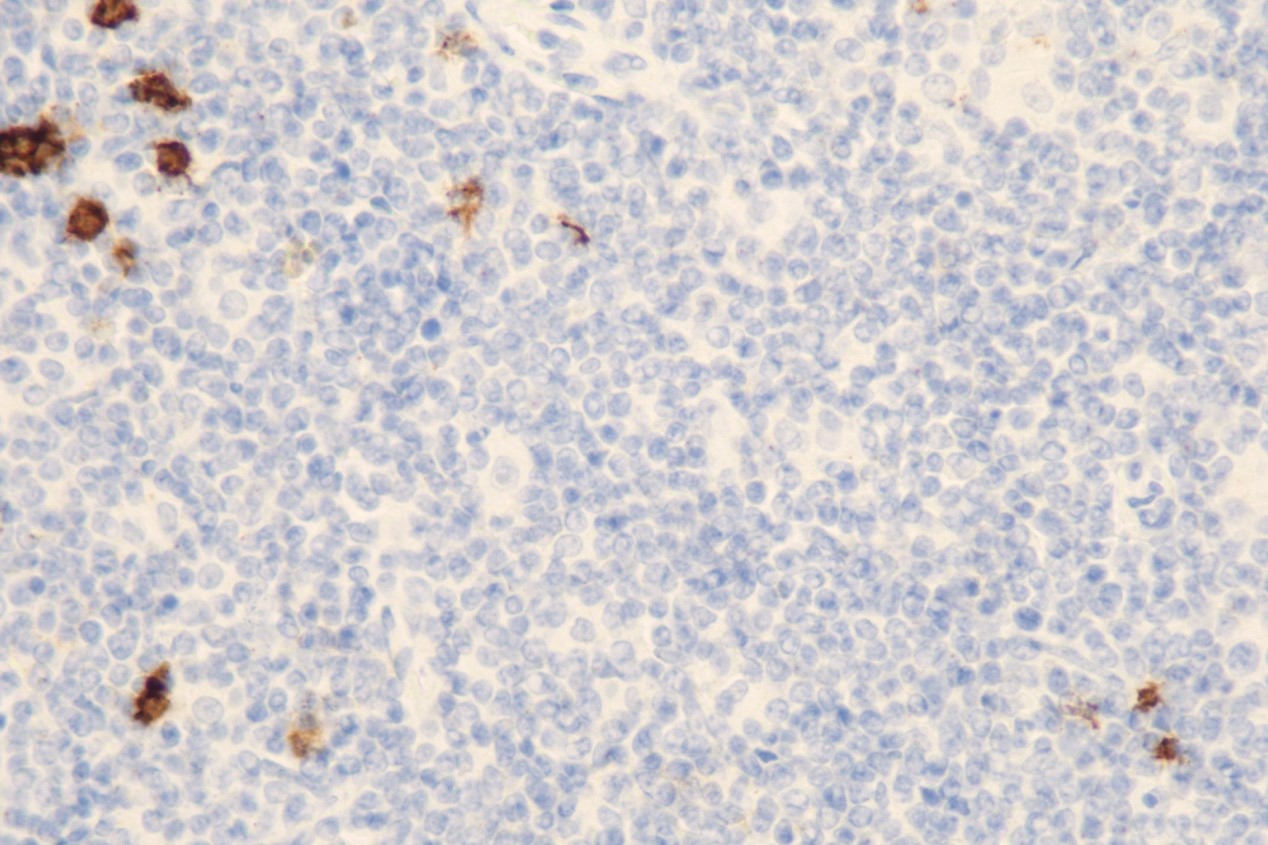 免疫组化:CD20(-)
免疫组化:CD20(-)





















共0条评论