[导读] 编译整理:强子
简介
任何部位体腔的过量液体积聚(积液)都是病理性的;其中约15%是恶性肿瘤所致。原发与继发肿瘤都可以导致体腔积液:前者如间皮瘤、原发性渗出性淋巴瘤;后者更为常见,可以是肿瘤直接侵犯而累及浆膜层,也可以是远处转移至浆膜腔。出现恶性积液一般意味着恶性肿瘤患者预后欠佳,此时的平均生存时间一般以周或月计算。因此,体腔积液细胞学检查的主要目的,就是排除恶性肿瘤。
浆膜腔积液细胞学标本一旦确诊为恶性之后,下一步就是确定原发肿瘤的部位。尽管这种情况下预后差,但确定原发部位还是有重要临床意义,比如淋巴瘤和转移性乳腺癌、卵巢癌、小细胞肺癌所致的恶性积液可能对相应的化疗或内分泌治疗有效,而间皮瘤、非小细胞肺癌、某些肉瘤所致者可能疗效差,需要采取姑息性措施,如胸膜黏连术、胸腹腔分流术。
美国密歇根大学病理专家Pantanowitz为通讯作者的几位病理医师曾在《Cytojournal》杂志发表文章,详尽介绍了确定恶性浆膜腔积液原发灶的相关知识点。为帮助大家更好的掌握并应用于临床实践,我们将该文要点编译介绍如下。
密切结合临床
大部分情况下,体腔积液内发现恶性细胞的患者会有恶性肿瘤病史。肿瘤转移灶和原发灶之间常存在相似性,因此一般将原发灶与体腔积液中肿瘤细胞的形态学进行比较分析就可以确定后者的来源。此时细胞病理医师的责任就是确定所看到的浆膜腔积液细胞学标本中恶性细胞的形态是否和原发肿瘤有相关性。
如果可能的话,应复阅此前的手术标本和/或细胞学标本,这对相应的判读有极大帮助。不过,一定要注意的是转移性肿瘤和原发肿瘤可能存在不同,这主要是因为:(1)肿瘤细胞(即使最初为梭形)出现在体液中时,会有变圆的倾向,因此可能表现为上皮样;(2)转移性肿瘤可能更具侵袭性,因此可能分化更差、和/或肿瘤分级有变化;(3)免疫表型也可能会有改变,一般是由于部分生物学标记表达缺失所致。
如果未能获取此前的恶性肿瘤病史,则确定原发肿瘤的部位可能很有难度。此外,少部分患者可能会以恶性积液为潜在恶性肿瘤的首发表现。患者的性别及年龄,积液的部位(比如膈肌上、还是膈肌下),实验室检查的结果(如肿瘤标记物),有时这些内容都有助于缩小考虑的范围。比如,老年女性患者以恶性腹水为肿瘤首发表现时,需要放在第一位考虑的就是卵巢的浆液性乳头状癌,尤其血清CA-125水平升高的情况下。如果男性成人患者以恶性腹水为首发表现,则要考虑胃肠道来源的肿瘤。对于恶性胸腔积液来说,如果是男性成人患者的首发表现,则原发肿瘤可能性最大的是肺癌;如果是女性成人患者,则最常见是乳腺癌的转移。需要注意的是,乳腺导管癌一般转移形成胸腔积液,而乳腺小叶癌更多见表现为腹腔积液。
恶性积液在儿童并不常见。有文献对103例儿童不同部位体腔积液进行分析,发现恶性几率为14%。儿童的恶性体腔积液大部分是淋巴瘤和白血病导致的,其次是儿童的所谓小圆形蓝染细胞肿瘤,具体如神经母细胞瘤、Wilms瘤、横纹肌肉瘤。儿童及年轻人中,生殖细胞肿瘤、转移性骨肉瘤、髓母细胞瘤也可导致恶性积液。
辅助检查
已有多种辅助检查手段可用于体腔积液细胞学标本的评估,具体如细胞化学、电镜检查、免疫细胞化学、流式细胞学、FISH、分子检测。目前,电镜很少用于积液的细胞型检查。细胞块技术不仅可以在涂片基础上作为补充来检出恶性病变,还可为免疫组化检测及其他辅助检测提供重要机会。这些检查在证实为恶性方面很有意义,尤其有助于间皮瘤和转移性腺癌的鉴别;也有助于确定恶性肿瘤可能的原发部位。
细胞化学价格相对低廉、且易于操作,如果应用得当,可以对肿瘤的进一步分类提供很有价值的信息。比如,黑色素瘤的胞质内黑素颗粒可以通过Fonatna-Masson染色证实。此外,证实有黏液产生,则倾向于腺癌。
免疫组化是体液细胞学中最常用的辅助检查。目前已有多项研究证实,应用一组指标进行免疫组化检测,在间皮瘤和转移性腺癌的鉴别中非常有价值:腺癌常用标记有MOC-31、claudin-4、CEA、B72.3、Ber-EP4,这些标记在腺癌中为程度不等的表达,因此有助于鉴别腺癌和间皮瘤的鉴别。胸膜腔积液腺癌与间皮细胞鉴别的情况下,Claudin-4要优于Ber-EP4和B72.3;但后面两个指标中,Ber-EP4的敏感性要优于B72.3。
需要注意的是,上述标记没有哪一项足以特异性的区分出恶性积液的来源;因此一般需要更加特异性的指标来对恶性积液做进一步分类。比如,前列腺癌的阳性标记有AR、NKX3.1、PSA、PSMA、PSAP;肺腺癌的阳性标记有TTF-1、Napsin-A、表面活性蛋白A;小细胞癌的阳性标记有Syn、CgA、CD56、TTF-1、INSM1、POUF2F3;乳腺癌的阳性标记有mammaglobin、GATA-3、GCDFP-15、TRPS1、ER;甲状腺乳头状癌的阳性标记有PAX-8、TTF-1、Tg;卵巢癌的阳性标记有PAX-8、CA-125、WT1、ER;肝细胞癌的阳性标记有CAM5.2、HepPar-1、arginase-1、TTF-1(胞质着色)、AFP、多克隆CEA;肾细胞癌的阳性标记有PAX-8、CA-9、RCC、CD10;结直肠癌的阳性标记有CK20、CDX2、SATB-2;黑色素瘤的阳性标记有S100、SOX19、Melan-A/Mart-1、HMB-45、酪氨酸酶、MiTF、PRAME;非霍奇金淋巴瘤的阳性标记有LCA(CD45)、B细胞标记、T细胞标记;间皮瘤的阳性标记有Calretinin、D2-40、WT1、CK5/6、GLUT-1、EMA、GATA3、IMP3、mesothelin。
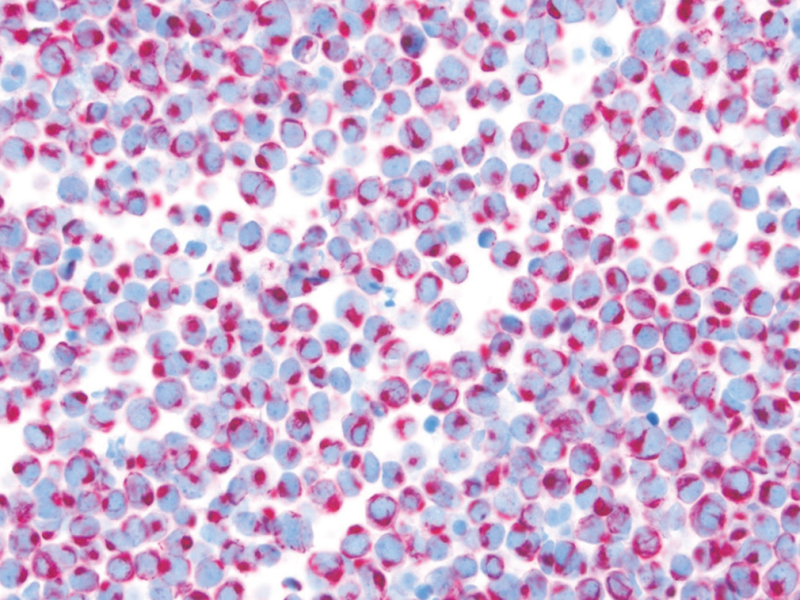
图1. 腹水中的Merkel细胞癌,形态为小细胞,CK20呈特征性的核旁逗点状着色。
由于某些CK表达的局限性,比如CK7和CK20在不同上皮及相应恶性肿瘤中表达不同,因此结合二者的表达情况可用于大致判断转移癌的原发灶。CK7和CK20的免疫组化结果组合具体有四种情况。
Ø CK7+/CK20-:多见于肺癌、乳腺癌、苗勒源性的癌(子宫内膜癌)、甲状腺癌、膀胱癌、上消化道的癌、卵巢(非黏液)癌;而不见于胰胆管的癌、间皮瘤、胸腺瘤;
Ø CK7-/CK20+:多见于结直肠癌、Merkel细胞癌;而不见于上消化道的癌;
Ø CK7+/CK20+:多见于尿路上皮癌、上消化道的癌、胰胆管的癌、卵巢(黏液)癌、直肠癌;仅偶见于肺(黏液)癌;
Ø CK7-/CK20-:多见于肝细胞癌、肾癌、前列腺癌、肾上腺皮质癌、鳞状细胞癌;而不见于神经内分泌癌、生殖细胞肿瘤。
当然,最后还要提醒大家的是,没有哪一项标记对具体某一瘤种绝对特异,有些肿瘤偶见对具体免疫组化标记出现异常表达模式。
未完待续
原文点此下载
参考文献
Jhala N, Arriola A, Pantanowitz L. Serous cavity metastasis: Evaluation of unknown primary. Cytojournal. 2022;19:16. Published 2022 Mar 19.
doi:10.25259/CMAS_02_11_2021














共0条评论