[导读] 编译:张波
摘要
甲基化类型“BCOR/BCOR(L1)融合的CNS肿瘤”是基于一系列21种神经上皮肿瘤的甲基化谱和tSNE分析后最近被定义的肿瘤,这些肿瘤主要存在BCOR融合和/或染色体22 q12. 31和染色体Xp 11. 4处的特征性CNV断点。这种肿瘤类型仍然缺乏明确的诊断标准,特别是BCOR/BCOR(L1)融合在这些肿瘤中尽管很常见,但并不是一个一致的发现,并且没有一种Heidelberger分类器版本能够清楚地识别这些病例,特别是具有BCOR、BCORL 1、EP 300和CREBBP以外的其他融合的肿瘤。在这项研究中,进行了包括7207个样本的6761例患者的文献综述和数据库中已发表的23篇中枢神经系统神经上皮肿瘤的分析研究,根据检索病例和文献中发现的35例病例,我们首次提出了甲基化类“BCOR/BCOR(L1)融合的CNS肿瘤”的典型组织学和分子特征。还介绍了4例成人弥漫性胶质瘤病例,包括GBM、IDH野生型和星形细胞瘤、IDH突变型与CREBBP融合,并描述具有BCOR/BCOR(L1)改变的CNS肿瘤的分子分析,以确保最终诊断的正确性。
前言
最近基于一系列21种神经上皮肿瘤的甲基化谱的研究,定义了甲基化类型“BCOR/BCOR(L1)融合的CNS肿瘤”,这些肿瘤主要存在BCOR融合和/或染色体22q12.31和染色体Xp11.4处的特征性CNV断点。这种肿瘤类型仍然缺乏明确的诊断标准,特别是BCOR/ BCOR(L1)融合在这些肿瘤中尽管很常见,但并不是一个一致的发现,并且没有一种Heidelberger分类器版本能够清楚地识别这些病例,特别是具有BCOR、BCORL 1、EP 300和CREBBP以外的其他融合的肿瘤。在这项研究中,介绍了一个BCOR::CREBBP融合在一个成年患者的右颞中底部肿瘤具有甲基化类“BCOR/BCOR(L1)融合的中枢神经系统肿瘤”。该研究对在库中23篇已发表的具有甲基化类的中枢神经系统神经上皮肿瘤的例外情况进行了一个全面的文献综述,并探讨了BCOR,BCORL 1和他们的典型融合伙伴EP 300,TRAP 1,CREBBP,和L3 MBTL 2分子遗传改变。
病例介绍
本病例是一个14岁的女孩,在MRI上有一个不均匀的右颞中底部大肿块,有轻微的对比增强和中线结构的连续移位(图1)。大体全切除后,组织学检查显示为细胞丰富的神经上皮肿瘤,具有室管膜瘤样组织学模式,包括血管周围假菊形团结构、局灶性钙化和高增殖活性(图2)。IDH 1/2焦磷酸测序和pTERT Sanger测序显示野生型序列。甲基化分析显示,对于甲基化家族类别“BCOR改变的CNS肿瘤”,在v12.5和v12.8版本的Heidelberger脑肿瘤分类器中显著的校准评分为0.99,在v11.b4中较低的校准评分为0.79。虽然版本12.5显示亚型“BCOR/BCOR(L1)融合的CNS肿瘤”的校准评分为0.65,但版本12.8显示亚型HGNET-BCOR-ITD的校准评分为0.91;然而,PCR分析显示无BCOR-ITD。基于RNA的NGS分析揭示了BCOR::CREBBP融合(图2)。预测BCOR::CREBBP融合体是框外的,在CREBBP区段内的密码子2337处产生提前终止密码子。在850 K-甲基化分析中,这是一个持续的发现,在代表CREBBP和BCOR基因位置的染色体区域16p13.3和Xp11.4处存在相应的拷贝数改变(图2)。患者接受质子放疗和替莫唑胺辅助治疗。30个月后,患者出现肿瘤复发,并接受了部分切除术(图1)。在首次诊断术后32个月一次随访时,患者存活,没有复发或进展的证据。
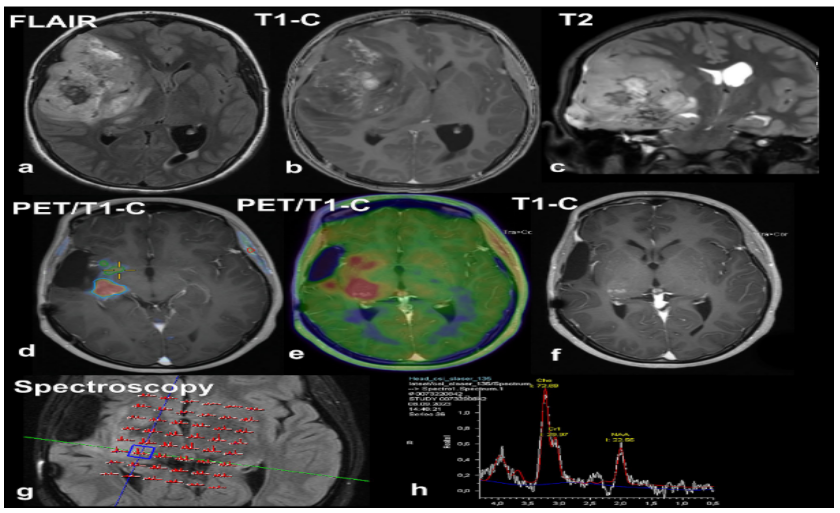
图1原发和复发肿瘤的影像学表现。原发肿瘤是一个不均匀的右颞中底肿块,有轻微的增强(T1-C)和中线结构的连续移位(a-c)。30个月后,PET/MRI和MR波谱检查结果清楚地表明肿瘤复发。18F-氟乙基-酪氨酸PET显示右侧基底节和丘脑(d-f)对比增强区域的示踪剂摄取增加,MR波谱显示相应的肿瘤轮廓,胆碱峰增加,N-乙酰天冬氨酸峰减少(g-h)
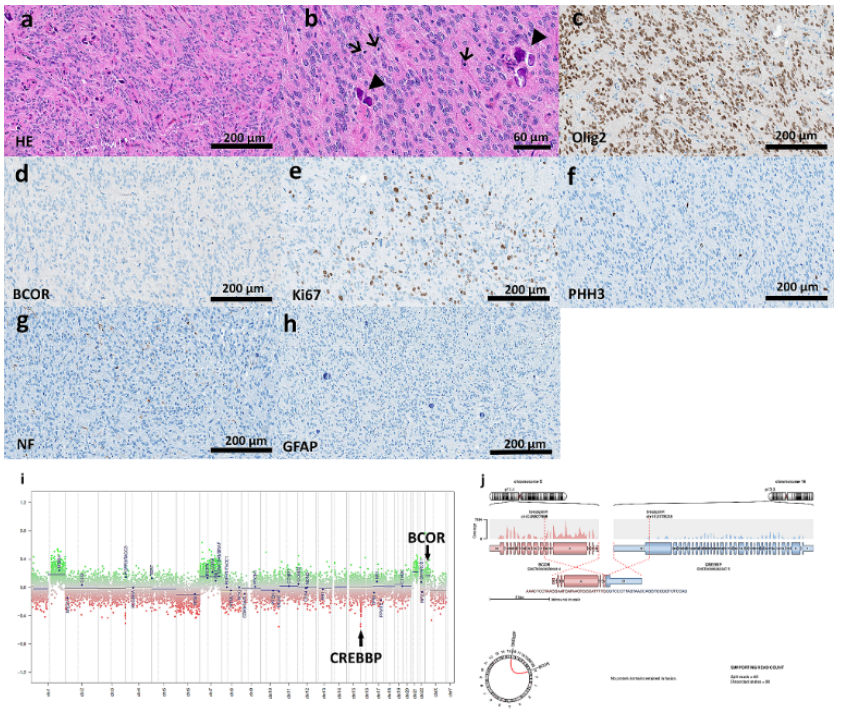
图2肿瘤的组织学、免疫组织化学和遗传/表观遗传特征。(a)组织学检查显示神经上皮肿瘤丰富,具有室管膜瘤样组织学模式,包括血管周围假菊形团、局灶性钙化(a,b)和高增殖活性(e)伴频繁的有丝分裂像(b,f)。Olig 2在肿瘤细胞中表达,BCOR为阴性(c,d)。NF染色证实了弥漫性生长模式(g)。GFAP阴性(h)。(i)基于RNA的下一代测序揭示了BCOR::CREBBP融合体,其断裂点位于BCOR的内含子6和CREBBP的外显子31中。(j)拷贝数谱显示在代表CREBBP和BCOR基因位置的染色体区域16p13.3和Xp11.4上的局灶性改变
讨论
BCOR的致病性改变已在各种肿瘤类型中报道,包括HGNET-BCOR-ITD,BCOR/BCOR(L1)融合的CNS肿瘤,子宫内膜间质和软组织肉瘤,婴儿原始粘液样间质肿瘤和未分化的圆细胞肉瘤。关于BCOR/BCOR(L1)融合的CNS肿瘤,除了原创出版物外,文献中报告的病例很少。“BCOR/ BCOR(L1)融合的CNS肿瘤”的核心特征定义为主要存在BCOR融合,通常以EP 300作为融合伴侣和/或如前所述的特征性CNV。在最早的研究中,个别病例显示出BCOR终止突变或MEAF 6::CXXC 5融合,而不是典型的BCOR融合。在文献的比较系统综述中,我们发现了35例已发表的神经上皮CNS肿瘤病例,这些肿瘤携带BCOR/BCOR(L1)融合或其他相关融合,或具有与BCOR/BCOR(L1)融合的CNS肿瘤相容的甲基化谱。大多数报告的病例是幕上的,偶尔发生在小脑。大多数患者是儿童或年轻的成年人。然而,这种肿瘤发病年龄范围广泛(5-72岁),55%的病例在40岁以下,85%在50岁以下。影像学和组织学检查肿瘤呈典型的T1低信号,T2高信号,边界清楚或呈弥漫性浸润。典型的组织形态学包括少突胶质细胞或室管膜瘤样组织学模式,具有纤细的裂隙状血管和血管周围的假菊形团结构。局灶性钙化是常见的,偶尔可能存在微囊/粘液样改变。肿瘤细胞核呈圆形至椭圆形,染色质细颗粒状,轻至中度的胶质细胞增生以及突出的胶质细胞突起。早期表现为坏死、频繁的核分裂和微血管增生。除Olig 2在这些肿瘤中经常呈阳性外,其他胶质细胞标记物均呈阴性表达。BCOR的核表达也是可变的,不能用作替代标记。尽管在报告的病例中,大多数未显示BCOR的阳性核表达(25例中的15例),但仍有10例病例显示BCOR的核表达。我们的病例BCOR呈阴性。类似地,BCOR染色不能区分HGNET-BCOR-ITD和具有BCOR/BCOR(L1)融合的CNS肿瘤,因为大多数HGNET-BCOR-ITD也显示核BCOR表达。BCOR-ITD不存在于任何BCOR/BCOR(L1)融合的CNS肿瘤中,这有助于与HGNET-BCOR-ITD区分。EP 300::BCOR是在这些肿瘤中发现的典型融合常见断点:EP 300的外显子31和BCOR的外显子4-7。在tSNE定义的病例中,已报告了替代融合,例如MEAF 6::CXXC 5、CREBBP::BCORL 1、EP 300::BCORL 1和BCOR::L3 MBTL 2。
本研究在文献中发现了神经上皮肿瘤中报告的BCOR::CREBBP融合,断点位于BCOR的外显子4和CREBBP的外显子31 。然而,该研究当时未进行甲基化分析,肿瘤未显示BCOR/ BCOR(L1)融合CNS肿瘤的典型组织病理学特征。
此外,在包括6761名患者的7207个样本的23篇已发表的关于神经上皮脑肿瘤的研究的库中搜索BCOR、BCORL1、EP300、TRAP1、CREBBP和L3MBTL2的分子改变后,发现了5个例外情况。这些病例显示进一步相关的融合,包括EP 300::BCOR; BCOR::L3 MBTL 2; BCOR::EP 300; BCOR::TRAP 1; CREBBP::GOLGA 6L 2; CREBBP::ENPP 7 P14; CREBBP::LCMT 1。CREBBP::GOLGA 6 L2和CREBBP::LCMT 1融合的两个病例符合GBM、IDH野生型的分子标准,包括CDKN 2 A/B的+ 7/-10特征和纯合缺失以及IDH野生型状态。1例CREBBP::ENPP 7 P14融合符合星形细胞瘤的分子标准,IDH突变体包括IDHR 132 H-mut、TP 53-mut、ATRX-mut,无1 p/19 q。1例神经上皮肿瘤具有3次融合(EP 300::BCOR; BCOR::L3 MBTL 2; BCOR::EP 300),组织学形态具有小梭形细胞模式和成胶质细胞瘤样或室管膜瘤样区域、钙化、纤细血管、坏死、高有丝分裂活性,似乎符合BCOR/BCOR(L1)融合的CNS肿瘤的典型组织学模式。然而,没有甲基化为基础的分类适用于这种肿瘤。1例BCOR::TRAP 1融合患者被诊断为弥漫性胶质瘤4级,并显示在SETD 2 C495 Lfs *6、PTPN 11 A72 V、PTPN 11 E76 G、TP 53 E258 K和CDKN 2 A/B纯合缺失上的突变,但无法进一步分类。
本研究显示,BCOR::CREBBP融合被预测为框外的,导致没有嵌合转录物,并可能导致BCOR功能的丧失。BCOR通过其PCGF Ub样折叠结构域(PUFD)调节组蛋白甲基化,在多能性维持、分化诱导和细胞命运决定中发挥作用。PUFD是BCOR肿瘤抑制功能的重要结构域。BCOR功能丧失与肿瘤发生相关。另一方面,BCOR基因位于X染色体上,仅可作为一个等位基因获得,因此索引病例中的融合可能导致PUFD介导的推定肿瘤抑制活性的完全丧失。框架外BCOR::CREBBP融合已在儿童恶性弥漫性胶质瘤中报告,可能是反对随机事件的支持证据。
结论
BCOR/BCOR(L1)融合的CNS肿瘤似乎是一种独立存在的肿瘤类型,具有典型的组织学和分子特征,但仍缺乏一致的诊断标准。这些肿瘤经常表现出少突胶质细胞或室管膜瘤样形态,具有纤细的裂隙状血管和血管周围的假菊形团结构,局灶性钙化,偶尔微囊/粘液样变化和恶性特征,如坏死,较高的核分裂和微血管增殖,以及频繁的Olig 2表达。没有一个Heidelberger分类器版本能够清楚地识别此类病例,特别是除了涉及BCOR、BCORL 1、EP 300和CREBBP的融合之外,具有替代融合的肿瘤。BCOR的核表达是可变的,不能用作替代标记。然而,缺乏BCOR-ITD有助于将它们与HGNET-BCOR-ITD区分开来。已知成人弥漫性胶质瘤如GBM、IDH-野生型和星形细胞瘤、IDHMutant可能存在CREBBP融合,在解释结果时考虑其他分子发现和组织形态学是至关重要的。















共0条评论