[导读] 编译:张波
摘要
以透明细胞为主的非小细胞肺癌是一种罕见的肺癌组织学类型。本研究报道31例显示广泛透明细胞特征的肺癌。患者为10名女性和21名男性,年龄47-92岁(平均:70岁)。肿瘤好发于右上叶和右下叶,直径0.8-9.5cm(平均4.2cm)。免疫组化结果显示,9例为腺癌,19例为鳞癌,3例为“null”型,腺癌或鳞癌标志物完全缺失。大多数类型为腺癌的病例显示出实性生长模式。一个实体腺癌病例子集显示出独特的“假鳞状”形态。在20例病例中进行了下一代测序,并显示了各种分子改变。最常见的异常发现在TP 53基因(9例),FGFR基因家族(8例),KRAS(5例),AKT 1(5例)和BRAF(3例)。21例患者进行了临床随访; 16/21例患者在首次诊断后6个月至12年(平均:4.2年,中位数:1.5年)死于肿瘤。4例患者存活4-27年(平均:11.5年,中位数:7.5年);均为病理分期1或2。具有透明细胞特征的NSCLC可显示侵袭性行为,需要与可显示透明细胞形态的各种其他肺肿瘤鉴别。在这些肿瘤中鉴定可靶向的分子改变可能对治疗管理有价值。
前言
具有透明细胞学改变的肺肿瘤可分为良性和恶性两类。虽然透明细胞常见于某些类型的肺肿瘤,但透明细胞细胞学在传统的非小细胞肺癌(NSCLC)中并不常见。虽然在NSCLC中识别出透明化的灶性区域并不罕见,但主要或完全由透明细胞组成的肿瘤较罕见。由于缺乏关于这些肿瘤的数据,世界卫生组织(WHO)不认为透明细胞变化是NSCLC的特定模式或其他亚型,而是类似于印戒细胞变化的一种补充细胞学特征。文献中仅发表了少数关于NSCLC伴透明细胞改变的研究。Yousem最大的研究报告了24例,Gu等人最近的一项研究通过直接测序研究了少量基因的突变状态。因此,具有透明细胞特征的NSCLC的临床病理学特征和分子遗传学特征的谱仍为不全面研究。
在此,我们研究了一系列31例NSCLC患者,这些患者的主要透明细胞成分至少>50%的肿瘤。由于透明细胞的优势,各种其他实体,如胎儿肺腺癌和其他器官的透明细胞癌转移,需列入鉴别诊断。这些肿瘤类型的鉴别通常需要免疫组织化学评估结合苏木素和伊红(H&E)染色玻片的检查,也可以通过辅助分子诊断和与详细临床病史的相关性来排除肺外原发部位,如肾脏或甲状腺。通过下一代测序评估了该透明细胞NSCLC队列的临床病理学特征、免疫组化特征和分子遗传学特征。
材料和方法
在对1980年至2020年期间登记的1273例肺癌病例进行回顾性分析时,确定了40例诊断为具有透明细胞特征的肺癌。本研究的入选标准是被分类为非小细胞肺癌的原发性恶性肺肿瘤,其表现出至少>50%的透明细胞细胞学变化。从研究中排除了4例病例,因为它们对应于来自其他器官的透明细胞肿瘤转移;排除了5例病例,因为用于评价的病理材料不足(活检、不完全切除、没有石蜡块)和/或缺乏足够的临床信息。本研究纳入了28例切除标本,这些标本显示了本文所述的特征,与具有透明细胞特征的NSCLC诊断一致。另外3例病例(均为切除标本)也纳入了研究,这些病例来自其中一位作者的个人咨询病例。先前报告了病例12、14-17、19和20中罕见基因融合的特征。9例腺癌也表现为不寻常的“假鳞样”组织学,定义为肿瘤具有大量透明细胞质的多角形肿瘤细胞实性岛,清晰的细胞膜和散在的胞浆内透明包涵体,类似于鳞状细胞癌(病例1、2、10、15、16、19、27、28和31)及其组织学特征也有报道。从4到15,所有病例的苏木素和伊红(H&E)染色的组织学玻片可用于审查。在所有病例中,还可获得用于免疫组织化学研究的代表性石蜡块。从患者的医疗记录或转诊病理学家中提取临床信息,包括年龄、性别、肿瘤的位置和大小、临床表现、治疗和临床随访。该研究是在机构审查委员会(IRB)批准下进行的。
免疫组织化学
对于免疫组织化学研究,将切片切成4μm,在二甲苯中脱蜡,在乙醇的递减稀释液中水合,并暴露于热诱导的表位修复。使用来自Dako Envision FLEX试剂盒和Dako AutostainerPlus染色仪(Agilent,Santa Clara,CA,USA)的试剂进行免疫组织化学染色。检测的抗体包括细胞角蛋白AE 1/AE 3,p40,PAX 8、CK 56,TTF 1,Napsin A、Ki-67,GATA 3和CD 10。用抗原修复液预处理后,用过氧化物酶阻断剂阻断组织5 min,并在室温下与一抗孵育。使用Dako FLEX检测试剂盒检测信号。在室温下用Envision FLEX苏木素进行复染7分钟。对于所有检测的抗体,同时使用适当的阳性和阴性对照。根据各种抗体的细胞核、细胞质或细胞膜反应性,将免疫组织化学反应分级为阳性。当阳性涉及肿瘤上皮细胞并影响至少50%的肿瘤细胞群时,阳性被认为是显著的。
分子检测
对于分子研究,审查了20个具有足够组织的病例,并选择具有至少>10%肿瘤含量的区域进行分析。在Ion Torrent Genexus纯化系统(ThermoFisher Scientific,Waltham,MA,USA)上使用市售的DNA/RNA纯化试剂盒,从福尔马林固定的石蜡包埋的肿瘤组织样品中提取高质量的DNA和RNA。使用多重PCR扩增,用靶向关键癌症相关基因的一组基因特异性引物进行靶向富集。文库制备、模板化、测序和比对在Ion Torrent™ Genexus™集成测序系统中以基于检测DNA聚合期间释放的氢离子的自动化方式进行。在IonTorrent Genexus平台(ThermoFisher Scientific,Waltham,MA,USA)上运行Oncomine精密度测定(OPA)。OPA旨在分析包括DNA在内的50个癌症相关基因的突变热点(AKT1、CHEK2、FGFR3、KIT、NTRK3、AKT2、CTNNB1、FGFR4、KRAS、PDGFRA、AKT3、EGFR、FLT3、MAP2K1、PIK3CA、ALK、ERBB2、GNA11、MAP2K2、PTEN、AR、ERBB3、GNAQ、MET、RAF1、ARAF、ERBB4、GNAS、MTOR、RET、BRAF、ESR1、HRAS、NRAS、ROS1、CDK4、FGFR1、IDH1、NTRK1、SMO、CDKN2A、FGFR2、IDH2、NTRK2、TP 53);拷贝数变体(CNV)(ALK、FGFR 1、AR、FGFR 2、CD 274、FGFR 3、CDKN 2A、KRAS、EGFR、MET、ERBB 2、PIK 3CA、ERBB 3、PTEN);基因间融合(ALK、NTRK 1、BRAF、NTRK 2、ESR 1、NTRK 3、FGFR 1、NUTM 1、FGFR 2、RET、FGFR 3、ROS 1、MET、RSPO 2、NRG 1、RSPO 3)和基因内融合(AR、EGFR、MET)。通过Genexus™流水线处理来自测序仪的DNA FASTQ读数:通过Torrent映射比对程序(TMAP)和Ion Torrent变体调用程序(TVC)进行比对,以调用SNV和INDEL。使用来自Genexus™流水线的去重复的、处理的BAM文件和变体识别器CNVkit来确定CNV。使用来自测序仪的去重复FASTQ RNA读段检测融合,其中RNA-Seq管道由比对器(STAR 2)和融合识别器(STAR-Fusion)组成。RNA外显子跳跃事件直接从Genexus™流水线输出中检索。样本质量指标包括平均覆盖率至少为×294,重复率不超过48%,至少99.5%的碱基覆盖率为×20或更高。将深度×300和最小5%的变异等位基因分数(VAF)设定为判定CNV、插入和缺失的截止标准,置信度>95%。CNV阈值分别为0拷贝和6个或更多拷贝,用于基因拷贝数的调用损失和增益。
结果
临床特点
患者的临床和病理特征总结如下。10名女性和21名男性,年龄47-92岁(平均值:70岁;中位数:72岁)。肿瘤好发于右肺上下叶,最大径0.8-9.5cm,平均4.2cm。23例位于胸膜下/外周位置; 7例位于中央/肺门位置。1例患者的肿瘤部位未知。患者出现咳嗽和胸痛症状,胸部X光和计算机断层扫描(CTS)发现肺部肿块。21例患者有吸烟史。1例患者有前列腺癌既往史,2例患者有慢性阻塞性肺疾病(COPD)病史,1例患者有终末期肾病既往史,1例患者有心脏移植史。所有患者均采用完全手术治疗切除肿瘤; 4例行楔形切除术,2例行全肺切除术,22例行肺叶切除术,2例行肿瘤累及右上叶和右中叶的双肺叶切除术。1例患者接受了切除术,但未记录外科手术的具体类型。3例患者除因癌细胞超出肺实质行肺切除外,还接受了部分肋骨或胸壁切除。2例患者在初次手术时接受了额外的同期同侧肺切除术,以治疗单独的肿瘤结节。6例接受了术后放疗和(或)辅助化疗。对21例患者进行了临床随访; 16/21例患者在初次诊断后6个月至12年(平均:4.2年,中位数:1.5年)死于肿瘤。4例患者存活良好,4-27年(平均:11.5年,中位数:7.5年);诊断时均为病理T分期1或2期。1例患者在术后1年存活且状况良好,但随后失访。8例患者在手术后失访。1例患者为近期病例,无随访可用。总体而言,9例患者的病理分期为1期(pT1 a、pT1 b或pT1 c)。11例患者的病理T分期为2期(pT 2a或pT 2b)。6例患者的病理T分期为3期(pT 3)。5例患者的病理T分期为4期(pT 4)。3例患者的淋巴结转移至同侧肺门淋巴结,2例患者的淋巴结转移至纵膈/隆突下淋巴结。在较高分期(pT 3或pT 4)出现的患者倾向于死于肿瘤,尽管一些患者失访。一些死于疾病的患者也处于早期阶段(1例患者处于pT 1aN 0阶段,1例患者处于pT 1bN 0阶段,2例患者处于pT 1cN 0阶段,1例患者处于pT 1cN 2阶段)。
病理检查
肿瘤大体描述为黄褐色-白色肿块,其中一些有出血和坏死区域。所有肿瘤的特征在于主要的透明细胞成分(>50%)。根据免疫组织化学染色结果进行组织学亚型分型。根据免疫组化结果,19例被归类为鳞状细胞癌,9例被归类为腺癌,3例被归类为“null”表型的大细胞癌。
鳞状细胞癌伴透明细胞特征
这些肿瘤以巢状结构为特征,通常被薄的胶原纤维间隔隔开(图1A)。肿瘤结节由片状多角形细胞组成,细胞边界清晰,细胞核位于中心位置(图1B)。肿瘤细胞核大,圆形至椭圆形,染色质致密,核仁突出。一些病例显示散在的嗜酸性胞浆内包涵体,可能与角化细胞角化相混淆;然而,角蛋白珠形成或明显的角化区域是罕见的,仅在1例中被确定。经常可见明显的核多形性区域,也存在散在的非典型多核巨细胞。所有肿瘤均显示频繁的核分裂和病理性核分裂(图1C)。肿瘤经常显示出明显的坏死区域;包括在肿瘤细胞岛中可观察到的中央粉刺样坏死的独特模式;一些病例还显示出大的融合区域的坏死。肿瘤在周围广泛浸润,并显示血管和神经束膜浸润灶。3例间质由致密淋巴细胞浸润组成使病变具有淋巴上皮瘤样外观(图1D)。1例病例(病例15)还显示肿瘤转变,伴有局灶性肉瘤样梭形细胞成分。1例病例(病例20)显示局灶性腺体样间隙,表现为局灶性胞浆内粘蛋白阳性,提高了腺鳞癌的可能性;然而,该病例为TTF 1阴性,CK 5/6和P40呈强弥漫性阳性,因此归类为鳞状细胞癌。
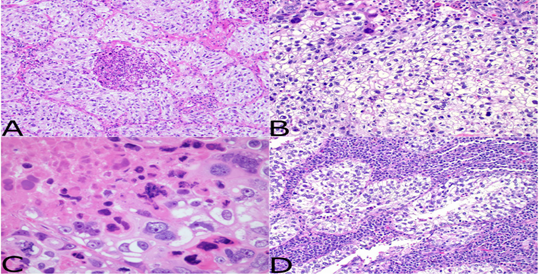
图1透明细胞鳞状细胞癌。(A)透明细胞特征的鳞状细胞癌表现为离散的肿瘤细胞岛,其中含有大量透明细胞质。注意中央的粉刺状坏死区。(B)透明细胞特征的鳞状细胞癌高倍镜下可见一片细胞,细胞核不典型,胞浆丰富透明。注意肿瘤细胞边界清晰,核多形,病理性核分裂。(C)鳞状细胞癌坏死灶(左上)高倍放大,细胞特征清晰,可见坏死区(右下)细胞核增大,核仁突出,部分细胞多核化,病理性核分裂。(D)透明细胞鳞状细胞癌表现为被丰富致密淋巴样基质分隔的透明肿瘤细胞岛
腺癌伴透明细胞特征
这些肿瘤都显示出独特的生长模式,在组织学检查中,与鳞状细胞癌类型的肿瘤惊人地相似。肿瘤的特征是由多角形的肿瘤细胞组成的实性岛,细胞质丰富透明,细胞膜轮廓清晰,但无细胞间桥;在实性巢内有时可发现提示腺体形成的细微腔隙(图2A)。肿瘤细胞显示增大的非典型细胞核,核仁突出,核分裂多(每10个高倍视野中>10个)。肿瘤细胞岛常表现为中央区域的粉刺样坏死。几乎在所有病例中也可发现散在的密集嗜酸性透明小球,常使肿瘤呈“假鳞状”外观,但不能识别出形成良好的角蛋白珠或明显的角化区域。3例病例显示非实性小部分的片状或微乳头状腺癌与实性部分合并(图2B),此种特征存在于肿瘤的周边。在两个病例中,可以观察到少量腺泡腺癌成分与实体成分合并(图2C)。
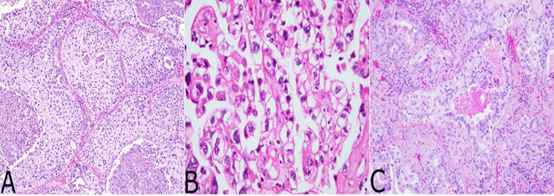
图2透明细胞肺腺癌。(A)透明细胞特征的肺腺癌表现为实性岛状肿瘤细胞,具有非典型核,丰富的透明胞浆和类似鳞状细胞癌的锐利细胞边界。注意中央的粉刺样坏死区。(B)肺透明细胞腺癌,表现为片状和微乳头状腺癌的局灶性区域。(C)腺泡腺分化的焦点存在于具有透明细胞特征的肺实体腺癌中。
具有“null”表型的透明细胞癌
3例病例对应于不表达腺癌或鳞状细胞癌标志物的透明细胞癌。肿瘤的特征是小叶生长模式,具有大的、多角形肿瘤细胞,细胞边界清晰,胞质丰富透明。除了缺乏腺或鳞状细胞癌的标记物表达外,肿瘤看起来与具有透明细胞特征的其他腺癌和鳞状细胞癌难以区分。
免疫组化结果
本研究中所有病例的免疫组织化学染色均可用。所有肿瘤均显示细胞角蛋白AE 1/AE 3的肿瘤细胞的强细胞质染色。19例肿瘤细胞核p40和/或CK 5/6呈强阳性,TTF 1和NapsinA呈阴性(图3A,B)。9例病例显示肿瘤细胞的TTF 1的强核染色和/或Napsin A的颗粒状细胞质染色,并且p40和CK 5/6通常为阴性(图3C、D)。1例鳞状细胞癌表现为弥漫性p40/CK 5/6强阳性,伴局灶性腺样间隙,粘蛋白卡红罕见阳性。3例鳞状或腺分化标志物阴性,包括p40、CK 5/6、TTF 1和Napsin A。Ki-67增殖抗原染色显示所有病例中肿瘤细胞的核阳性率为50-80%。例15的肉瘤样梭形细胞成分也对细胞角蛋白AE 1/AE 3染色阳性,但对p40、CK 5/6、TTF 1和Napsin A染色阴性。在所有检测病例中,PAX 8、GATA 3和CD 10染色均为阴性。
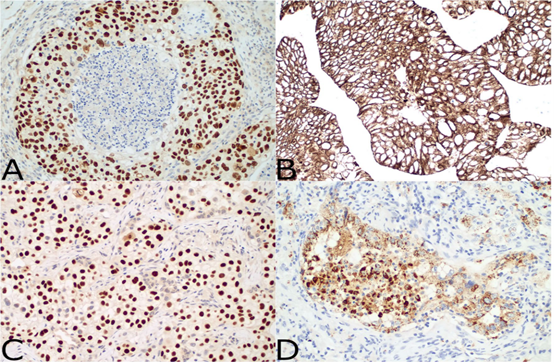
图3免疫组织化学染色。(A)在透明细胞鳞状细胞癌的肿瘤细胞岛中可见强的p40核阳性。(B)透明细胞鳞状细胞癌中也存在CK 5/6阳性细胞质染色。(C)TTF 1的核阳性存在于实性透明细胞腺癌的肿瘤细胞岛中。(D)在透明细胞肺腺癌的病例中,也可见Napsin A的阳性胞浆染色
下一代测序
在20例病例中可获得足够的组织用于下一代测序分析,并鉴定出许多致病性改变,包括点突变、拷贝数丢失和获得以及基因融合(图4)。在9个基因中共检测到27个致病性点突变。TP 53基因具有最常检测到的致病性突变(9例[45%]),其次是KRAS(5例[25%])、BRAF(3例[15%])、PIK 3CA和PTEN(各2例[10%])以及FGFR 4、FGFR 3、EGFR和ERBB 3(各1例[5%])。在9例病例中,在15个基因中检测到拷贝数变异(8个[53%]丢失; 7个[47%]增加)。拷贝数丢失发生在CDKN 2A、CD 274、GNAQ、NTRK 2、PTEN、BRAF、MET和SMO基因中。拷贝数增加的基因包括AKT 1、GNAS、EGFR、FGFR 1、FGFR 3、PDGFRA和KIT,鉴定出6至10个拷贝。融合基因检出率为40%。最值得注意的是,一个7例病例的亚组具有复发性FGFR 3::TACC 3基因融合,导致FGFR 3外显子17和TACC3外显子6融合(chr4的FGFR 3断裂点:1,808,661,chr4的TACC3断裂点:1,732,899)。1例病例存在ESR1::CCDC170融合。
当按组织学亚型分层时,仅在鳞状细胞癌(8例)和大细胞癌(NULL)(1例)组织学中发现TP 53突变。鳞状细胞癌还包含BRAF中的两个突变以及KRAS中的两个突变和涉及多个基因的各种拷贝数改变。在检测的5例腺癌病例中未发现TP 53改变。这些肿瘤的特征是频繁的KRAS突变(3/5例)以及EGFR和BRAF突变,一些病例显示各种基因的拷贝数增加或丢失。测序的一个大细胞癌(NULL)仅显示ERBB 3和TP 53突变。FGFR 3::TACC 3融合在鳞状细胞癌和腺癌组织学中均发生,并且在鳞状细胞癌组织学中更频繁地发生(5例病例vs.2例病例)。
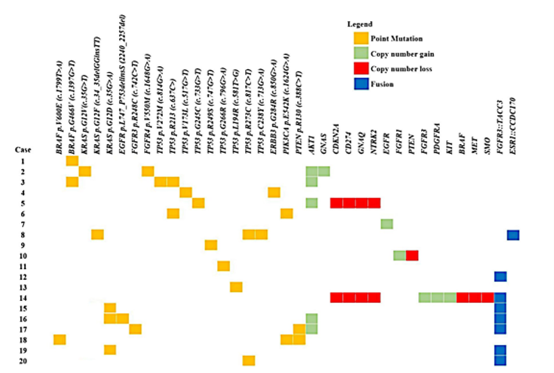
图4具有透明细胞特征的NSCLC的分子遗传学改变。该图显示了测序的20个病例中分子改变的分布。最常见的改变是跨各种基因的点突变,最常见的是TP53,但也包括各种拷贝数改变和一些融合,最值得注意的是FGFR 3::TACC 3
讨论
以透明细胞为主的肺癌是罕见的肿瘤,文献中尚未对其进行广泛研究。据我们所知,这项研究代表了迄今为止报道的最大的肺癌系列,主要表现为透明细胞特征。尽管在NSCLC中可局部观察到透明细胞特征,但具有广泛透明细胞改变或主要透明细胞改变的肿瘤罕见,可能导致与转移或其他透明细胞肿瘤类型混淆。在该队列中,最常见的透明细胞癌类型为鳞状细胞癌(19/31例病例; 61%),其次为腺癌(9/31例病例; 29%)。在本研究中,3例病例显示了“null”表型(3/31例病例:10%)。肿瘤好发于右肺上叶和右肺下叶,多见于老年男性。所有病例均以透明细胞为主(>50%),可能与其他类型的肺透明细胞瘤混淆。经病理分型为腺癌的病例免疫组化显示主要为实性生长模式,具有类似于鳞状细胞癌的大多边形细胞巢,但其通常为TTF 1/Napsin A阳性和p40/CK 5/6阴性。3个“null”的病例,表现出类似其他病例的组织学形态,但只阳性表达细胞角蛋白AE 1/AE 3。值得注意的是,本研究中的肿瘤倾向于以侵袭性方式表现; 21例临床随访患者中有16例在初次诊断后6个月至12年死于肿瘤。还应该注意的是,本队列中的一些患者尽管为早期病理T分期但仍最终死亡。
很少有研究涉及具有透明细胞特征肺癌的分子特征,并且它们的范围有限。Yousem的研究在24例病例中使用聚合酶链反应(PCR)检测EGFR、KRAS和BRAF,并使用荧光原位杂交(FISH)检测ALK、EWSR 1和ETV 6。Yousem发现,在他的病例中最常见的分子改变是KRAS突变;然而,他的测试面板非常有限。Gu et al.的另一项研究通过直接测序在38例具有透明细胞成分的肺腺癌中研究了EGFR、KRAS、HER 2、BRAF和AKT 1的突变状态。他们发现50%的病例携带EGFR突变,41%有KRAS,5%有AKT 1突变。然而,在该研究中纳入病例的阈值相当低,并且包括具有最少仅5%透明细胞组分的病例;因此,结果可能更能反映表现出局灶性透明细胞变化(一种已知现象)的常规腺癌,而不是本文所述的透明细胞NSCLC病例(即,主要以透明细胞成分为特征的肿瘤)。此外,未提供免疫表型相关数据支持其病例的腺癌诊断。最近,我们报告了7例以FGFR 3::TACC 3基因融合为特征的透明细胞肺癌病例;这些病例被纳入当前更大、更全面的研究,作为透明细胞肺癌的索引队列,并收集了另外13例透明细胞NSCLC病例的档案材料,现在提供了这些病例的分子数据。FGFR改变在NSCLC中很少见,涉及FGFR 3基因的重排仅在肺癌中以很小的频率被发现(所有肺癌的0.2-3%)。
在本研究中,发现最常见的异常是TP53基因(9例),FGFR基因家族(8例),KRAS(5例),AKT1(5例)和BRAF(3例)。许多病例还显示同步改变,在同一肿瘤中表达多个突变,提示不稳定的遗传组成,尽管人们承认这些肿瘤中的一些相关突变可能代表“乘客”伴随突变而不是驱动突变,并且是单个肿瘤中肿瘤异质性或亚克隆性的表现。有趣的是,这些透明细胞肿瘤中最常见的基因改变之一涉及FGFR基因,这表明具有这种改变的肿瘤可能富集透明细胞组织学形态;然而,在研究大量病例时,我们无法确定该基因的其他改变。鉴于这种改变的罕见性以及肿瘤通常具有透明细胞组织学,需要检查更大规模的FGFR改变的肺癌队列,以确定是否实际存在任何类型的真正基因型-表型相关性。分子特征相对非特异性,显示出传统NSCLC的其他改变。当根据组织学亚型分层时,最显著的差异是腺癌病例中不存在TP 53突变;然而,研究中纳入的腺癌和大细胞癌(NULL)病例太少,无法对不同组织学亚型的分子变化进行任何有意义的比较分析。最终,在具有透明细胞特征的NSCLC中最重要的分子发现是潜在的可靶向基因改变的鉴定,这将扩大患者的治疗选择。
这些肿瘤的鉴别诊断主要包括来自其他器官的透明细胞肿瘤和其他罕见的透明细胞肿瘤的转移到肺部。最常见的透明细胞肿瘤转移到肺部的类型包括肾细胞癌和卵巢和子宫的透明细胞癌。肺是透明细胞肾细胞癌的常见转移部位,转移可与原发肿瘤同时发生或在原发肿瘤切除后多年出现。临床病史对于正确评估是必不可少的;然而,免疫组化染色也可能有助于鉴别诊断。大多数透明细胞肾细胞癌对CD 10、PAX 8和肾细胞癌抗原呈阳性,对p40、CK 5/6、TTF 1和Napsin A呈阴性。本研究的肿瘤对后一种标记物的强免疫阳性以及所有病例中PAX 8和CD 10的阴性染色有助于排除转移性肾细胞癌。女性生殖道的转移性透明细胞癌也可以表现出与本研究的一些病例密切的形态学相似性,并且很少表现为隐匿性原发性肺转移,这可能在活检材料上与原发性透明细胞肺癌混淆;然而,此类肿瘤与ARID 1和PIK 3CA的分子异常相关,并会与PAX 8和HNF 1 β的抗体发生反应,并且它们通常对TTF 1,p40和CK 5/6是阴性的。然而,在这种情况下,一个潜在的诊断陷阱是强Napsin A阳性,这可以在>80%的卵巢透明细胞癌中观察到,因此与肺腺癌的免疫表型重叠。这些病例需要详细的临床病史。
其他罕见类型的原发性肺癌可显示显著的透明细胞形态,包括胎儿型肺腺癌和涎腺型透明细胞癌。由于透明细胞癌的免疫组化标记物的表达有共同的重叠,仔细的形态学评估可以排除这种可能性。在胎儿型肺腺癌中,透明胞质空泡位于核上和核下,并倾向形成筛状结构,这种形态不存在于任何本研究病例中。此外,胎儿型腺癌的两个显著特征是在腺体基部形成独特的鳞状“桑椹结构”和存在CTNNB 1基因突变(在低级别变体中);这些发现实际上是这些肿瘤的特异性,并且在本研究的任何病例中都不存在。涎腺型透明细胞癌是一种非常罕见的原发性肺恶性肿瘤,只有少数病例报告。肿瘤显示出独特的组织学特征,其特征为小巢和透明(有时为鳞状细胞样,嗜酸性)肿瘤细胞索,由透明化的无细胞结缔组织致密带分隔。有丝分裂活性通常较低,通常未观察到坏死。这些病例的生长模式与本研究病例形成鲜明对比,在本研究病例中,实体瘤细胞巢仅由薄的纤维间隔隔开,没有明显的在涎腺型肺癌中所见的玻璃样变区域。虽然可能有一些免疫组化与透明细胞NSCLC重叠,如p63/ p40染色阳性,但涎腺型透明细胞肿瘤的特点是一个特定的EWSR 1::ATF 1基因融合。
其他一些以透明细胞为特征的非上皮性肺肿瘤也可能进入鉴别诊断;这些包括透明细胞(“糖”)瘤和最近描述的肺血管母细胞瘤样透明细胞间质肿瘤。透明细胞(“糖”)肿瘤是血管周围上皮样细胞(PEComa)肿瘤家族的一员,其特征为透明细胞实性片状结构,伴有扩张的血管间隙,缺乏异型性、坏死或核分裂活性。在某些情况下,肿瘤可能具有TFE 3重排,并且对细胞角蛋白、p40、TTF 1和Napsin A呈阴性,但特征性地与平滑肌和黑素细胞标志物反应,例如SMA、Melan-A和HMB 45。由于缺乏细胞学上的异型性、坏死和核分裂活性,我们可以从形态学上将这些肿瘤与本研究病例区分鉴别开。肺血管母细胞瘤样透明细胞间质肿瘤是另一种罕见的、最近描述的肺部良性肿瘤,其特征也是明显的透明细胞组织学。这些肿瘤的特征是以支气管内生长为主,良性透明细胞增殖,与血管母细胞瘤有细微的相似之处。通过免疫组织化学,这些肿瘤仅表达波形蛋白,PAX 8、S100和细胞角蛋白呈阴性,但TFE 3抗体显示核阳性。与透明细胞“糖”瘤类似,在某些情况下也发现它们含有YAP 1-TFE 3基因重排。免疫组化和分子水平有助于区分肺血管母细胞瘤样透明细胞间质肿瘤。
具有透明细胞特征的肺癌的生物学行为似乎与处于类似阶段的其他NSCLC相似。在Katzenstein等人的研究中,发现与非透明细胞NSCLC相比,肿瘤表现出相似的生物学行为和预后。在最近的两项基于从诊断为肺透明细胞癌的患者的监测、流行病学和最终结果(SEER)数据库中提取的数据的调查中,表明具有透明细胞特征的肺癌比非透明细胞癌具有更好的预后,至少对于较低分期的患者。研究发现,这些肿瘤与年龄较小和诊断早期相关,并且对于局限性和区域性疾病,癌症特异性生存率优于传统非NSCLC。然而,在Ke等人的研究中,作者发现,在肺透明细胞腺癌患者中,年龄较大(>65岁)、肿瘤较大以及淋巴结和远处转移是生存率较差的独立预后因素。本研究结果还表明,具有透明细胞特征的肺癌可能表现为侵袭性方式,并可能与显著的死亡率相关,如几名死于其疾病的患者所证明的那样,包括一些患有低分期的患者。
总之,具有透明细胞特征的肺癌代表了具有潜在侵袭性行为的罕见肿瘤,需要与具有透明细胞特征的侵袭性较低的肺癌区分开来。尽管WHO目前未将其归类为一种独特的癌症亚型,但在NSCLC中发现显著的透明细胞变化可能需要进行广泛的鉴别,并给诊断带来问题。从本研究和文献回顾来看,大多数病例对应于鳞状细胞癌,尽管腺癌也可能发生透明细胞变化。完整的临床病史结合病理学检查和辅助诊断可区分该类肿瘤。
点此下载原文献

















共0条评论