1、病例资料:患者男性,35岁。吸烟10余年,饮酒10余年,每周3次,每次1斤白酒。患者2023年7月右侧腹部不适,于当地医院就诊,发现肝脏占位,直径9cm,考虑血管瘤可能,患者无不适症状,自服中药调理,未见明显好转。2023年12月出现腹部疼痛,复查腹部CT,肝脏占位增大至12cm,继续服用中药治疗。2024年1月患者出现乏力、食欲减退,伴有肝区不适,近2个月自觉肝区胀痛不适较前加重,2024年4月复查腹部增强CT提示:肝右叶占位较前增大,172x123mm,肝周少许积液,当地医院建议手术治疗。我院门诊以肝占位收入院。上腹部增强CT:肝右叶巨大不均匀低密度团块,大小约221x132mm,CT值约为28-42HU,余肝实质密度较均匀,CT值约为56HU,增强扫描动脉期病灶内多发斑片及畸形血管影,平衡期病灶内片状稍高密度灶,病灶向肝外突出,周围组织受压移位,与右肾、右肾静脉、胰腺、十二指肠、结肠肝曲分界欠清,提示血管肉瘤可能性大。患者自发病以来,食量减少,睡眠欠佳,体重近3月下降5kg,患者现腹胀腹痛,无法平卧。行右半肝切除术。显微镜下:肿瘤细胞形成血管腔或窦隙样结构,细胞呈短梭形、长梭形或卵圆形,胞质较少,核浆比显著增高,核仁不明显,细胞异型性显著,呈新月形衬覆于肝窦内或鞋钉样突出至周围肝窦内,随着肿瘤细胞的浸润可见肝板断裂。免疫组化:ERG、CD31、CD34、Vimentin阳性,Ki67约50%+。病理诊断:(右半肝)血管肉瘤。
2、讨论:血管肉瘤被认为是一种来源于血管或淋巴管内皮细胞的高度恶性肿瘤。它最常见于头颈部,其次是乳房,肝脏是血管肉瘤的第五大常见部位。
流行病学和病因:原发性肝脏血管肉瘤(HAS)是一种罕见但侵袭性很强的恶性肿瘤,是成人最常见的原发性肝脏恶性间质肿瘤。每1000万人中有0.5-2.5例,占原发性肝脏恶性肿瘤的0.1%-2%,占所有血管肉瘤的5%。HAS通常发生老年男性中,60-70岁发病率最高,男性比女性更易感染,比例为3:1-4:1。然而,在儿童时期,女孩的发病率高于男孩。有研究统计了1990年至2019年全球范围内已报道的HAS患者,其平均发病年龄56.7岁,最小年龄为出生后1d,最大年龄为89岁,男女比例约为1.88∶1。
HAS的患者大部分没有已知病因,但最常见的已知病因是接触氯乙烯和其它工业材料、医源性接触二氧化钍胶体、使用雄激素类固醇、长期摄入砷剂和放射性镭等。也有研究表明,肿瘤与己烯雌酚、氨基甲酸酯、环磷酰胺和口服避孕药之间存在关联。由于环境暴露导致的肝血管肉瘤具有10-40年的延长潜伏期。目前暴露于环境致癌物(可能的雄激素类固醇除外)已大大减少,因此大多数HAS病例似乎是特发性的。有研究统计在131例HAS患者中,有19例为乙型肝炎, 阳性率为14.5%,但病毒性肝炎是否导致HAS的发生尚无明确报道。另有研究发现,职业暴露于电离辐射可能会导致HAS的发生。
临床表现:HAS患者的临床表现并不典型,大多数表现为腹痛、腹胀,部分患者表现为身体乏力、体质量减轻、纳差或食欲减退、黄疸,也可表现为恶心、呕吐、反酸、嗳气、腹泻、腹部不适、便血等消化道症状,以及发热、盗汗、胸闷气短等非特异性症状。HAS也可表现为无症状,在影像学检查时偶然被发现,或在体格检查时发现腹水和肝肿大。HAS常有肺、脾、骨的转移,故也可表现为咯血、脾脏破裂出血。部分患者因自发性肿瘤破裂导致腹腔出血而就诊,行手术治疗后获得明确诊断。Kasabach-Merritt综合征是HAS一种罕见的并发症,常表现为贫血、血小板减少、凝血酶原时间延长、低纤维蛋白原血症、纤维蛋白原降解产物和D-二聚体明显升高。
实验室检查及影像学检查:有研究统计在102例HAS患者中,90.2%的患者肿瘤标志物水平正常,只有 9.8%的患者AFP、CEA和CA199水平升高,59.0%的患者转氨酶轻度升高,说明肿瘤标志物和转氨酶对本病的诊断价值不大。
由于HAS的富血管特征,在放射学上很难将其与其他肝脏肿瘤区分开来。超声检查显示HAS病灶内有多个结节或孤立性肿块,根据肿瘤坏死和出血程度的不同,表现为不均质回声,缺乏特异性依据。CT和MRI检查比较具有特征性。CT显示肿块边界不清,密度不均,易出血,少数病例继发钙化,而增强扫描呈典型的向心不均匀强化。然而,很难将血管瘤与较小且均匀增强的血管肉瘤区分开来,少数血管肉瘤强化不均匀,早期强化较快,边界清晰,与肝细胞癌鉴别困难。此外,恶性程度高的血管肉瘤不被强化。MRI可用于显示肿瘤的异质性、出血性及富血管性质,特点为T1WI呈低信号,T2WI呈高信号,增强后早期呈不均匀强化,晚期进行性填充式强化,延迟期病灶可呈斑片状无强化。
HAS主要需要与肝海绵状血管瘤、原发性肝细胞癌、肝转移瘤、胆管癌进行鉴别。(1)肝海绵状血管瘤:增强后动脉期周边结节状强化,静脉及延迟期向心性增强。T2WI上呈“灯泡征”。HAS部分信号不均,可见短T1或短T2信号影,增强扫描强化方式多样,部分HAS与肝海绵状血管瘤影像表现有重合,此类鉴别诊断较困难。(2)肝细胞癌:通常有肝炎、肝硬化史,AFP高,“快进快出”是其特征性增强扫描模式。HAS患者通常AFP指标无明显异常,增强后无强化或填充式强化。(3)肝转移瘤:通常有原发灶,为肝内散在分布的多发球形病灶,一般呈环形强化,呈“牛眼征”。当无明确原发肿瘤病史时,与部分HAS弥漫多发结节型鉴别困难。(4)肝内胆管细胞癌:增强扫描伴包膜缩回,延迟期持续强化,但肝内胆管细胞癌可伴有肝内胆管的扩张,可与HAS鉴别诊断。(5)上皮样血管内皮瘤:通常位于外周并延伸至被膜,典型者可见“晕环征”、“棒棒糖征”,有助于与HAS相鉴别。
病理学检查:HAS的确诊依赖于组织病理学检查。肿瘤细胞沿肝板周围肝窦生长,呈乳头状或鞋钉样突出于肝窦表面,血管之间相互沟通融合呈迷宫样或血管样结构,内衬梭形、卵圆形或不规则形的肿瘤细胞,瘤细胞体积大,核深染。同时伴有肝细胞萎缩、肝窦变宽。分化较差的肿瘤低倍镜下可见大小不一的肿瘤性血管,呈裂隙样血管腔样结构及实性结构,肿瘤细胞异型性明显,并形成多核瘤巨细胞,易见核分裂像及病理性核分裂像,肿瘤细胞间可见幼稚的血管腔形成,腔内可见红细胞,常见出血、坏死。部分肿瘤细胞可排列成海绵状血管腔样结构。
HAS可表达一些特异性的分子标志物,免疫组化显示CD31、CD34、FVIII相关抗原等血管内皮标志物阳性,此外泛细胞角蛋白、Vimentin、ERG、GPC-3、Ki67均可表达为阳性。其余可表达为阳性的标志物有FLI-1、D2-40、CD68、AE1/AE3和CAM5.2。目前发现与氯乙烯接触相关的HAS存在TP53突变, 二氧化钍诱发的和散发的HAS存在KRAS-2突变。同时研究发现PIK3CA/AKT/mTOR信号转导通路可能与HAS形成有关。
治疗和预后:对HAS患者来说,目前尚无标准的治疗方案。HAS具有侵袭性的临床特点,加上延迟诊断,通常导致其预后不良,诊断后的总生存期仅为6个月,而1年、3年和5年生存率分别仅为30%、8%和5%。随着医疗技术的进步,如今HAS患者的预后已得到改善。HAS最常见的死亡原因包括肝功能衰竭、弥散性血管内凝血和失血性休克。
目前没有关于HAS最佳治疗方式的既定指南。现有的治疗方式包括手术切除、肝动脉化疗栓塞、肝移植、化疗及靶向免疫治疗等。手术切除被认为是最佳的治疗选择,辅助化疗提供了进一步的生存获益,但证据有限。有回顾性分析44例HAS患者,8例可接受手术切除的患者中有6例接受了R0切除,5年后只有2例接受R0切除的患者存活。接受手术切除的患者中位总生存期为33.4个月,而接受局部治疗的患者中位总生存期为9.3个月,接受化疗的患者中位总生存期为7.7个月,未接受任何治疗的患者中位总生存期为1.9个月。肝动脉化疗栓塞通常是控制紧急出血的首选治疗方式,同时也是姑息性的治疗方式。有研究报道22例肝移植患者的中位总生存期为6个月,其中5例(23%)死于感染性并发症,17例(77%)死于肿瘤复发,其中存活时间最长为3个月。另有报道1例HAS患者,肝移植16个月后肿瘤复发,辅以患者紫杉醇化疗,最终存活期为31个月。以上结果说明肝移植治疗HAS仍存在争议,不仅患者可能获益有限,甚至可能会造成器官浪费。
对于无手术指征的患者,如病情允许,行化疗可能改善预后。基于阿霉素的方案和紫杉烷被认为是有效的,目前常用于一线或二线治疗。由于HAS发病率低,导致人们对基因异常情况的了解有限,靶向治疗进展甚微。目前已知的有RAS-RAF-MAPK通路、TP53和CDKN2A/p16的基因突变。血管内皮生长因子及其受体也被发现在肿瘤中高表达,从而支持抑制血管生成的药物(如贝伐珠单抗、索拉非尼、帕唑帕尼等)进行临床研究。目前已取得一定的成果,应用mTOR抑制剂依维莫司靶向抑制RAS-RAF-MAPK通路,使2例血管肉瘤患者获得了持续6-12个月的部分缓解。此外,还有较多的治疗方案被尝试,如化疗联合靶向治疗、免疫联合靶向治疗等。1例HAS伴多发肝转移患者,经帕唑帕尼加程序性死亡因子-1抑制剂和RAK细胞治疗后病情稳定。尽管这只是一个病例报告,但这项研究显示了新的治疗时代的希望。
综上所述,HAS是一种罕见的肝脏恶性肿瘤,由于其临床表现和影像学检查缺乏特异性,难以与其他肝脏肿瘤相鉴别,极易误诊,明确诊断依赖于病理学的免疫组化检查。手术是主要的治疗选择,辅助化疗、靶向免疫治疗可改善患者的预后。
病例图片:


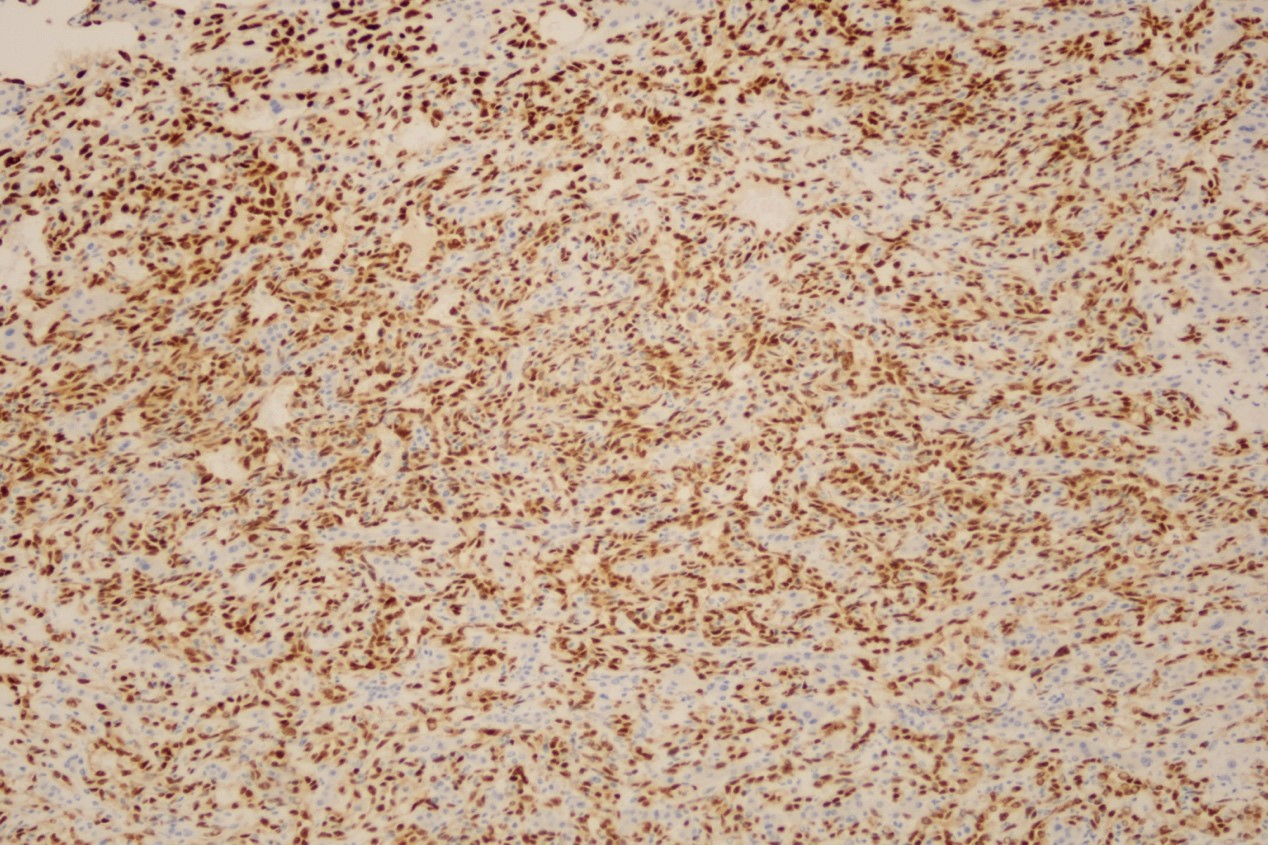 免疫组化:ERG(+)
免疫组化:ERG(+)
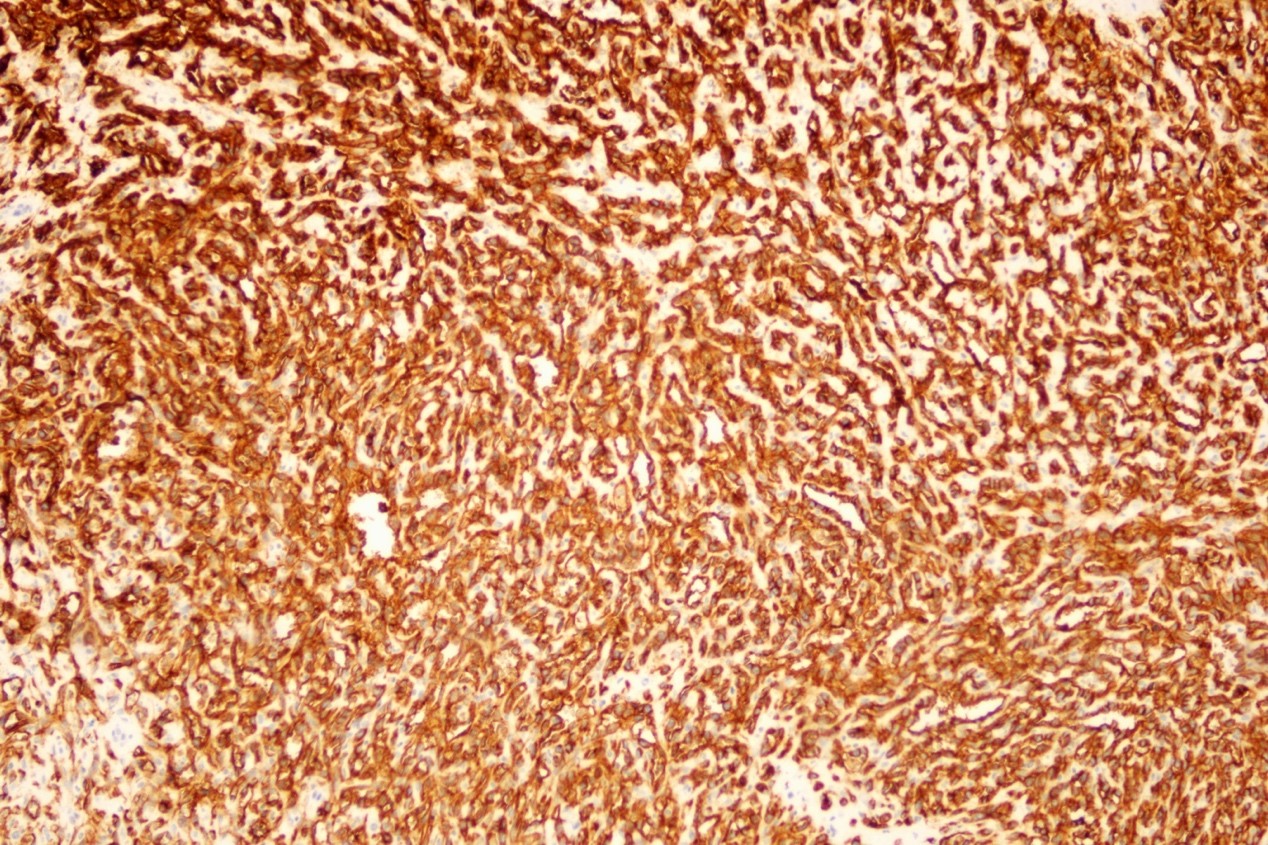 免疫组化:CD34(+)
免疫组化:CD34(+)
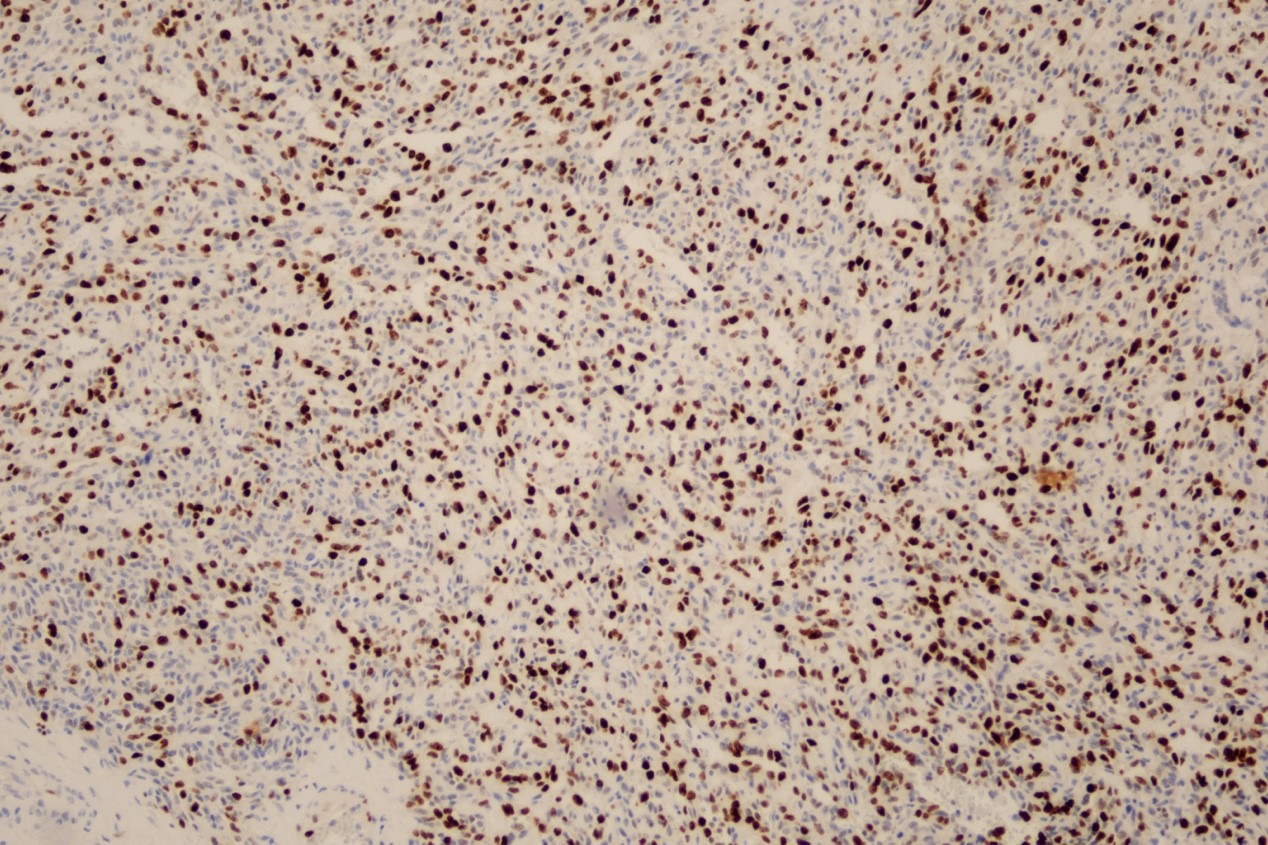 免疫组化:Ki67(约50%+)
免疫组化:Ki67(约50%+)


















共0条评论