WHO女生5ed第10章外阴肿瘤
第10章 外阴肿瘤
外阴肿瘤WHO分类5ed
1、上皮性肿瘤
脂溢性角化病
尖锐湿疣
8077/0 低级别鳞状上皮内病变
8077/0 外阴上皮内肿瘤,1级
8077/2 高度鳞状上皮内病变
8077/2 外阴上皮内肿瘤,2级
8077/2 外阴上皮内肿瘤,3级
8071/2 分化型外阴上皮内肿瘤(VIN)
分化型外生性外阴上皮内病变
外阴棘层肥厚伴分化改变
8085/3 鳞状细胞癌,HPV相关
8086/3 鳞状细胞癌,与HPV不相关
8070/3 鳞状细胞癌NOS
8090/3 基底细胞癌NOS
8405/0 乳头状汗腺瘤
8940/0 软骨样汗管瘤,NOS
9010/0 纤维腺瘤NOS
9020/1 叶状肿瘤NOS
9020/0 叶状肿瘤,良性
9020/1 分叶状肿瘤,交界性
9020/3 分叶状肿瘤,恶性
8500/3 肛门生殖区乳腺样腺癌
2、前庭大腺病变
前庭大腺囊肿
8140/0 腺瘤NOS
8932/0 腺肌瘤NOS
8070/3 鳞状细胞癌NOS
8200/3 腺样囊性癌
8020/3 低分化癌NOS
8560/3 腺鳞癌
8240/3 神经内分泌肿瘤NOS
8982/3 肌上皮癌
8562/3 上皮-肌上皮癌
8085/3 鳞状细胞癌,HPV阳性
8542/3 乳腺外佩吉特病
8400/3 汗腺腺癌
8401/3 顶泌腺癌
8413/3 小汗腺腺癌
8409/3 汗孔癌NOS
8200/3 腺样囊性癌
8144/3 肠型腺癌
3、生殖细胞肿瘤
9064/3 生殖细胞肿瘤NOS
9071/3 卵黄囊瘤NOS
————
形态学代码来自《国际肿瘤疾病分类》,第三版,第二版(ICD-0-3.2)。生物学行为代码/0用于良性肿瘤;/1用于非特指、交界性或不确定行为;/2用于原位癌和III级上皮内肿瘤;/3用于恶性肿瘤的原发部位;/6用于恶性肿瘤的转移部位。癌症登记处通常不使用行为代码/6。
新分类来自第4版WHO分类的修订,考虑到我们对这些病变的理解发生了变化
*IARC WHO ICD-O委员会在2020年6月的会议上批准了标有星号的代码。
以下为旧版分类,供学习比较
外阴肿瘤WHO分类4ed
1、上皮肿瘤
鳞状细胞病变
鳞状上皮内病变
低度鳞状上皮内性病变 8077/0
高度鳞状上皮内性病变 8077/2
分化型外阴上皮内肿瘤(肿瘤)8071/2*
鳞状细胞癌 8070/3
角化型8071/3
非角化型8072/3
基底样 8083/3
疣性癌 8051/3 (warty carcinoma)
疣状癌 8051/3 (verrucous carcinoma)
基底细胞癌 8090/3
良性鳞状上皮病变
尖锐湿疣
前庭乳头状瘤 8052/0
脂溢性角化病
角化棘皮瘤
腺上皮病变
Paget病 8542/3
Bartholin腺及其他阴肛部特化腺体发生的肿瘤
Bartholin腺发生的癌
腺癌 8140/3
鳞状细胞癌 8070/3
腺鳞癌 8560/3
腺样囊性癌 8200/3
移行细胞癌 8120/3
乳腺型腺癌 8500/3
Skene腺起源的腺癌 8140/3
叶状肿瘤,恶性 9020/3
其他类型腺癌
汗腺型腺癌 8140/3
肠型腺癌 8140/3
良性肿瘤和囊肿
乳头状汗腺瘤 8405/0
混合瘤 8940/0
纤维腺瘤 9010/0
腺瘤 8140/0
腺肌瘤 8932/0
Bartholin腺囊肿
结节性Bartholin腺增生
其他前庭腺体囊肿
其他囊肿
神经内分泌肿瘤
高级别神经内分泌癌
小细胞神经内分泌癌 8041/3
大细胞神经内分泌癌 8013/3
Merkel细胞肿瘤 8247/3
2、神经外胚层肿瘤
Ewing肉瘤 9364/3
3、软组织肿瘤
良性肿瘤
脂肪瘤 8850/0
纤维上皮性间质息肉
浅表血管黏液瘤 8841/0*
浅表肌纤维母细胞瘤 8825/0
富细胞性血管纤维瘤 9160/0
血管肌纤维母细胞瘤 8826/0
侵袭性血管黏液瘤 8841/0*
平滑肌瘤 8890/0
颗粒细胞瘤 9580/0
其他良性肿瘤
恶性肿瘤
横纹肌肉瘤
胚胎性 8910/3
腺泡状 8920/3
平滑肌肉瘤 8890/3
上皮样肉瘤 8804/3
腺泡状软组织肉瘤 9581/3
其他肉瘤
脂肪肉瘤 8850/3
恶性外周神经鞘瘤 9540/3
Kaposi肉瘤 9140/3
纤维肉瘤 8810/3
隆突性皮肤纤维肉瘤 8832/1*
4、黑色素细胞肿瘤
黑色素细胞痣
先天性痣 8761/0
获得性痣 8720/0
蓝痣 8780/0
生殖道型非典型黑色素细胞痣8720/0
异型增生痣 8727/0
恶性黑色素瘤 8720/3
5、生殖细胞肿瘤
卵黄囊瘤 9071/3
6、淋巴和髓系肿瘤
淋巴瘤
髓系肿瘤
7、继发性肿瘤
外阴肿瘤:简介
鳞状细胞癌(SCC)是远远最常见的外阴恶性肿瘤。本版WHO分类与前几版的不同之处在于,根据SCC与HPV感染的关系对其进行分类。大约三分之二的外阴SCC是通过HPV不相关途径产生的;它们的生物学行为比HPV相关癌的侵袭性更强。尽管每种病原学亚型(译注:即上文HPV相关和不相关)都有几种形态学模式,但除非使用分子HPV检测,否则无法可靠地区分这两类癌。p16的大片状免疫染色是HPV相关SCC的可靠(尽管不完美)替代品,可以在大多数实验室进行评估。尽管目前两种不同的病因类型在治疗上没有差异,但建议在病理报告中记录SCC的类型(HPV相关或HPV不相关)。然而,在没有条件进行区分的情况下,不加区分的形态学诊断也可接受。
与之前的版本一样,鳞状细胞癌的前驱病变分为HPV相关型和HPV不相关型。HPV相关病变称为鳞状上皮内病变(SIL),这符合统一的肛门下生殖区鳞状细胞术语(LAST)标准化项目建议。与子宫颈和阴道不同,平坦型低度SIL在外阴很少见,大多数HPV相关的外阴前驱病变都是高度SIL。“HPV不相关外阴上皮内肿瘤(VIN)”这个术语推荐用于HPV不相关的前驱病变。该类别中的大多数病变在形态学上归类为分化型VIN,但分化型VIN与高度SIL之间存在一些形态学重叠。最近描述了另外两种HPV不相关SCC的前驱病变:分化型外生性外阴上皮内病变和外阴棘层肥厚伴分化改变。这两种前驱病变归入HPV不相关VIN的亚型。
尖锐湿疣可发生在子宫颈和阴道,但在外阴尤为常见,因此本章将对此进行讨论。年轻女性中的大多数脂溢性角化病代表尖锐湿疣的亚型,应诊断为尖锐湿疣。然而,老年患者中有一部分病例与HPV不相关,本章保留了该实体。
其他原发性肿瘤(如表皮囊肿或基底细胞癌)等同于其他皮肤部位的对应病变,读者可查阅皮肤肿瘤参考书。本章涵盖了起源于乳腺型腺体的肿瘤和来自前庭大腺的病变,以及佩吉特病和其他罕见的原发性外阴腺癌。
外阴黑素细胞病变放在第14章:黑素细胞病变中进行讨论。外阴发生的许多间叶性肿瘤,有些是该区域特有的。这些肿瘤现在归入第13章:下生殖道间叶性肿瘤中,将下生殖道的间叶性肿瘤作为一个整体进行分类和讨论。其他病变,统一归入第11章“神经内分泌肿瘤”、第12章“血液淋巴增生和肿瘤”以及第15章“转移性肿瘤”。
1、上皮性肿瘤
01. 脂溢性角化病
定义
脂溢性角化病是一种良性病变,其特征是鳞状上皮的副基底细胞增殖。
ICD-O编码
无
ICD-11编码
2F21.0脂溢性角化病
相关命名
可接受:老年疣;脂溢性疣
亚型
无
部位
脂溢性角化病发生在外阴的毛发皮肤、擦伤区域(intertriginous area)和大腿内侧。最近,子宫颈和阴道也报道了一些具有脂溢性角化病样特征的病变。
临床特征
脂溢性角化病是无症状的、隆起的斑丘疹、结节或斑块状,通常是色素性病变。
流行病学
脂溢性角化病可见于所有年龄组。
病因
大多数脂溢性角化病,特别是年轻女性,与生殖器型低危型HPV感染有关,应被视为尖锐湿疣。然而,在老年患者,很大一部分病例没有发现HPV。此类病例可能代表涉及外阴的传统非生殖器型脂溢性角化病,但不能排除老年患者低拷贝数HPV感染。
发病机制
在年轻女性中,这些病变更可能是尖锐湿疣。
大体检查
脂溢性角化病呈凸起、蜡样斑丘疹、结节或斑块,通常为色素沉着病变,具有所谓的敷贴外观。
组织病理学
脂溢性角化病表现为表皮棘层肥厚,伴有不同程度的乳头状瘤病、角化过度,无明显核细胞型;有些形态区域可能与尖锐湿疣重叠。通常,角质假囊肿(松散角蛋白形成的病变内囊肿)很容易识别。通过原位杂交和/或PCR检测HPV阳性有助于诊断貌似脂溢性角化病的尖锐湿疣。
细胞学
无临床相关性
诊断分子病理学
无临床相关性
诊断标准
必要标准:棘层肥厚;乳头状瘤病;角化过度伴充角囊肿;无明显异型性。
分期
无临床相关性
预后和预测
脂溢性角化病是良性病变。
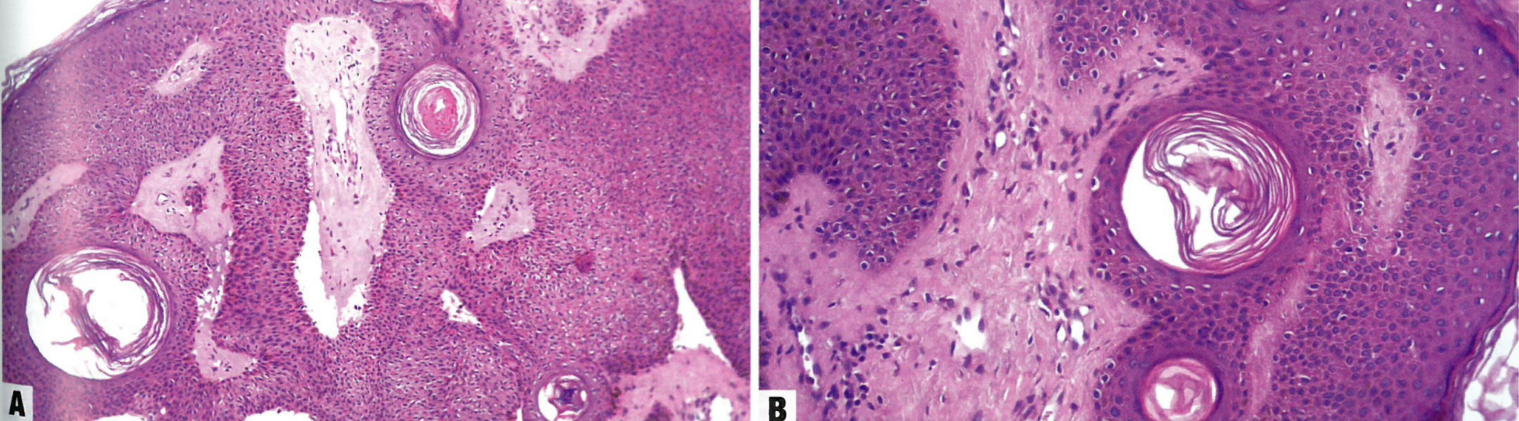 图10.01脂溢性角化病。A棘层肥厚伴基底样细胞增生,角囊肿形成。B充满角质蛋白的囊肿,无异型性。
图10.01脂溢性角化病。A棘层肥厚伴基底样细胞增生,角囊肿形成。B充满角质蛋白的囊肿,无异型性。
02. 尖锐湿疣
定义
尖锐湿疣是由HPV引起的良性疣状乳头状病变。
ICD-O编码
无
ICD-11编码
1A95.1&XA2GU7生殖器疣&女性生殖器官
相关命名
可接受:生殖器疣;肛门生殖区疣;低度鳞状上皮内病变伴尖锐湿疣特征
亚型
巨大尖锐湿疣
部位
尖锐湿疣较常见于外阴皮肤、前庭、会阴和肛周皮肤,但也可见于阴道黏膜和(更罕见的)子宫颈。很少病例累及尿道。
临床特征
生殖器疣可能单独发生,但更常见成簇发生。通常体积小(直径1-5mm),但也可能在生殖区或肛门区生长或扩散并形成大块。它们通常没有症状,但可能引起瘙痒、发红或不适,尤其是在肛门周围。多发性、广泛性、非退行性,有时甚至是巨大病变,更常与免疫抑制有关。
流行病学
尖锐湿疣更常见于性活跃的年轻女性。据估计,大多数病变可以通过四价或九价疫苗预防。
病因
尖锐湿疣是复制性感染HPV的结果,通常是低危型。HPV6和HPV11是最常见类型。偶见高危型HPV。与儿童外阴尖锐湿疣无法区分的病变可能继发于非生殖器型HPV(即HPV2)。
发病机制
尖锐湿疣是一种HPV诱导的鳞状上皮细胞增殖,与其他HPV相关病变一样。
大体检查
尖锐湿疣是外生性、疣状或丘疹性病变。
组织病理学
棘层肥厚和乳头状瘤病,伴乳头状结构形成,以及不同程度的角化不全、颗粒层肥厚和角化过度,是关键特征。表皮突通常增厚。不同程度的挖空细胞改变(角质细胞伴核周透明和核增大,可能核深染),取决于病变的位置和年龄,可能难以观测。还可以观察到核分裂象和细胞凋亡。间质/真皮显示新生血管和慢性炎症浸润。偶尔,尖锐湿疣可能与脂溢性角化病难以区分,尤其是年轻女性和女孩。巨大的尖锐湿疣,也称为Buschke-Lowenstein肿瘤,是一种罕见亚型,偶尔与免疫抑制相关,可能具有局部浸润性,并有恶性转化潜能。前庭乳头状瘤病可能与尖锐湿疣混淆,但缺乏棘层肥厚和挖空细胞。
细胞学
当病变涉及子宫颈或阴道时,宫颈细胞学经常出现低度鳞状上皮内病变(挖空细胞异型性)、意义未明的非典型鳞状细胞或非典型角化不全。
诊断分子病理学
HPV,通常是低危型,可以通过PCR或原位杂交进行鉴定。HPV6和HPV11是最常见的类型。p16免疫染色通常显示不规则、斑片状、非大片状染色。
诊断标准
基本标准:棘层肥厚和乳头状瘤病,伴乳头状结构形成和表皮突增厚;角化不全、角化过度和不同程度的挖空细胞。
分期
无临床相关性
预后和预测
尖锐湿疣是一种良性病变。这种疾病可以通过观察、局部切除、烧灼或局部咪喹莫特来治疗。大多数病例在切除后会自行消退或不再复发。当病变为多灶性或发生于免疫抑制患者时,复发更为频繁。尖锐湿疣会增加艾滋病毒传播的风险。
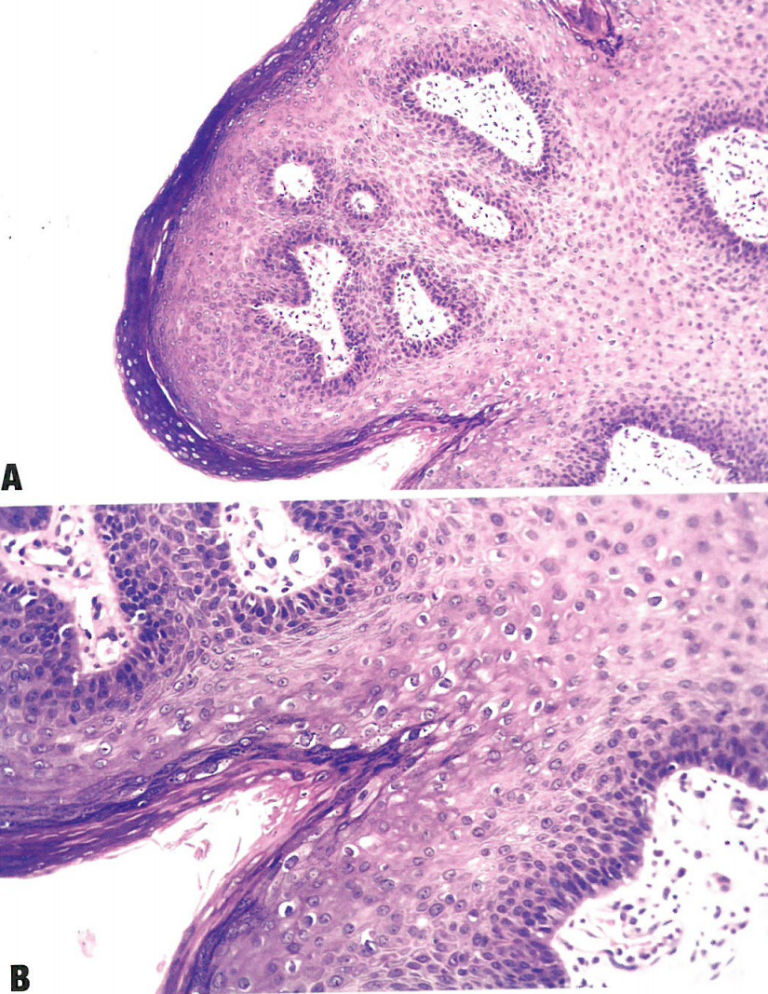 图10.02尖锐湿疣。疣状病变伴乳头状瘤病、棘层肥厚和角化过度的。B浅表角质细胞存在挖空细胞。
图10.02尖锐湿疣。疣状病变伴乳头状瘤病、棘层肥厚和角化过度的。B浅表角质细胞存在挖空细胞。
03. 外阴的HPV相关性鳞状上皮内病变
定义
外阴的HPV相关性鳞状上皮内病变(SIL)(也称为外阴上皮内肿瘤,VIN)是由HPV感染驱动的鳞状细胞增殖,表现出成熟异常和核深染,不超出基底膜。
ICD-O编码
8077/0低度鳞状上皮内病变
8077/2高度鳞状上皮内病变
ICD-11编码
GA13.1&XN8JY外阴上皮内肿瘤NOS&人乳头瘤病毒
相关命名
可接受:低度鳞状上皮内病变(VIN 1);高度鳞状上皮内病变(VIN 2);高度鳞状上皮内病变(VIN 3);普通型VIN 2或3
不建议:中度鳞状细胞异型增生;重度鳞状细胞异型增生;鳞状细胞原位癌;普通型外阴原位癌;鲍温病;鲍温样丘疹病
亚型
外阴上皮内肿瘤,1级;外阴上皮内肿瘤,2级;外阴上皮内肿瘤,3级
部位
这些病变位于大阴唇、小阴唇、前庭、阴蒂、阴道口和会阴。常见多灶性和多中心病变(子宫颈、阴道和/或肛门的过去、同时或未来发生的高级别SIL)。免疫功能低下的女性更常见多灶性。
临床特征
约60%的患者出现瘙痒和刺激性症状。大部分患者无症状。
流行病学
外阴诊断的大多数上皮内病变是HPV相关HSIL。最近几十年来,全球发病率有所上升,但随着HPV疫苗的接种,预计会有所下降。病变通常影响较年轻女性。
病因
高危型HPV是HSIL的病因。70%以上的病例中发现HPV16。其他高危型HPV检出率较低。吸烟和免疫功能低下在流行病学上与HSIL风险增加有关。
发病机制
其发病机制与其他HPV相关高度上皮内肿瘤相似;参见子宫颈HPV相关鳞状细胞癌(原书第347页)。
大体检查
病变表现为白色、红斑或色素沉着的斑块、丘疹或疣状斑块,可以融合。
组织病理学
HSIL中通常发现的特征包括成熟丧失、核深染、N:C比值高、细胞异型性、结构异型性和核分裂象。常见累及皮肤附属物,可能貌似浸润。HSIL有两种形态模式:基底样(未分化)和疣性(尖锐湿疣性、鲍温样),但这两种模式经常重叠。基底样HSIL显示未分化细胞,胞质稀少,取代表皮。疣性HSIL的特征是上皮增厚伴乳头状瘤病、多形性、挖空细胞改变和多核。罕见HSIL可以貌似分化型VIN或乳腺外佩吉特病。间质常见丰富的噬黑素细胞。偶见皮肤淀粉样沉积物和黏液样区域。LSIL主要局限于尖锐湿疣,平坦型LSIL在外阴罕见。
细胞学
无临床相关性
诊断分子病理学
外阴HSIL可以检出HPV DNA或mRNA,p16过表达。p53免疫染色通常显示野生型模式,但可能看到p53染色加重。如果p53表达增加,它通常会保持基底层阴性,强表达仅限于基底层上方的细胞,相反,分化型VIN呈基底层染色。
诊断标准
必要标准:成熟度下降丧失;核深染;高核质比;细胞和结构异型性;核分裂象活跃,表皮上层核分裂象。
理想标准:免疫染色p16弥漫强阳性。
分期
无临床相关性
预后和预测
如果不治疗,HSIL进展为鳞状细胞癌的风险显著但相对较低。自发消退很少见。来自HSIL的鳞状细胞癌通常是基底样和疣性亚型,但角化性癌也很常见。目前的治疗选择包括局部咪喹莫特、局部切除加西多福韦和光动力或激光治疗。复发的风险因素包括年龄>50岁、手术切缘阳性、体积大和免疫抑制。
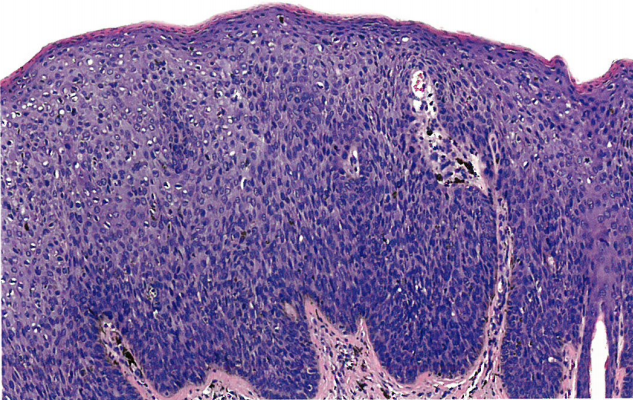
图10.03 HSIL伴混合性基底样和疣性特征。上皮增厚,被核深染、胞质稀少的非典型小细胞取代。没有明显的多形性。上皮的下三分之二出现了结构紊乱,吹风样。存在浅表角化不全。乳头状真皮中可见丰富的噬黑素细胞。
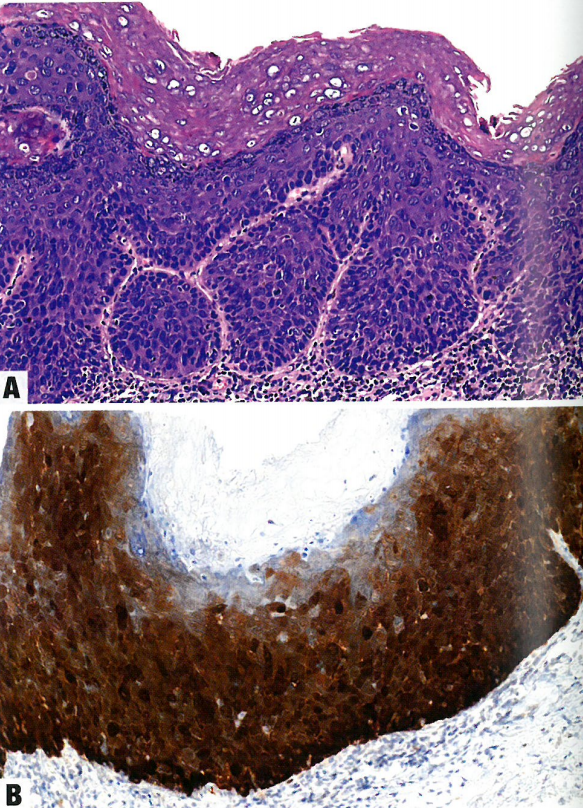
图10.04外阴HSIL。A 混合的基底样和分化特征。病变显示明显的角化过度、颗粒层增厚和真皮乳头间表皮突的吻合。表皮的下三分之一紊乱,被高核质比的未成熟深染细胞所取代。易见一些核分裂象。上皮表面似乎成熟。在某些地区,非典型似乎仅限于基底层。B p16弥漫强阳性,胞质和核都显色,非常有助于区分HPV不相关分化型上皮内肿瘤伴基底样或疣样特征。
04. HPV不相关外阴上皮内肿瘤
定义
HPV不相关外阴上皮内肿瘤(VIN)是的外阴HPV不相关鳞状细胞癌的非浸润性前驱病变,其特征是基底层和副基底的角质细胞异型性,其余上皮分化良好。
ICD-O编码
8071/2分化型外阴上皮内肿瘤(VIN)
ICD-11编码
GA13.1外阴上皮内肿瘤NOS
相关命名
可接受:分化型VIN
不推荐:简单型VIN;简单型原位癌
亚型
分化型外生性外阴上皮内病变;外阴棘层肥厚伴分化改变
部位
不适用
临床特征
常见症状包括瘙痒、刺激、疼痛,和长期瘙痒和灼热感,与先前存在的炎症性疾病(通常是肛门生殖区硬化性苔藓或扁平苔藓)有关。然而,多达50%的病例没有症状。
流行病学
HPV不相关VIN往往影响绝经后妇女,但也可能发生在年轻患者。
病因
HPV不相关VIN的病因尚不清楚。慢性炎症性外阴疾病被认为是主要的致病因素。
发病机制
经常发现TP53突变;可以检测到3号和8号染色体中的cycin D1扩增和拷贝数变化。HPV不相关VIN没有特异性生物标志物。基底层和基底层上方角质细胞中异常核p53免疫染色相对频繁(p53过表达,提示TP53错义突变),但多达30%的HPV不相关VIN病例可能完全缺乏p53染色(无表达或空表达;p53完全不表达模式提示TP53无义突变或截短突变)。在TP53野生型HPV不相关上皮内病变中发现了PIK3CA、NOTCH和HRAS中的体细胞突变。
大体检查
病变往往是单灶性和单中心性,但HPV不相关VIN可能在硬化性扁平苔藓累及的皮肤/黏膜中多灶出现。HPV不相关VIN可表现为角化黏膜中的厚角化斑块,或前庭中的糜烂性红斑或斑块
组织病理学
分化型VIN的标志是在完全分化的上皮中存在异常的非典型角质细胞,后者通常局限于基底层和副基底层。表皮呈现角化不全,可能萎缩或棘层肥厚,表皮突细长并吻合成网。以流产型角化珠形式突然出现的异常角化或角化不良具有特征性。非典型细胞增大、嗜酸性,具有大的空泡状核、大核仁和明显的细胞间桥。常见基底层细胞深染和非典型核分裂象。偶尔,基底层会显示明显的细胞和结构异型性,但仍向上层成熟。罕见累及皮肤附属物,这与HPV相关HSIL不同。即使对于经验丰富的病理学家来说,识别分化型VIN也可能具有挑战性。组织学特征通常与良性反应性上皮(慢性单纯性苔藓、肥厚性硬化性苔藓或扁平苔藓)的组织学特征重叠。分化型VIN可能显示基底样或疣性/尖锐湿疣性形态,貌似HPV相关HSIL。临床病史、p16和p53可能对这些病例有帮助。值得注意的是,硬化性苔藓中p53的过表达可能与缺血有关,不应被误认为分化型VIN的标志物。最近描述了两种不同亚型的HPV不相关前驱病变VIN:分化型外生性VIN和外阴棘层肥厚伴分化改变,其特征是外生性生长、棘层肥厚或疣状结构,并且没有明显的核异型性。
细胞学
无临床相关性
诊断分子病理学
无临床相关性
诊断标准
必要标准:基底层的异型性。
理想标准:p16阴性;异常的p53免疫染色。
分期
无临床相关性
预后和预测
尽管貌似轻微异常,但HPV不相关VIN具有恶性转化的高风险。此外,可能短期内进展为浸润性癌。治疗(残留)皮肤病可能降低浸润性癌的风险。诸如外阴棘层肥厚伴分化改变或分化型外生性VIN这些亚型的预后尚无充分资料,但有报道称其进展为TP53突变癌。来自HPV不相关VIN的鳞状细胞癌大多数属于角化型,但也有非角化型、基底样和疣性亚型。治疗方式是完全切除。
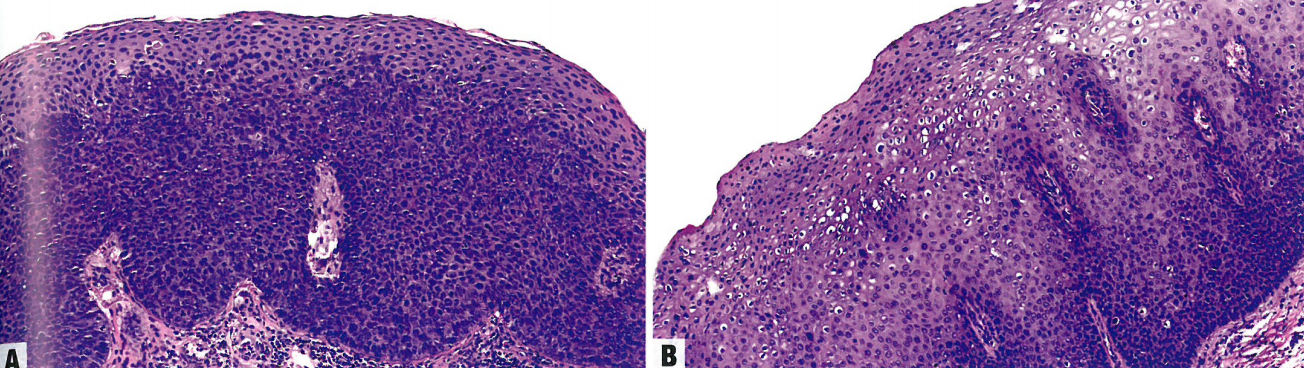 图10.05外阴HSIL。A 基底样HSIL。表皮被非典型小细胞完全取代,核大、胞质少、核分裂象活跃。B 疣性HSIL。表皮有疣状结构,表皮突深而宽。有挖空细胞改变。
图10.05外阴HSIL。A 基底样HSIL。表皮被非典型小细胞完全取代,核大、胞质少、核分裂象活跃。B 疣性HSIL。表皮有疣状结构,表皮突深而宽。有挖空细胞改变。
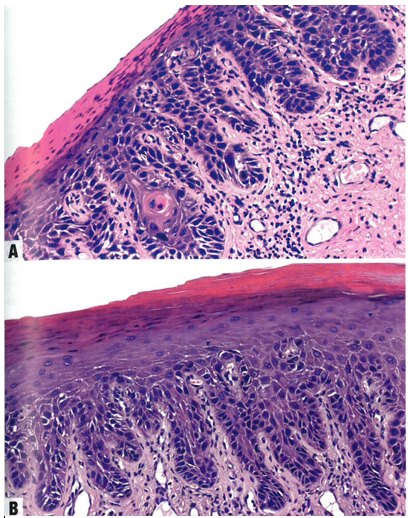
图10.06分化型VIN。A 表皮角化过度。表皮突拉长并吻合。基底层异型性显著,有一些非典型核分裂象。注意存在异常角化,呈角化不良和流产型小角化珠。B 表皮角化过度,表皮突拉长并吻合,细胞间桥明显。在完全分化的上皮中,非典型角质细胞局限在基底层和副基底层。
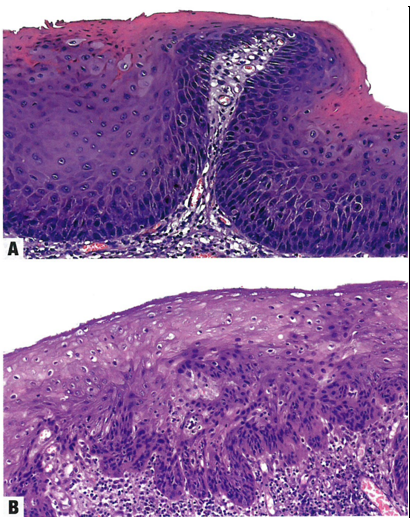
图10.07分化型VIN。A 表皮增厚,表面角化不全。下层由异常的非典型角质细胞组成,有一些核分裂象。B 偶尔,基底层显示出明显的细胞和结构异型性,但仍向上层成熟。
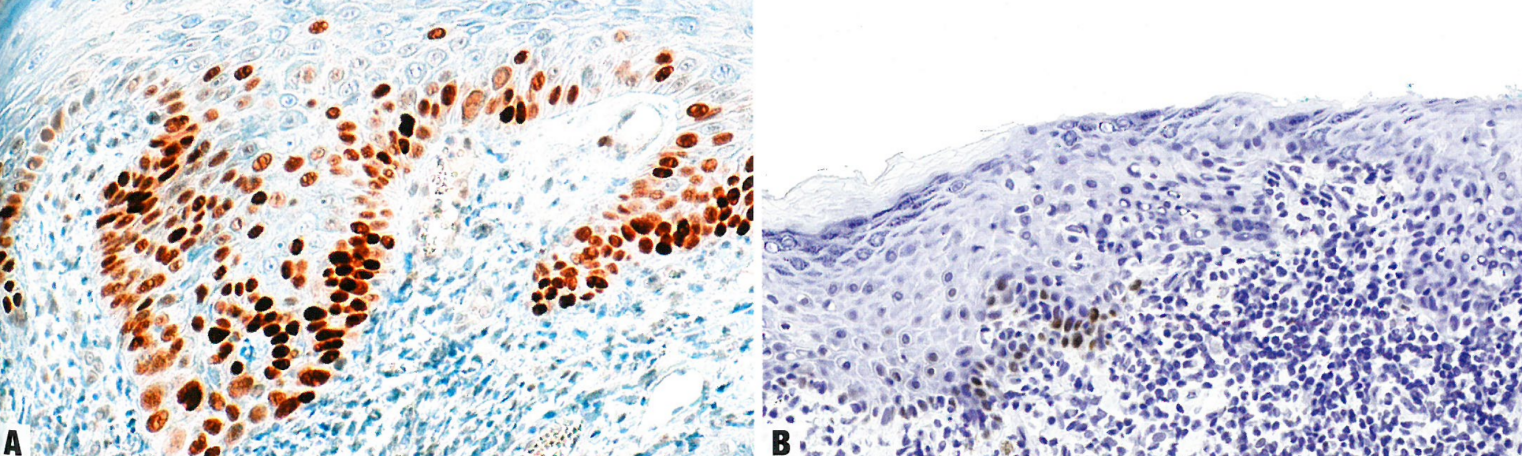
图10.08分化型VIN。A 异常p53染色,其特征是基底层过表达,稍微向基底层上方延伸。B p53无表达。正常上皮(野生型p53染色)和异常上皮(分化型VIN病变无p53染色)之间存在过渡。
01. 外阴的HPV相关鳞状细胞癌
定义
外阴的HPV相关鳞状细胞癌(SCC),是一种HPV相关的恶性鳞状细胞肿瘤,伴有间质浸润。
ICD-O编码
8085/3鳞状细胞癌,HPV相关
ICD-11编码
2C70.2&XHOEJ7外阴鳞状细胞癌&鳞状细胞癌,HPV阳性
相关命名
无
亚型
无
部位
女性外生殖区,包括大阴唇、小阴唇、前庭、阴蒂、阴道口、会阴和尿道口
临床特征
发病高峰出现在60多岁,但也可能发生于年轻人。大多数肿瘤表现为无症状的肿块或溃疡,但也有一些患者出现瘙痒、灼热感、疼痛或出血,尤其是晚期疾病。
流行病学
2018年,外阴癌症(不管HPV状态)占全球癌症女性病例的1%以下,估计当年新增病例44000例。据测算(主要在高收入国家),估计5年生存率为50-70%,全球每年约有15000例死于外阴癌症。从地理角度来看,记录在案的癌症外阴发病率有30倍的差异。德国人群的标准化(世界)发病率最高(每10万人每年6例),亚洲和中东人群的发病率最低(每10万人每年<0.2例)。与HPV感染相关的外阴癌比例为25%。人们对这些肿瘤的兴趣越来越大,有人猜测,在一些高收入国家,<60岁女性发病率的增加是由致癌HPV感染的增加引起的。未来,高覆盖率的HPV疫苗接种可能抵消这些癌症带来的日益增加的负担,这在一定程度上与人口老龄化有关,但这种影响只有在几十年后才能观察到。
病因
这种肿瘤是由HPV感染引起的,尤其是高危型HPV。在所有的HPV相关外阴肿瘤中,有70%以上涉及HPV16。在特殊病例中,低危型HPV基因型,如HPV6和HPV11,被确定为外阴SCC的唯一原因。吸烟和免疫功能低下在流行病学上与HPV相关SCC风险增加有关。
发病机制
病毒癌蛋白E6和E7导致p53和RB的降解,进而导致p16的过表达。因此,免疫组织化学通常显示p16染色呈弥漫强阳性,p53染色呈野生型模式。有时会发现TP53突变,但少见。参见子宫颈HPV相关鳞状细胞癌(原书第347页)。
大体检查
这些肿瘤经常表现为外生性病变。常见多灶性发生。
组织病理学
肿瘤形成浸润性恶性鳞状细胞岛,或广泛、复杂、外生性的膨胀性生长。外阴HPV相关SCC通常为中至低分化。肿瘤可有几种组织学模式。基底样肿瘤由未成熟基底样鳞状细胞粘附成巢,可能类似于HSIL。疣性(尖锐湿疣性)肿瘤具有明显的表层细胞异型性和挖空细胞样改变。这两种模式可以混合,也可以显示角化。1/3的HPV相关SCC为角化性。HPV相关和HPV不相关的外阴鳞状细胞癌之间存在相当大的组织形态学重叠;因此,不能仅凭HE染色进行区分。
浅表浸润性肿瘤和活检,可能难以识别间质浸润。形状不规则的巢、与表面不相连的巢、极性丧失、浸润细胞呈嗜酸性胞质以及存在促结缔组织增生,倾向于间质浸润。
理想情况下,使用具有足够灵敏度和对照的经过验证的分子方法来确认HPV的存在。然而,弥漫性、连续性大片状p16染色是HPV存在的可接受替代标志物,也是该诊断的重要标准。发现邻近的HSIL比较理想,但不是必需的。
细胞学
无临床相关性
诊断分子病理学
无临床相关性
诊断标准
必要标准:浸润性、成角的、大小和形状不规则的巢、成网的条索和实性成片;核多形性和核分裂象;促结缔组织增生性或炎症性间质;p16大片状染色和/或HPV分子检测阳性。
分期
适用国际癌症控制联盟(UICC)和FIGO分期系统。
预后和预测
早期疾病的预后良好,据报道5年生存率为80-90%。分期和淋巴结状态是临床结局最重要的预后因素。淋巴结受累会显著降低生存率。浸润深度与淋巴结受累有关,因此被纳入手术的临床决策树中。与HPV不相关肿瘤相比,HPV相关的外阴SCC无进展生存率较高。
疾病复发率高(12-37%),复发的预测因素包括非根治性切除或阴性边缘<3 mm、肿瘤大小、浸润深度以及淋巴管血管浸润和神经周围浸润的存在。最近的数据表明,具有破坏性浸润和纤维黏液样间质的SCC与不良预后有关,这可能与上皮间质转化有关。
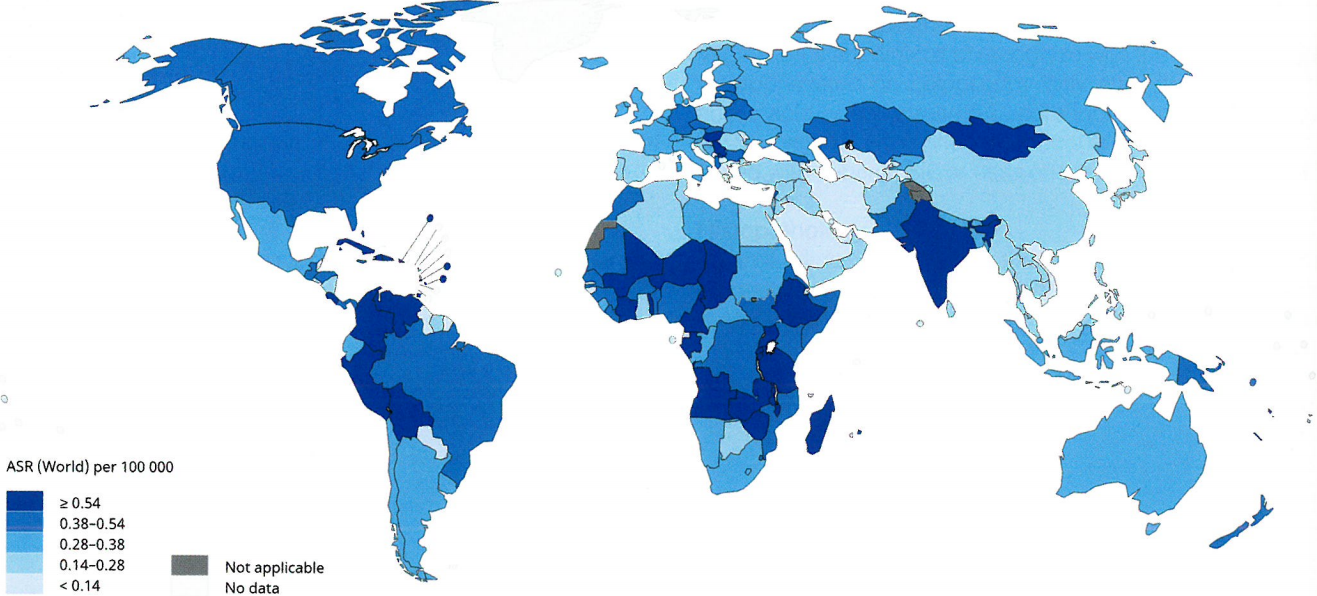 图10.10阴道癌症分布图。2018年外阴癌症的估计年龄标准化发病率(ASR;全球)每10万人每年
图10.10阴道癌症分布图。2018年外阴癌症的估计年龄标准化发病率(ASR;全球)每10万人每年
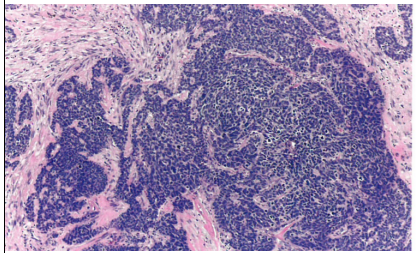
图10.11 外阴的HPV相关鳞状细胞癌,基底样型。
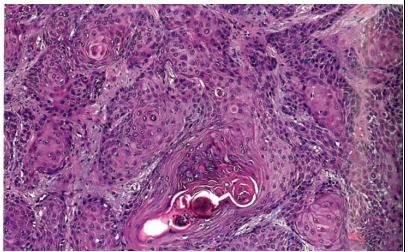
图10.12 外阴的HPV相关鳞状细胞癌伴角化模式。大约1/3的病例显示出这种不同寻常的模式。
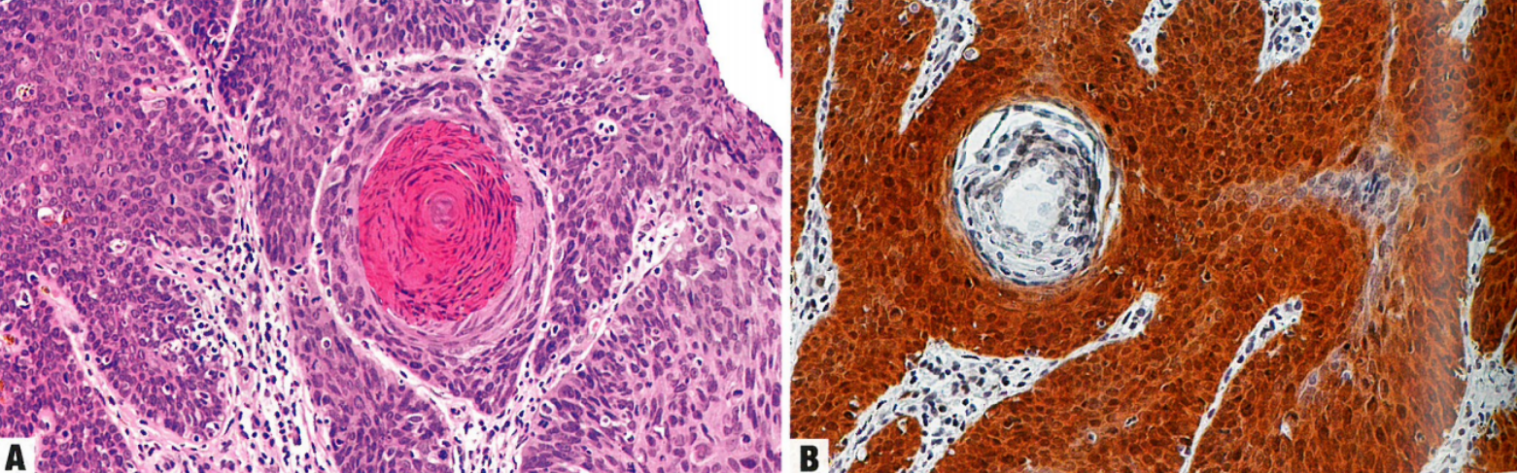 图10.13 外阴HPV相关鳞状细胞癌。A 基底样和角化特征相混合。肿瘤形成形状不规则的巢,巢由紊乱的、未成熟、未分化的细胞组成,类似于HSIL,核分裂象易见。也有角化灶。左侧可见丰富的噬黑素细胞。B 肿瘤细胞呈pl6弥漫强阳性,核和胞质显色。pI6在外阴HPV相关鳞状细胞癌中通常过表达。
图10.13 外阴HPV相关鳞状细胞癌。A 基底样和角化特征相混合。肿瘤形成形状不规则的巢,巢由紊乱的、未成熟、未分化的细胞组成,类似于HSIL,核分裂象易见。也有角化灶。左侧可见丰富的噬黑素细胞。B 肿瘤细胞呈pl6弥漫强阳性,核和胞质显色。pI6在外阴HPV相关鳞状细胞癌中通常过表达。
02. 外阴的HPV不相关鳞状细胞癌
定义
HPV不相关鳞状细胞癌(SCC)是一种HPV不相关恶性鳞状细胞肿瘤,具有间质浸润。
ICD-O编码
8086/3鳞状细胞癌,HPV不相关
ICD-11编码
2C70.2&XH2138外阴鳞状细胞癌&鳞状细胞癌,HPV阴性
相关命名
无
亚型
无
部位
女性外生殖区,包括大阴唇、小阴唇前庭、阴蒂、阴道口、会阴和尿道口。
临床特征
发病率在大约70多岁达到峰值,但也可能发生于年轻女性,特别是硬化性苔藓或扁平苔藓病例。肿瘤表现为无症状肿块或溃疡。一些患者会出现瘙痒、灼热感、疼痛或出血,尤其是晚期疾病。就诊时常见高FIGO分期和/或多发性原发性肿瘤。
流行病学
外阴癌症的一般流行病学特征(不管HPV状态)见“外阴HPV相关鳞状细胞癌(原书第429页)”。风险因素尚不清楚,但外阴HPV不相关SCC通常与硬化性苔藓或扁平苔藓有关。文献中外阴HPV不相关SCC的发病率差异很大(25-80%),并且高度依赖于HPV分布的地理差异。
病因
病因尚不清楚。尽管HPV不相关鳞状细胞癌与外阴皮肤病之间存在很强的关联,但持续性慢性炎症的作用目前尚不清楚。
发病机制
分化型外阴上皮内肿瘤(VIN)是最明确的前驱病变病变。大约80%的外阴HPV不相关SCC具有TP53的体细胞突变,据报道,NOTCH1/、HRAS和PIK3CA的激活突变也很常见。
大体检查
肿瘤通常是外生性肿块,并可能形成溃疡。
组织病理学
HPV不相关SCC通常是高分化角化性癌,形成角化珠。一组肿瘤侵袭性更强的生长模式,在浸润前沿有小巢或单个非典型肿瘤细胞的出芽,并有广泛的促结缔组织增生。其他特征包括棘层松解(腺样或假腺样)或梭形细胞(假肉瘤)分化,伴明显的纤维黏液样间质反应。可能看到其他组织学模式,包括非角化性、基底样和疣性模式。在HE切片上无法可靠地区分HPV相关和HPV不相关的外阴SCC。邻近的表面上皮常见分化型VIN、硬化性苔藓或扁平苔藓。
诊断外阴SCC必需有明确的浸润。这在浅表浸润性肿瘤和活检中可能具有挑战性。理想情况下,应使用经过验证的分子方法来确认HPV阴性。或者,p16免疫染色阴性或非大片状染色可以作为高危型HPV阴性的可接受替代标记物。邻近上皮中存在HPV不相关癌前病变是较为理想的,但不是必需的。
疣状癌(verrucous carcinoma)是HPV不相关癌谱系之一。这些肿瘤分化非常好,显示粘附性或疣状生长模式,浸润通常表现为具有宽阔前沿的球茎状,并有不同程度的角化。这些肿瘤表现出轻微的异型性、丰富的嗜酸性胞质、缺乏异常核分裂象和野生型p53染色。
细胞学
无临床相关性
诊断分子病理学
DNA测序可以识别TP53突变。免疫组织化学显示,增殖的角质细胞或显示核p53过表达(错义突变)或无表达(截短突变/获得突变)。p16染色通常为阴性。
诊断标准
必要标准:浸润、成角、大小和形状不规则的巢、吻合成网的条索和实性成片;核多形性和核分裂象;促结缔组织增生性或炎症性间质;p16阴性和/或HPV分子检测阴性。
分期
适用国际癌症控制联盟(UICC)和FIGO分期系统。
预后和预测
分期和淋巴结受累是最重要的预后因素,手术切除达到阴性边缘是主要的治疗选择。HPV不相关外阴SCC的预后比HPV相关外阴SCC差。TP53状态有助于预测HPV不相关外阴SCC的预后。当浸润深度>1mm时,建议进行单侧或双侧股腹股沟淋巴结切除术或前哨淋巴结活检,因为淋巴结状态(包括受累淋巴结的数量、转移灶大小和淋巴结外生长)会显著影响临床结局。复发率高于HPV相关SCC,范围为12%-37%,可能与残留皮肤病有关。常见多发性局部复发和快速进展。治疗(残留)皮肤病可以降低恶性转化的风险。
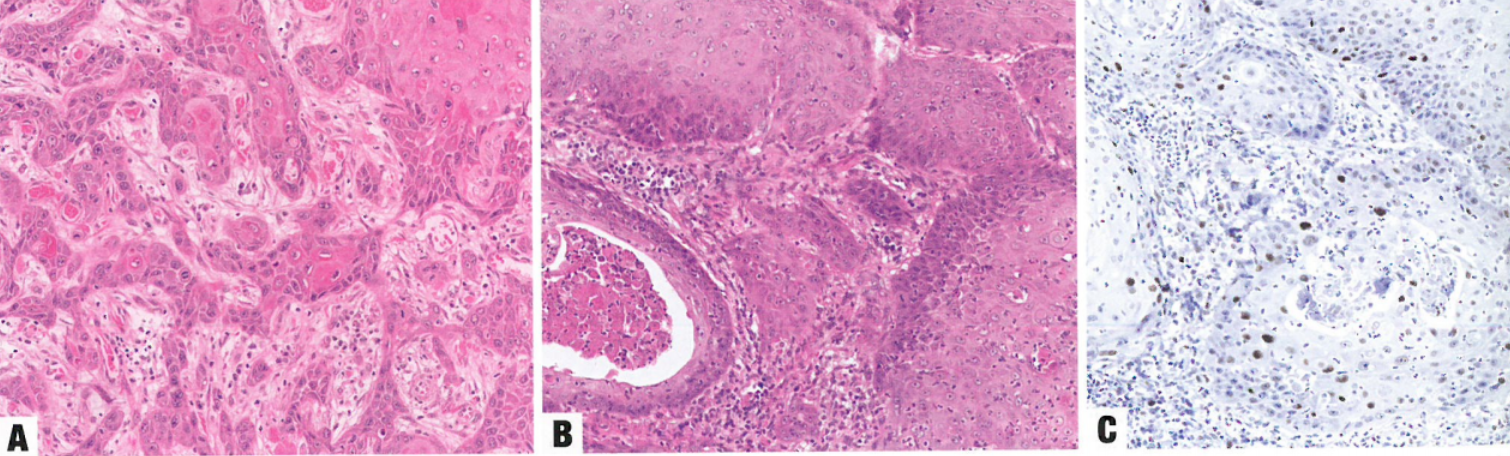 图10.14 HPV不相关SCC。A 角化型。高分化鳞状细胞癌伴明显的角化珠和单个细胞角化。pl6阴性,p53呈弥漫强阳性性核染色。B 疣状癌。C p53免疫染色显示增殖角质细胞呈散在核阳性,代表野生型表达。
图10.14 HPV不相关SCC。A 角化型。高分化鳞状细胞癌伴明显的角化珠和单个细胞角化。pl6阴性,p53呈弥漫强阳性性核染色。B 疣状癌。C p53免疫染色显示增殖角质细胞呈散在核阳性,代表野生型表达。
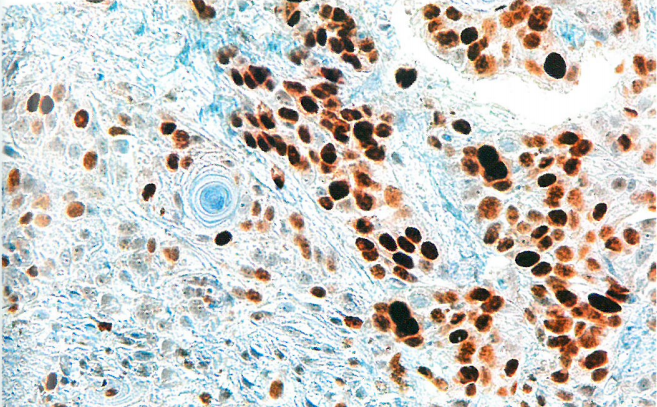
图10.15 HPV不相关SCC。p53免疫染色呈核强阳性(过表达),符合错义突变。
03. 外阴的鳞状细胞癌NOS
外阴的HPV相关和HPV不相关鳞状细胞癌(SCC)的比例因地理区域而异;总体而言,大约2/3的外阴SCC是通过HPV不相关途径发生的。尽管目前HPV相关和HPV不相关肿瘤的治疗没有差异,但建议在病理报告中记录外阴SCC的类型(HPV相关或HPV不相关)。然而,在没有条件进行p16免疫组化或HPV检测的情况下,SCC-NOS的形态学诊断也是一种可接受的替代方法。
ICD-O编码
8070/3鳞状细胞癌NOS
04. 基底细胞癌
外阴基底细胞癌罕见,类似于其他皮肤部位的对应肿瘤。请参考《皮肤肿瘤WHO分类》,了解更多详细信息。
ICD-O编码
8090/3基底细胞癌NOS
05. Papillary hidradenoma
定义
乳头状汗腺瘤(papillary hidradenoma)是一种良性肿瘤,其特征是上皮和间质成分呈分支状和相互连接。
ICD-O编码
8405/0乳头状汗腺瘤
ICD-11编码
2F22&XH4DX4表皮附属器良性肿瘤&乳头状汗腺瘤
相关命名
可接受:乳头状汗腺瘤(hidradenoma papilliferum)
亚型
无
部位
乳头状汗腺瘤最常见于阴唇沟或大阴唇。见《皮肤肿瘤WHO分类》。
临床特征
乳头状汗腺瘤最常见于30-40岁女性。通常表现为孤立、质硬的肿块,有时伴有表面溃疡和出血。病变边界清晰,可移动。上覆表皮通常正常。
流行病学
乳头状汗腺瘤是外阴最常见的良性腺体肿瘤。几乎只影响20-89岁的女性。儿童极罕见。主要发生在白种人群;黑人罕见。
病因
未知
发病机制
有人认为乳头状汗腺瘤来自肛门生殖区乳腺样腺体。乳腺样腺体是外阴(尤其是阴唇沟)、会阴区和肛周区的正常成分。Pl3K/AKT通路中的致瘤性改变已被确定为最常见的遗传异常。
大体检查
乳头状汗腺瘤通常呈褐色或红色的结节,切面从实变到不同程度的囊性,平均大小为1.5cm。
组织病理学
乳头状汗腺瘤由复杂分支和相互连接的小管和乳头组成,乳头含有纤细的中央血管轴心,被覆均匀的立方形至柱状分泌细胞,伴下层肌上皮细胞。常见嗜酸性化生。常有核分裂象活性,偶尔核分裂象活跃。
细胞学
无临床相关性
诊断分子病理学
无临床相关性
诊断标准
必要标准:复杂分支和相互连接的上皮性小管和乳头,伴下层肌上皮细胞。
分期
无临床相关性
预后和预测
乳头状汗腺瘤是良性肿瘤,但如果不完全切除,可能局部复发。据报道,乳头状汗腺瘤中发生原位癌(类似乳腺导管原位癌)和低级别叶状肿瘤。
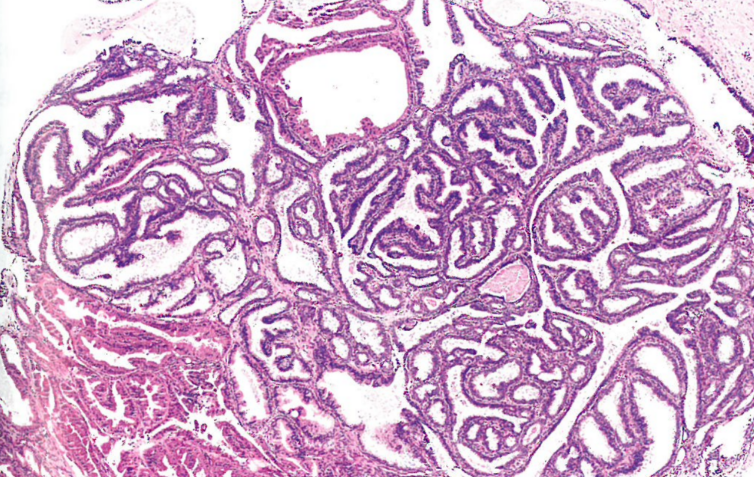 图10.16乳头状汗腺瘤。复杂分支和相互连接的小管和乳头,被覆一致的立方形至柱状分泌细胞,伴下层肌上皮细胞。注意左下方大汗腺变化区域。
图10.16乳头状汗腺瘤。复杂分支和相互连接的小管和乳头,被覆一致的立方形至柱状分泌细胞,伴下层肌上皮细胞。注意左下方大汗腺变化区域。
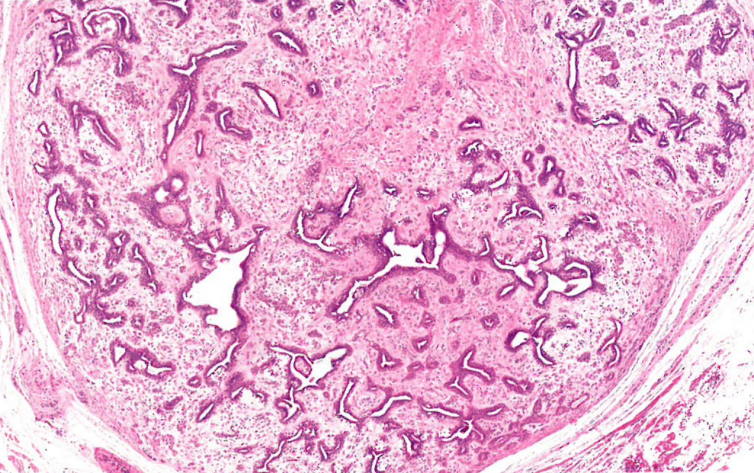
图10.17软骨样汗管瘤。边界清楚的病变,含有上皮、肌上皮和间质成分。上皮细胞形成小管或小梁,伴腺上皮细胞,位于纤维黏液样间质内。
06. 软骨样汗管瘤
定义
软骨样汗管瘤是一种良性外阴肿瘤,混合有上皮、肌上皮和间叶成分。
ICD-O编码
8940/0软骨样汗管瘤NOS
ICD-11编码
GA13.Y&XH7ON8外阴或会阴的其他特指性获得性异常&软骨样汗管瘤
相关命名
可接受:多形性腺瘤;外阴混合瘤
亚型
无
部位
广泛分布于外阴。软骨样汗管瘤肿瘤可能来自前庭大腺或其他前庭腺,也可能来自肛门生殖区乳腺样腺。
临床特征
患者通常是绝经后妇女,通常表现为生长缓慢、孤立、无痛的结节。
流行病学
软骨样汗管瘤是少见的外阴肿瘤。
病因
未知
发病机制
8q12染色体上的PLAG1基因在涎腺多形性腺瘤中持续重排,但尚未在外阴肿瘤中进行研究。
大体检查
软骨样汗管瘤通常是边界清楚的圆形至卵圆形肿块,直径<3cm,切面呈实性或囊实性,白色,有光泽。
组织病理学
组织学通常显示基于真皮的、边界清晰的病变,有上皮、肌上皮和间质成分。上皮细胞形成小管或小梁,伴肌上皮细胞。肌上皮细胞可呈透明细胞、浆细胞样或梭形细胞。间质成分通常呈纤维黏液样,但也可能呈现脂肪细胞、软骨样或骨样分化。
细胞学
细胞学检查与相应的涎腺肿瘤相似。
诊断分子病理学
无临床相关性
诊断标准
必要标准:上皮、肌上皮和间质成分的混合物。
分期
无临床相关性
预后和预测
如果不完全切除,软骨样汗管瘤可能复发。外阴软骨样汗管瘤发生腺癌的罕见病例已有报道。
07. 纤维腺瘤
定义
纤维腺瘤是一种良性、边界清楚的双相上皮-间质肿瘤,类似于乳腺中的相应肿瘤
ICD-O编码
9010/0纤维腺瘤NOS
ICD-11编码
GA13.Y&XH9HE2外阴或会阴的其他特指性获得性异常&纤维腺瘤NOS
相关命名
无
亚型
无
部位
纤维腺瘤最常见的位置是阴唇沟,偶尔出现在外阴的其他部位,以及会阴和肛周区域。
临床特征
外阴纤维腺瘤主要发生在育龄妇女,但也可能发生在绝经后妇女和(很少)青春期前女孩。病变通常呈孤立、质硬的皮下结节,不固定在深层组织上。妊娠期可能出现肿大。
流行病学
外阴纤维腺瘤是非常罕见的肿瘤。
病因
未知
发病机制
有人认为,外阴纤维腺瘤是由肛门生殖区乳腺样腺引起的,其特征类似于乳腺的对应肿瘤(见《乳腺肿瘤WHO分类》)。
大体检查
大多数报道的病例最大径<4cm(范围<1cm至6cm或更大)。切面呈纤维状,可有小囊腔。
组织病理学
与相应的乳腺病变一样,外阴纤维腺瘤边界清晰,形态温和的腺体成分位于相对一致的少细胞间质内。间质由梭形或星状细胞组成,没有核异型性。间质核分裂象活性罕见或缺失。潜在的形态变化包括柱状细胞、大汗腺细胞、囊性或哺乳期变化;常见导管增生;假血管瘤样间质增生;以及多核间质巨细胞。上皮和间质成分通常都表达激素受体(ER和PR)。
细胞学
无临床相关性
诊断分子病理学
无临床相关性
诊断标准
必要标准:具有上皮和间质成分的双相组织学。
分期
无临床相关性
预后和预测
外阴纤维腺瘤是良性病变,通常随访平安,但很少复发,特别是如果切除不完全。
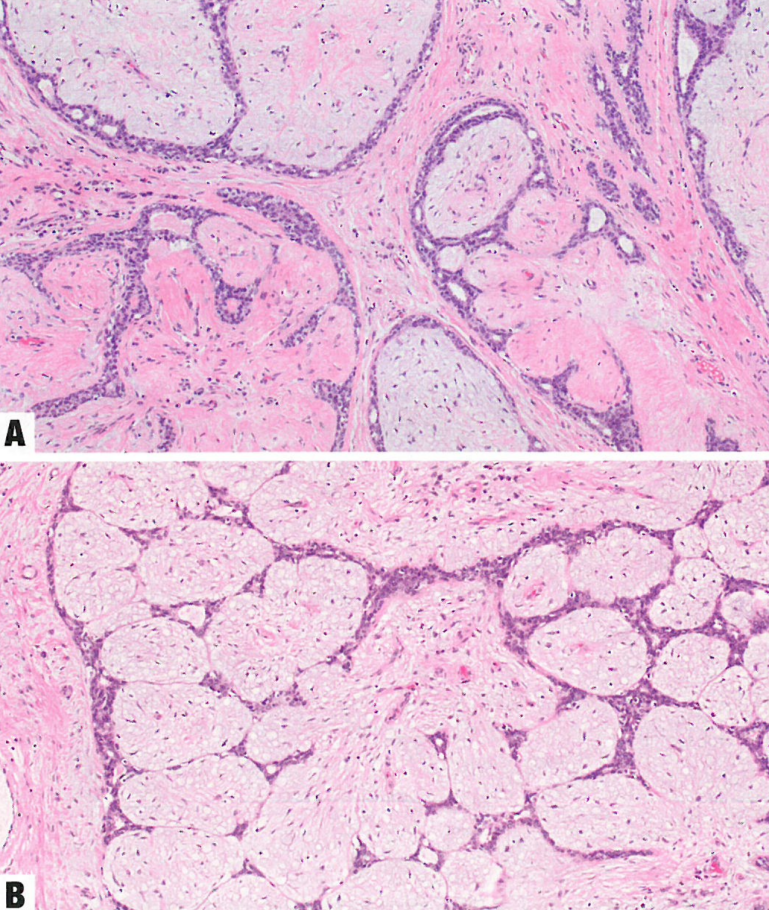 图10.18纤维腺瘤。A 双相上皮-间质肿瘤,形态温和的上皮,位于相对一致的少细胞性间质内,间质细胞呈梭形或星状,无异型性。B 纤维腺瘤伴明显的黏液样间质。
图10.18纤维腺瘤。A 双相上皮-间质肿瘤,形态温和的上皮,位于相对一致的少细胞性间质内,间质细胞呈梭形或星状,无异型性。B 纤维腺瘤伴明显的黏液样间质。
08. 叶状肿瘤
定义
叶状肿瘤是一种双相肿瘤,由乳腺样上皮组成,具有明显的叶状生长和间质细胞增多。
ICD-O编码
9020/1叶状肿瘤NOS
9020/0叶状肿瘤,良性
9020/1交界性叶状肿瘤
9020/3叶状肿瘤,恶性
ICD-11编码
2F33.Y&XH50P7女性生殖器官的其他特指性良性肿瘤&叶状肿瘤,良性
GA13.Y&XH5NK4外阴或会阴的其他特指性获得性异常&分叶状肿瘤,交界性
2C70.Y&XH8HJ7外阴的其他特指性恶性肿瘤&叶状肿瘤,恶性
相关命名
无
亚型
无
部位
大阴唇是最常见的发生部位。
临床特征
就诊时的平均患者年龄为39岁(范围:17-69岁)。患者的外阴肿块可能正在迅速增长。
流行病学
外阴叶状肿瘤是非常罕见的外阴肿瘤
病因
未知
发病机制
有人认为,外阴叶状肿瘤来自肛门生殖区乳腺样腺体。
大体检查
肿块边界情况不一致,切面呈实性或囊实性。肉眼可能见到明显叶状结构。平均大小为3.3cm(范围:0.7-6.6cm)。
组织病理学
外阴叶状肿瘤含有温和的腺体成分,衬覆温和的乳腺样上皮细胞,伴明显的叶状间质生长,突入腺腔中。间质细胞密度常有区域性差异,上皮成分周围有带状的富细胞区域和核分裂象增多。根据间质异型性和核分裂象活性的程度,叶状肿瘤分为良性、交界性或恶性;建议使用与乳腺相似的标准。见《乳腺肿瘤WHO分类》。
细胞学
无临床相关性
诊断分子病理学
无临床相关性
诊断标准
必要标准:双相组织学;乳腺样上皮伴明显的叶状结构;富细胞性间质。
分期
因为叶状肿瘤的间质成分代表肿瘤成分,所以使用国际癌症控制联盟(UICC)TNM分类的第八版,恶性叶状肿瘤可以按肉瘤进行分期。
预后和预测
大约20%的报道病例局部复发,包括一些组织学上“良性”的肿瘤。目前还没有关于远处转移的病例报道。建议使用与乳腺癌类似的标准来预测恶性行为;然而,由于这些是少见的外阴肿瘤,预测恶性行为的标准尚未确立。
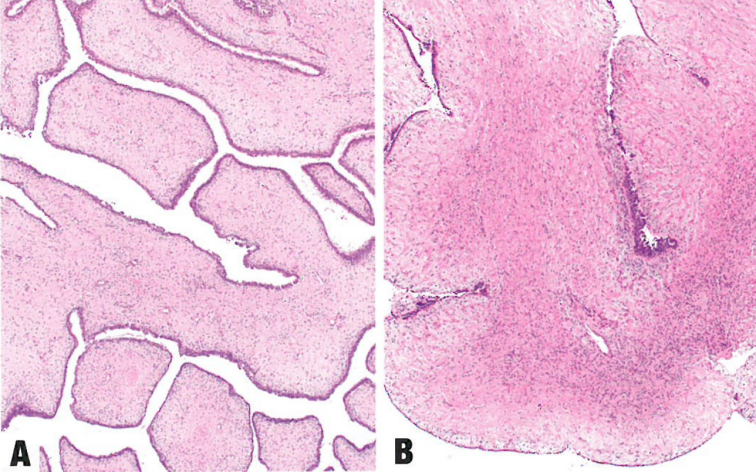 图10.19叶状肿瘤。A 温和的腺体成分衬覆乳腺样上皮,伴明显的明显的叶状间质生长并突入腺腔内。B 间质细胞密度不一,上皮成分周围呈带状富细胞区和核分裂象增多。
图10.19叶状肿瘤。A 温和的腺体成分衬覆乳腺样上皮,伴明显的明显的叶状间质生长并突入腺腔内。B 间质细胞密度不一,上皮成分周围呈带状富细胞区和核分裂象增多。
09. 乳腺型腺癌
定义
乳腺型腺癌是一组原发性外阴肿瘤,其组织病理学特征等同于乳腺癌。
ICD-O编码
8500/3肛门生殖区乳腺样腺癌
ICD-11编码
2C70.Z&XH9FX2外阴的恶性肿瘤,非特指&乳腺型腺癌
相关命名
可接受:肛门生殖区乳腺样腺癌(见《乳腺肿瘤WHO分类》)
亚型
无
部位
最常见的位置是大阴唇。
临床特征
大多数患者是绝经后妇女,表现为孤立的外阴肿块。
流行病学
乳腺型腺癌是少见的外阴肿瘤,通常发生在60岁以上的多产次妇女。
病因
未知
发病机制
有人认为,乳腺型腺癌起源于肛门生殖区的乳腺样腺体。在少数研究案例中发现了Pl3K/AKT级联基因的突变。尤其是分泌性癌携带ETV6-NTRK3融合。
大体检查
大体表现为单发结节,切面呈纤维状,与乳腺癌相似。
组织病理学
最常见的类型是腺癌,等同于乳腺浸润性导管癌,偶尔可识别原位癌。罕见类型包括小叶癌、小管小叶癌、混合性导管和小叶癌以及分泌性癌。常表达ER、PR和HER2。病变必须以皮肤为中心,不应有广泛的上方表皮受累,否则应归类为浸润性佩吉特病。根据免疫特征,这些肿瘤可以像乳腺肿瘤一样分为管腔A、管腔B、富含HER2和基底样亚型。
细胞学
无临床相关性
诊断分子病理学
无临床相关性
诊断标准
必要标准和理想标准等同于乳腺的相应肿瘤。
分期
适用国际癌症控制联盟(UICC)TNM系统,按其他外阴癌分期。
预后和预测
乳腺型腺癌是局部侵袭性肿瘤,通常转移到区域淋巴结。远处转移相对少见。
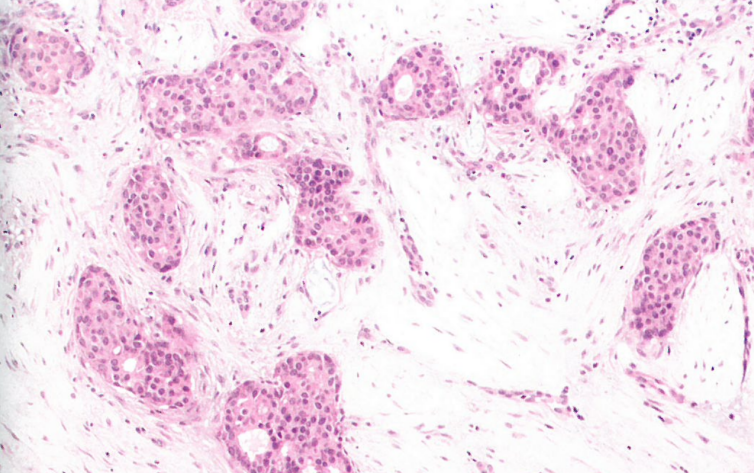 图10.20乳腺型腺癌。肿瘤显示导管分化,类似于乳腺浸润性导管癌。
图10.20乳腺型腺癌。肿瘤显示导管分化,类似于乳腺浸润性导管癌。
2、前庭大腺病变
01. 前庭大腺囊肿
定义
前庭大腺囊肿是累及前庭大腺/导管的囊肿。
ICD-O编码
无
ICD-11编码
GA03.1前庭大腺囊肿
相关命名
可接受:前庭大腺导管囊肿
亚型
无
部位
前庭大腺囊肿发生在前庭大腺区域(位于后外侧阴道口的双侧对称腺体)。
临床特征
前庭大腺囊肿可能无症状;然而,可能增大而变得明显,成为无痛的肿块。如果感染或体积大,可能疼痛。
流行病学
前庭大腺囊肿是相对常见的病变。
病因
未知
发病机制
前庭大腺导管阻塞,形成囊肿。
大体检查
大体表现为囊性病变,囊壁厚度各不相同;囊肿大小可以变化。
组织病理学
前庭大腺/导管囊肿衬覆移行上皮或鳞状上皮,囊壁通常含有正常的前庭大腺组织。常见衬覆上皮的炎症,以及溃疡和脓肿形成。
细胞学
无临床相关性
诊断分子病理学
无临床相关性
诊断标准
必要标准:囊肿衬覆鳞状上皮或移行上皮,位于前庭大腺区。
理想标准:囊壁内正常的前庭大腺组织。
分期
无临床相关性
预后和预测
前庭大腺囊肿是良性病变,但在袋形缝合术或切除术后可能复发。
02. 前庭大腺增生、腺瘤和腺肌瘤
定义
前庭大腺增生是正常前庭大腺组织和导管的良性增生。伴或不伴平滑肌成分的前庭大腺良性肿瘤分别称为前庭大腺的腺瘤和腺肌瘤,但极罕见。
ICD-O编码
8140/0腺瘤NOS
8932/0腺肌瘤NOS
ICD-11编码
GA03.Y前庭大腺的其他特指性疾病
GA03.Y&XH3DV3前庭大腺的其他特指性疾病&腺瘤NOS
GA03.Y&XH4ZH4前庭大腺的其他特指性疾病&腺肌瘤
相关命名
可接受:前庭大腺结节性增生
亚型
无
部位
前庭大腺增生、腺瘤和腺肌瘤发生在前庭大腺(位于后外侧阴道口的双侧对称腺体)区域。
临床特征
在最大的报道系列中,患者的平均年龄为35岁(范围:19-56岁)。通常表现为无痛肿胀。
流行病学
这些病变都是少见病变。腺瘤(已报道2例)和腺肌瘤(已报道1例)都是极罕见。
病因
未知
发病机制
未知
大体检查
这些病变通常相对较小,主要是实性病变,有时有小的囊性区域。
组织病理学
前庭大腺增生由形态温和的黏液性腺泡形成结节状/小叶状增生,保持正常的腺泡和导管排列。导管可能出现炎症和鳞状化生。罕见黏液大量外渗。
真正的前庭大腺腺瘤由小而密集的腺泡和小管形成小叶状排列,腺泡和小管内衬形态温和的上皮,偶有胶体样分泌物,以及邻近的正常前庭大腺成分。Bartholin腺肌瘤除此之外还有纤维肌样间质成分,desmin阳性。据报道,罕见病例伴有腺样囊性癌或上皮-肌上皮癌。
细胞学
无临床相关性
诊断分子病理学
无临床相关性
诊断标准
必要标准:
增生:在前庭大腺内,形态温和的黏液性腺泡形成结节状/小叶状增生,保持正常的腺泡和导管排列;
腺瘤:腺泡和小管紧密排列,与相邻的前庭大腺成分相连续,呈边界清楚的病变;
腺肌瘤:与腺瘤相似,还有纤维肌样间质成分。
分期
无临床相关性
预后和预测
这些实体都是良性病变。
 图10.21前庭大腺增生。形态温和的黏液腺泡增生,围绕导管。
图10.21前庭大腺增生。形态温和的黏液腺泡增生,围绕导管。
03. 前庭大腺癌
定义
前庭大腺癌是起源于前庭大腺的原发性外阴癌。
ICD-O编码
8070/3鳞状细胞癌NOS
8200/3腺样囊性癌
8020/3低分化癌,NOS
8560/3腺鳞癌
8240/3神经内分泌肿瘤NOS
8982/3肌上皮癌
8562/3上皮-肌上皮癌
8085/3鳞状细胞癌,HPV阳性
ICD-11编码
2C70.Z&XH74S1外阴的恶性肿瘤,非特指&腺癌NOS
相关命名
无
亚型
无
部位
前庭大腺癌发生在前庭大腺(位于后外侧阴道口的双侧对称腺体)区域。
临床特征
前庭大腺癌通常发生在中老年妇女,在前庭大腺区域出现无痛性肿块。临床上可能与前庭大腺囊肿或脓肿相混淆。
流行病学
这些癌都是罕见肿瘤,占女性生殖道恶性肿瘤的1%以下和外阴肿瘤的5%以下。
病因
未知
发病机制
一般认为,大多数前庭大腺的鳞癌高危型HPV相关肿瘤。腺样囊性癌可能伴有NFIB相关基因重排。
大体检查
前庭大腺癌形成大小不一的肿块,表面可能形成溃疡,也可能距表面较深,被覆完整的皮肤。
组织病理学
已提出以下标准,将肿瘤视为前庭大腺原发:(1)肿瘤应累及前庭大腺的解剖区域,(2)肿瘤应在组织学上符合前庭大腺起源,(3)良性前庭大腺和肿瘤之间应存在过渡区域,并且(4)不应有其他原发肿瘤的证据。然而,在实际工作中,并非每个病例都符合所有这些标准。
鳞状细胞癌是最常见的形态类型,其次是腺癌。较少见的组织学类型包括:低分化癌、腺鳞癌、神经内分泌癌和各种涎腺型癌(包括腺样囊性癌、肌上皮癌和上皮-肌上皮癌)。鳞状细胞癌通常分化较差,某种程度上呈基底样形态,乳头状和移行细胞样模式也有描述;p16免疫染色通常呈弥漫强阳性,提示可能继发于高危型HPV感染。腺癌分化程度不一致,可能是黏液型或乳头状结构。前庭大腺癌伴外阴乳腺外佩吉特病的偶见病例已有报道。其他肿瘤的形态特征等同于其他部位的对应肿瘤。
细胞学
无临床相关性
诊断分子病理学
无临床相关性
诊断标准
必要标准:累及前庭大腺的解剖区域;组织学符合前庭大腺起源。
理想标准:邻近非肿瘤性前庭大腺。
分期
分期与其他外阴癌相同。
预后和预测
预后在很大程度上取决于诊断时分期。约20%的病例在就诊时发现同侧腹股沟淋巴结转移。在一个系列中,5年生存率为67%,54.5%的患者在平均73.5个月的随访期内复发。另一项研究的结论是,大多数肿瘤处于早期,临床结局较好。
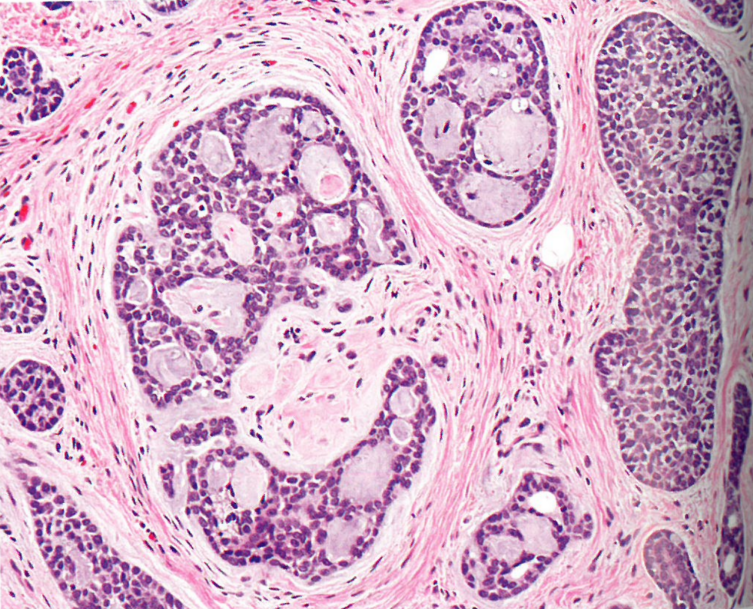 图10.22前庭大腺的腺样囊性癌。肿瘤由单形细胞排列而筛孔,圆形腔隙中含有黏液样物质。
图10.22前庭大腺的腺样囊性癌。肿瘤由单形细胞排列而筛孔,圆形腔隙中含有黏液样物质。
04. 外阴的其他囊肿
定义
发生在外阴的良性囊肿,除外前庭大腺囊肿。
ICD发生
无
ICD-11编码
GA13.3外阴囊肿
相关命名
无
亚型
无
部位
外阴
临床特征
通常表现为无痛肿胀。如果伴有炎症或溃疡,可能疼痛。
流行病学
这些囊肿是少见的外阴病变。
病因
囊肿可能是由于导管阻塞,或上皮细胞陷入而继发囊肿,例如手术或创伤后。Nuck管的囊肿继发于间皮被覆囊肿脱出。
发病机制
未知
大体检查
大体特征是含有液体的囊肿,囊液可能是稀水样、黏液样、浓稠或皮脂样。
组织病理学
外阴前庭出现由良性黏液上皮和/或纤毛上皮衬覆的囊肿。表皮包合囊肿由鳞状上皮构成,而Nuck管的囊肿则由良性间皮构成。囊性子宫内膜异位症也可能发生。
细胞学
无临床相关性
诊断分子病理学
无临床相关性
诊断标准
必要标准:良性外阴囊肿,内衬各种上皮或间皮。
分期
无临床相关性
预后和预测
这些囊肿都是良性病变,切除后很少复发。
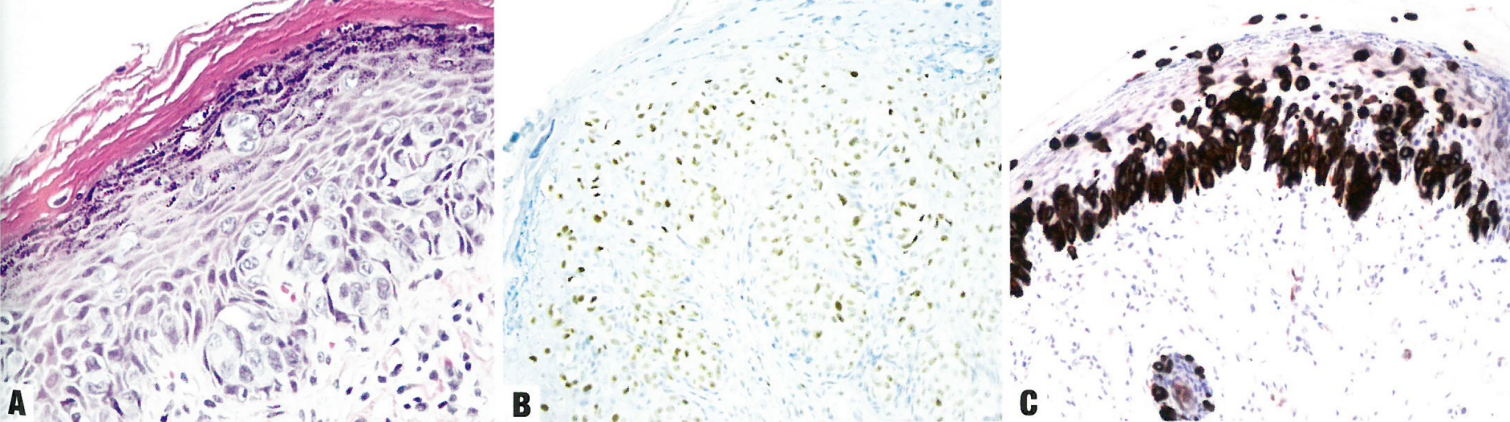
图10.23外阴佩吉特病。A 基底层出现成簇的非典型空泡状细胞,并有单个细胞和小簇向表皮上方延伸。B 佩吉特细胞ER弥漫阳性。C佩吉特病细胞呈CK7强阳性。
05. 佩吉特病
定义
外阴佩吉特病是一种外阴皮肤的原位腺癌,伴或不伴下方的浸润性腺癌。直肠癌、膀胱癌或子宫颈癌继发性累犯外阴皮肤称为“继发性佩吉特病”。
ICD-O编码
8542/3佩吉特病,乳腺外
ICD-11编码
2E67.11外阴佩吉特病
相关命名
可接受:乳腺外佩吉特病;原发性外阴佩吉特病
亚型
无
部位
外阴佩吉特病可能来自小阴唇或大阴唇,并可能延伸到外阴外皮肤和/或累及阴道或(罕见)子宫颈黏膜。
临床特征
患者表现为瘙痒、红斑、湿疹病变,貌似外阴皮肤病或或高度鳞状上皮内病变(VIN 3)。
流行病学
原发性外阴佩吉特病少见,通常影响60岁以上的白人女性。
病因
未知
发病机制
一般认为,外阴佩吉特病起源于表皮或皮肤附件中的多能干细胞。Paget细胞可以表达乳腺癌生物标志物。大多数表达ER和PR,较少表达HER2,据报道HER2扩增率也各不相同。已发现编码Pl3K/AKT级联的基因突变与CDH1高甲基化显著相关。一项使用比较基因组杂交的研究显示,Xcent-q21染色体扩增,10q24-qter染色体缺失。
大体检查
与邻近的正常皮肤相比,佩吉特病通常轻微隆起和发红,边缘不清晰。
组织病理学
表皮内存在大圆形佩吉特细胞,胞质淡染,核增大,常有明显核仁;它们主要位于表皮的基底层,有时单个细胞或小巢细胞向表皮上方延伸,到达表层。常见累及皮肤附件。胞质含有黏液,大多数病例可用PAS或黏液卡红染色来证实。真皮浅层常见明显的宿主炎症反应,伴明显的新生血管形成;导致临床上貌似湿疹。通常以单个或小团细胞的形式浸润真皮,有时形成腺体结构
原发性佩吉特病的细胞持续表达CK7,有助于区分HSIL、HPV不相关VIN和黑色素瘤的细胞。CK7染色可能有助于识别真皮浸润的小病灶。EMA、CAM5、CEA和GATA3通常呈弥漫性阳性。黑色素瘤标志物和HPV均为阴性,但p16可能呈弥漫性阳性。这些细胞通常对uroplakin3、CDX和CK20呈阴性(偶见病例呈CK20局灶阳性);如果阳性,特别是弥漫阳性,应提示尿路上皮癌或直肠腺癌继发性累及外阴皮肤。
细胞学
无临床相关性
诊断分子病理学
无临床相关性
诊断标准
必要标准:胞质丰富的上皮样大细胞,集中在表皮下层,但单个细胞或小团细胞向上延伸,呈佩吉特样模式;这些细胞表达CK7。
分期
浸润性佩吉特病的分期与其他外阴癌的分期相同。
预后和预测
局部复发很常见,尤其是(但不限于)不完全切除后。切除不净很常见,因为佩吉特细胞的延伸通常超过临床可辨认的范围(35%-60%)。疾病相关的死亡率少见(<5%),除非有浸润。随着多次复发,局部控制可能越来越难。浸润深度和腹股沟淋巴结转移与死亡率增加有关。真皮浅层出现很少的孤立肿瘤细胞与预后不良无关。HER2阳性肿瘤患者如有临床指征,可能从靶向治疗中受益。
06. 汗腺起源的癌
定义
汗腺起源的癌都是汗腺型原发性外阴腺癌。
ICD-O编码
8400/3汗腺腺癌
发病机制
未知
大体检查
这些病变通常是坚硬、硬结的肿块,有时伴有上覆溃疡。
ICD-11编码
2C70&XH5LY3外阴恶性肿瘤及汗腺腺癌
相关命名
无
亚型
大汗腺腺癌;小汗腺腺癌;汗孔癌NOS;腺样囊性癌
部位
汗腺起源的癌最常见于大阴唇。汗孔癌来自汗腺瘤,起源于先前存在的汗腺的真皮内部分。
临床特征
大多数患者处于围绝经期或绝经后。典型表现为外阴肿块。
流行病学
没有流行病学数据。
组织病理学
组织学表现变化多端,等同于其他皮肤部位的汗腺癌,见《皮肤肿瘤WHO分类》及其他文献。应排除前庭大腺的起源。
细胞学
无临床相关性
诊断分子病理学
无临床相关性
诊断标准
见《皮肤肿瘤WHO分类》的各个肿瘤类型。
分期
分期与其他外阴癌相同。
预后和预测
常见肿瘤复发,一些患者发生远处转移。
07. 肠型腺癌
定义
外阴的肠型腺癌是一种表现为肠型分化的原发性外阴腺癌。
ICD-O编码
8144/3肠型腺癌
ICD-11编码
2C70&XH外阴恶性肿瘤&肠型腺癌
相关命名
不推荐:泄殖腔源性腺癌(cloacogenic adenocarconoma)
亚型
无
部位
外阴
临床特征
大多数患者表现为前庭后部/阴唇系带的肿块或出血。
流行病学
外阴的肠型腺癌是极为罕见的外阴肿瘤。报道的患者年龄范围为42-69岁。
病因
未知
发病机制
未知
大体检查
大体表现为溃疡或息肉样肿块。
组织病理学
其形态与结直肠腺癌相似,通常具有胞质内黏液和杯状细胞。有一例报道称,存在间变性和梭形细胞癌成分,并含有异源性软骨肉瘤和骨肉瘤成分(癌肉瘤)。这些肿瘤通常呈CK20和CDX2阳性。
细胞学
外阴的肠型腺癌通常不通过细胞学方法诊断。细胞学特征预期与结直肠癌相同。
诊断分子病理学
无临床相关性
诊断标准
必要标准:原发性外阴腺癌伴肠型分化。
分期
分期与其他外阴癌相同
预后和预测
由于这些肿瘤的罕见,数据有限。
3、生殖细胞肿瘤
01. 外阴的生殖细胞肿瘤
定义
生殖细胞肿瘤是原始生殖细胞成分的肿瘤。
ICD-O编码
9064/3生殖细胞肿瘤NOS
9071/3卵黄囊瘤NOS
ICD-11编码
2C70&XH1E13外阴恶性肿瘤&生殖细胞瘤
相关命名
不推荐:内胚窦瘤
亚型
无
部位
外阴
临床特征
患者大多为年龄<30岁的年轻女性(平均19岁;范围:1-52岁),其中2例报道为妊娠期。表现为外阴肿块逐渐增大,最常见于右侧阴唇。血清AFP水平并未持续升高。
流行病学
外阴生殖细胞肿瘤罕见。
病因
未知
发病机制
一般认为,外阴生殖细胞肿瘤来自外阴的生殖细胞,这些生殖细胞由于迁徙错误而持续存在。
大体检查
中位大小为4cm。可能有边界。切面实性,灰白色,鱼肉样,呈斑驳外观,包括出血和坏死
组织病理学
几乎所有病例都代表卵黄囊瘤。肿瘤显示出多种结构模式,其中网状结构最常见。肿瘤细胞大,核深染,不规则;核仁明显;透明胞质(AFP、GPC3和SALL4阳性)。细胞内和细胞外有PAS阳性的透明小球。可能看到SD小体(像胎儿肾小球)。罕见情况下,混合有其他原始生殖细胞肿瘤的成分。
细胞学
无临床相关性
诊断分子病理学
无临床相关性
诊断标准
必备:结构模式符合、细胞细节和免疫组织化学。
分期
其分期与外阴癌症相似。
预后和预测
治疗方法为局部切除联合辅助化疗。大多在诊断后1年内出现外阴复发,通常伴有淋巴结(腹股沟淋巴结、盆腔淋巴结或纵隔淋巴结)、骨或肺/胸膜转移。复发性或转移性病变通过切除和化疗得到控制。
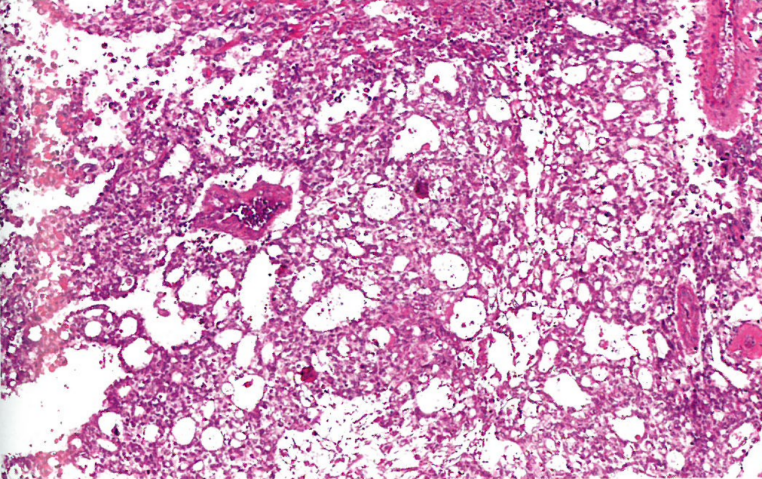 图10.25卵黄囊瘤,网状结构。
图10.25卵黄囊瘤,网状结构。
责任编辑:华夏病理 本站欢迎原创文章投稿,来稿一经采用稿酬从优,投稿邮箱tougao@ipathology.com.cn
相关阅读
 数据加载中
数据加载中
我要评论

热点导读
-

淋巴瘤诊断中CD30检测那些事(五)
强子 华夏病理2022-06-02 -

【以例学病】肺结节状淋巴组织增生
华夏病理 华夏病理2022-05-31 -

这不是演习-一例穿刺活检的艰难诊断路
强子 华夏病理2022-05-26 -

黏液性血性胸水一例技术处理及诊断经验分享
华夏病理 华夏病理2022-05-25 -

中老年女性,怎么突发喘气困难?低度恶性纤维/肌纤维母细胞性肉瘤一例
华夏病理 华夏病理2022-05-07







共0条评论