[导读] 编译整理:强子
简介
大部分非小细胞肺癌都可以从形态学查见腺样分化特征或鳞状分化特征,但也的确有部分病例为低分化,组织学及免疫表型方面无显著谱系分化证据。部分低分化癌的某些区域形态学高度非典型、或仅为这样的表现。因为形态学与未分化多形性肉瘤及梭形细胞肉瘤相似,所以世界卫生组织将其称为“肉瘤样”癌。不过,对这类低分化肺癌的认识仍在探索过程中。
近日,美国罗格斯大学病理专家Suster等人在《Am J Surg Pathol》杂志发表文章,报道了一组14例组织形态学特殊的低分化肺癌病例。这样的病例在世界卫生组织著作中,最初是被归为大细胞癌的;但近些年将其重新归为了肉瘤样癌或多形性癌,且称之为“巨细胞癌”。该文对这组病例的临床病理特征、形态学表现、免疫组化、分子遗传学特征进行了详尽研究。为帮助大家更好的了解相关知识点,我们将该文要点编译介绍如下。
研究内容及结果
该组14个病例来自作者所在单位1980年至2020年间的存档资料。临床病理特征方面,男女性各7例;年龄42岁至72岁不等,平均57岁。影像学上,所有肿瘤都表现为外周肿物,大多见于胸膜下,且主要见于上叶。肿瘤最大径1.3cm至9.0cm不等,平均4.6cm。切面描述为灰白色、分叶状肿物,质软,伴出血及坏死。所有患者均为手术切除,是否辅助化疗、和/或放疗以及临床症状及吸烟史等更多信息,详见原文。
有3个病例首诊即表现为转移;后续影像学检查中均发现了肺部原发灶。13例有临床随访信息,8例死于该病,具体与确诊时的时间间隔为6个月至8年不等,平均2.7年。需要注意的是,这8个病例中有6例的T分期相对低,为T1或T2期。3例仍存活,无病时间间隔4-6年不等。
组织学上,低倍镜下该组肿瘤为失黏附的片状瘤细胞,背景为大量炎症细胞。高倍镜下,瘤细胞表现不一:从类似组织细胞的小而非典型细胞、至较大的细胞均有,后者大小为组织细胞的2-3被,细胞核深染、增大,胞质丰富。更大的多核巨细胞则大于正常组织细胞的十倍。较大瘤细胞的特征是细胞核增大,染色质呈开发模式,且有增大、多为多个的核仁。容易查见多个散在的双核、R-S样瘤细胞。个别病例中,较大瘤细胞的胞质细腻、空泡状,类似脂母细胞。还可见染色质呈马蹄样分布、有显著核仁而类似间变性大细胞淋巴瘤中标志细胞样表现的细胞。
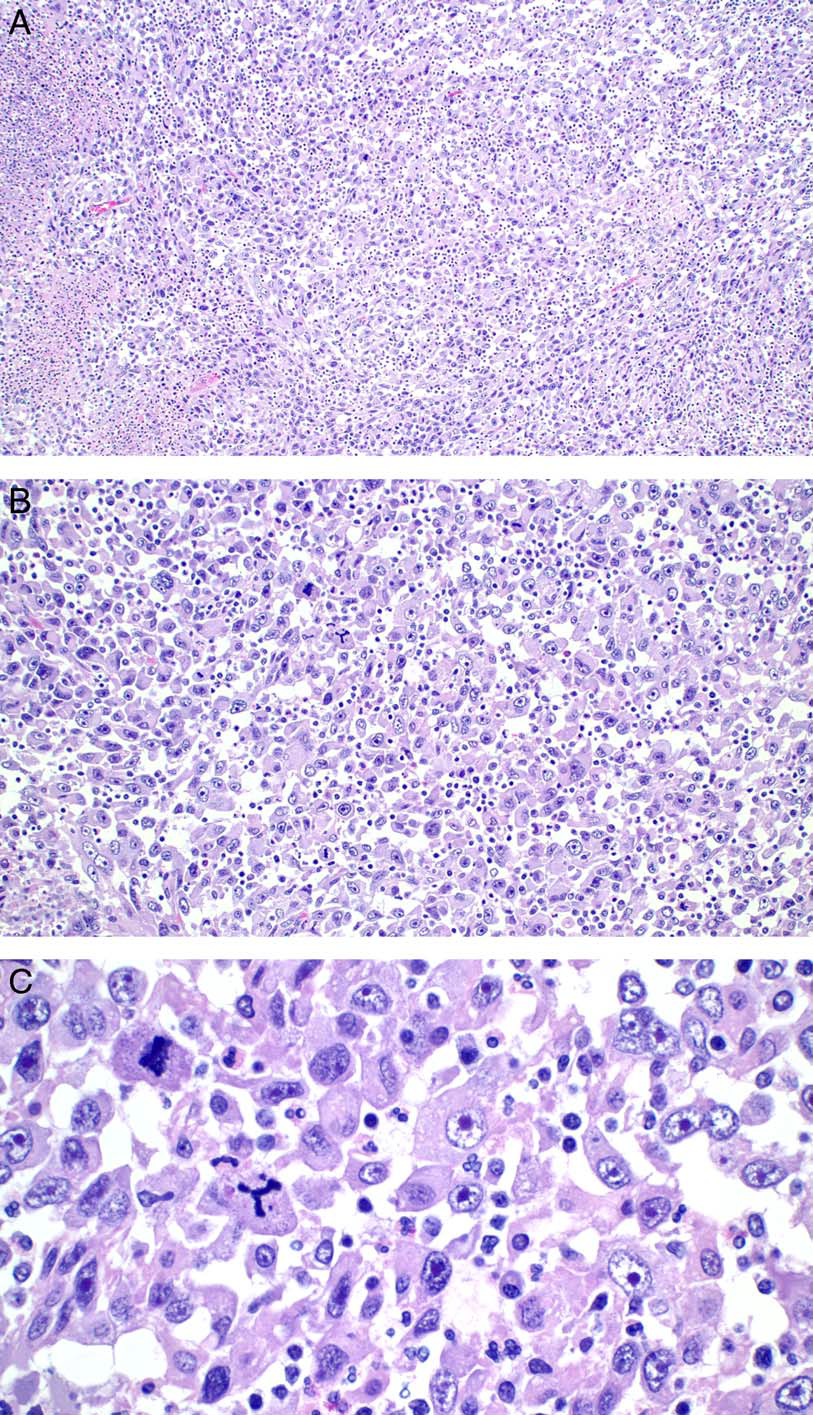 图1.肺的炎性巨细胞癌。(A)低倍镜下,失黏附的非典型上皮样细胞呈片分布,其间有大量炎症细胞;(B)中倍镜下,失黏附的瘤细胞细胞核大、有显著合肥,散在核分裂,偶见多核细胞;(C)高倍镜下的单个散在非典型细胞,细胞核大、染色质空泡状,有显著核仁;胞质嗜酸性,可见异常核分裂。背景中可见散在炎症细胞浸润。
图1.肺的炎性巨细胞癌。(A)低倍镜下,失黏附的非典型上皮样细胞呈片分布,其间有大量炎症细胞;(B)中倍镜下,失黏附的瘤细胞细胞核大、有显著合肥,散在核分裂,偶见多核细胞;(C)高倍镜下的单个散在非典型细胞,细胞核大、染色质空泡状,有显著核仁;胞质嗜酸性,可见异常核分裂。背景中可见散在炎症细胞浸润。
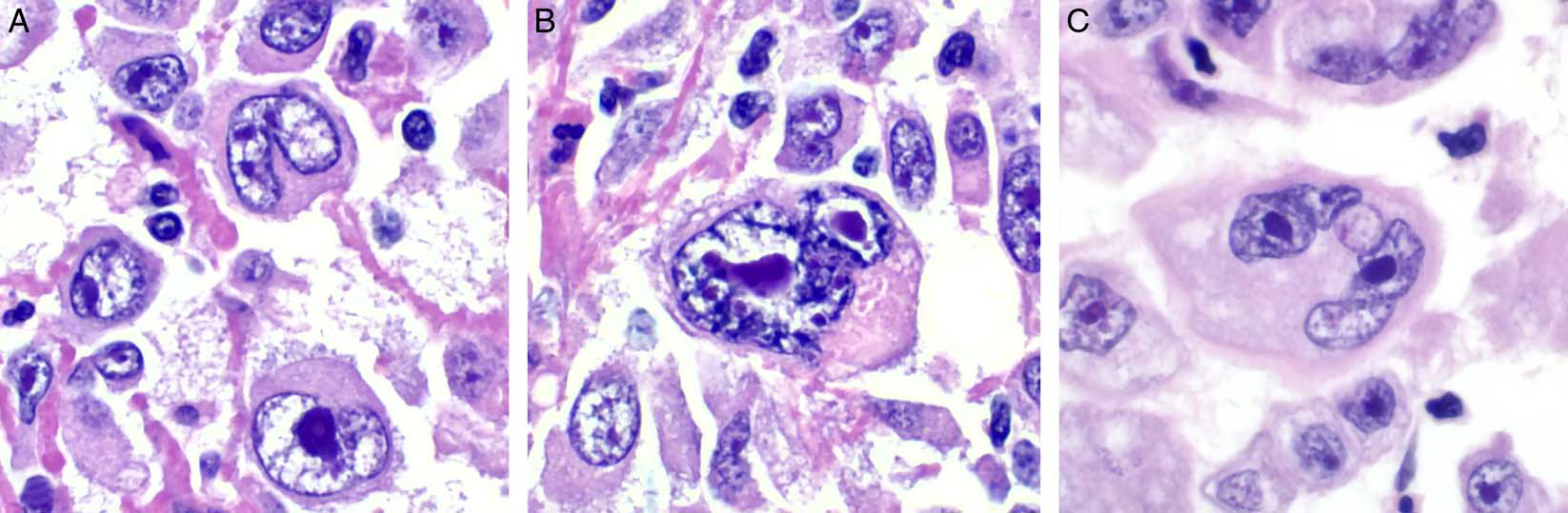 图2.(A)大而失黏附的瘤细胞高倍镜,细胞核大、间变性表现,核仁显著,常为多个;(B)双核瘤细胞,核仁呈显著嗜碱性、“枭眼样”,类似Reed-Sternberg细胞;(C)细胞核呈马蹄样的较大瘤细胞,类似间变性大细胞淋巴瘤中的标志性细胞。
图2.(A)大而失黏附的瘤细胞高倍镜,细胞核大、间变性表现,核仁显著,常为多个;(B)双核瘤细胞,核仁呈显著嗜碱性、“枭眼样”,类似Reed-Sternberg细胞;(C)细胞核呈马蹄样的较大瘤细胞,类似间变性大细胞淋巴瘤中的标志性细胞。
该组病例中,未见细胞核怪异、污浊表现且染色质极为致密的大而嗜碱性细胞,即合体滋养细胞肿瘤中细胞的表现。散在有细胞可见致密嗜酸性包涵体,即“横纹肌样”细胞。背景中的炎症成分将肿瘤细胞分隔开来,具体主要为多形性中性粒细胞、混杂有散在的小淋巴细胞、浆细胞,偶见组织细胞。少数区域可见微脓肿。大部分病例中的炎症程度为轻至中度,有2例极为严重、甚至掩盖了肿瘤细胞。
该组肿瘤均核分裂活跃,核分裂计数8-18个/2mm2;大部分病例容易查见异常的三极核分裂或星爆状核分裂。大部分病例中的另一个显著特点是吞噬现象,具体从1-2个小淋巴细胞位于单个肿瘤细胞的胞质内、到“口袋状”的中性粒细胞和淋巴细胞位于非典型细胞的胞质内不等。该组肿瘤大部分都有肿瘤性坏死区。有6例可见少量腺癌或鳞癌局灶过渡;5例局灶有腺癌成分,具体包括实性表现腺癌2例、腺泡状腺癌2例;1例可见岛状低分化鳞癌。不过,这些病例中还是间变性表现的巨细胞成分为主,具体超过80%至90%。
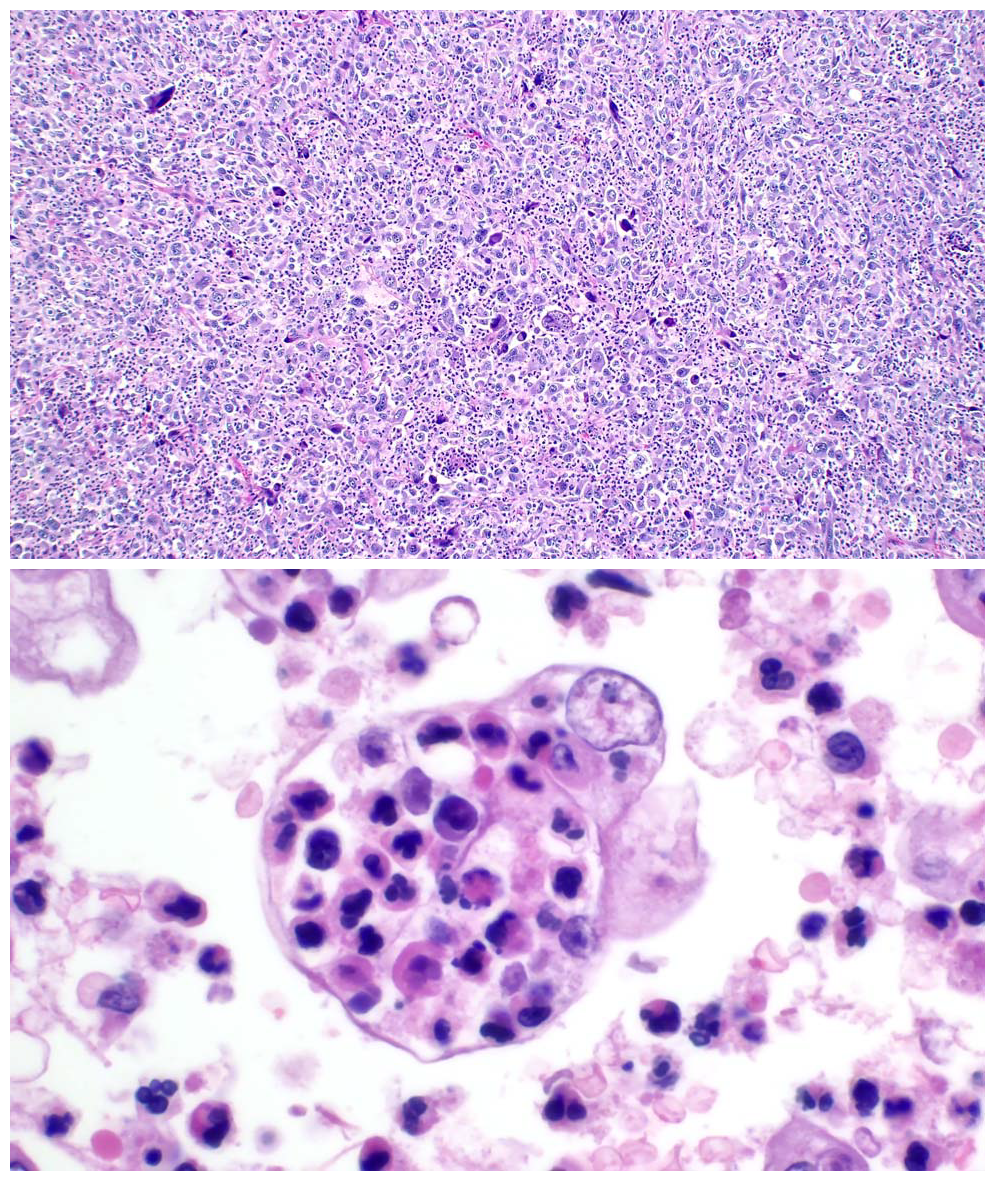 图3.肺的炎性巨细胞癌中,背景可见大量炎症细胞浸润,且常见吞噬现象;本例瘤细胞胞质中有大量淋巴细胞和中性粒细胞。
图3.肺的炎性巨细胞癌中,背景可见大量炎症细胞浸润,且常见吞噬现象;本例瘤细胞胞质中有大量淋巴细胞和中性粒细胞。
所有病例均做了免疫组化,瘤细胞表达AE1/AE3和CK8/18。所有病例中的肉瘤样大细胞均不表达TTF1、napsin A、p40、CK5/6。前述病例中的小灶腺癌成分程度不等的表达TTF1和napsin A;小灶鳞状分化区域表达p40。Ki-67表明增殖活性升高,从50%至80%不等。为排除转移性黑色素瘤,做了S100免疫组化,且均为阴性。有横纹肌样胞质的病例做了BRG1(SMARCA4)检测,以排除SMARCA4缺陷型肿瘤,所有病例均有阳性表达。
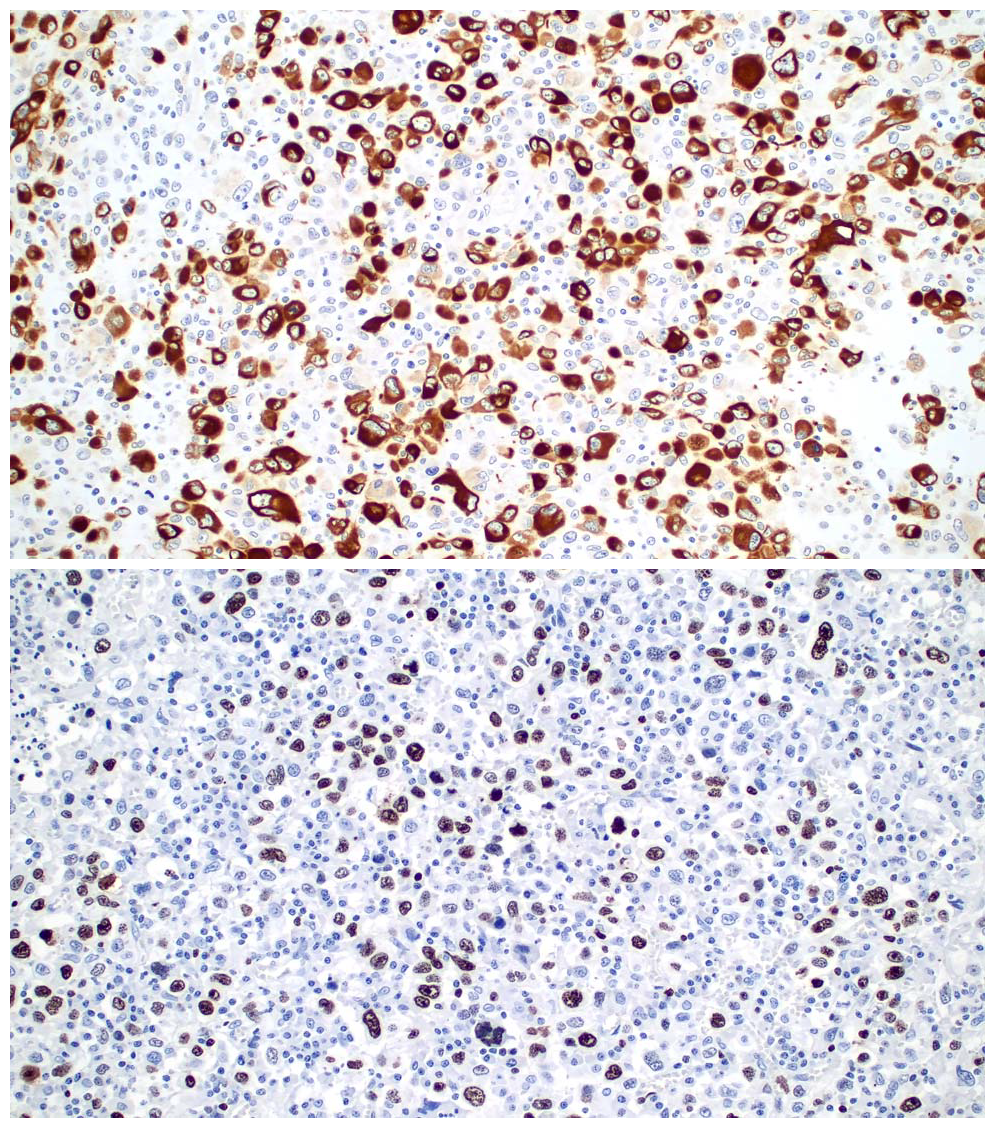 图4.(上)免疫组化CK8/18,肿瘤细胞强阳性表达,而背景中的炎症细胞不表达;(下)Ki-67,本例增殖指数约50%。
图4.(上)免疫组化CK8/18,肿瘤细胞强阳性表达,而背景中的炎症细胞不表达;(下)Ki-67,本例增殖指数约50%。
14个病例中,均检出了不同类型的致病性遗传学改变,涉及14种癌相关基因。最常见为TP53基因的点突变,还有一例涉及TP53的多个突变;其他基因改变还涉及KRAS、MAP2K1/2、FGFR1、GNA11、HRAS、PIK3CA等。具体的分布情况及不同基因改变的组合情况,请参阅图5并移步原文。
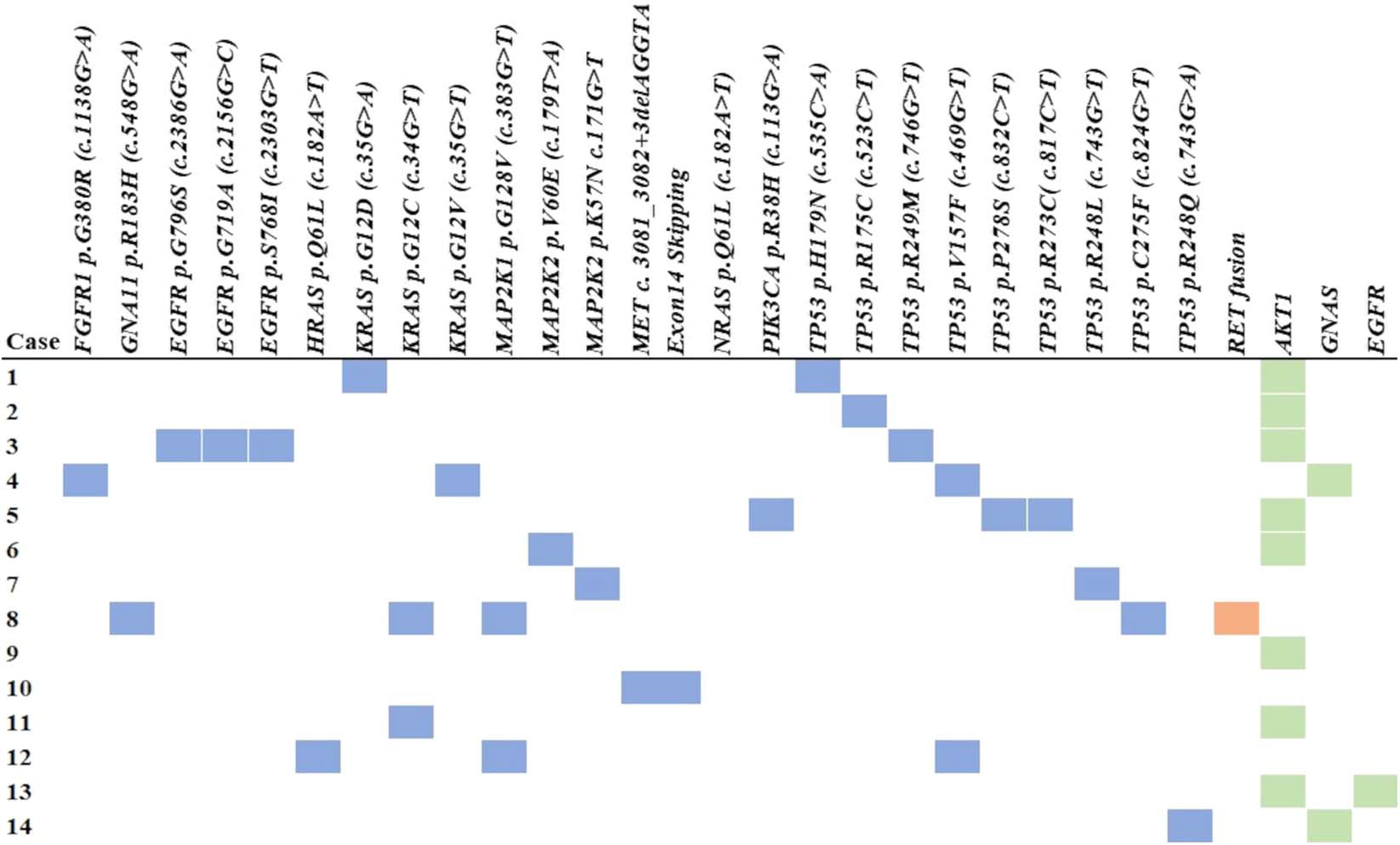 图5.该组14个病例检出的分子改变情况。其中蓝色代表致病性突变,绿色代表基因扩增,橘黄色代表基因融合。
图5.该组14个病例检出的分子改变情况。其中蓝色代表致病性突变,绿色代表基因扩增,橘黄色代表基因融合。
小结
主要为肉瘤样细胞构成的肺原发癌准确分类,还是有一定难度的。目前的世界卫生组织分类将这类肿瘤归为肉瘤样癌,且具体分为三种:(1)多形性癌,是指低分化的非小细胞肺癌,或至少有10%梭形细胞和/或巨细胞的大细胞癌,或仅为梭形细胞及巨细胞的癌;(2)癌肉瘤,是指非小细胞肺癌混杂真正肉瘤样成分,后者有特殊的异源性成分;(3)肺母细胞瘤,是指肿瘤中有胚胎型上皮成分和原始间叶性成分。不过,这些肿瘤之间的特征存在重叠,因此常导致准确分类和诊断较为困难。
其实巨细胞癌的名称早已见于文献,只是当时报道中的病例有些含有梭形细胞成分,还有些可能是伴HCG分泌的滋养层巨细胞癌。
本文报道的14例肺部低分化癌,根据其肿瘤形态和显著炎症细胞浸润,作者认为最好将其归为炎性巨细胞癌。具体来说,瘤细胞失黏附、致密炎症细胞浸润,是该组肿瘤最显著、最独特的形态学特征,也因此而可以和其他多形性癌、肉瘤样癌区别开。该组肿瘤一般为侵袭性行为,但已手术切除的早期病例也可获得较好的生存数据。
点此下载原文献
参考文献
[1]Suster DI, Mackinnon AC, Ronen N, et al. Inflammatory Giant Cell Carcinoma of the Lung: Clinicopathologic, Immunohistochemical, and Next-generation Sequencing Study of 14 Cases. Am J Surg Pathol. Published online July 11, 2024.
doi:10.1097/PAS.0000000000002285


















共0条评论