[导读] 编译整理:强子
前言
体细胞来源的卵黄囊瘤为罕见肿瘤,目前认为其来源是通过逆分化、异常分化、化生而发生的上皮性恶性肿瘤。该肿瘤临床最常见于绝经后,且常见和多种类型的癌同时出现。除发生于卵巢外,该肿瘤还常见于子宫内膜和其他的生殖道之外部位,某些情况下推测是来源于子宫内膜异位。
子宫内膜中体细胞来源的卵黄囊瘤最常见同时伴有经典的癌。对于纯粹为卵黄囊形态的病例来说,则认为是经典的癌未能取到或卵黄囊瘤成分过度生长。与经典的卵黄囊瘤一样,体细胞来源的卵黄囊瘤也可出现诸多形态学表现,因此很可能会误判为其他病种,如伴分泌分化的子宫内膜样癌、透明细胞癌、浆液性癌、转移性结直肠癌。
近日,弗吉尼亚大学病理专家Mills等人在《Am J Surg Pathol》杂志发表文章,报道了他们对300例连续的子宫内膜恶性肿瘤进行卵黄囊分化免疫标记情况的研究结果。为帮助大家更好的了解相关知识点并指导临床实践,我们将该文要点编译介绍如下。
研究内容及结论
作者日常工作中,遇到了一例通过免疫组化SALL-4、Glypican-3、AFP免疫组化而推测为体细胞来源卵黄囊瘤的高级别子宫内膜恶性肿瘤。在此基础上,作者对存档病例制作组织微阵列,筛选出免疫组化有卵黄囊样分化证据的子宫内膜癌并进行至少5年临床随访,对相关数据总结整理后发表了该文章。
本文的索引病例(index case)为74岁女性,因绝经后出血就诊。子宫内膜活检为高级别肿瘤,瘤细胞呈片状及岛状分布,背景伴广泛坏死;瘤细胞胞质中等,透明至嗜酸性,散在核下空泡。细胞核不规则,核仁显著,有大量非典型核分裂(30个/10HPF)。未见Schiller-Duval小体。免疫组化p53为过表达,而Napsin A、ER、p16均为阴性。
鉴于该肿瘤形态学独特,如有显著核下空泡、数量极高的核分裂,因此加做免疫组化SALL-4、Glypican-3、AFP:前两者弥漫、强阳性(90%以上细胞3+),AFP散在局灶阳性(30%细胞,3+),坏死组织中为弥漫着色。结合形态学,这一免疫组化特点支持体细胞来源的卵黄囊瘤。该例加做错配修复蛋白检测,未见缺陷。BRG/INI1表达无缺失。本例活检标本中未见经典表现的子宫内膜癌/癌肉瘤。建议临床查血清AFP,结果为10024ng/mL。后续子宫切除标本中,背景可见有大量软骨分化的癌肉瘤成分;FIGO分期IB;文章发表时未能获取到随访信息。
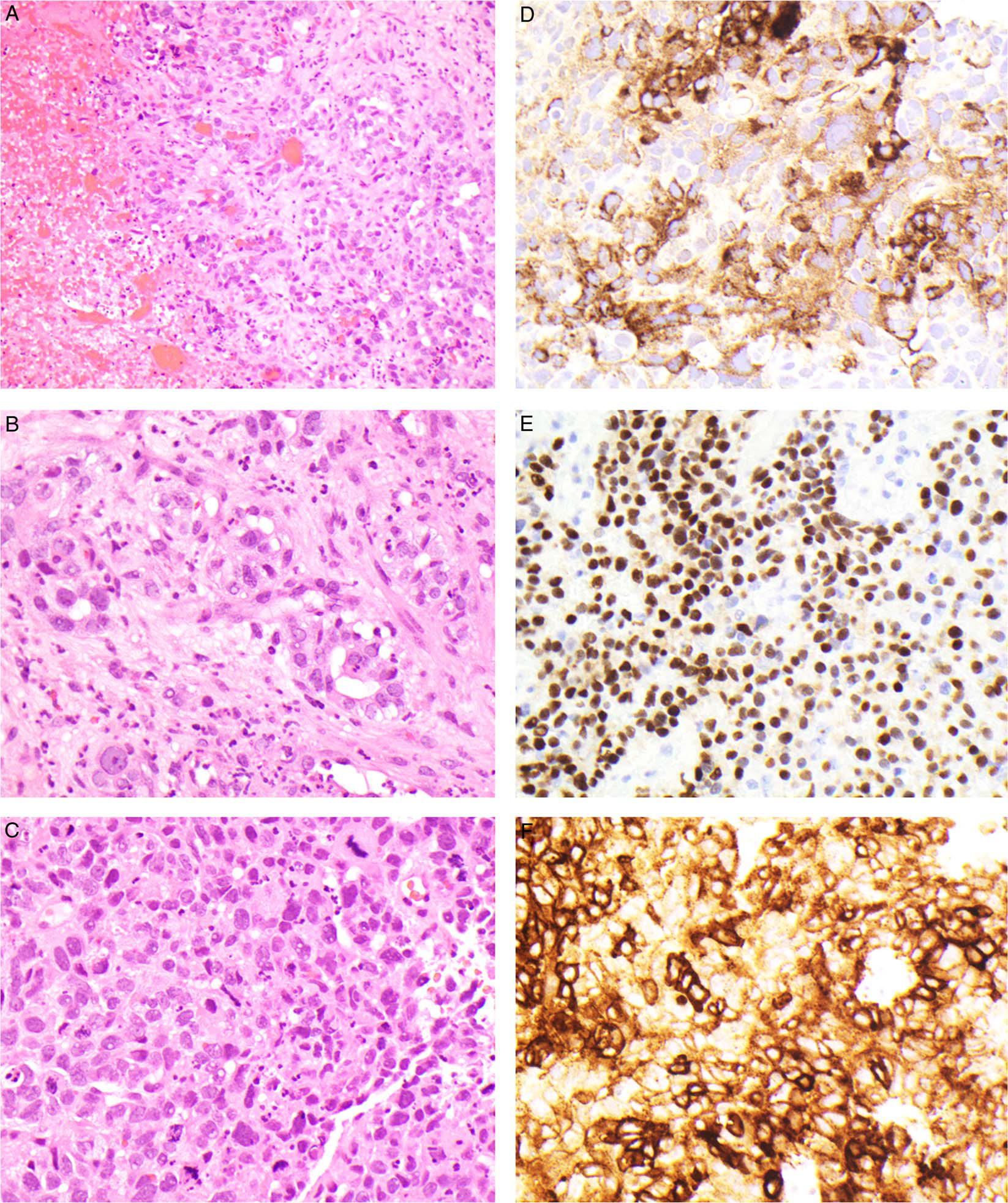 图1.索引病例形态学:本例结构为非典型细胞形成片状及疏松腺样,胞质嗜酸性至透明,散在核下空泡,核分裂多见。免疫组化检测,AFP、SALL-4、Glypican-3均为弥漫、强阳性。
图1.索引病例形态学:本例结构为非典型细胞形成片状及疏松腺样,胞质嗜酸性至透明,散在核下空泡,核分裂多见。免疫组化检测,AFP、SALL-4、Glypican-3均为弥漫、强阳性。
在索引病例基础上,作者对所在单位3年多内的所有子宫内膜癌病例制作了组织微阵列并检测了卵黄囊标记物表达的研究。结果在300例子宫内膜癌中检出27例(9%)表达SALL-4和/或Glypican-3,还有1例同时表达AFP。更多相关信息详列如下:
病例2:患者82岁,最初病理诊断为非特殊类型的高级别癌,FIGO分期IB;组织学为复杂的腺体,细胞核呈原始表现,核分裂多见,且有核上/核下空泡;核分裂38个/10HPF。免疫组化方面,错配修复蛋白无缺陷;AFP为2%的细胞2-3+,SALL-4为90%的细胞3+,Glypican-3为60%的蛋白1+;此外,p53在部分细胞过表达;CDX2+、CK20+、ER-、TTF-1、GATA3-、Napsin A-,BRG/INI1表达无缺失。随访数据表明,患者8个月后死于肺转移。
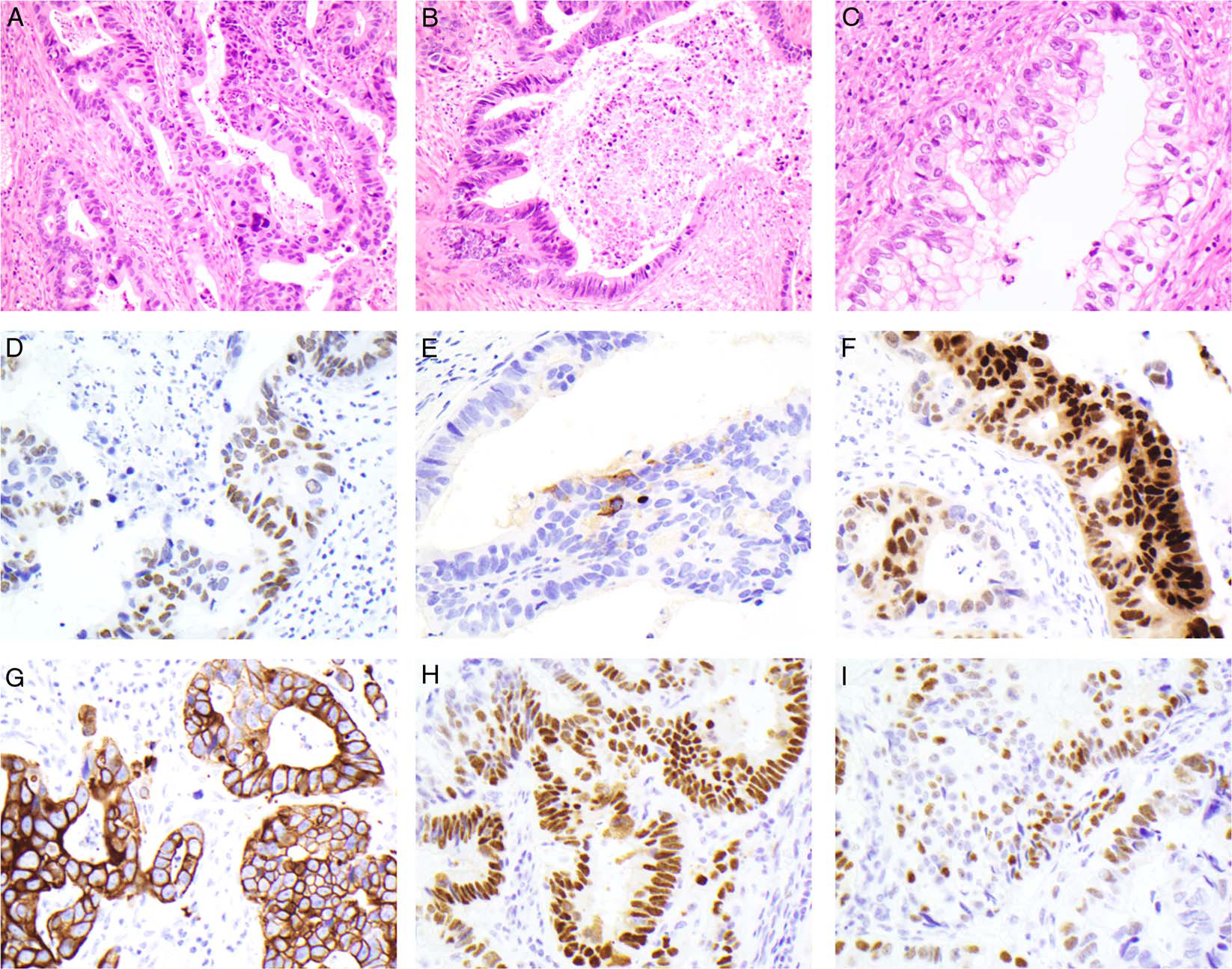 图2.病例2相关信息:形态学表现为明确的腺体结构,衬覆拉长、深染的细胞,伴大量腺腔内坏死,类似结直肠癌。散在腺体呈显著核下及核上空泡。免疫组化SALL-4(D)、AFP(E)、CDX2(F)、CK20(G)、p53(H、I)。
图2.病例2相关信息:形态学表现为明确的腺体结构,衬覆拉长、深染的细胞,伴大量腺腔内坏死,类似结直肠癌。散在腺体呈显著核下及核上空泡。免疫组化SALL-4(D)、AFP(E)、CDX2(F)、CK20(G)、p53(H、I)。
病例3:患者70岁,最初病理诊断为浆液性癌,FIGO分期IB。组织学为伴黏液样间质的网状生长,可见Schiller-Duval小体、玻璃样小球表现。核分裂20个/10HPF。免疫组化方面,错配修复蛋白无缺陷,SALL-3为70%的细胞2-3+,Glypican-3为5%的细胞2+,AFP-;p53弥漫过表达,ER、TTF1、GATA3、Napsin A、CDX2、CK20均为阴性,BRG/INI1表达无缺失。本例患者34个月后死于该病。
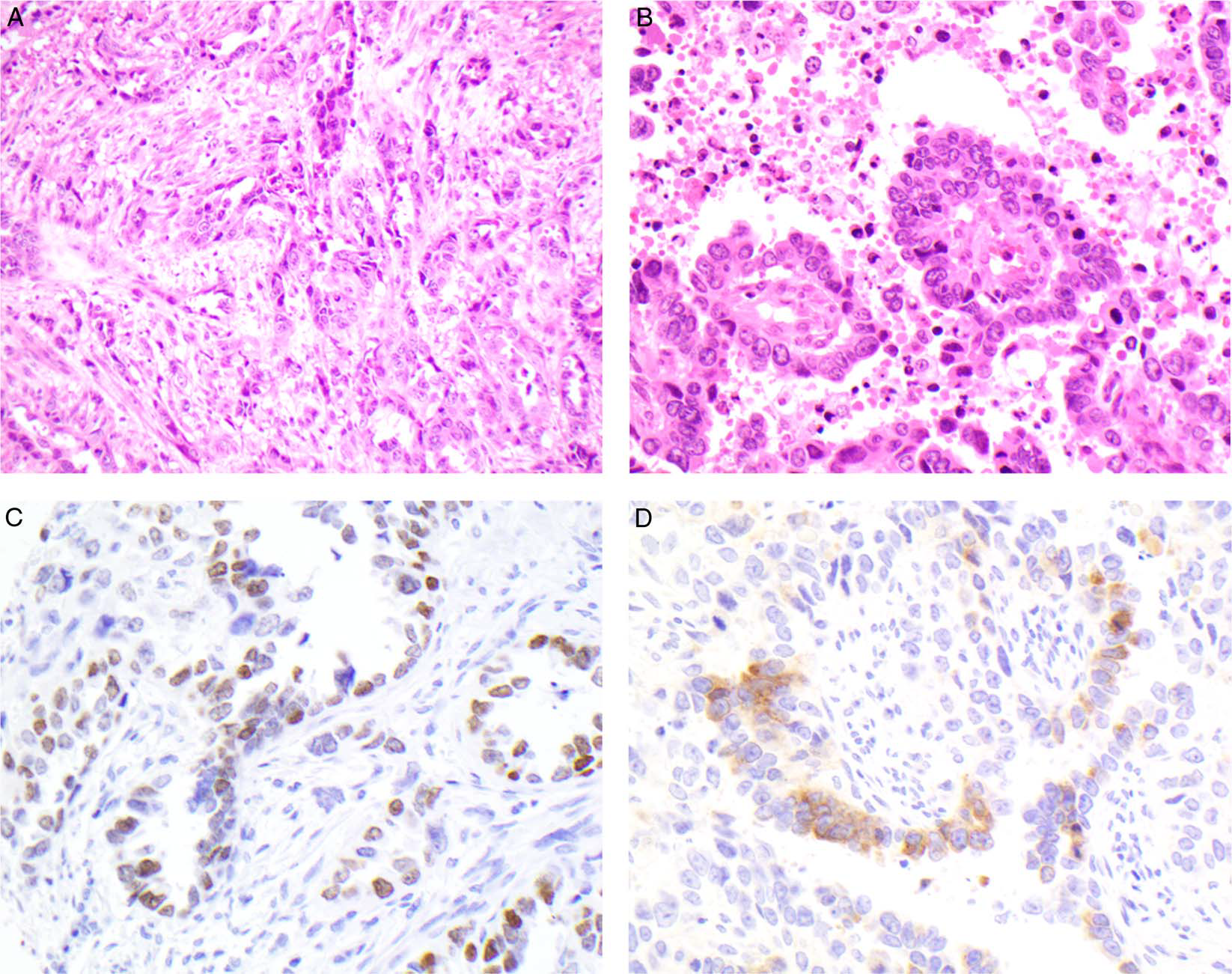 图3.病例3相关信息:形态学为黏液样基质中的网状结构,且有Schiller-Duval小体(B)。免疫组化SALL-4(C)、Glypican-3(D)。
图3.病例3相关信息:形态学为黏液样基质中的网状结构,且有Schiller-Duval小体(B)。免疫组化SALL-4(C)、Glypican-3(D)。
病例4:患者59岁,最初病理诊断为去分化癌,FIGO分期IA期。形态学为低级别的子宫内膜腺体、混杂有实性片状的横纹肌样细胞和伴透明胞质的细胞,背景为黏液样间质,核分裂18个/10HPF。免疫组化方面,错配修复检测MLH1/PMS2表达缺失;SALL4为去分化成分90%细胞2-3+,Glypican-3为去分化成分100%的细胞2-3+;去分化成分BRG1表达缺失;INI1表达无缺失,p53为野生型,ER、TTF-1、GATA3、Napsin A、CDX2、CK20均为阴性。48个月的时候随访,患者无病健在。
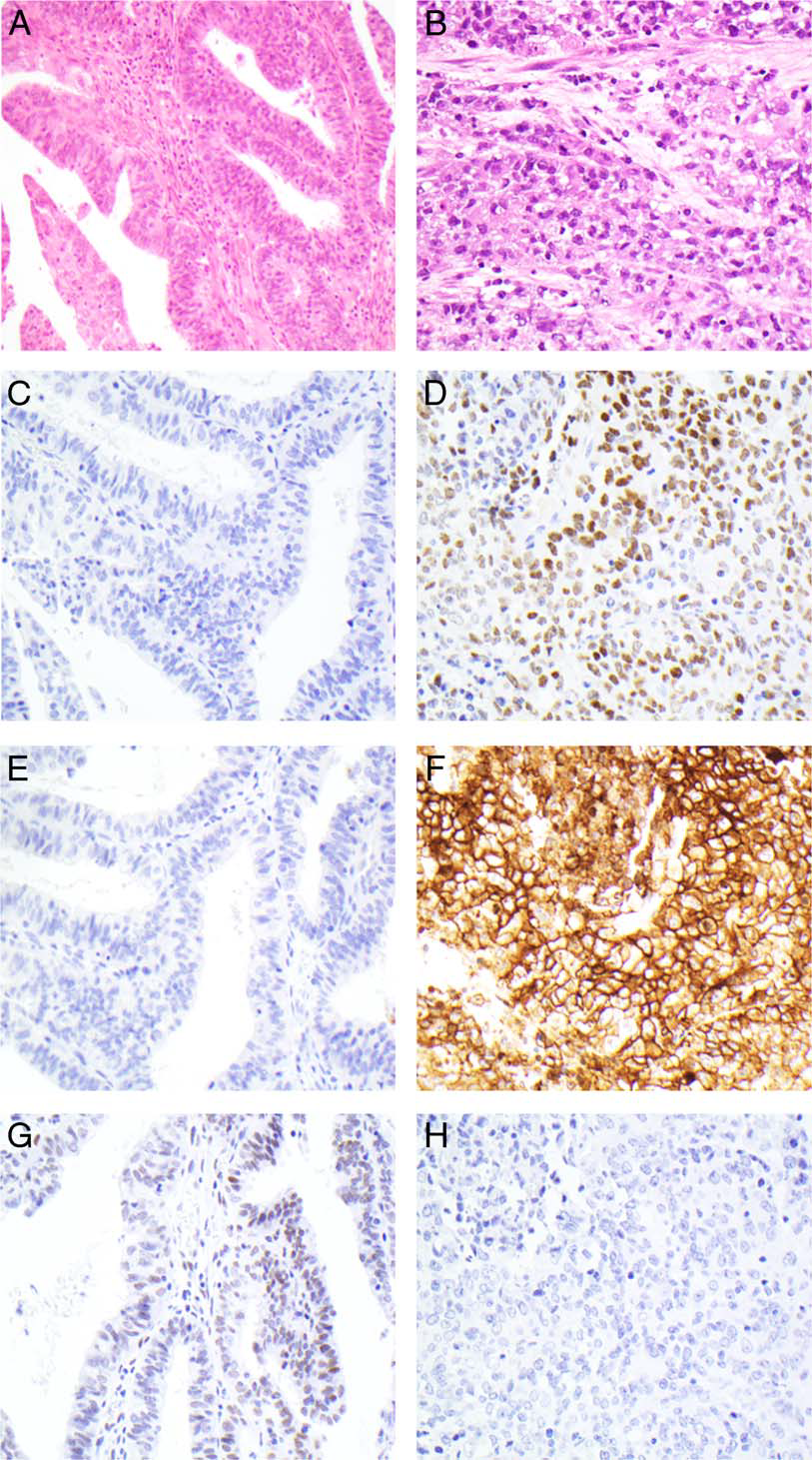 图4.病例4相关信息:形态学为明确的子宫内膜样腺体(A)、相邻有片状的横纹肌样细胞,背景为黏液样间质(B)。高分化成分不表达SALL-4(C)和Glypican-3(E),而BRG1仍有表达(G);与此对应,去分化成分SALL-4弥漫阳性(D)、Glypican-3弥漫阳性(E),BRG1也是表达缺失(H)。
图4.病例4相关信息:形态学为明确的子宫内膜样腺体(A)、相邻有片状的横纹肌样细胞,背景为黏液样间质(B)。高分化成分不表达SALL-4(C)和Glypican-3(E),而BRG1仍有表达(G);与此对应,去分化成分SALL-4弥漫阳性(D)、Glypican-3弥漫阳性(E),BRG1也是表达缺失(H)。
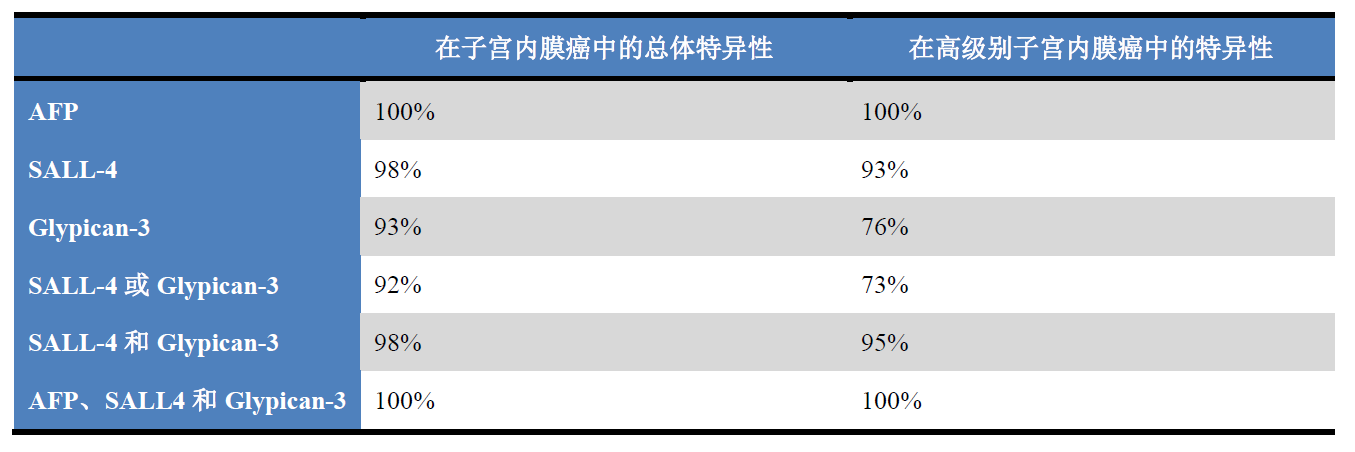
根据该组病例及相关文献,作者分析了形态学无卵黄囊分化的子宫内膜癌中卵黄囊标记非特异性表达情况、子宫内膜体细胞来源卵黄囊瘤中卵黄囊标记的特异性。简单说来,所有的癌中,8%(24/297)的病例表达至少一种卵黄囊标记、但并无明确支持卵黄囊分化的形态学特征:大部分(71%,n=17)都仅表达Glypican-3,2例(8%,n=2)仅表达SALL-4,5例(20%)表达上述两种标记。更多细节,详见原文及表1。
表1.子宫内膜体细胞来源卵黄囊瘤中卵黄囊标记的特异性
 根据相关文献及作者自己经验,该文中还提出了子宫内膜中体细胞来源卵黄囊瘤的诊断策略,详见图5。
根据相关文献及作者自己经验,该文中还提出了子宫内膜中体细胞来源卵黄囊瘤的诊断策略,详见图5。
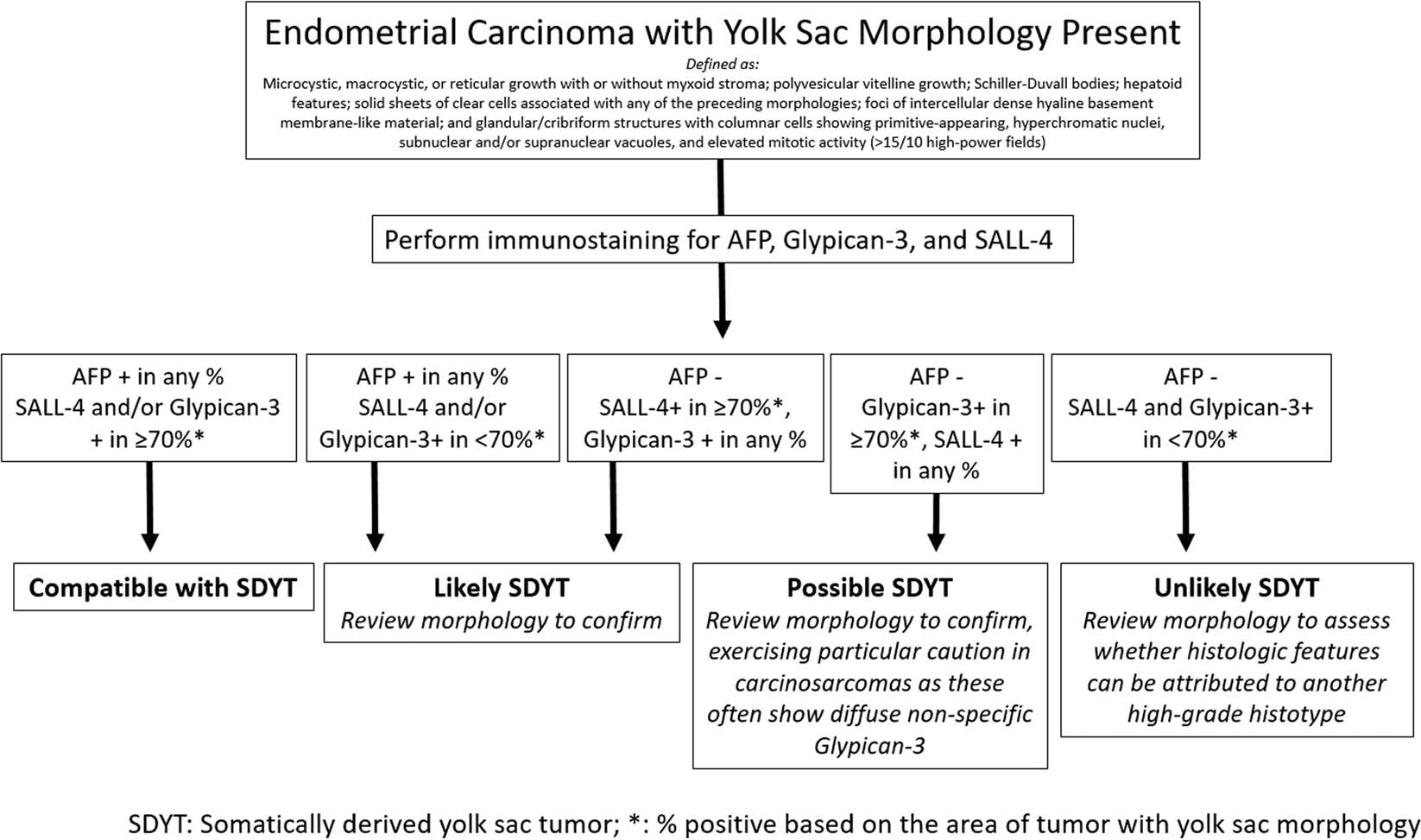 图5.子宫内膜中体细胞来源卵黄囊瘤的诊断策略
图5.子宫内膜中体细胞来源卵黄囊瘤的诊断策略
1.伴卵黄囊瘤形态的子宫内膜癌,具体是指:微囊状、大囊状、网状生长,伴或不伴黏液样间质;多泡卵黄囊状(polyvesicular vitelline)生长;Schiller-Duvall小体;肝阳特征;实性片状的透明细胞伴任何前述形态;局灶细胞间有致密透明样基底膜样物质;柱状细胞形成的、具有原始表现的腺样/筛状结构,细胞核深染,有核上和/或和下空泡,且核分裂活性升高(>15个/10HPF);
2.在形态学评估的基础上,加做免疫组化AFP、Glypican-3、SALL-4(下述阳性百分比,指的是卵黄囊瘤形态细胞的阳性百分比);
(A)任意比例的AFP+、≥70%的SALL-4和/或Glypican-3阳性,则符合体细胞来源卵黄囊瘤;
(B)任意比例的AFP+、<70%的ALL-4和/或Glypican-3阳性,或AFP-、≥70%的SALL-4+、任意比例的Glypican-3+,则很可能(likely)为体细胞来源卵黄囊瘤,复阅形态学证实;
(C)AFP-、≥70%的Glypican-3+、任意比例的SALL-4+,则可能(possible)为体细胞来源卵黄囊瘤,复阅形态学证实,尤其关注癌肉瘤,因为此时常非特异性的弥漫阳性表达Glypican-3;
(D)AFP-、SALL4和Glypican-3的阳性比例<70%,则不太能是体细胞来源卵黄囊瘤,复阅形态学,确定其组织学特征是否为其他高级别亚型所致。
点此下载原文献
参考文献
[1]Mills AM, Jenkins TM, Dibbern ME, et al. Yolk Sac Differentiation in Endometrial Carcinoma: Incidence and Clinicopathologic Features of Somatically Derived Yolk Sac Tumors Versus Carcinomas With Nonspecific Immunoexpression of Yolk Sac Markers. Am J Surg Pathol. 2024;48(7):790-802.
doi:10.1097/PAS.0000000000002230



















共0条评论