往期回顾:
WHO女生5ed第6章子宫体肿瘤(一)
06. 子宫体的未分化癌和去分化癌
定义
子宫内膜未分化癌是一种恶性上皮性肿瘤,不伴明显的细胞系分化。去分化癌由未分化癌和去分化成分(通常为FIGO1级或2级子宫内膜样癌)混合而成。
ICD-O编码
8441/3 未分化癌NOS
ICD-11编码
2C76.Y&XH1YY4 子宫的其他特指性恶性肿瘤&未分化癌
相关命名
无
亚型
无
部位
子宫
临床特征
大多数患者为围绝经期或绝经后期,据报道中位年龄55岁(范围:30-80岁)。大多数患者表现为绝经后出血,少数表现为腹痛。
流行病学
未分化癌少见,约占所有子宫内膜癌的2%。有人提出未分化癌与Lynch综合征有关。
病因学
未知
发病机制
在去分化病例中,未分化癌与并存的分化性癌呈克隆性相关,表明未分化癌是通过从潜在的分化性癌成分发生了去分化的过程而产生的。具有错配修复蛋白缺陷/高微卫星不稳定性的子宫内膜癌似乎更倾向于去分化,因为大约一半到三分之二的去分化癌和一半的未分化癌具有错配修复缺陷/微卫星不稳定。
去分化/未分化癌也可能发生在其他分子环境中,低拷贝数的子宫内膜样体癌是第二常见的分子亚组,其次是POLE突变或TP53突变的癌。超过一半的肿瘤发现了涉及PTEN、PIK3CA和/或PIK3R1的激活Pl3K通路突变,这些突变存在于分化性癌和未分化癌的成分中。在大约三分之二的去分化癌和一半的未分化癌中,涉及核心SWI/SNF复合蛋白的失活突变与去分化有关,这导致未分化癌成分中SMARCA4(BRG1)、SMARCB1(IN1)以及ARID1A和ARID1B的表达缺失。根据分子特征进一步定义这种肿瘤类型亚组的尝试正在进行中。
大体检查
大多数未分化癌形成巨大、息肉状、宫腔内肿块,大小范围2-15cm。常见坏死。大多数肿瘤累及子宫体;然而,许多肿瘤累犯子宫下段。
组织病理学
单形性未分化癌
肿瘤由大小相对均匀的、小到中等的、不粘附的细胞组成,这些细胞成片排列,没有任何明显的巢状或小梁状结构,类似于淋巴瘤、浆细胞瘤、高级别子宫内膜间质肉瘤或小细胞癌。不存在腺体形成;然而,可以看到突然角化。核染色质通常凝缩,核分裂象常见(>25个/2mm²,相当于直径0.55 mm,面积0.24 mm²视野下>30个/10HPF)。偶尔肿瘤可有横纹肌样形态。虽然间质通常不明显,但一些肿瘤有黏液样基质。肿瘤浸润性淋巴细胞通常很多。常见地图样坏死。
去分化癌
几乎40%的单形性未分化癌含有分化性癌,成为第二种成分,后者最常见类型的是FIGO 1级或2级子宫内膜样癌,但高级别癌(如FIGO 3级子宫内膜状癌和浆液性癌)也有罕见报道。这两种成分的比例可以变化,两种成分之间的间隔显得很突然(呈现双相性外观),或混杂存在。
免疫组织化学
未分化癌仅有少数肿瘤细胞显示上皮分化的证据,通常EMA和角蛋白具有非常局灶性但强阳性的核周点状染色;不应出现广谱角蛋白(PCK)的弥漫性强阳性。由于PCK在这些肿瘤中通常是完全阴性,因此建议使用多种上皮标记物来确认上皮起源。在上皮分化的标志物中,CK8/18和EMA更可能呈阳性。肿瘤细胞表达波形蛋白,但不表达ER、PR或E-cadherin。PAX8通常是阴性,但也可能有散在的单个或小簇细胞呈局灶性阳性
图6.17去分化子宫内膜癌。A肿瘤呈混合状
子宫内膜样和未分化成分。B显示rhab-doid功能的高倍视图
少数肿瘤细胞也可能表达CgA和/或Syn,通常<10%。大约三分之一的子宫内膜未分化癌可见SMARCA4(BRG1)表达缺失。
鉴别诊断
未分化癌可能与FIGO 3级子宫内膜样腺癌、高级别神经内分泌癌(NEC)和浆液性癌的实性成分相混淆。支持未分化癌诊断的特征包括不粘附的细胞形态、免疫组织化学PAX8阴性、角蛋白减少/阴性以及神经内分泌标志物阳性<10%。
细胞学
无临床相关性
诊断性分子病理学
涉及SMARCA4、SMARCB1,或ARID1A和ARID1B两者兼有的失活突变的存在(或免疫组织化学检测到的蛋白质表达缺失)可以支持去分化/未分化子宫内膜癌的诊断。在有条件的情况下,可以考虑微卫星不稳定性/错配修复免疫组织化学分析和POLE核酸外切酶结构域分析来指导临床管理。
诊断标准
必要标准:未分化组织学和免疫表型(用于未分化癌/成分)。
理想标准:遗传学分析或免疫组化,SMARCA4(BRG1)、SMARCB1(INI1),或ARID1A和ARID1B两者兼有,显示失活突变或失表达。
分期
根据国际癌症控制联盟(UICC)TNM分类(见子宫内膜肿瘤的TNM分期,原书第18页)和FIGO分期系统进行分期。
预后和预测
这些肿瘤通常具有高度侵袭性,55-95%的病例复发或死于疾病。未分化癌成分的存在,无论占比如何,都预示着预后较差;因此,将这种肿瘤与FIGO 3级子宫内膜样癌区分开来具有临床意义。然而,POLE核酸外切酶结构域突变的存在提示预后较好。与SWI/SNF存在的肿瘤相比,显示核心SWI/SNF蛋白缺乏的肿瘤似乎侵袭性更强。错配修复蛋白缺乏似乎不是预后因素,但它可能会在合适的患者中提示额外的治疗选择(即免疫疗法),尽管免疫疗法在癌症错配修复不足的去分化/未分化子宫内膜癌试验中的临床疗效尚未得到具体证明。
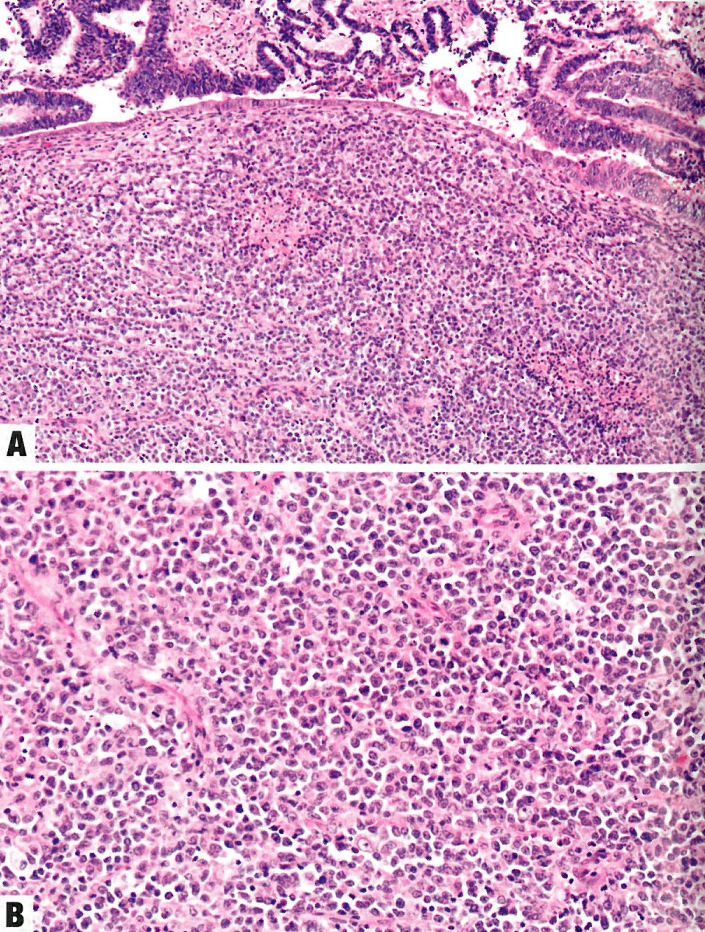
图6.16 去分化子宫内膜癌。A 分化和去分化区域有明显边界。B 高倍,显示未分化成分的小圆细胞。
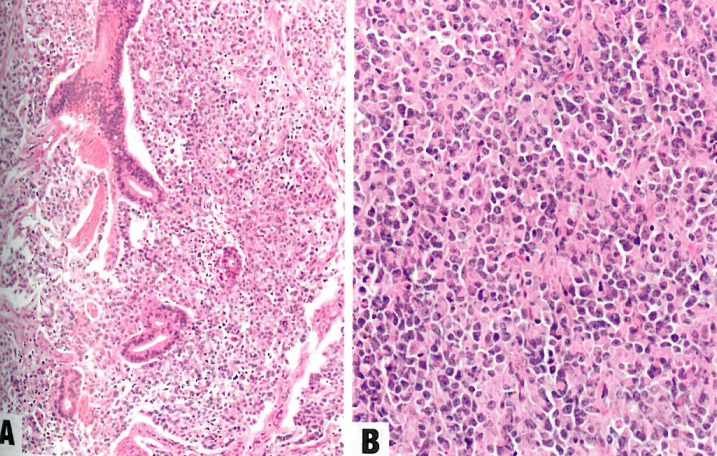
图6.17 低分化子宫内膜癌。A 肿瘤显示混杂的子宫内膜样和未分化成分。B 高倍,显示横纹肌样特征。
07. 子宫体的混合性癌
定义
混合性癌。
ICD-O编码
8323/3 混合细胞腺癌
ICD-11编码
2C76.4 子宫内膜混合性腺癌
相关命名
无
亚型
无
部位
子宫
临床特征
没有明显的临床特征。
流行病学
混合性子宫内膜癌罕见;混合性子宫内膜样和浆液性癌占子宫内膜癌的10%。
病因学
未知
发病机制
有些混合性子宫内膜癌可能代表同时发生的、生物学上无关的碰撞肿瘤。另一些代表低级别子宫内膜样癌的异常分化或进展。通常,肿瘤显示各自成分的分子特征,但可能存在一些重叠的特征和一定程度的分子特征不确定性。
大体检查
大体表现有所变化。一些肿瘤表现为明显的子宫内膜恶性肿瘤,通常会过度侵犯子宫肌层和子宫颈,有时还会累及附件。其他病例,起源于萎缩的子宫,可能仅在显微镜下可见,有时仅限于息肉内。
组织病理学
必须通过组织学和免疫组织化学识别至少两种空间分布上不同的子宫内膜癌组织类型。混合性癌这种诊断类别不要用于子宫内膜样癌、透明细胞癌或浆液性癌的形态变异型,也不要用于形态学不确定的癌、去分化癌或癌肉瘤。子宫内膜样癌和浆液性癌的混合最常见。另一种可能混合的独特亚型是透明细胞癌。只要能够自信地证明,高级别癌的任何占比都足以将肿瘤分类为混合性子宫内膜癌,因为即使是很少占比的浆液性癌或透明细胞癌也可能导致不利的预后和临床结局。
细胞学
无临床相关性
诊断性分子病理学
存在TP53突变,分子检测或直接用免疫组化检测,可用于支持浆液性癌的诊断。
诊断标准
必要标准:细胞学高级别子宫内膜癌伴复杂乳头和/或腺样结构。
理想标准:异常p53和弥漫性p16免疫染色。
分期
根据国际癌症控制联盟(UICC)TNM分类(见子宫内膜肿瘤的TNM分期,原书第18页)和FIGO分期系统进行分期。
预后和预测
这些肿瘤的生物学行为取决于最高分级的成分。因此,不论浆液性癌或透明细胞癌的比例如何,都归入高级别。
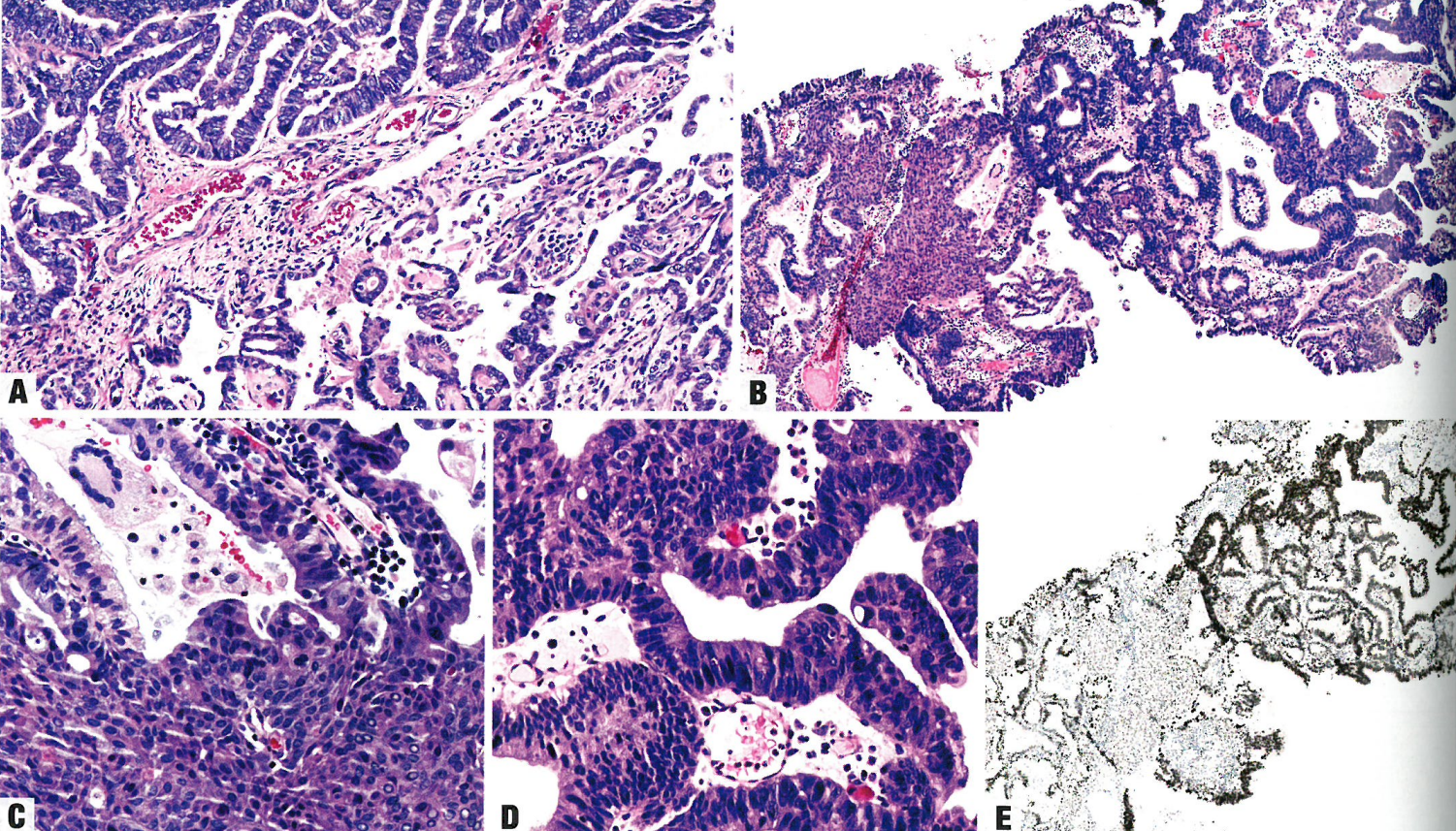
图6.18 具有混合性子宫内膜样和浆液性癌模式的子宫内膜癌。A 注意低级别子宫内膜样癌(图上)和浆液性癌(图下)。重要的是,用免疫组织化学证明这两种肿瘤成分是不同的,因为浆液性癌的乳头状成分与腺体成分相比,可能貌似低级别。B-E为同一例B子宫内膜癌伴有混合子宫内膜样(左)和浆液性(右)模式。浆液性癌呈腺样模式,貌似子宫内膜样癌。C 高倍,子宫内膜样成分呈低级别核伴鳞状化生。D 浆液性成分呈高级别核,有明显核仁,高度核分裂象活性。E 浆液性成分呈p53强阳性,子宫内膜样成分呈野生型。两种不同肿瘤类型之间存在一种过渡的染色模式,存在过渡提示子宫内膜样癌可能向浆液性癌的转化。
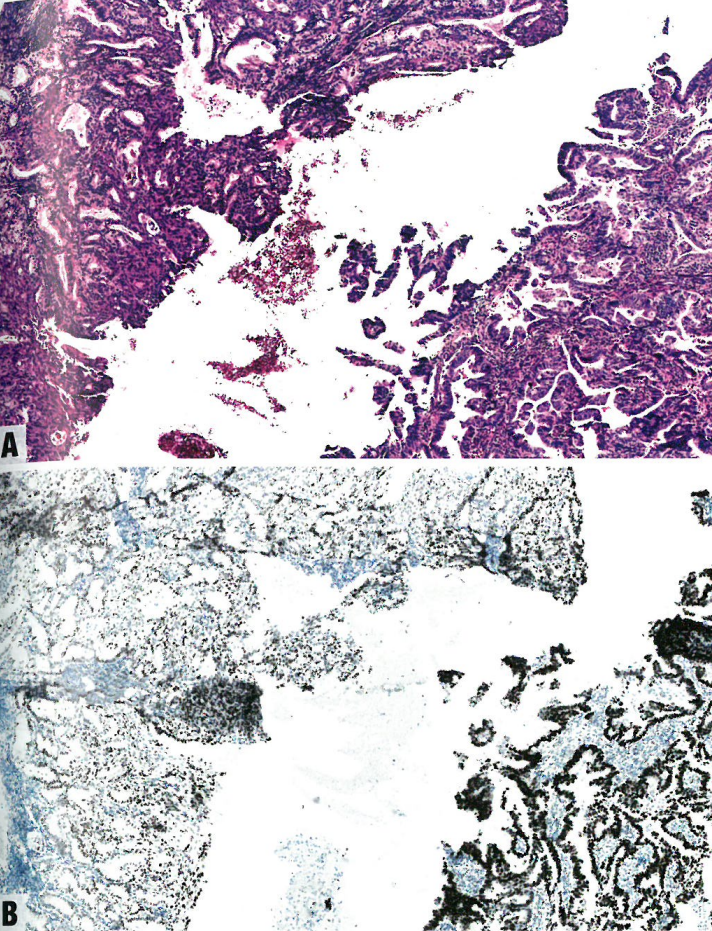
图6.19 伴有混合性子宫内膜样(左)和浆液性(右)模式的子宫内膜癌。这例显示两块分型的碎片组织,具有不同的组织学模式。A 左侧,显示低级别子宫内膜样癌伴鳞状分化,而右侧显示乳头状浆液性癌。B 免疫组化,左侧显示野生型p53,右侧显示p53弥漫强阳性。
08. 其他子宫内膜癌
定义
中肾管腺癌起源于中肾管残余。中肾管样腺癌类似于中肾管分化。原发性鳞癌全部由鳞状分化细胞组成。原发性胃(胃肠)型黏液性癌具有黏液性胃/胃肠特征。
ICD-O编码
9110/3 中肾管腺癌
8070/3 鳞状细胞癌 NOS
8480/3 黏液癌,肠型
9111/3* 中肾管样腺癌
ICD-11编码
2C76.Y&XH5GW5 子宫体的其他特指性恶性肿瘤&恶性中肾瘤
2C76.Y&XH0945 子宫体的其他特指性恶性肿瘤&鳞状细胞癌NOS
2C76.1 子宫内膜黏液性腺癌
相关命名
无
亚型
无
部位
子宫
临床特征
临床特征类似于其他子宫内膜癌,但中肾管癌可能起源于子宫壁。
流行病学
原发性子宫中肾管癌极罕见,要排除宫颈起源。据估计中肾管样腺癌约占子宫内膜癌的1%。原发性子宫内膜鳞状细胞癌(SCC)约点所有子宫内膜癌的0.5%。原发性胃(胃肠)型癌罕见。
病因学
中肾管和中肾管样癌的病因未知。原发性子宫内膜鳞状细胞癌与慢性炎症、长期子宫积脓和子宫鳞癣病有关;并涉及先前的放疗和HPV感染。胃型黏液性癌没有特定的病因特征。据报道,罕见病例与女性生殖道同时发生的黏液性化生有关。
发病机制
中肾科和中肾管样腺癌的大多数病例显示KRAS突变伴1q获得,少数病例显示ARID1A突变,但这些突变没有特异性。除了罕见病例中的高危HPV外,原发性子宫内膜鳞状细胞癌没有明显的分子变化。胃肠道型黏液性子宫内膜癌可能存在错配修复缺陷。
大体检查
SCC可能显示湿疣样表现,因存在角化而显示切面白色,没有其他特征。其他肿瘤没有特殊的大体表现。
组织病理学
中肾管和中肾管样腺癌典型地表现出多种组织学模式:主要为小腺体和小管,腔内含有嗜酸性胶体样物质,混杂着乳头状、导管状、网状、实性或梭形结构。肿瘤细胞具有中度非典型的泡状核,通常显示核成角或核重叠。免疫组织化学,ER和PR通常完全阴性,具有野生型p53表达模式。通常存在弥漫性GATA3表达(除外较实性和梭形的区域),不同数量的病例显示TTF1、calretinin和CD10(管腔)染色阳性。GATA3和TTF1可以显示相反的染色模式。原发性子宫内膜鳞状细胞癌显示典型的鳞状细胞癌的明显恶性特征,正如其他部位;但也可能貌似温良,由糖原化上皮组成,具有宽阔的浸润前沿。胃(胃肠道)型黏液性癌由分泌黏液的上皮形成的腺体,其中可能含有杯状细胞。细胞核通常是低级别(见“宫颈腺癌,HPV不相关,胃型”,原书第374页)。
细胞学
无临床相关性
诊断性分子病理学
存在TP53突变,分子检测或直接用免疫组化检测,可用于支持浆液性癌的诊断。
诊断标准
必要标准:细胞学高级别子宫内膜癌伴复杂乳头和/或腺样结构。
理想标准:异常p53和弥漫性p16免疫染色。
分期
浆液性癌根据国际癌症控制联盟(UICC)TNM分类(见子宫内膜肿瘤的TNM分期,原书第18页)和FIGO分期系统进行分期。
预后和预测
局限于子宫内膜的癌,预后较好,但子宫外扩散的患者,包括浆液性子宫内膜上皮内癌和微浸润疾病的患者,预后较差。ERBB2(HER2)过表达和/或基因扩增见于>30%的子宫内膜浆液性癌。复发性或晚期ERBB2(HER2)阳性子宫内膜浆液性癌患者,可以从卡铂和紫杉醇方案加曲妥珠单抗中获益。
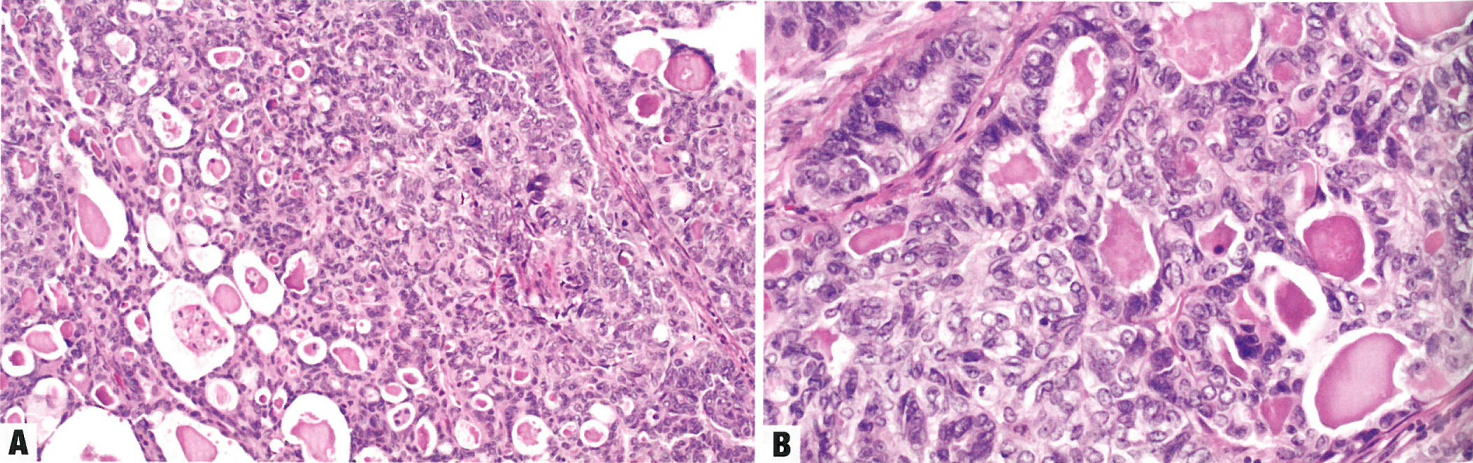 图6.20 中肾样子宫内膜腺癌。A 主要是小腺体和小管伴腔内嗜酸性胶样分泌物。B 肿瘤细胞具有中度异型空泡状核,核成角或重叠。
图6.20 中肾样子宫内膜腺癌。A 主要是小腺体和小管伴腔内嗜酸性胶样分泌物。B 肿瘤细胞具有中度异型空泡状核,核成角或重叠。
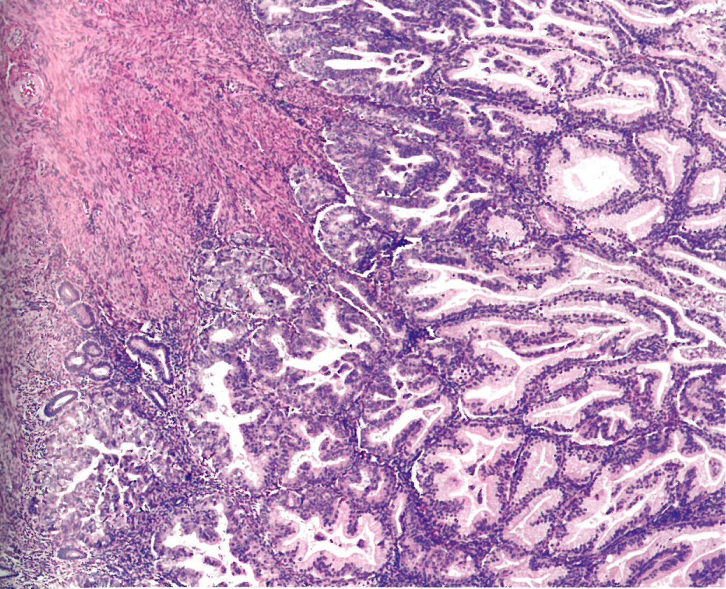
图6.21 胃(胃肠)型子宫内膜腺癌。肿瘤腺体由分泌黏液的上皮组成,可含有杯状细胞。
09. 子宫体的癌肉瘤
定义
癌肉瘤是一种双相性肿瘤,由高级别癌性成分和肉瘤性成分组成。
ICD-O编码
8980/3 癌肉瘤NOS
ICD-11编码
2C72.3 子宫韧带、子宫旁或子宫附件的癌肉瘤
相关命名
不推荐:恶性苗勒混合瘤
亚型
无
部位
子宫
临床特征
患者通常表现为绝后出血、子宫增大或盆腔肿块。诊断时大约45%的病例为III期或IV期。
流行病学
5癌肉瘤约占所有子宫恶性肿瘤的%%。患者通常是绝经后妇女,具有与子宫内膜癌相同的风险因素。
病因学
大约6%的子宫内膜癌肉瘤患者有他莫昔酚使用史。癌肉瘤也可能是盆腔放疗的长期并发症,距放疗间隔时间5-20年。
发病机制
癌和肉瘤成分中都存在类似的遗传学改变。现在认为,肉瘤来自癌,是由肿瘤演进过程中的转分化(上皮间质转化)所致。大多数病例的特征是TP53突变(90%),类似于子宫内膜浆液性癌。通常与子宫内膜样子宫内膜癌相关的突变,在癌肉瘤不太常见。因此,60-78%的癌肉瘤被归类为高拷贝数亚组,22-38%被归类为低拷贝数亚组,<5%的子宫内膜癌肉瘤属于突变组(POLE突变)或超突变组(错配修复缺陷)。
大体检查
巨大的息肉样肿块,通常充满宫腔,并且通常从宫颈外口脱出。常见出血、坏死和囊性变的区域。
组织病理学
肿瘤由恶性上皮成分和间叶成分混合物组成,两种成分的边界通常很明显。40-60%的病例以肉瘤成分为主。癌成分最常显示子宫内膜样癌或浆液性癌,但也可能遇到透明细胞癌和未分化癌。间叶成分最常见的是高级别肉瘤NOS,但也可能出现异源成分(包括横纹肌肉、软骨肉瘤,很少是骨肉瘤)。30-45%和36-40%的肿瘤分别存在深肌层浸润和淋巴管血管浸润{1675 8}。癌肉瘤转移后形态各不相同,但大多数转移(约90%)含有癌成分。
细胞学
无临床相关性
诊断性分子病理学
无临床相关性
诊断标准
必要标准:高级别恶性上皮性和间叶性成分。
理想标准:罕见病例,免疫组化可能有助于证实特异性间叶性分化(如,横纹肌母细胞分化)。
分期
浆液性癌根据国际癌症控制联盟(UICC)TNM分类(见子宫内膜肿瘤的TNM分期,原书第18页)和FIGO分期系统进行分期。
预后和预测
FIGO I-II期患者的5年疾病特异性生存率为60%,而III期和IV期患者分别为25%和10%。除了晚期,与不利预后相关的其他独立因素包括:大小>5cm、肌层浸润>50%、淋巴管血管浸润和肉瘤占主导地位。最近的一些大型系列研究表明,浆液性组织学和异源性横纹肌母细胞分化与较差的生存率显著相关。
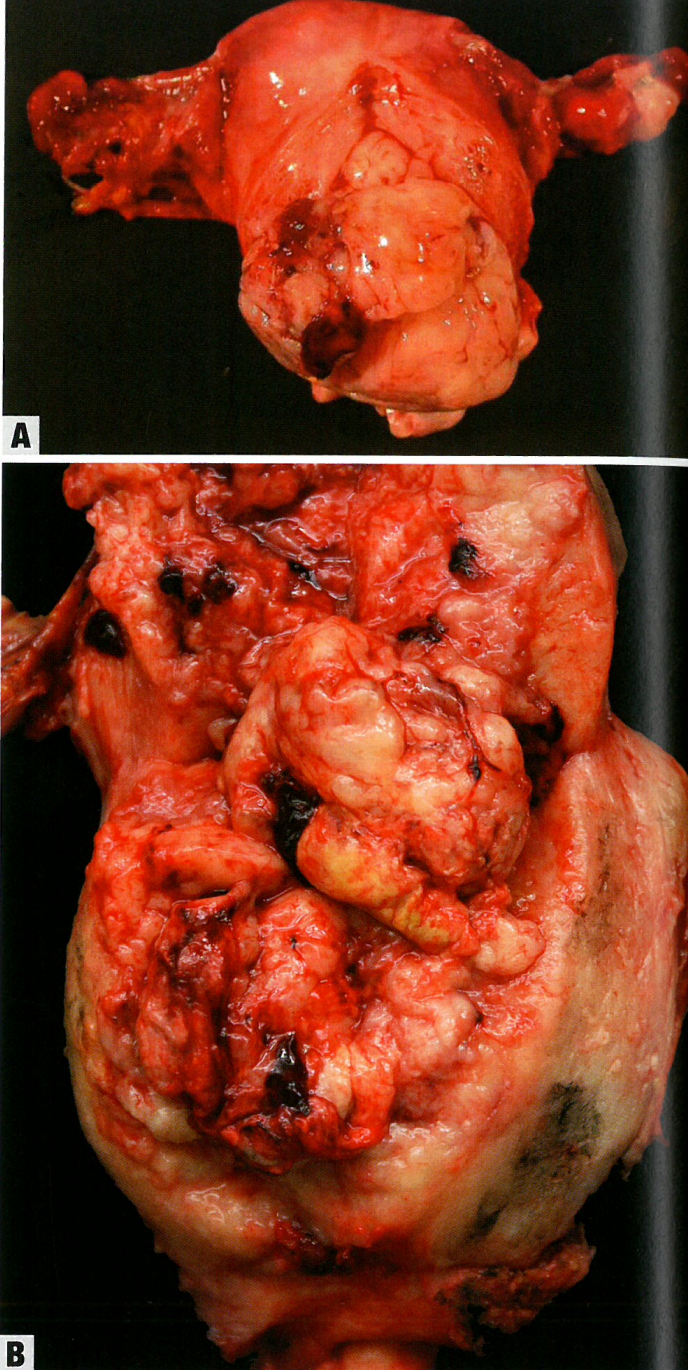
图6.22 癌肉瘤。A 大体,宫腔内巨大的息肉样肿块。B 宫腔内巨大的蕈状肿块。
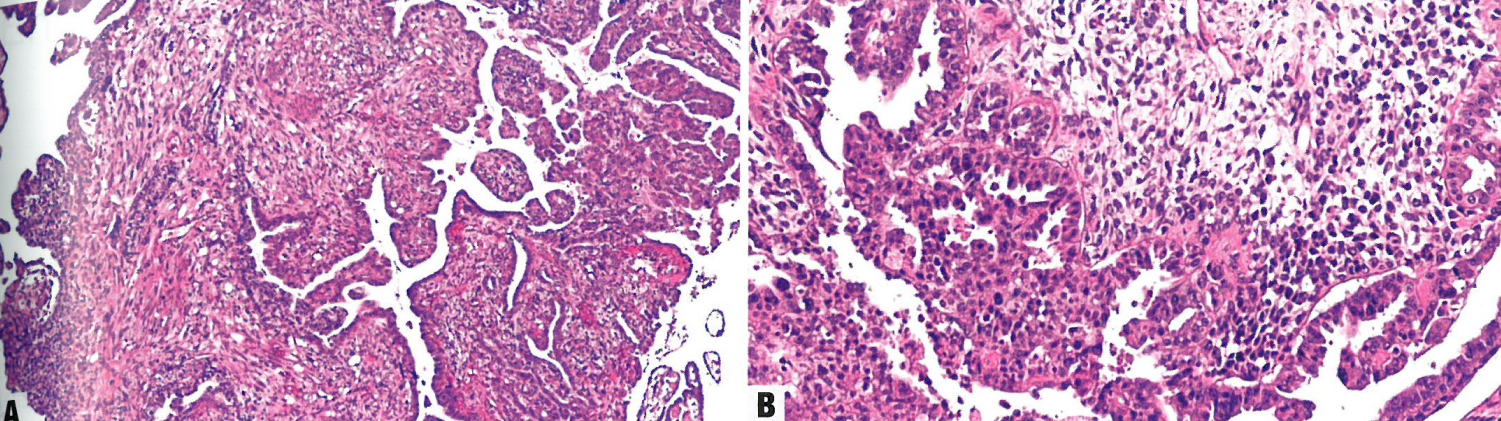 图6.23 癌肉瘤。A肿瘤呈双相性模式:高级别癌成分和肉瘤成分。B 肿瘤显示两种恶性成分:上皮性和肉瘤性。
图6.23 癌肉瘤。A肿瘤呈双相性模式:高级别癌成分和肉瘤成分。B 肿瘤显示两种恶性成分:上皮性和肉瘤性。

图6.24 癌肉瘤。高级别癌紧邻恶性间叶性成分,后者显示异源性软骨肉瘤分化。
10. 子宫内膜息肉
定义
子宫内膜息肉是一种子宫内膜腺体的增殖,腺体大小和形状均不规则,无显著的细胞学异型性。
ICD-O编码
无
ICD-11编码
GA16.Y 子宫、子宫颈的其他特指性获得性异常
相关命名
无
亚型
无
部位
最常见于子宫底
临床特征
临床特征包括异常子宫出血和不育。他莫昔酚治疗的患者,常见子宫内膜癌息肉。
流行病学
间质成分为克隆性。高迁移率族蛋白基因之一HMGA1(6p21-p22)或HMGA2(12q13-q15)或7q22区域发生了重排
病因学
未知
发病机制
绝大多数肿瘤显示TP53突变。其他常见的遗传学改变涉及PIK3CA、PP2R1A和FBXW7。30%的病例存在ERBB2(HER2)扩增,通常分布不均匀。在癌症基因组图谱(TCGA)队列中,所有浆液性癌都属于拷贝数高的亚组。
大体检查
息肉有细蒂或宽基,切面呈纤维性。他莫昔酚相关息肉通常巨大且多发。
组织病理学
成簇的形状不规则的腺体,腺体长轴平行于表面。腺体与厚壁血管和富细胞、少细胞或纤维性间质交替出现,间质可能(罕见)含有奇异形退变的间质细胞。腺体通常不活跃,囊性扩张,具有输卵管化生或纤毛化生,但腺体偶尔有功能。常见息肉扭转,可导致出血性梗死、上皮化生和反应性异型性。在服用激素的患者中,可能同时存在乳头状增生。三苯氧胺治疗相关的息肉,其腺体通常呈鹿角形,腺体周围有袖套状聚集的间质细胞,但与腺肉瘤不同,息肉的间质细胞是良性的,无核分裂活性。间质有明显的平滑肌时,称为腺肌瘤性息肉。
细胞学
无临床相关性
诊断性分子病理学
无临床相关性
诊断标准
必要标准:分枝状或囊性扩张的腺体,位于有变化的间质中。
理想标准:可能有厚壁血管。
分期
无临床相关性
预后和预测
尽管息肉是良性的,但子宫内膜息肉患者分别有11-30%和0.5-3%同时/随后出现增生和癌。绝经后阴道异常出血妇女的息肉更可能是恶性的。在三苯氧胺相关病例中,癌的发生率达到10.7%。息肉内浆液性癌的累及可能很细微,可能需要免疫组织化学进行确认。
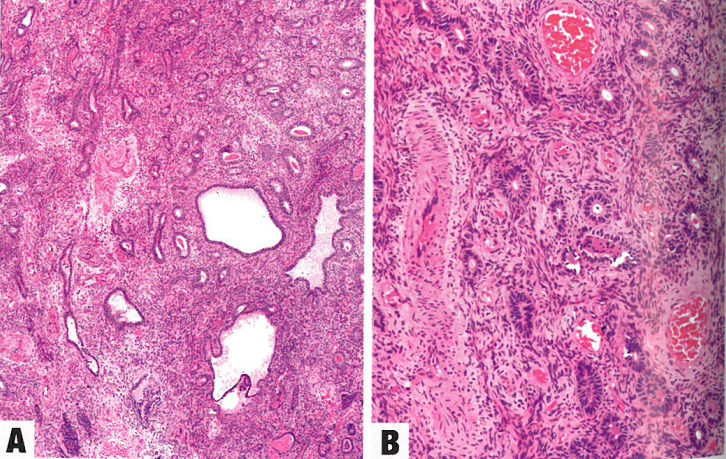
图6.25子宫内膜息肉。A 大小不一的腺体,位于富细胞的纤维化间质内。B 腺体衬覆良性、不活跃细胞。间质有明显的厚壁血管。
11. 子宫内膜化生
定义
子宫内膜化生是子宫内膜上皮的一种形态学改变,从一种成熟细胞类型变成另一种。
ICD-O编码
无
ICD-11编码
GA16.Y 子宫、子宫颈的其他特指性获得性异常
相关命名
无
亚型
无
部位
子宫
临床特征
大多数子宫内膜化生的妇女为绝经后。有些患者在诊刮或子宫内膜活检3个月内曾接受口服雌激素治疗。
流行病学
未知
病因学
激素或刺激性因素是导致子宫内膜化生的主要因素。部分病例为突变性起源。
发病机制
子宫内膜化生继发于变化的激素水平、修复、子宫内膜崩解、慢性炎症或息肉梗死。
大体检查
无临床相关性
组织病理学
嗜酸性(嗜酸细胞)化生具有均匀的中央核和丰富、致密的嗜酸性或颗粒状细胞质(具有大量线粒体)。纤毛(输卵管)化生显示许多顶端纤毛。在鞋钉化生中,单层、无分裂活性的立方细胞突出到表面。黏液化生具有柱状细胞,胞质富含黏液,可见于息肉和乳头增生。鳞状化生可能表现为成熟的鳞状细胞伴角化和/或糖原化,也可能表现为不成熟(桑椹样)鳞化,即未成熟梭形细胞巢,细胞边界不清晰,核形态温和。不成熟鳞化的免疫表达谱(β-catenin+、CDX2+、CD10+、p16+、EMA-、ER-、p63-)与成熟鳞状化生相反。透明细胞化生显示丰富的、透明的、富含糖原的细胞质或富含脂质的泡沫状细胞质{120}。乳头状增生具有纤维血管轴心,被覆细胞学良性的上皮,通常发生在黏液化生或其他化生中。简单乳头具有短的、无分枝的蒂;复杂乳头具有细长的蒂和复杂的分枝。
其中一些改变与化生有关,每种改变都可能与前驱病变和/或癌有关;因此,识别这些化生过程的背景非常重要。合体细胞乳头状改变(乳头状合体细胞化生)是修复性的,而不是真正的化生。嗜酸性细胞形成合体细胞聚集、出芽或无间质的乳头,伴有明显的中性粒细胞。
细胞学
无临床相关性
诊断性分子病理学
无临床相关性
诊断标准
必要标准:一种非肿瘤性子宫内膜病变或非肿瘤性成分位于肿瘤性子宫内膜病变中;识别每种子宫内膜化生的组织学模式和特征(详见上文)。
理想标准:有选择的病例做免疫组化。
分期
无临床相关性
预后和预测
如有广泛的化生和/或结构复杂,可能伴有潜在的增生/癌。这些化生包括合体细胞乳头状改变、复杂性黏液性腺增殖、桑椹样化生和复杂性乳头状增殖。乳头状增殖伴显著的黏液性化生在形态学上与乳头状黏液性化生(黏液癌的前驱病变)重叠。
附最后一句原文:Papillry proliferation with striking mucinous metaplasia overlaps mor phologically with papillary mucinous metaplasia(a precursor d mucinous carcinoma).
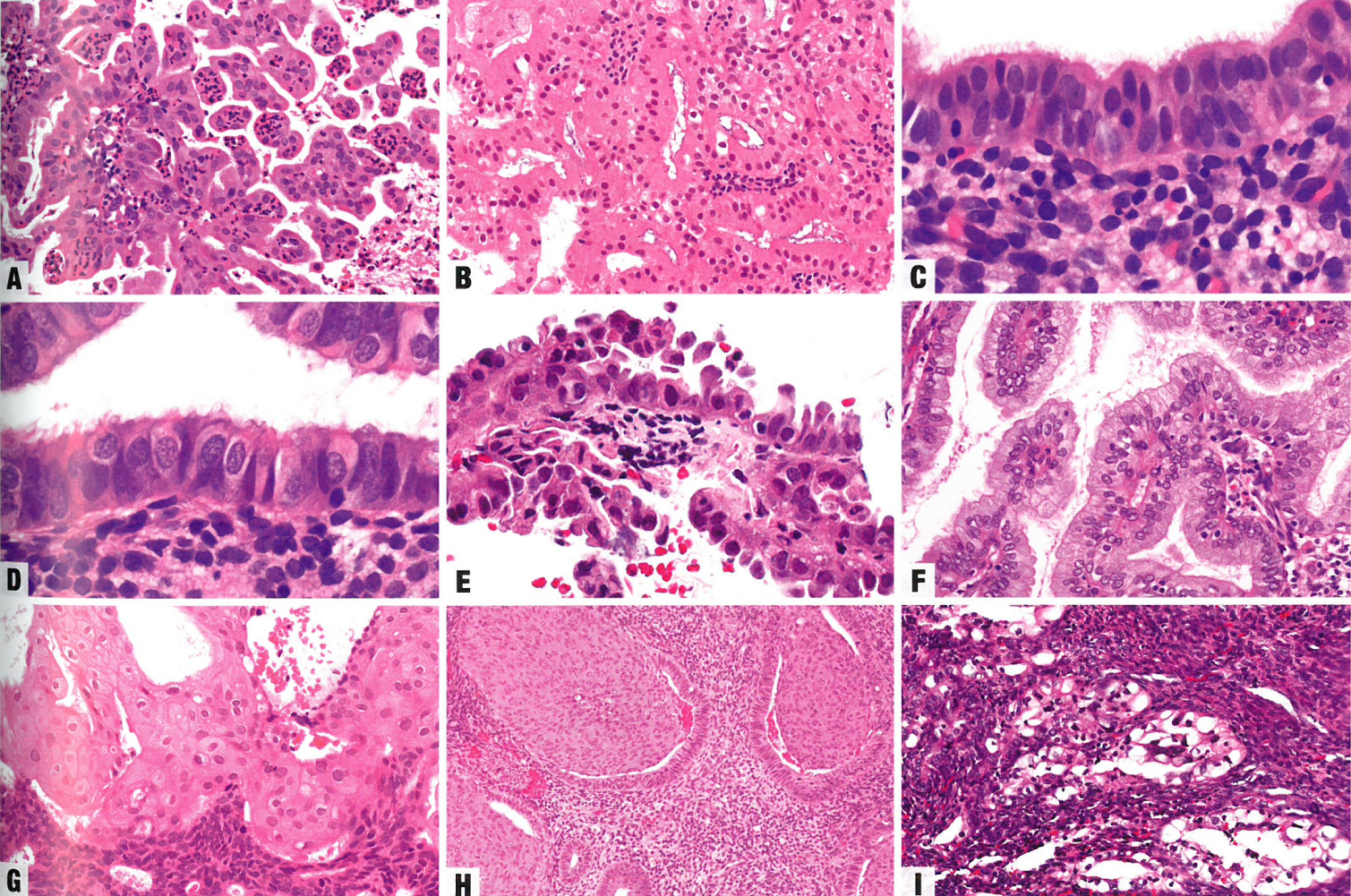
图6.26 子宫内膜化生。A 合体细胞乳头状改变变。无间质的乳头,由嗜酸性细胞组成,无异型性。有明显的中性粒细胞。B嗜酸性化生。腺上皮细胞有丰富的嗜酸性细胞质。C 纤毛细胞化生。表面上皮都有显著的顶端纤毛。D 输卵管化生。上皮由纤毛柱状细胞和插入细胞混合组成。E 鞋钉细胞化生。上皮细胞向表面突出,进入腔内。胞质稀少,核增大深染,没有核分裂象活性。F 黏液性化生。核位于基底,有显著的胞质空泡。G 鳞状化生。成熟的鳞状细胞缺乏细胞异型性。H 桑椹样化生。腺腔含有不成熟的、圆形到梭形上皮细胞巢。I 透明细胞化生。细胞质丰富透明,富含糖原。
12. 子宫体的Arias-Stella反应
定义
Arias-Stella反应是一种良性子宫内膜改变,由增大的、鞋钉细胞组成,维持正常的核质比,与妊娠、妊娠滋养细胞疾病或大剂量孕激素有关。
ICD-O编码
无
ICD-11编码
GA1Y 女性生殖道的其他特指性非炎症性疾病
相关命名
可接受:Arias-Stella现象;Arias-Stella效应
亚型
无
部位
子宫体和子宫颈,和子宫内膜异位症内
临床特征
临床特征与潜在病因有关。妊娠病例中血清HCG升高。
流行病学
没有足够的流行病学数据。
病因学
Arias-Stella反应由激素水平升高或失衡所致。
发病机制
病变的范围和非典型程度取决于激素水平、妊娠分期、外源性激素的类型和剂量。
大体检查
无临床相关性
组织病理学
部分或几乎全部腺体、细胞丛和乳头通常都受累,细胞有丰富的嗜酸性或糖原丰富的透明胞质。可见鞋钉细胞。核高度非典型,染色质污浊或空泡状。可能出现核假包含体。核分裂象罕见。免疫组化价值有限,因为许多标记物与需要鉴别的透明细胞癌重叠。
细胞学
无临床相关性
诊断性分子病理学
无临床相关性
诊断标准
必要标准:非典型细胞呈显微镜下局限性并且无浸润;高度非典型柱状、立方形或鞋钉细胞伴丰富的透明或嗜酸性胞质;增大的不规则核伴污浊状或空泡状染色质,或有假包含体;无核分裂象;与妊娠或激素药物强相关。。
分期
无临床相关性
预后和预测
无临床相关性
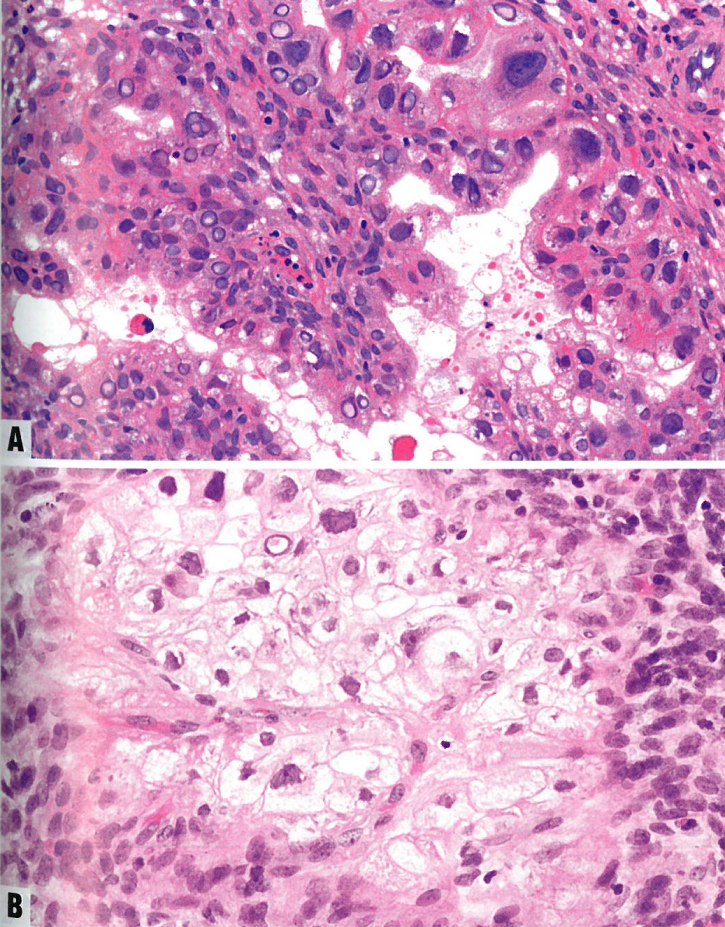
图6.27 Arias-Stella反应。A 腺体中的大多数细胞具有嗜酸性胞质。许多细胞有核假包含体。B 上皮细胞具有透明胞质和增大的不规则核和污浊染色质。
本章未完待续

























共0条评论