第6章 子宫体肿瘤
子宫体肿瘤WHO分类表5ed
1、子宫内膜上皮性肿瘤和前驱病变
1.1前驱病变
无非典型性子宫内膜增生
8380/2 子宫内膜非典型增生
1.2子宫内膜癌
8380/3 子宫内膜样腺癌 NOS
POLE超突变的子宫内膜样癌
错配修复缺陷的子宫内膜样癌
p53突变的子宫内膜样癌
无特定分子谱(NSMP)的子宫内膜样癌
8441/3 浆液性癌 NOS
8310/3 透明细胞腺癌 NOS
8020/3 未分化癌 NOS
8323/3 混合细胞腺癌
9110/3 中肾管腺癌
8070/3 鳞状细胞癌 NOS
8480/3 黏液癌,肠型
9111/3* 中肾管样腺癌
8980/3 癌肉瘤 NOS
1.3瘤样病变
子宫内膜息肉
子宫内膜化生
Arias-Stella反应
2、子宫特异性间叶肿瘤
2.1平滑肌分化
2.1.1良性
8890/0 平滑肌瘤 NOS
脂肪平滑肌瘤
卒中性平滑肌瘤
水肿性平滑肌瘤
分割性平滑肌瘤
8892/0 富细胞性平滑肌瘤
8896/0 黏液样平滑肌瘤
8891/0 上皮样平滑肌瘤
8893/0 合胞体平滑肌瘤
2.1.2恶性潜能
8890/1 平滑肌瘤病 NOS
8897/1 恶性潜能未定的平滑肌肿瘤
8891/1* 恶性潜能未定的上皮样平滑肌肿瘤
8896/1* 恶性潜能未定的黏液样平滑肌肿瘤
恶性潜能未定的梭形细胞平滑肌肿瘤
8898/1 转移性平滑肌瘤
2.1.3 恶性
8890/3 平滑肌肉瘤 NOS
梭形细胞平滑肌肉瘤
8891/3 上皮样平滑肌肉瘤
8896/3 黏液样平滑肌肉瘤
2.2子宫内膜间质分化
8930/0 子宫内膜间质结节
8931/3 子宫内膜间质肉瘤,低级别
8930/3 子宫内膜间质肉瘤,高级别
8805/3 未分化肉瘤
2.3其他
8590/1 类似卵巢性索肿瘤的子宫肿瘤
8714/0 血管周上皮样细胞肿瘤,良性
8714/3 血管周上皮样细胞肿瘤,恶性
8825/1 炎性肌纤维母细胞肿瘤
上皮样肌纤维母细胞肉瘤
3、混合性上皮-间叶肿瘤
8932/0 腺肌瘤
8932/0 非典型性息肉样腺肌瘤
8933/3 腺肉瘤
4、杂类肿瘤
9473/3 原始神经外胚层肿瘤 NOS
9064/3 生殖细胞肿瘤 NOS
9071/3 卵黄囊瘤 NOS
9080/0 成熟性畸胎瘤 NOS
9080/3 不成熟畸胎瘤 NOS
/0良性肿瘤;/1非特指、交界性或不确定行为;/2原位癌和Ⅲ级上皮内肿瘤;/3恶性肿瘤,原发部位;/6恶性肿瘤,转移部位
加星号的编码:2020年6月由IARC/WHO委员会ICD-O会议批准
以下为旧版分类,供学习比较
子宫体肿瘤WHO分类表4ed
1、上皮肿瘤及其前驱病变
1.1前驱病变
无非典型性子宫内膜增生
非典型增生/子宫内膜样上皮内瘤变 8380/2*
1.2子宫内膜癌
子宫内膜样癌 8380/3
伴鳞状分化 8570/3
绒毛腺型 8263/3
分泌型 8382/3
黏液癌 8480/3
浆液性子宫内膜上皮内癌 8441/2*
浆液性癌 8441/3
透明细胞癌 8310/3
神经内分泌肿瘤
低级别神经内分泌肿瘤
类癌 8240/3
高级别神经内分泌癌
小细胞神经内分泌癌 8041/3
大细胞神经内分泌癌 8013/3
混合细胞腺癌 8323/3
未分化癌 8020/3
去分化癌
1.3瘤样病变
息肉
化生
Arias-Stella反应
淋巴瘤样病变
2、间叶肿瘤
2.1平滑肌瘤 8890/0
富于细胞性平滑肌瘤 8892/0
平滑肌瘤伴奇异形核 8893/0
核分裂活跃的平滑肌瘤 8890/0
水肿性平滑肌瘤 8890/0
卒中性平滑肌瘤 8890/0
脂肪瘤样平滑肌瘤(脂肪平滑肌瘤) 8890/0
上皮样平滑肌瘤 8891/0
黏液样平滑肌瘤 8896/0*
分割性平滑肌瘤 8890/0
弥漫性平滑肌瘤病 8890/1
静脉内平滑肌瘤病 8890/1
转移性平滑肌瘤 8898/1
2.2恶性潜能未定的平滑肌肿瘤 8897/1
2.3平滑肌肉瘤 8890/3
上皮样平滑肌肉瘤 8891/3
黏液样平滑肌肉瘤 8896/3
2.4子宫内膜间质肿瘤及相关肿瘤
子宫内膜间质结节 8930/0
低级别子宫内膜间质肉瘤 8931/3
高级别子宫内膜间质肉瘤 8930/3
未分化子宫肉瘤 8805/3
类似卵巢性索肿瘤的子宫肿瘤 8590/1*
2.5其它间叶肿瘤
横纹肌肉瘤 8900/3
血管周上皮样细胞肿瘤
良性 8714/0*
恶性 8714/3*
2.6其它
3、混合性上皮-间叶肿瘤
腺肌瘤 8932/0
非典型性息肉状腺肌瘤 8932/0
腺纤维瘤 9013/0
腺肉瘤 8933/3
癌肉瘤 8980/3
4、杂类肿瘤
腺瘤样瘤 9054/0
神经外胚层肿瘤
生殖细胞肿瘤
5、淋巴和髓系肿瘤
淋巴瘤
髓系肿瘤
6、继发性肿瘤
子宫体肿瘤简介
目前根据形态学诊断子宫内膜癌。Bokhman提出两大遗传学类型。I型肿瘤为低级别,ER相关,通常是临床惰性的子宫内膜样癌。II型,非子宫内膜样,临床侵袭性,与ER刺激无关,包括浆液性癌和透明细胞癌。I型和II型分类有教学和流行病学意义,但对肿瘤分层无用,因为临床、病理学和分子水平存在明显重叠。
大多数病例,显微镜诊断子宫内膜癌具有可重复性,特别是低级别肿瘤。但高级别肿瘤肿瘤产生了很大的观察者之间差异,这些肿瘤具有重叠的分子特征。通过整合基因组特征,癌症基因组计划(TCGA)识别4组癌(图6.01):1组有POLE突变,预后好;2组有微卫星不稳定性,中间预后;3组有低拷贝数改变,也是中间预后;4组有高拷贝数改变和TP53突变,预后差。

研究者使用一组有限的免疫组化加上POLE突变分析,试图把TCGA方法引入临床实践。这对3级子宫内膜样癌的预后评估特别有用,对其他类型子宫内膜癌也有潜在用途。有条件开展这些技术的地区,结合显微镜下特征和分子特征是最佳的预后分层方法。新版WHO分类包括新的肿瘤类型,如中肾管样腺癌和胃型黏液癌。
重要的分子进展也影响了子宫混合性上皮和间叶肿瘤以及子宫纯间质肿瘤的分类。多证据表明,癌肉瘤是一种侵袭性很强的子宫内膜癌,其肿瘤细胞表达上皮-间叶转化的特征。因此,癌肉瘤现在归入子宫内膜癌,而不是混合性上皮和间叶肿瘤。在子宫内膜间质肿瘤领域,发现了大量基因融合,促进了分类改进,将高级别子宫内膜间质肿瘤进一步分类,现在可以根据形态学、免疫组化和特异性分子发现而诊断。深入了解这些肿瘤特征,未分化子宫肉瘤的诊断减少了,并可能消失在不远的将来。
是否存在腺纤维瘤,一直争议。一方面,根据不寻常的形态学(局灶叶状结构,腺体周围间质细胞增多),其鉴别诊断包括良性子宫内膜息肉和宫颈息肉。另一方面,由于具有低度核分裂象活性,也要鉴别腺肉瘤。这些病变远比腺纤维瘤更常见,诊断腺纤维瘤应谨慎。
间叶肿瘤是子宫体的第二常见肿瘤类别,近年描述了一些新实体。在这些肿瘤类别中,重要的是FH缺陷平滑肌瘤,它可能是遗传性平滑肌瘤病和肾细胞癌综合征的表现之一,有相对特异性形态学,对于患者本人及其家庭,适当情况下应促使遗传学咨询。
尽管良性和恶性平滑肌肿瘤的鉴别诊断仍然是根据形态学标准(这与软组织中使用的标准不同),但已努力阐明这些良性和恶性肿瘤的分子基础,特别是实施二代测序,许多良性平滑肌肿瘤含有MED12突变,而平滑肌肉瘤含有TP53、ATRX和(非常少见的)MED12突变。分子研究也帮助识别了上皮样和黏液样平滑肌肉瘤中分别涉及PGR和PLAG1的特异性突变。
对于子宫内膜间质肿瘤类别,使用分子遗传学发现的重要进展,已拓宽了高级别子宫内膜间质肉瘤的谱系。这些肿瘤中新的一组包括ZC3H7B-BCOR和BCOR内部串联复制(ITD)肿瘤,其形态学与黏液样平滑肌肉瘤明显重叠。结合新的分子信息和形态学发现,在不久的将来,未分化肉瘤这组肿瘤可能消失。
血管周上皮样细胞肿瘤(PEComa)和炎性肌纤维母细胞肿瘤放在本章,是因为它们在子宫中研究最广泛。尽管形态学类似于其他部位描述的PEComa,子宫PEComa可能伴结节性硬化和淋巴管血管平滑肌瘤病,其中一个特殊亚型显示透明细胞和TFE3融合且缺乏TSC突变。子宫的炎性肌纤维母细胞肿瘤也是新近描述的。在子宫,最常见的鉴别诊断是平滑肌肿瘤,后者远远更常见。由于该肿瘤也能发生于其他部位,通过ALK阳性和ALK重排而建立炎性肌纤维母细胞肿瘤的诊断。
其他间叶肿瘤包括横纹肌肉瘤,放在第13章,因为下生殖道更常见。其他罕见肿瘤,仅在其他杂类间叶肿瘤中提及。
一、子宫内膜上皮性肿瘤和前驱病变
01. 无非典型性子宫内膜增生
定义
无非典型性子宫内膜增生是一种子宫内膜腺体的增殖,腺体大小和形状均不规则,无显著的细胞学异型性。
ICD-O编码
无
ICD-11编码
GA16.0 子宫内膜腺体增生
相关命名
可接受:良性子宫内膜增生;简单型子宫内膜增生不伴异型性;复杂性子宫内膜增生不伴异型性
亚型
无
部位
子宫内膜
临床特征
最常诊断于围绝经期,症状包括异常的非周期性阴道流血。超声检测,子宫内膜增厚。
流行病学
风险因素包括围绝经期、肥胖、多囊性卵巢综合征和糖尿病。
病因学
长期暴露于无对抗雌激素是风险因素。
发病机制
无非典型性子宫内膜增生是由于不受孕酮或孕激素类药物对抗的雌激素的长期暴露,并影响整个子宫内膜区域所致。
大体检查
子宫内膜有所变化,从晚增殖期的均匀褐色外观到明显增厚,有时呈息肉状或因囊肿而呈海绵状。
组织病理学
管状腺体夹杂分枝状和/或囊性扩张腺体,通常不规则分布,使得腺体密度增大,腺体与间质的比例也增大。上皮结构简单,但核交错排列可能貌似假复层结构。较高的雌激素水平会驱动核分裂并使细胞核变圆,而雌激素水平下降会产生核分裂静止的圆形或细长的细胞核。诊断的关键是在核特征所有送检的组织中均匀分布,有时会被随机散在分布的输卵管化生、纤维素血栓和间质崩解所影响。
细胞学
无临床相关性
诊断性分子病理学
无临床相关性
诊断标准
必要标准:腺体与间质的比例升高;管状、分枝状和/或囊性扩张的类似增殖期子宫内膜的腺体;所有送检标本中核特征呈均匀分布。
分期
无临床相关性
预后和预测
暴露于无对抗雌激素的妇女,子宫内膜癌的风险增加3-4倍,并在10年后增加至10倍。无非典型性子宫内膜增生的妇女,1-3%进展为高分化子宫内膜癌。
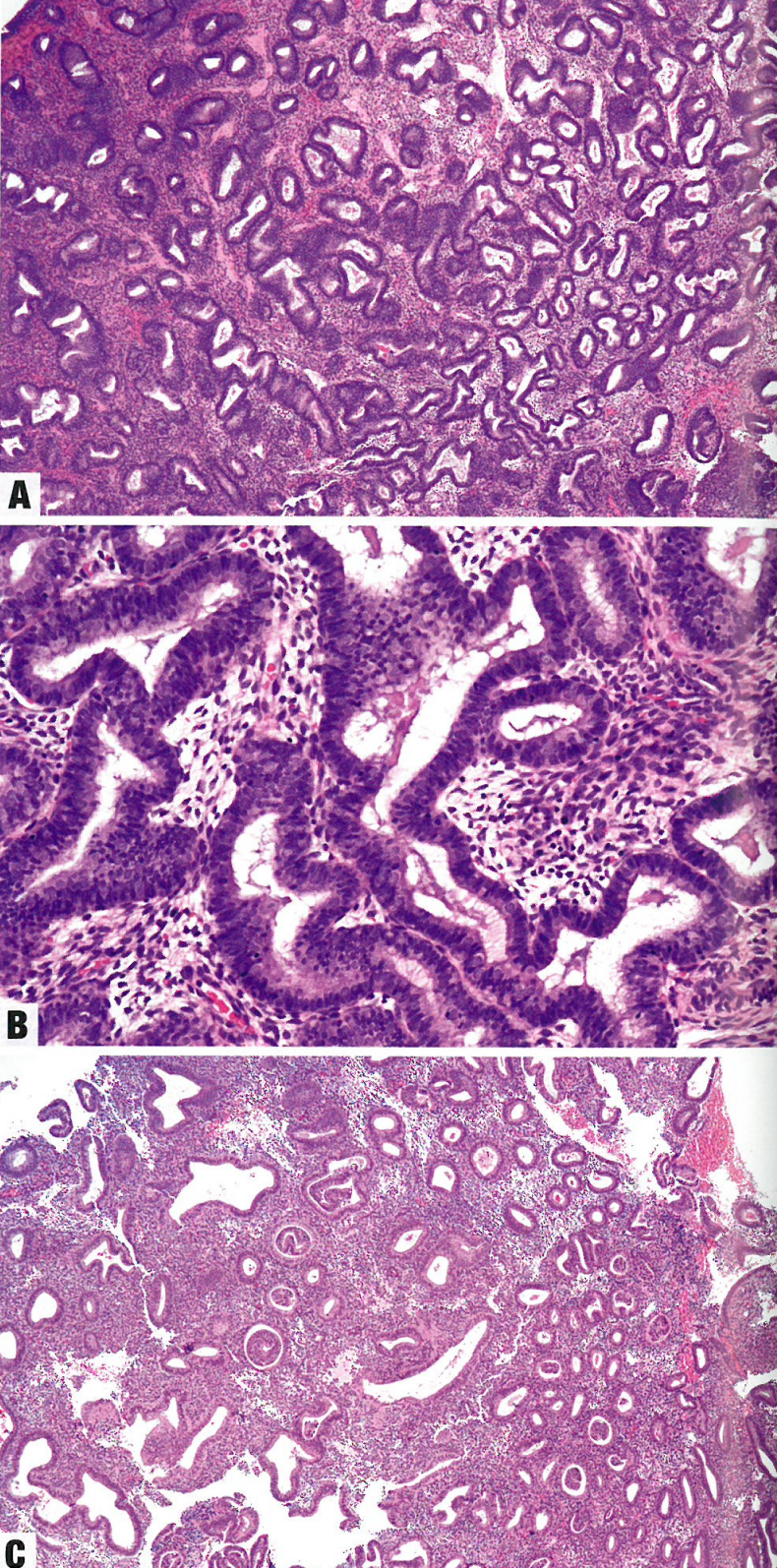
图6.02 无非典型性子宫内膜增生。A 注意结构改变(分枝状和扩张的腺体)和腺体之间的间质含量减少。B子宫内膜腺体呈分枝状和扩张。肌上皮缺乏细胞异型性。C 注意扩张的子宫内膜腺体有腺腔内乳头,这是一种假象(套叠现象)
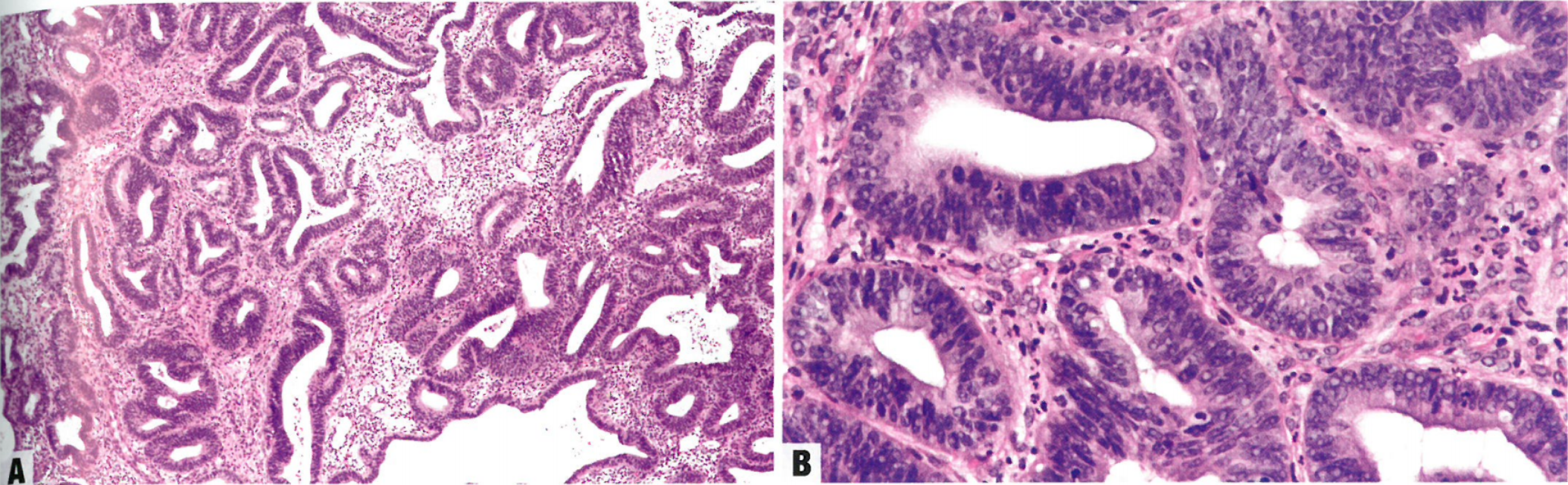 图6.03 无非典型性子宫内膜增生。A 结构改变包括分枝状腺体、囊腔和拥挤。B 腺体衬覆细胞呈柱状、假复层,核呈雪茄形,垂直于基底膜。
图6.03 无非典型性子宫内膜增生。A 结构改变包括分枝状腺体、囊腔和拥挤。B 腺体衬覆细胞呈柱状、假复层,核呈雪茄形,垂直于基底膜。
02. 子宫内膜非典型增生/子宫内膜样上皮内肿瘤
定义
子宫内膜非典型增生/子宫内膜样上皮内肿瘤(EAH/EIN)是上皮细胞学和子宫内膜腺体数量增多的同时改变,腺体比间质明显增多(拥挤的腺体结构),位于局限的形态学限定区域,与周围子宫内膜或陷入的正常腺体有明显分界。
ICD-O编码
8380/2 子宫内膜非典型增生
ICD-11编码
GA16.0&XH4Z68 子宫内膜腺体增生&子宫内膜样上皮内肿瘤
相关命名
不推荐:复杂性非典型子宫内膜增生;简单型非典型子宫内膜增生;子宫内膜上皮内肿瘤
亚型
无
部位
子宫内膜
临床特征
患者年龄平均为50-55岁。绝经后或围绝经期出血是最最常见的临床症状。
流行病学
遗传易感性类似于伴有子宫内膜样子宫内膜癌风险增加相关的遗传综合征,包括Cowden综合征和Lynch综合征。
病因学
高雌激素状态是风险因素。
发病机制
EAH/EIN表现为突变腺体的克隆性增生,突变腺体最初为局部病变,并可能扩展到占据整个子宫内膜范围。EAH/EIN包含许多子宫内膜样癌中可见的遗传学变化,例如:微卫星不稳定性(包括Lynch综合征);PAX2失活;以及PTEN、KRAS和CTNNB1突变。
大体检查
许多病变无肉眼可辨认的大体特征;其他一些病例表现局灶增厚,类似息肉,或位于弥漫增厚的子宫内膜内。大体表现通常被无非典型性子宫内膜增生、子宫内膜息肉或癌所遮盖。
组织病理学
EAH/EIN由拥挤的管状或分枝状腺体聚集而成,其结构和细胞学均不同于背景中的结构模式和细胞学模式。在EAH/EIN区域,腺体含量超过基质,导致基质含量相对减少。病变必须足够大(诚然,这是一个主观的衡量标准),可以排除人为假象;并且结构和细胞学改变是一致的和明显的。不同患者之间,核形态有所不同,但总是不同于病变所在的背景。EAH/EIN的核异型性可能伴有细胞质变化(各种类型的化生)。必须排除常见的类似改变(基底层子宫内膜、息肉、子宫内膜不同步)。无非典型性子宫内膜增生和EAH/EIN的区分,需要同时考虑结构特征(分别为全范围分布与局部分布)和细胞学特征(分别是全范围一致与不同于背景)。PTEN、PAX2或错配修复蛋白呈免疫染色阴性,可能是有帮助的诊断工具。
细胞学
无临床相关性
诊断性分子病理学
无临床相关性
诊断标准
必要标准:形态学局限的子宫内膜改变,具有拥挤的腺体结构和变化的上皮细胞学,不同于周围子宫内膜和/或陷入的非肿瘤腺体。
理想标准:免疫组化,PTEN、PAX2或错配修复蛋白均为阴性。
分期
无临床相关性
预后和预测
活检诊断为EAH/EIN的妇女,1/4至1/3会在立即切除的子宫内或在随访第一年发现癌。长期风险升高,估计从较早期的4级分类研究中的14倍至2级EIN分类研究中的45倍。1级子宫内膜样癌或EAH/EIN使用激素治疗的效果可用组织学监测,但尚未成为标准的临床实践。
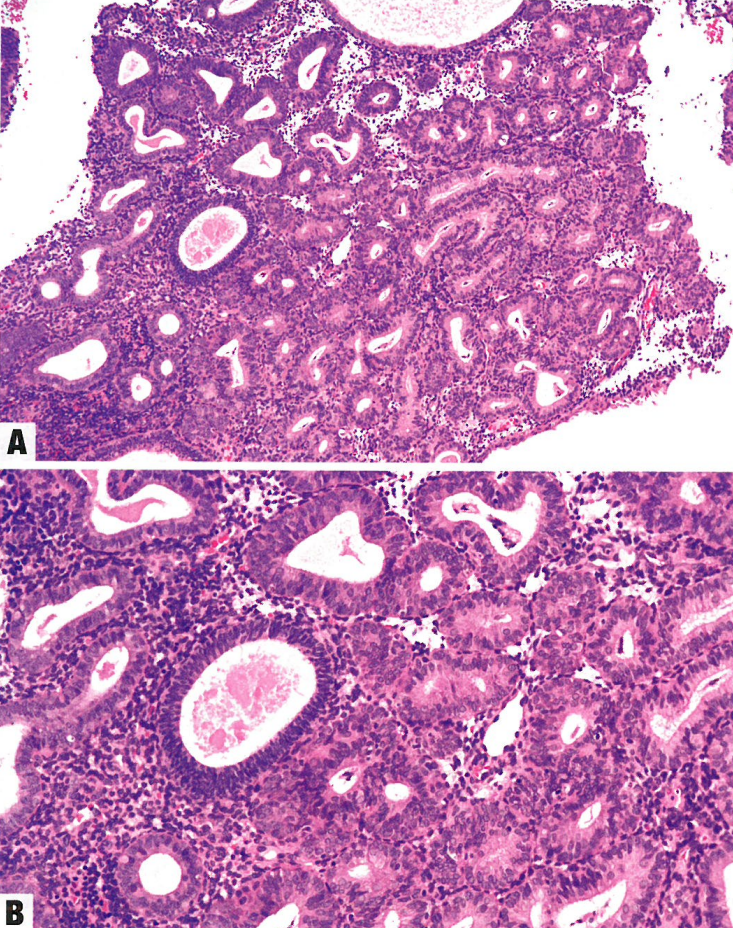
图6.04 子宫内膜非典型增生/子宫内膜样上皮内肿瘤(EAH/EIN)。A 此例病变由密集的子宫内膜腺体和很少间质组成。B 拥挤腺体的核和胞质特征不同于图中央陷入的无非典型性腺体。细胞异型性特征表现为腺上皮失去极性。核不规则分布,核增大,常为空泡状,或可能有明显核仁。
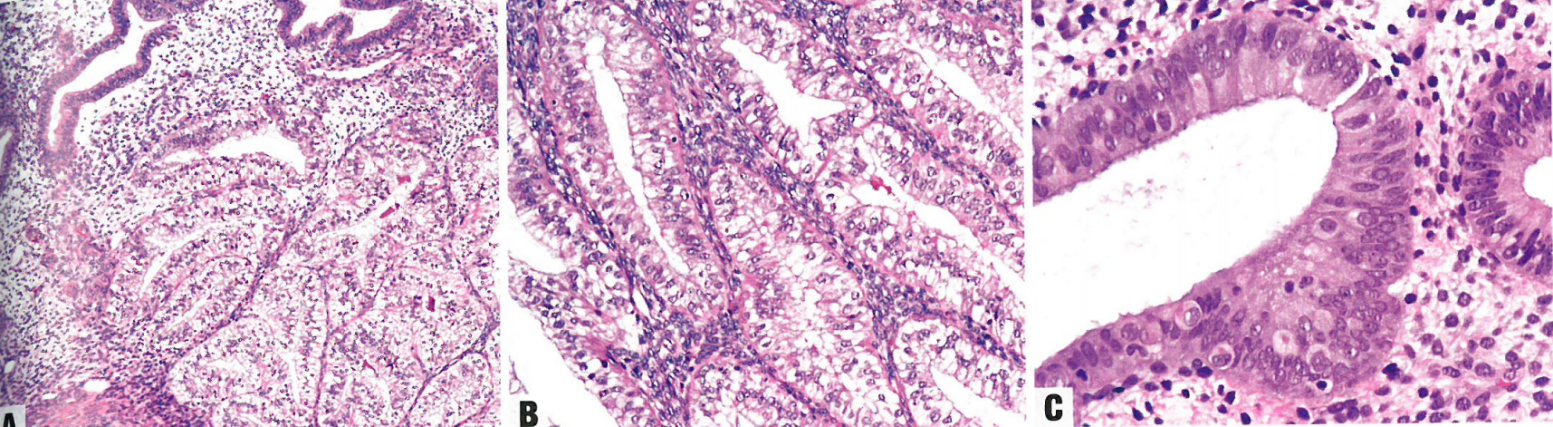
图6.05 A EAH/EIN伴分泌改变。拥挤的腺体显示分泌改变,类似于早分泌期子宫内膜。该病变不同于邻近的非病变腺体,后者没有广泛的分泌改变。B EAH/EIN伴分泌改变。非典型腺体特征表现为广泛的胞质透明,核增大,常有明显核仁。C EAH/EIN。非典型腺体有增大的、不规则分布的、圆形至卵圆形核(左),不同于邻近的非病变腺体,后者表现为较小的、细长的、假复层核(右)。

图6.06 EAH/EIN。A 低倍,此例EIN呈局限性病变:其结构显示拥挤腺体的聚集。B 有拥挤腺体的局部,非典型腺体的核和胞质特征不同于不太密集的背景腺体。
03. 子宫体的子宫内膜样癌
定义
子宫内膜样癌(endometrioid carcinoma)是一种恶性上皮性肿瘤,呈现不同比例的腺样、乳头状或实性结构,肿瘤细胞显示子宫内膜样分化。
ICD-O编码
8380/3 子宫内膜样腺癌(Endometrioid adenocarcinoma) NOS
ICD-11编码
2C76.0 子宫内膜的子宫内膜样腺癌(Endometrial endometrioid adenocarcinoma)
相关命名
无
亚型
有4种分子亚型:POLE超突变子宫内膜样癌;错配修复缺陷型子宫内膜样癌;TP53突变型子宫内膜样癌;无特定分子谱(NSMP)子宫内膜样癌
部位
子宫
临床特征
子宫内膜样子宫内膜癌(Endometrioid endometrial carcinoma,EEC)最常见于绝经后女妇女(90%以上患者>50岁),中位年龄63岁。典型表现为异常的/绝经后出血。进展期疾病表现为与卵巢癌相似的盆腹腔症状。
流行病学
子宫内膜癌占子宫体恶性肿瘤的绝大多数(欧洲80%,美国>90%);它是女性第六常见的癌症,也是第二常见的女性生殖器官癌症。据估计,2018年全球约有38.2万名妇女被诊断为子宫体癌,年龄标准化(世界)发病率从每10万人年1例到25例不等。最高的发病率出现在人类发展指数(HDI)非常高的国家国家(超过一半的病例)和中欧和东欧(如白俄罗斯),最低的发病率发生在低HDI国家(如也门、冈比亚和马拉维)(见图6.07)。在一些国家,子宫内膜癌发病率在过去几十年和几代人中一直在上升,尤其是在经历快速社会经济转型的国家,如中国、巴西和南非。子宫切除的女性不再有患癌风险。未能将他们排除在高危人群之外,人为地降低了发病率,但子宫切除率很少用于相应地校正发病率。子宫体癌通常是在月经过多和出血后早期诊断的。在高收入国家,5年生存率很高(美国约为80%)。在全球范围内,子宫体癌是癌症死亡的第14大原因,每年有近90000人死亡。根据2018年的估计年龄标准化死亡率范围,从每10万人年<1例死亡(在发病率最低的国家)到每10万人口中6例死亡(在发病率高或中等且获得治疗机会有限的国家)。
病因学
长期暴露于无对抗雌激素是风险因素。
发病机制
EEC与子宫内膜非典型增生/子宫内膜样上皮内肿瘤(EAH/EIN)存在共同的分子改变。暴露于总浓度较高的雌激素会增加患癌风险,如月经初潮早、绝经晚期、未产妇、肥胖、三苯氧胺、多囊卵巢综合征或产生雌激素的卵巢肿瘤。EEC也与Lynch综合征和Cowden综合征有关。
大体检查
肿瘤呈外生性或弥漫浸润。可能见到不同程度的坏死和出血。部分病例来自子宫下段。。
组织病理学
EEC通常显示(绒毛状)腺样结构,其组成细胞呈柱状,常有假复层核。这些(绒毛状)腺样结构通常显示平滑的腺腔轮廓。肿瘤细胞的细胞质通常呈嗜酸性和颗粒状。核异型性为轻度至中度,核仁不明显,但高级别EEC除外。核分裂计数变化很大。鳞状细胞分化很常见(发生在10-25%的病例中),表现为桑椹样不成熟鳞化或实性成片的嗜酸性细胞,甚至伴有角化。组织学模式(与不同的预后无关)包括分泌模式(类似于早分泌期子宫内膜,局灶性或弥漫性,貌似透明细胞癌)、小的非绒毛状乳头、微腺体模式、梭形细胞模式、Sertoly样模式和性索样结构和透明化。可能存在不同程度的粘液性模式,并可能占主导地位。
高分化EEC与EAH/EIN的区别是基于间质浸润,间质浸润的定义是腺体间穿插的间质消失(融合的腺体、筛状或迷宫样模式)、改变的子宫内膜间质(促结缔组织增生性间质反应)或复杂的(主要是绒毛状腺样)结构。具有粘液性分化的EEC可能难以区分非典型粘液腺增生;筛状或融合性结构和细胞学异型性是区分特征。
分级
EEC使用FIGO分级标准:1、2和3级肿瘤分别表现出≤5%、6-50%和>50%的实性非腺体、非鳞状细胞生长。大多数细胞存在严重的细胞学异型性(>50%)会使分级增加一个级别,但在核异型性与结构不成比例的情况下,应排除浆液性癌。建议使用二级分级系统,其中1级和2级肿瘤归类为低级别,3级肿瘤归类为高级别。在低级别EEC中,子宫内膜样病变可以通过常规组织学诊断。在高级别肿瘤中,鳞状分化强烈支持EEC,而不是其他组织学子宫内膜癌类型。
免疫组织化学
低级别EEC显示ER/PR呈弥漫性强阳性,p16呈斑片状阳性。这一特征可用于区分与子宫颈管腺癌,后者通常显示p16弥漫阳性,而ER和PR阴性(HPV相关子宫颈管腺癌),或p16、ER和PR均为阴性(HPV不相关子宫颈管腺癌)。高级别EEC可能难以与浆液性子宫内膜癌区分,但前者通常为实性,核多形性不太明显。与结构特征不成比例的弥漫性高度异型性需要怀疑浆液性癌的可能性。免疫组化,ARID1A、PTEN或错配修复蛋白之一呈阴性,支持高级别EEC。据报道,2-5%的低级别EEC和20%的高级别EEC中p53表达异常。
淋巴管血管浸润
5-15%的病例存在淋巴管血管浸润,通常与微囊、细长和碎片型(MELF)侵袭模式以及错配修复缺陷有关。特定的假象,如肿瘤细胞移位至淋巴管血管腔内和由于延迟固定导致的组织收缩,可能貌似淋巴管血管浸润,应予以排除。
细胞学
无临床相关性
诊断性分子病理学
结合公认的分子参数,可以清晰地区分4种生物学不同的EEC(见上文表6.01和原书第246页图6.01),增加相关的预后信息(见图6.09)。所有分子亚型的替代标记物(靶向POLE测序;MSH6、PMS2和p53免疫组织化学)促进了采用这种分子分类。
诊断标准
必要标准:浸润性子宫内膜癌伴子宫内膜样分化。
理想标准:某种程度的鳞化、分泌性或黏液性分化。
分期
EEC根据国际癌症控制联盟(UICC)TNM分类(见子宫内膜肿瘤的TNM分期,原书第18页)和FIGO分期系统进行分期。
预后和预测
FIGO和UICC分期是根据子宫肌层浸润深度(<50%或≥50%)和是否累及子宫颈管间质、附件和淋巴结。明确的淋巴管血管浸润已用于治疗决策,区分局限性和广泛性淋巴管血管浸润(≥5个脉管)可能具有预后意义。已经证明,子宫内膜和卵巢同步发生的子宫内膜样癌存在高度克隆相关性,它们呈惰性行为,当满足以下四个标准时,支持保守性治疗:(1)两个肿瘤都是低级别的,(2)肌层浸润<50%,(3)不累及任何其他部位,以及(4)任何部位都没有广泛的淋巴管血管浸润。出于治疗目的,这些肿瘤应作为独立的肿瘤进行管理。用激素药物保守治疗1级子宫内膜样癌或EAH/EIN的疗效可以通过组织学监测,但尚未成为标准的临床实践。

图6.07 2018年估计年龄标准化发病率(全球),子宫体,所有年龄段。
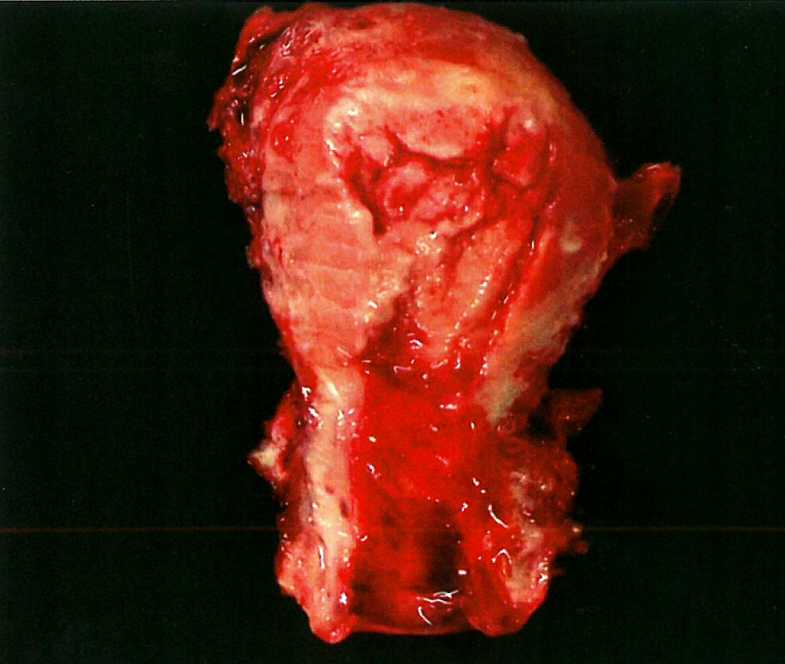 图6.08 子宫内膜样癌。1级子宫内膜样癌的大体表现。
图6.08 子宫内膜样癌。1级子宫内膜样癌的大体表现。
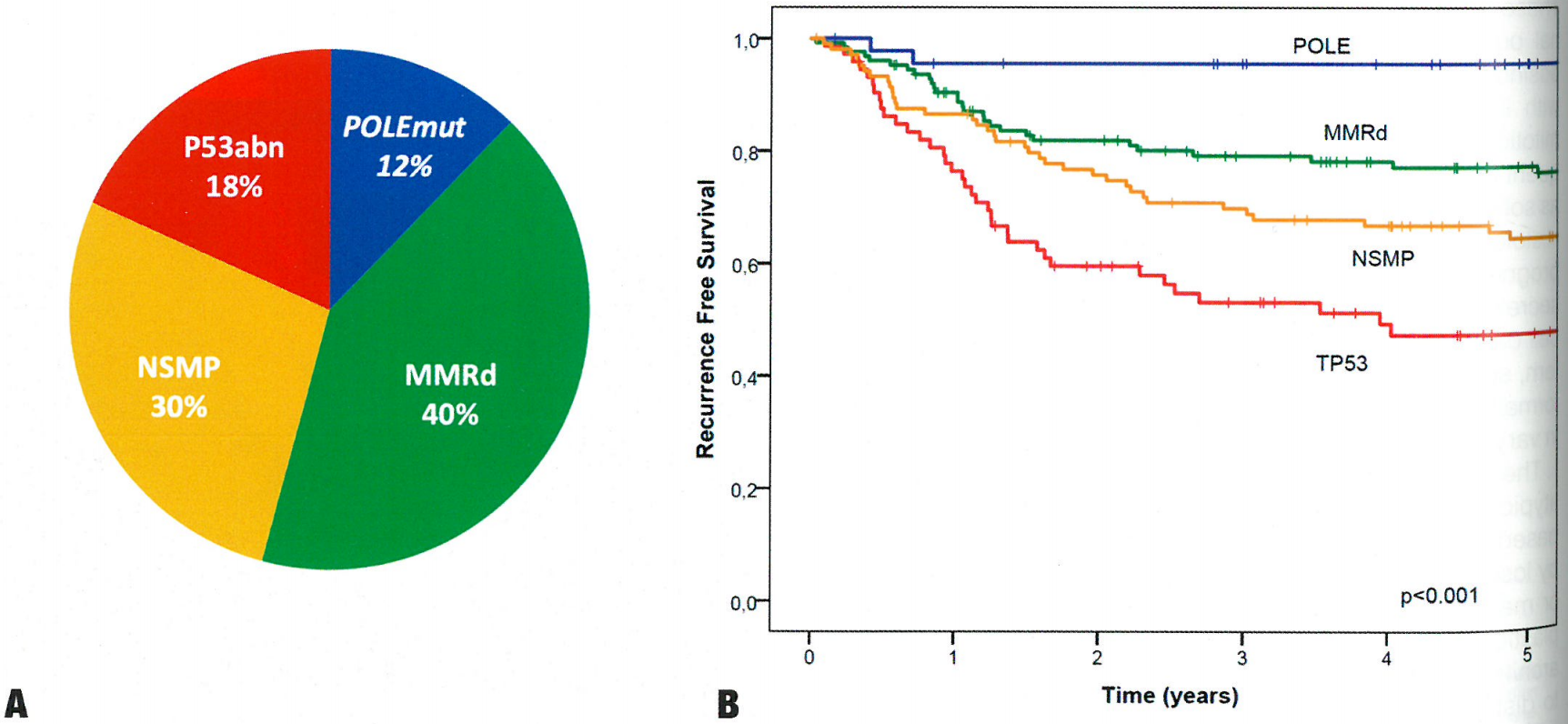
图6.09 FIGO3级子宫内膜样子宫内膜癌的分子亚型的分布(A)和无复发生存期(B)。3级子宫内膜样子宫内膜癌的分子分类识别了不同的预后亚组。
 图6.10 子宫内膜样癌。高级别子宫内膜样子宫内膜癌(FIGO 3级),p53突变。
图6.10 子宫内膜样癌。高级别子宫内膜样子宫内膜癌(FIGO 3级),p53突变。

图6.11 子宫内膜样癌。A 高级别EEC(FIGO 3级),错配修复缺陷型。注意丰富的肿瘤浸润性淋巴细胞和大量淋巴管血管浸润。B 低级别EEC(FIGO 1级),无特定分子谱(NSMP)。这例肿瘤无错配修复缺陷和p53突变,亦无致病性POLE变异型;因此归入NSMP。注意鳞状分化。
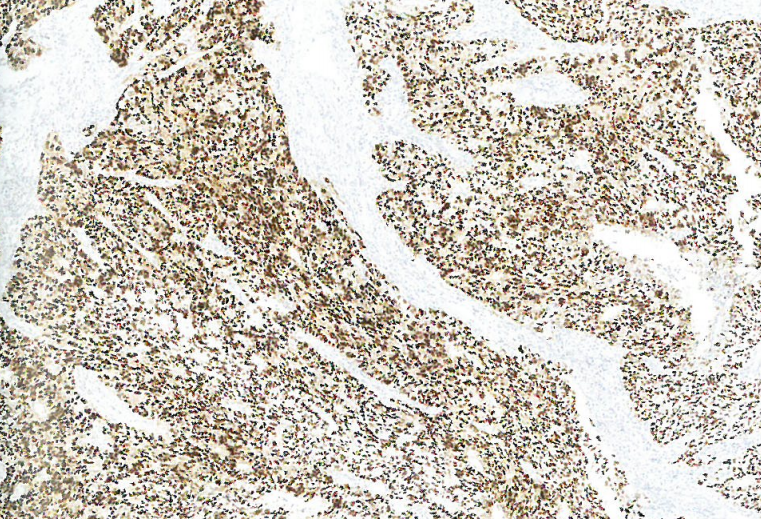 图6.12 子宫内膜样癌。免疫组化,p53呈异常的弥漫核阳性。
图6.12 子宫内膜样癌。免疫组化,p53呈异常的弥漫核阳性。
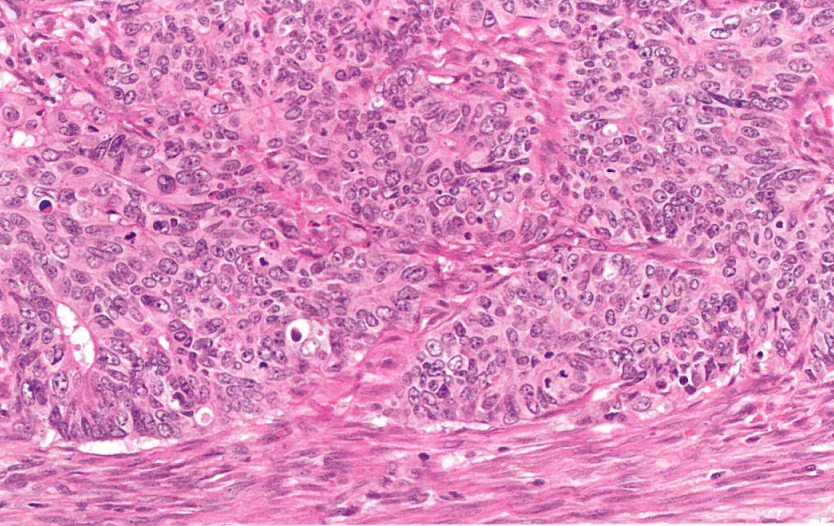
图6.13 子宫内膜样癌。高级别子宫内膜样子宫内膜癌(FIGO 3级),POLE突变。注意实性非鳞状生长。
表6.01 子宫内膜样癌(EC)的分子分类及其典型特征
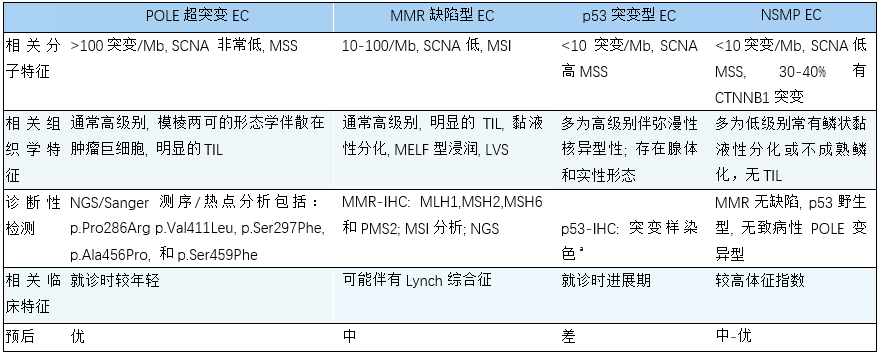
IHC,免疫组化;LVSI,淋巴管血管浸润;MELF,微囊、细胞和碎片;MR,错配修复;MSI,微卫星不稳定性;MSS,微卫星稳定性;NGS,二代测序;NSMP, 无特定分子谱; SCNA,体细胞拷贝数改变;TL,肿瘤浸润性淋巴细胞。
a 弥漫强阳性核表达,核染色完全缺失或胞质表达。
04. 子宫体的浆液性癌
定义
浆液性癌具有弥漫性、显著核多形性,典型者呈现乳头状和/或腺样生长模式。
ICD-O编码
8441/3 浆液性癌NOS
ICD-11编码
2C76.3 子宫内膜浆液性腺癌
相关命名
可接受:子宫浆液性癌;浆液性腺癌
亚型
无
部位
子宫
临床特征
大多数患者表现为绝后出血。手术分期的病例,40-50%发生子宫外转移,最常累及淋巴结或腹膜部位和网膜。
流行病学
浆液性癌约占所有子宫内膜癌的10%,但占子宫内膜癌相关死亡的40%。校正子宫切除率后,黑人女性子宫体浆液性癌的发病率高于其他人群。患者通常是多胎妊娠,有乳腺癌和/或三苯氧胺使用史,与肥胖相关的相对风险低于子宫内膜样癌。有些病例与之前的盆腔放疗有关。浆液性癌可能与种系和体细胞BRCA突变有关。
病因学
未知
发病机制
绝大多数肿瘤显示TP53突变。其他常见的遗传学改变涉及PIK3CA、PP2R1A和FBXW7。30%的病例存在ERBB2(HER2)扩增,通常分布不均匀。在癌症基因组图谱(TCGA)队列中,所有浆液性癌都属于拷贝数高的亚组。
大体检查
大体表现有所变化。一些肿瘤表现为明显的子宫内膜恶性肿瘤,通常会过度侵犯子宫肌层和子宫颈,有时还会累及附件。其他病例,起源于萎缩的子宫,可能仅在显微镜下可见,有时仅限于息肉内。
组织病理学
浆液性癌通常发生在萎缩性子宫内膜或子宫内膜息肉的背景下。在大多数病例中,出现复杂的乳头状和/或腺样结构特征,腺体通常细长、不规则,具有裂隙状腺腔。较少情况下,腺体圆形,腺腔边缘光滑,就像子宫内膜样癌,也可能出现实性生长模式。细胞学为高级别,有明显的核多形性大核仁和明显的核分裂活性。有时可能见到多核和砂粒体样钙化。浸润肌层的肿瘤可能具有不完整腺体,并显示出明显的淋巴管血管腔浸润。在没有浸润的情况下,取代固有宫腔表面和腺上皮的癌(浆液性子宫内膜上皮内癌,EIC)可能出现在浆液性癌附近,或在没有浸润性疾病的情况下被发现。在没有明显浸润的情况下,EIC可以脱落恶性细胞并转移到子宫外部位,因此应将EIC视为具有转移潜能。浆液性癌几乎总是显示突变型p53免疫染色,通常有p16、IMP3和HMGA2的弥漫性表达。有时出现ERBB2(HER2)过表达,ER/PR染色不一致。与3级子宫内膜样癌不同,浆液性癌中PTEN、β-catenin、ARID1A(BAF250a)和错配修复蛋白的异常染色非常罕见。浆液性癌可能是混合癌的组成部分之一,浆液样特征也可能出现在组织学不明确的肿瘤中,偶尔也出现在POLE突变的癌中。
细胞学
无临床相关性
诊断性分子病理学
存在TP53突变,分子检测或直接用免疫组化检测,可用于支持浆液性癌的诊断。
诊断标准
必要标准:细胞学高级别子宫内膜癌伴复杂乳头和/或腺样结构。
理想标准:异常p53和弥漫性p16免疫染色。
分期
浆液性癌根据国际癌症控制联盟(UICC)TNM分类(见子宫内膜肿瘤的TNM分期,原书第18页)和FIGO分期系统进行分期。
预后和预测
局限于子宫内膜的癌,预后较好,但子宫外扩散的患者,包括浆液性子宫内膜上皮内癌和微浸润疾病的患者,预后较差。ERBB2(HER2)过表达和/或基因扩增见于>30%的子宫内膜浆液性癌。复发性或晚期ERBB2(HER2)阳性子宫内膜浆液性癌患者,可以从卡铂和紫杉醇方案加曲妥珠单抗中获益。
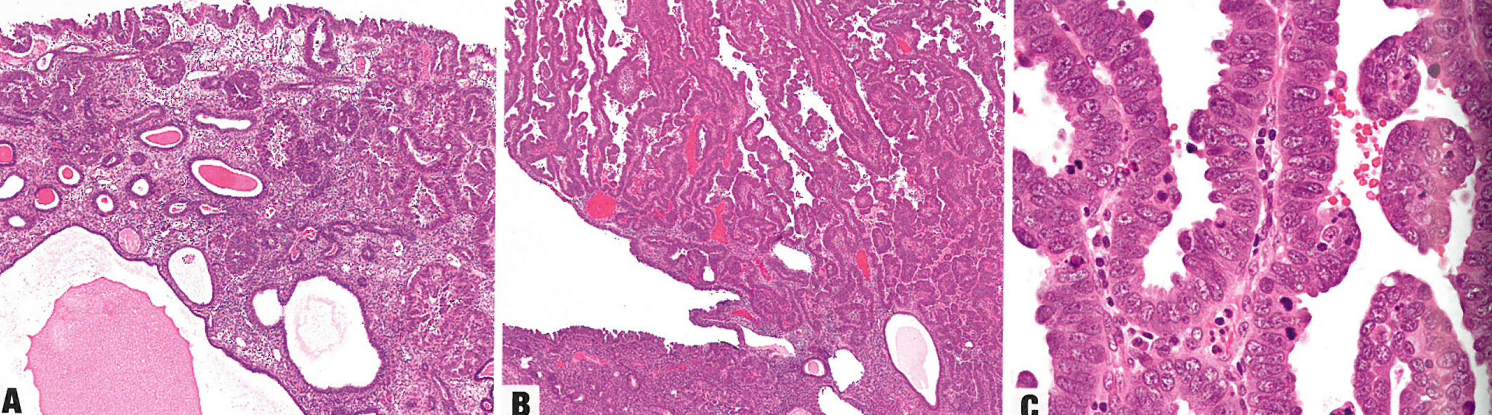 图6.14 浆液性癌。A 局限于子宫内膜息肉内的浆液性癌。腺体衬覆细胞有明显的细胞异型性,无明确的间质浸润。B 浆液性癌呈乳头状和腺样结构,并有鞋钉样特征,伴间质浸润。C 浆液性癌的细胞呈高级别特征,有明显的核多形性,大核仁,和明显的核分裂象。
图6.14 浆液性癌。A 局限于子宫内膜息肉内的浆液性癌。腺体衬覆细胞有明显的细胞异型性,无明确的间质浸润。B 浆液性癌呈乳头状和腺样结构,并有鞋钉样特征,伴间质浸润。C 浆液性癌的细胞呈高级别特征,有明显的核多形性,大核仁,和明显的核分裂象。
05. 子宫体的透明细胞癌
定义
透明细胞癌是一种癌,显示乳头状、管囊状和/或实性结构模式,具有多形性程度不同的多角形、立方形、扁平或鞋钉样细胞伴透明胞质。
ICD-O编码
8441/3 透明细胞腺癌NOS
ICD-11编码
2C76.2 子宫内膜透明细胞腺癌
相关命名
无
亚型
无
部位
子宫
临床特征
患者的平均年龄为70多岁。绝经后出血是最常见的症状,但宫颈细胞学筛查也可能异常,特别是进展期疾病。大约50-60%的肿瘤在就诊时处于早期。患者发生静脉血栓栓塞事件的风险可能增加。
流行病学
透明细胞癌罕见,约占所有子宫内膜癌的10%以下。
病因学
未知
发病机制
没有已知的组织学类型特异性分子特征;肿瘤亚群表现出分子异质性,可能与浆液性癌、子宫内膜样癌重叠,两皆无或两者兼有。重现性体细胞突变包括TP53(36-59%)、PPP2R1A(16-37%)、PIK3CA(11-36%)、PIK3R1(16-21%)、KRAS(11-14%)、ARID14(15.9-27%)和SPOP(14-18%)的突变。关于PTEN突变(0-14%)和POLE突变(0-7%)的报道结果相互矛盾。据报道,11-14%的病例显示高度微卫星不稳定性,但DNA错配修复蛋白缺失的频率存在显著差异(0-33%)。
大体检查
大多数病例形成质脆易碎的肿块,与其他子宫内膜癌的特征无法区分。
组织病理学
为了区分透明细胞癌和潜在的组织学类似疾病,并最大限度地提高诊断的可重复性,需要严格遵守诊断标准,包括结构和细胞学标准。主要的结构模式(管囊状、乳头状和实性)经常相合混杂。乳头通常短而圆,通常有透明化的间质。管囊状区域显示不同程度的腺体和囊肿相融合。肿瘤细胞呈立方形、多角形、鞋钉样或扁平,细胞质透明或嗜酸性。然而,诊断既不需要细胞质透明,也不需要鞋钉细胞。高柱状细胞、明显复层化、腺体内细胞丛和脱落的细胞芽要么不存在,要么仅局部存在;没有鳞状细胞分化。核多形性程度不一,但典型病例至少存在局灶性中度至重度异型性。核分裂活性可能存在明显的瘤内和瘤间差异,但大多数肿瘤显示<5个有丝分裂/2 mm²(相当于直径0.55 mm、面积0.24 mm²视野下<6个/10HPF)。免疫组织化学显示,肿瘤HNF1β、napsin A和AMACR(P504S)阳性率分别为67-100%、56-93%和75-88%,通常在大多数细胞呈阳性染色。ER和PR通常为阴性或仅局部阳性;22-72%的病例显示突变型p53染色。
细胞学
无临床相关性
诊断性分子病理学
存在TP53突变,分子检测或直接用免疫组化检测,可用于支持透明细胞癌的诊断。
诊断标准
必要标准:管囊状、乳头状和/或实性模式的混杂;透明至嗜酸性立方形、多角形、鞋钉样或扁平细胞。
理想标准:免疫染色证实。
分期
透明细胞癌根据国际癌症控制联盟(UICC)TNM分类(见子宫内膜肿瘤的TNM分期,原书第18页)和FIGO分期系统进行分期。
预后和预测
5年总生存率为55-78%。复发病例大多数发生在盆腔外。晚期患者年龄和肿瘤分期是公认的不良预后因素。其他可能的预后因素包括:癌症基因组图谱(TCGA)亚组(特别是POLE突变的存在);L1CAM、IMP3和细胞周期蛋白E的高表达;ARID1A(BAF250a)的表达缺失;p53表型异常;其他早期疾病的腹膜细胞学阳性;种族;辅助治疗模式;肿瘤大小;肿瘤结构模式;淋巴管血管浸润。
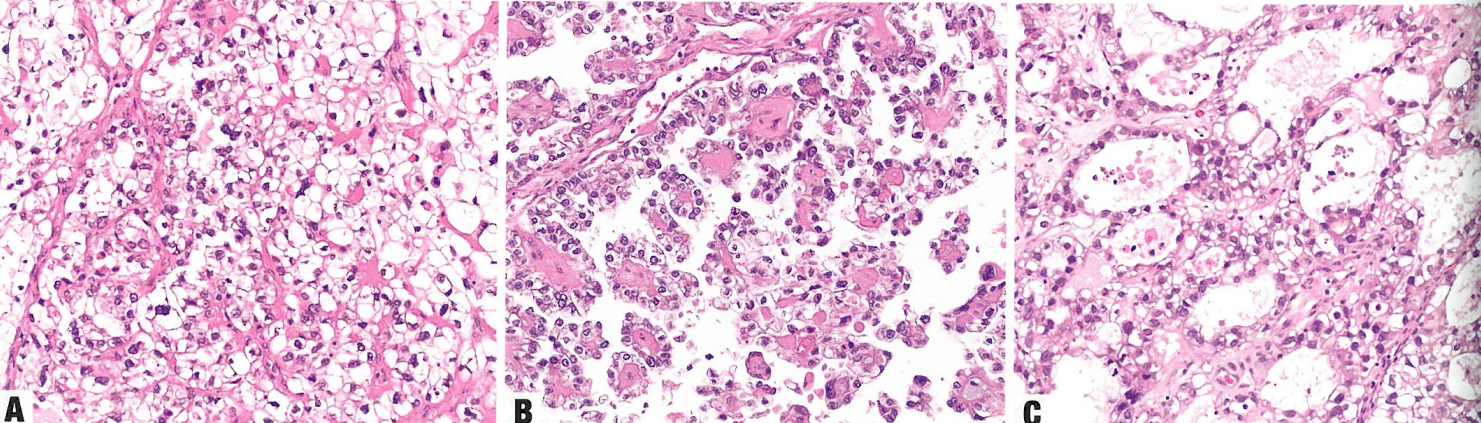 图6.14 透明细胞癌。A 实性模式。B 乳头状模式。C 管囊状模式。
图6.14 透明细胞癌。A 实性模式。B 乳头状模式。C 管囊状模式。
本章未完待续




























共0条评论