[导读] 作者:陈旭
临床情况
18岁女性患者,无外伤史,体育运动(晨跑)后伴左侧上肢疼痛4天,期间行传统针灸治疗,效果欠佳,至我院就诊。门诊影像学检查发现左侧肱骨中上段广基底肿物。遂于我院骨科住院,行骨病变切除术。
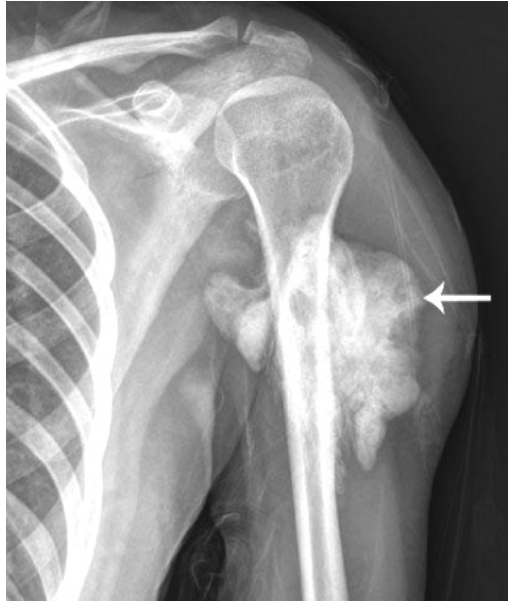
图1.X线平片示左肱骨近段见一密实的、形态不规则的肿块(箭头所示)。
大体观察
(左侧肱骨病变刮除标本):灰白灰褐色破碎组织一堆,大小:5cm×3.5cm×2.8cm,局部可见骨组织,软组织切面灰白实性质地中,局部砂砾感(骨组织EDTA脱钙处理,送检组织全部取材制片)。
组织学改变
镜下均由分化相对成熟的骨小梁构成,多为不规则的编织骨,骨小梁周围缺乏骨母细胞被覆,有平行排列倾向。小梁间为梭形细胞间质伴胶原形成。大多数梭形细胞类似纤维母细胞,呈长束状或交织状排列,缺乏明显的异型性。
 图2.组织学形态。(A)低倍镜下,病变主要由分化较好的肿瘤性骨组织和浸润于其间的梭形成纤维细胞组成(10X)。(B)中倍镜下,骨组织较为成熟,表现为细细长、平行的骨小梁或不规则的编织骨(20X)。(C)高倍镜下,梭形肿瘤细胞似纤维母细胞,多呈长束状或交织状排列,细胞之间多伴有明显的胶原化;核细长,轻度异型性,未见核分裂(40X)。
图2.组织学形态。(A)低倍镜下,病变主要由分化较好的肿瘤性骨组织和浸润于其间的梭形成纤维细胞组成(10X)。(B)中倍镜下,骨组织较为成熟,表现为细细长、平行的骨小梁或不规则的编织骨(20X)。(C)高倍镜下,梭形肿瘤细胞似纤维母细胞,多呈长束状或交织状排列,细胞之间多伴有明显的胶原化;核细长,轻度异型性,未见核分裂(40X)。
免疫组化染色结果
SATB-2(+)、CDK4(+)、MDM-2(部分+),Ki-67(增殖指数约为3%-5%)
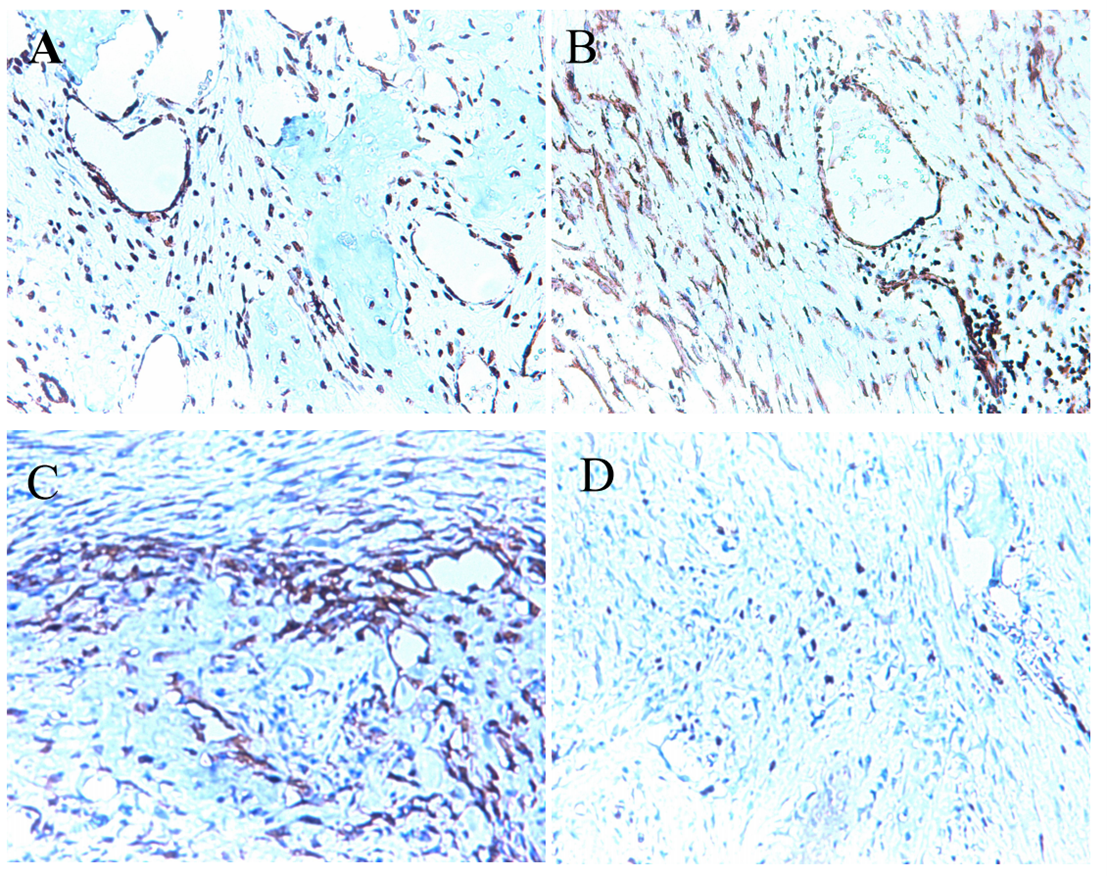 图3. 免疫组化结果。(A)SATB-2;(B)CDK-4;(C)MDM-2;(D)Ki-67。
图3. 免疫组化结果。(A)SATB-2;(B)CDK-4;(C)MDM-2;(D)Ki-67。
分子遗传学改变
CDK4扩增阳性,MDM2扩增阳性,USP6重排阴性,GNAS1基因突变检测阴性。
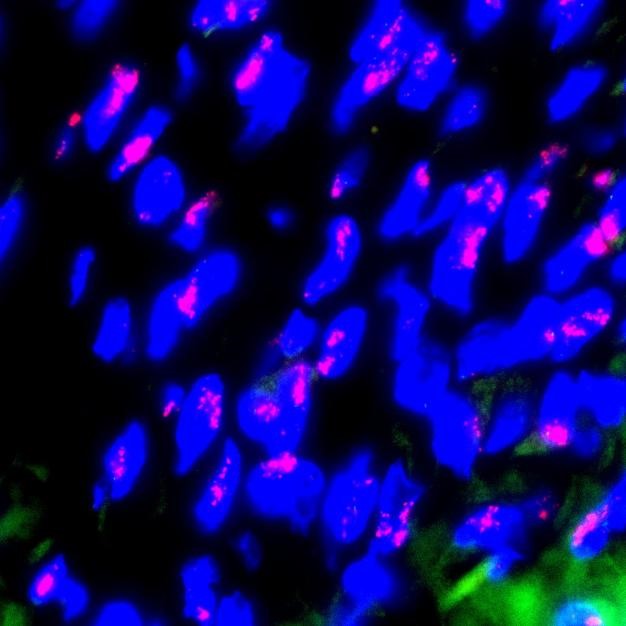
图4.FISH检测结果显示,MDM2扩增阳性。
最终诊断
(左侧肱骨病变)骨旁骨肉瘤(皮质旁骨肉瘤)。
小结
疾病概述
骨旁骨肉瘤又称为皮质旁骨肉瘤(parosteal osteosarcoma,POS)是一组起源于骨表面的低度恶性成骨性肿瘤,是骨肉瘤中的一种少见亚型,约占原发性骨肉瘤的3.7%。
临床表现
发病年龄9至75岁,中位年龄31岁,女性略多于男性,男女比例2∶3。病变部位主要位于长管状骨两端,尤以股骨远端后方表面为主(约占70%),其次为股骨及肱骨近端,胫骨、桡骨、尺骨、腓骨等长骨也可发生,而颌骨、肋骨、颅骨国内外罕见。表现为骨表面缓慢生长的无痛性肿块,病程较长,可达数年,患者常无特异性表现,易被忽视、误诊。
影像学改变
X线检查可见附着于骨表面矿化显著的卵圆形或分叶状广基肿块影,即生骨现象。随着肿瘤的增大,有包绕骨干的趋势。30%可出现肿瘤与骨皮质之间透亮线或称“线样征”(string sign),晚期可有骨皮质侵犯,可及髓腔,通常无骨膜反应。
CT和MRI都能显示肿瘤的软组织成分及其对髓腔的侵犯,但CT很难将肿瘤与母体骨区分清楚。而且CT也较难发现主瘤体周围新生瘤骨沉积的卫星状瘤结节。在MRI检查中,肿瘤较小时,T1WI及T2WI加权多呈低信号。一些专家认为,T1WI、T2WI均呈低信号的肿瘤病理分级低,T2WI呈高信号的肿瘤病理分级高。
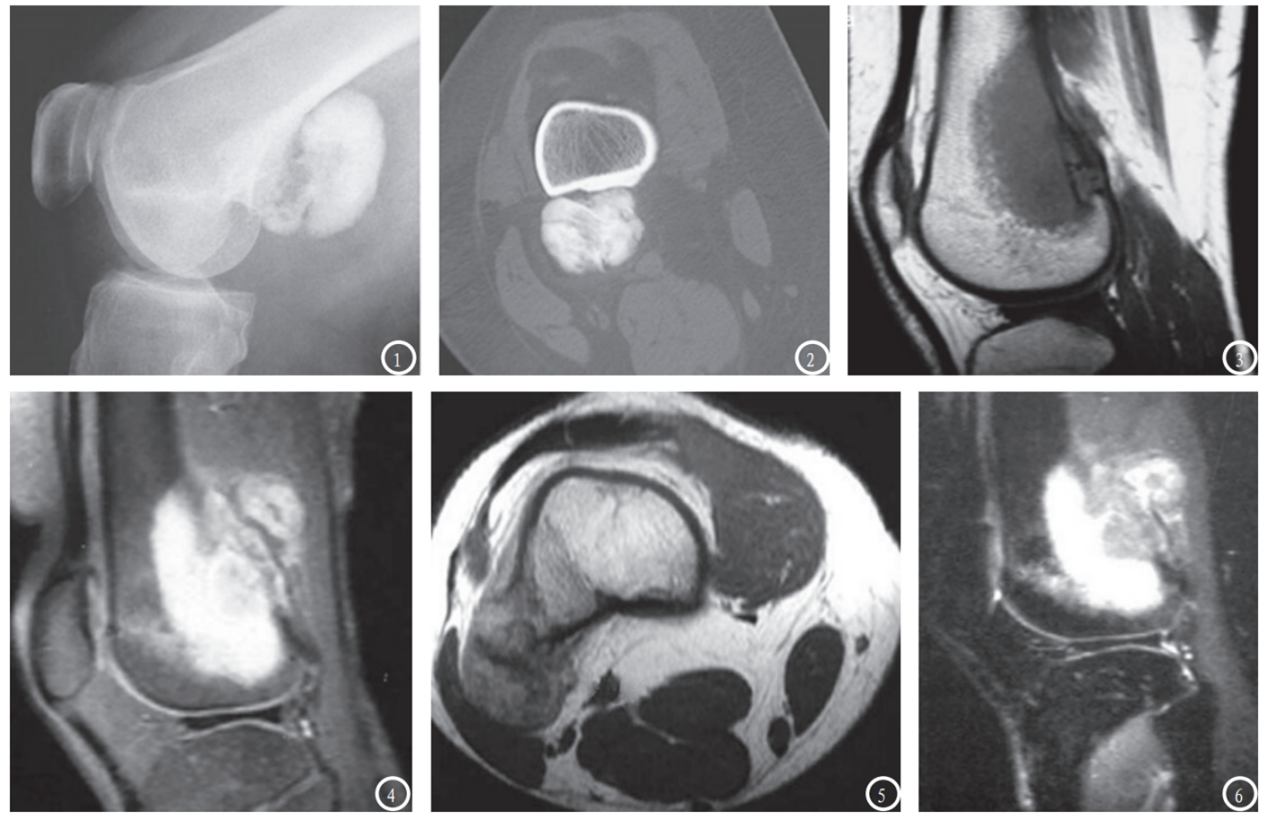
图5.膝关节骨旁骨肉瘤,患者,女性,28岁,①膝关节侧位示股骨后缘见一密实的、略呈分叶状的骨块,其与股骨后缘骨皮质间见透亮线;② CT轴位显示肿块与骨皮质间透亮线。③T1WI加权显示股骨后缘骨皮质欠规整,髓腔内见大片状低信号浸润;④T1WI压脂增强扫描显示,髓腔浸润灶均匀一致强化,位于股骨后方的肿块实性成分亦见强化。⑤ T1WI增强扫描,肿瘤的软组织成分强化;⑥图6 T2WI压脂,骨髓浸润灶呈高信号,周围的软组织成分呈中等信号。
组织学改变
组织学上,肿瘤为坚硬骨性包块,连于干骺端皮质一侧或半周;镜下由新生的骨小梁与活跃的纤维性间质组成。皮质附着处成骨现象明显,骨小梁最成熟,愈向边缘成骨愈少,具层状结构。小梁被纤维母细胞及胶原纤维组成的稀疏的梭形组织分隔,异型性不明显,核分裂少见;大部分骨小梁表面缺乏骨母细胞被覆,缺乏钙化。少数原发病例及复发肿瘤细胞密度及异型性明显,出现去分化区域,即使为灶性也提示预后不佳,故建议在病理报告中注明。
免疫组化及分子遗传学改变
免疫组化MDM2和CDK4阳性有助于骨旁骨肉瘤和相关疾病的鉴别,但在预测预后方面没有意义。在骨旁骨肉瘤中,可见MDM2基因扩增。
鉴别诊断
(1)骨软骨瘤
骨柄部分与骨皮质相连,松质骨处的骨小梁间为脂肪或造血组织;软骨帽内软骨细胞排列规则,呈柱状。X线示肿瘤与骨组织相延续,锥形或钩状;而骨旁骨肉瘤肿块圆而广基,与宿主骨间可有间隙或“线样征”。镜下骨旁骨肉瘤的肿瘤性骨小梁间为梭形细胞,具有一定的异型性。肿瘤边缘偶见软骨岛,软骨细胞排列凌乱。
(2)骨化性肌炎
存在外伤史,病史短,约3-5周。病情变化迅速,呈肿块形成快、骨化出现快及缩小也快的“三快”现象。病变位于骨旁软组织,可紧贴骨膜或在软组织内浸润性生长。骨化自外周向中央发展。X线表现与骨旁骨肉瘤相反,肿物周边密度高,中心较透亮。镜下呈分带现象,中央纤维细胞增生,骨母细胞形成不成熟的骨样组织;中间带为反应性新生骨小梁,外周为成熟骨壳。分子检测USP6基因重排阳性。
(3)纤维骨性假瘤
主要发生于手足部且与创伤和感染有关。X线肿块与骨膜相连伴骨膜反应。镜下可见大量不成熟骨样组织和编织状骨小梁,有较肥胖成骨细胞被覆,纤维间质内可见上皮样成骨细胞和破骨细胞样巨细胞。
(4)骨痂机化
常有外伤史。出血明显,血管丰富,也有分带现象,呈现软骨化骨过程,即从幼稚的软骨组织及骨样组织到钙化编织骨,再到成熟板层骨形成连续的谱系。细胞生长活跃,但缺乏
核的异型性和病理性核分裂,细胞很少呈梭形。而骨旁骨肉瘤的梭形细胞更丰富,缺乏钙化灶性结节由低级别软骨肉瘤细胞组成,排列杂乱,有轻度异型。
(5)普通型骨肉瘤(纤维母细胞型)
发病年龄常比POS小。后者骨小梁间充满稀疏的梭形细胞及其间质,不仅缺乏结构多样性及显著细胞异型性,而且缺乏肿瘤性骨样基质。POS多无髓质浸润,即使有也发生较晚,且往往为局灶性。
(6)低级别中央型骨肉瘤
除了位置外,其形态改变几乎与POS一样。只是前者病变位于髓内,浸润骨髓,而后者位于骨旁。
(7)高级别表面型骨肉瘤
男性多于女性,病程短,恶性程度高。生长于骨表面,骨质坚硬,表面糜烂或呈溶骨性破坏。肿块形态不规则,与皮质紧密相连,无明显分界。主要由成骨性肉瘤样成分组成,间质形成大量的肿瘤性骨样组织。瘤细胞多呈多边形,异型性明显。缺乏低级别骨肉瘤成分。
(8)骨膜骨肉瘤(皮质旁软骨母细胞型骨肉瘤)
骨膜骨肉瘤不累及髓腔,而1/4POS可见骨髓腔侵犯。肿瘤组织多为软骨母细胞性,之间一般能见到花边样骨样组织或骨组织,而不像POS那样,中央区无软骨小叶,趋于平行的肿瘤性骨小梁间充满纤维母细胞,缺乏钙化。
纤维结构不良
当肿瘤内由大片分化较好的纤维组织构成,仅出现散在的不连续的呈字母状的肿瘤性编织骨时,易与该病混淆,但纤维结构不良发生在髓内,且是一种纤维化身骨,存在GNAS1基因突变。
治疗与预后
POS具有局部侵袭性伴有限的远处扩散潜能。对于体积较小者可行单纯肿瘤切除术,对于体积较大、侵袭相邻骨骼或复发者应行广泛、彻底切除。若肿瘤浸润重要的血管或神经无法彻底切除,则考虑截肢。骨截平面安全手术切缘距肿瘤至少2cm,软组织至少3cm。若肿瘤切除不彻底可复发、转移甚至发生去分化。如发生去分化,其预后与普通型骨肉瘤无异,但好于去分化软骨肉瘤。POS生长缓慢,复发、转移多发生于术后数年后。
参考文献
[1]Han I, Oh J H, Na Y G, et al. Clinical outcome of parosteal osteosarcoma[J]. Journal of surgical oncology, 2008, 97(2): 146-149.
[2]Ruengwanichayakun P, Gambarotti M, Frisoni T, et al. Parosteal osteosarcoma: a monocentric retrospective analysis of 195 patients[J]. Human pathology, 2019, 91: 11-18.
[3]陈婷婷,徐钢,巫娟,等.7例骨旁骨肉瘤的临床病理分析[J].标记免疫分析与临床,2021,28(11):1916-1919.
[4]孙文萍,李梅,孙贞魁,等.骨旁骨肉瘤的影像学表现及相关病理改变[J].中国医学计算机成像杂志,2020,26(03):266-270
[5]肖林,胡剑波,吴泽文,等.12例长骨皮质旁骨肉瘤的影像学表现分析[J].中国CT和MRI杂志,2015,13(02):73-76.
[6]方三高,李艳青,马强,等.骨旁骨肉瘤5例临床病理分析[J].诊断病理学杂志,2016,23(04):247-251.


















共0条评论