[导读] 编译:张波
摘要 转移是非小细胞肺癌(NSCLC)患者死亡的关键因素。上皮间质转化(EMT)在调节肿瘤转移中起着至关重要的作用。胶质瘤相关癌基因1(Gli1)在一系列肿瘤组织中异常活跃。然而,Gli1与NSCLC转移之间的分子调控关系尚未确定。本研究报道了Gli1可促进NSCLC的转移。Gli1的高表达与NSCLC患者的生存不良有关。Gli1在低转移A549和NCI-H460细胞中的异位表达增强了其迁移、侵袭能力,并促进了EMT过程,而在高转移的NCI-H1299和NCI-H1703细胞中Gli1的异位表达则相反。值得注意的是,在静脉注射转移模型中,Gli1过表达加速了NSCLC的肺和肝转移。进一步的研究表明,Gli1通过与其启动子结合并促进它的蛋白质稳定性,从而促进了非小细胞肺癌的迁移、侵袭和EMT。此外,Gli1抑制剂Gant-61可明显抑制NSCLC的转移。总之,本研究表明,Gli1是NSCLC转移的关键调节因子,并提示靶向Gli1是转移性NSCLC的一种前瞻性治疗策略。
前言
NSCLC包括肺腺癌(LUAC)、肺鳞癌(LUSC)和大细胞癌亚型,具有发病率高、生存率低的特点。NSCLC患者的总生存率为10%~20%,中位生存期为8~10个月。转移是NSCLC相关死亡的首要原因。大约75%的NSCLC患者有局部或远处转移的迹象,只有大约15%的转移性NSCLC患者在确诊后存活5年或更长时间。NSCLC可单独或同时转移到肺、肝、脑、骨等局部或远处器官。大多数NSCLC患者在确诊时已有远处转移,这严重增加了治疗的难度,降低了患者的生存率。而这些过程背后的分子机制在很大程度上仍不清楚。因此,迫切需要揭示转移性NSCLC的潜在机制,寻找有效的治疗靶点或预后生物标记物。
NSCLC转移是一个复杂的多步骤细胞生物学过程,涉及一系列级联事件,包括间质细胞能力的获得、原发肿瘤的解离和血管内皮细胞转化为循环中的肿瘤细胞、存活的循环中的肿瘤细胞渗入实质、黏附和在靶部位定植。越来越多的证据表明,EMT在肿瘤转移中起着关键作用。EMT参与了几个肿瘤转移的过程,包括癌细胞从原发肿瘤脱落,进入循环并在循环中存活,以及渗出到远处的器官。EMT还与许多癌细胞的干性和化疗耐药性有关。在EMT过程中,上皮标志物(如E-钙粘蛋白和ZO1)水平降低,而间质标志物(如Vimentin、N-钙粘附素和纤维连接蛋白)水平升高。肿瘤组织中高Ncadherin、Vimentin和低E-cadherin水平通常预示着患者总体存活率较低。而使用某些化疗药物或基因缺失逆转EMT过程已被证明可以减弱NSCLC的转移过程。Snail是最重要的EMT诱导转录因子之一,已被证明在多种上皮性癌细胞株和原发肿瘤中激活EMT过程。这些都表明EMT在NSCLC转移中起关键作用,尽管确切的机制尚不清楚。
Hhedgehog/Glioma相关癌基因(HH/Gli)信号通路在乳腺癌、结直肠癌、胃癌和骨肉瘤等多种肿瘤组织中经常被激活。Gli1是HH/Gli1信号通路的关键效应者,它通过持续反式激活HH、Gli1、PTCH1、SMO等靶基因启动肿瘤进展。Gli1通过上游PTCH/SMO依赖(经典)或PTCH/SMO非依赖(非经典)信号通路,在许多肿瘤组织中异常活跃。Gli1的过度表达与肿瘤干细胞的自我更新表型、耐药性和侵袭行为有关。最近,一些研究表明HH/Gli1在非小细胞肺癌的发生和维持中起关键作用。Gli1在腺癌和鳞癌中的表达增强。Gli1的高表达可能与肺癌的侵袭行为有关。此外,Gli1在肺癌组织中的表达被认为与EMT标志物的表达有关。然而,Gli1在NSCLC转移中的作用及其机制尚不清楚。
在这项研究中,发现Gli1在NSCLC组织中表达上调,高Gli1表达表明NSCLC患者的总体生存率较低。Gli1可增强NSCLC的体内外侵袭转移能力。从机制上讲,发现Snail在Gli1介导的NSCLC侵袭和EMT增强中起关键作用。Gli1通过与其启动子结合,增强其蛋白稳定性,正向调控Snail的表达。此外,Gant-61靶向Gli1可显著抑制NSCLC的转移。综上所述,本研究提供了强有力的证据,证明Gli1是NSCLC转移的促进剂,并阐明了其潜在的分子机制。本研究提示Gli1有可能成为治疗NSCLC转移的潜在靶点。
材料及方法
该研究通过患者种属和免疫组织化学(IHC)染色、Gli1稳定转染细胞系的建立、Transwell迁移和侵袭测定、RNA提取和定量实时聚合酶链反应(RT-qPCR)、免疫荧光法、免疫印迹实验、Snail蛋白半衰期测定、体内转移测定、质粒和小干扰RNA(siRNA)的瞬时转染、荧光素酶报告基因测定、染色质免疫沉淀(ChIP)测定、统计分析等方法检测。
结果
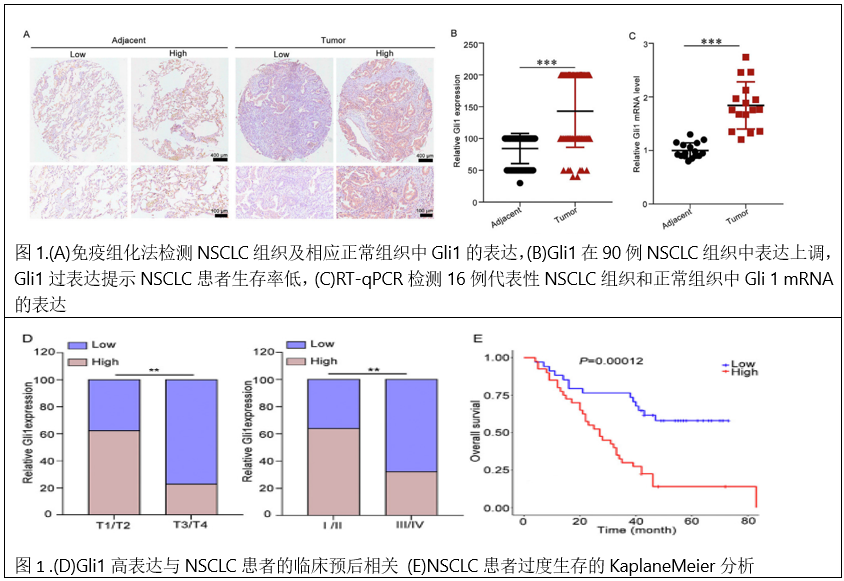
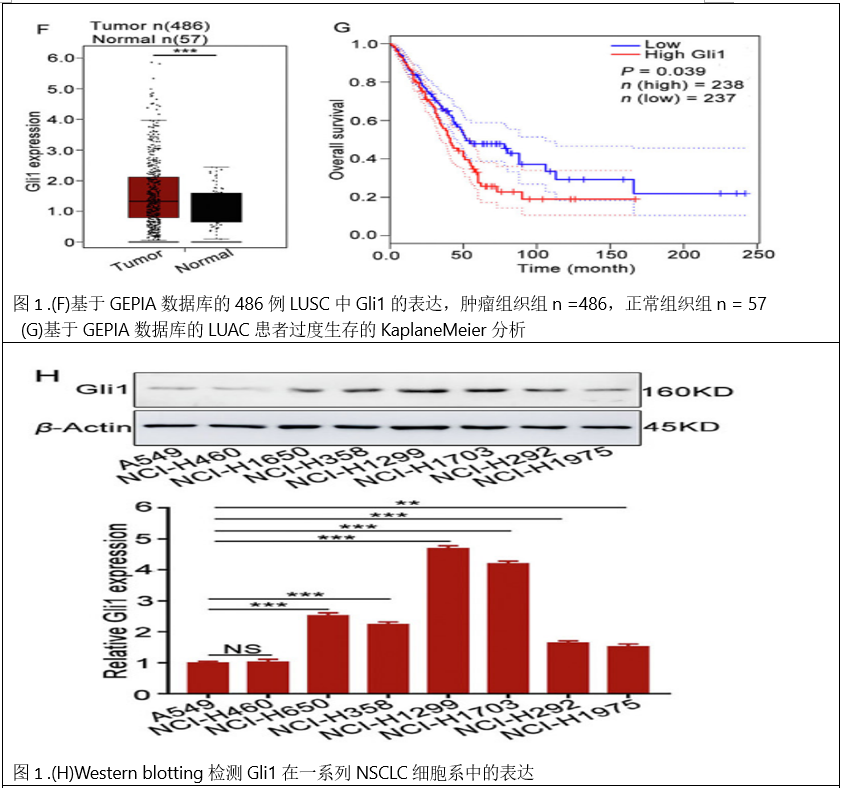
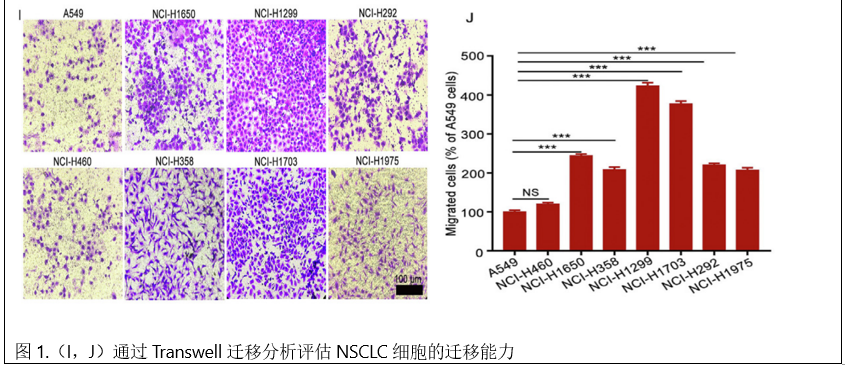
1、Gli1在NSCLC组织中的高表达与转移和低生存率相关。为了解Gli 1在NSCLC中的作用,首先采用免疫组化(IHC)方法检测了90例正常肺组织和NSCLC组织的石蜡包埋组织芯片中Gli 1的表达水平。结果显示,Gli 1在肿瘤组织中的水平明显高于配对的正常组织(图1A、B)。采用RT-qPCR方法进一步证实了Gli 1在代表性的16对NSCLC组织和正常组织中的过表达。与邻近肺组织相比,Gli 1 mRNA在肿瘤组织中显著增加(图1C)。进一步分析了Gli 1水平与NSCLC患者临床参数的关系。没有观察到基于性别或年龄的Gli 1表达的任何显著差异。Gli 1表达与NSCLC患者的T分期和TNM分期显著正相关(图1D)。KaplaneMeier分析表明高Gli 1水平患者总生存期短于低Gli 1表达的患者(图1 E)。GEPIA数据库结果显示,LUSC患者肿瘤组织中Gli 1表达上调。高Gli 1水平的LUAD患者预后较差(图1F和G)。Western blotting检测Gli 1在一系列NSCLC细胞系中的表达,Transwell迁移实验检测其迁移能力。结果表明,Gli 1的表达与NSCLC细胞的迁移能力呈正相关。Gli 1水平较高的NCI-H1299和NCI-H1703迁移能力较其他细胞的能力强(图1H-J)。综上所述,这些结果表明,高Gli1水平可能与NSCLC组织和细胞的临床结局相关。
 2、增强的Gli1表达促进迁移、侵袭和EMT
2、增强的Gli1表达促进迁移、侵袭和EMT
该研究推测Gli 1可能与NSCLC的侵袭和转移相关。人NSCLC细胞系,包括NCI-H1299、NCI-H292、NCI-H460、NCI-H1975、NCI-H1703、NCI-H358、NCI-H1650和A549,以及HEK-293 T细胞。为了证实这一假设,Gli 1在另一种低转移性NCI-H460细胞中过表达,并使用Western印迹测定和RT-qPCR测定进一步验证其转染功效。通过创伤愈合实验、Transwell迁移实验和侵袭实验研究Gli 1的生物学效应。在伤口愈合试验中,发现Gli 1过表达明显增强了A549细胞和NCI-H460细胞的迁移能力。Transwell迁移和侵袭实验也表明Gli 1过表达组A549和NCI-H460细胞的迁移和侵袭能力显著增强(图2 E和F)。为了确定Gli 1过表达是否促进了EMT过程,还采用免疫荧光法和Western blotting法检测了这些细胞的上皮和间充质标志物。免疫荧光检测显示Gli 1过表达增加了间质标志物(包括N-钙粘蛋白、波形蛋白、Snail)的水平,但减少了E-钙粘蛋白(上皮标志物)表达(图2G)。在Western印迹分析中观察到类似的结果,Gli 1过表达上调N-钙粘蛋白、波形蛋白和Snail表达,但降低E-钙粘蛋白表达(图2 H)。



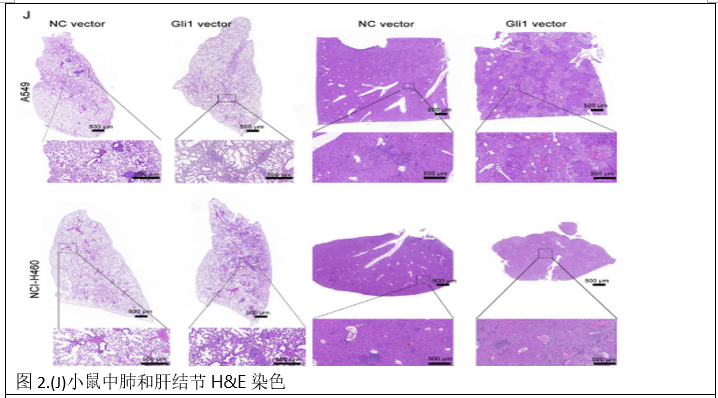
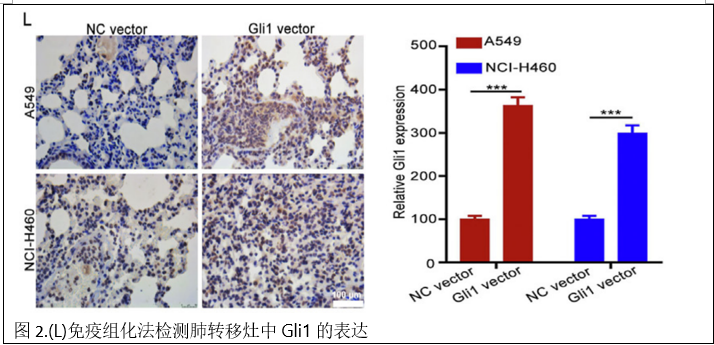
为了进一步研究Gli 1的作用,建立了尾静脉注射A549 NC载体/A549 Gli 1载体和NCI-H460 NC载体/NCIH 460 Gli 1载体细胞的转移模型。体内成像系统显示,注射A549 Gli 1载体或NCI-H460 Gli 1载体细胞的小鼠的肺和肝脏中的生物发光比注射A549 NC载体或NCI-H460 NC载体细胞的小鼠更强。还使用HE染色研究了小鼠中肺和肝结节的形成,并发现Glil过表达增加了肺和肝中的转移灶数量(图2 J和K)。免疫组化结果显示,A549 Gli 1载体组和NCI-H460 Gli 1载体组肺转移灶中Gli 1的表达明显高于A549 NC载体组和NCI-H460 NC载体组(图2L)。这些结果表明Gli 1过表达促进了NSCLC的迁移、侵袭、EMT和转移。
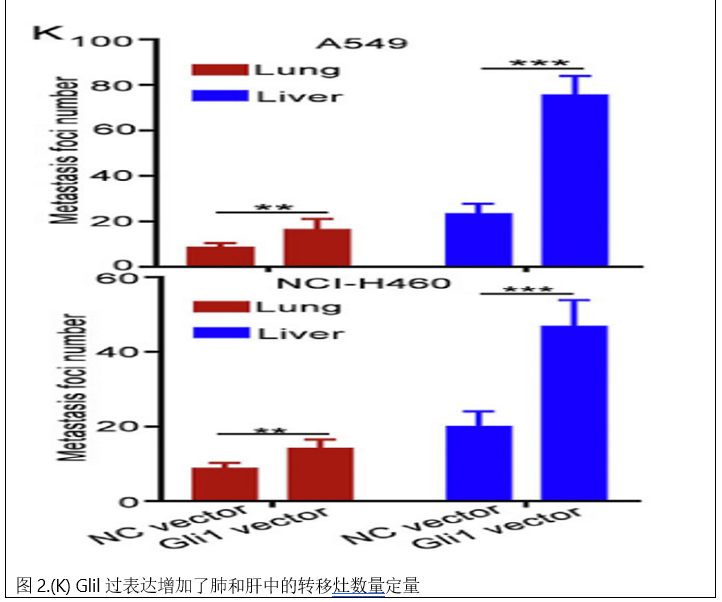
3.Gli1基因缺失抑制非小细胞肺癌的迁移、侵袭、EMT和转移
在Transwell迁移和侵袭试验中,Gli 1耗竭也明显减少了迁移和侵袭细胞(图3D和E)。在免疫荧光试验和蛋白质印迹试验中,Gli 1敲除下调了N-cadherin、Vimentin和Snail的表达,但上调了E-cadherin的表达(图3F和G),表明Gli 1敲除减弱了EMT过程。生物发光成像结果显示,Gli 1耗竭明显抑制了肺和肝结节的形成。HE染色显示,与NCI-H1299 shNC和NCI-H1703 shNC组相比,NCI-H1299 shGli 1和NCI-H1703 shGli 1组显示肺和肝结节的平均数量较低。IHC分析显示,与NCI-H1299 shNC和NCIH 1703 shNC组相比,NCI-H1299 shGli 1和NCIH 1703 shGli 1组中Gli 1表达降低(图3 K)。这些结果提示Gli 1可能是NSCLC转移的潜在驱动因子。
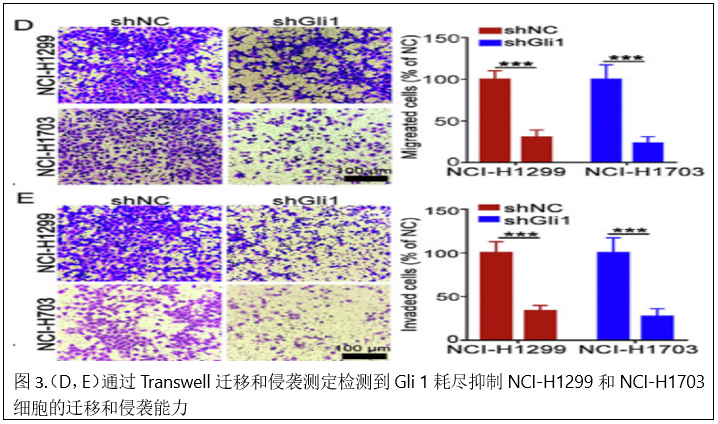
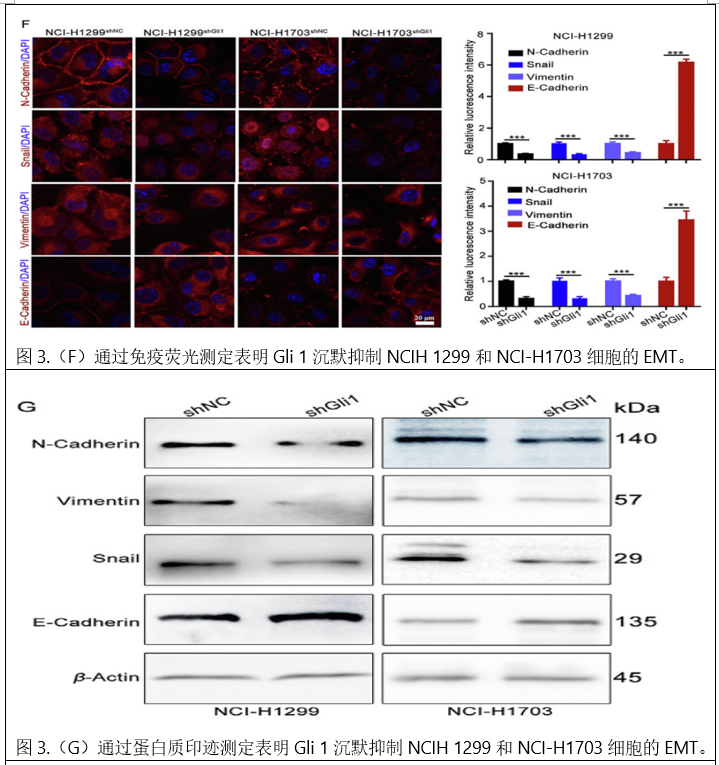

4.Snail在Gli1相关EMT和NSCLC转移中的作用
考虑到Snail是EMT标志物中上调最明显的基因之一,并且E-cadherin、Vimentin和MMP 11等一系列不同表达的基因也与Snail相关,推测Snail可能是Gli 1的关键下游效应子。为了验证这一假设,通过转染的Snail载体在NCI-H1299 shGli 1和NCIH 1703 shGli 1细胞中过表达Snail,并通过RT-qPCR和蛋白质印迹测定证实转染功效。结果表明,在本研究中Snail不影响Gli 1表达。此外,RT-qPCR检测证实,与亲代组相比,NSCLC患者肺肿瘤组织中Snail水平明显升高。相关性分析显示,NSCLC组织中Gli 1水平与Snail水平呈正相关。提示Gli 1促进了部分依赖Snail的非小细胞肺癌细胞的迁移、侵袭和EMT。
5.Gli1通过增强转录活性和蛋白质稳定性促进snail表达
采用Western blotting和RT-qPCR方法分别检测各组细胞中Snail蛋白和mRNA的表达水平。结果表明,Gli 1基因正调控Snail mRNA的表达。双荧光素酶报告基因检测表明,Gli 1过表达明显增强了Snail报告基因的活性,提示Gli 1可能影响Snail的转录。这些结果表明,Gli 1可能通过与Snail的启动子结合来调控Snail的mRNA表达。考虑到Snail是一种高度不稳定的Gli 1蛋白,Gli1也可能影响Snail的降解。结论Gli 1通过与Snail启动子直接结合,增强Snail蛋白的稳定性,促进NSCLC的EMT和转移,进而加速NSCLC的EMT和转移。
6.Gli1药理学抑制作用抑制NSCLC的迁移、侵袭和转移
Transwell迁移和侵袭测定也证实GANT-61处理以剂量依赖性方式引起迁移和侵袭细胞数量的显著减少。Western印迹和RTqPCR测定显示GANT-61处理降低N-钙粘蛋白、波形蛋白、Snail和Slug表达,增加E-钙粘蛋白和ZO 1表达。总的来说,这些数据表明靶向Gli1有可能成为NSCLC转移的治疗策略。
讨论
NSCLC是最常见的恶性肿瘤之一,转移发生率高。大多数患者在晚期诊断为转移,常导致治疗失败。目前,介导NSCLC转移的潜在机制尚未阐明。因此,迫切需要识别和研究NSCLC转移的新转移驱动因子。在本研究中,发现Gli 1是一种新的EMT和NSCLC转移驱动因子,并发现Gli 1通过抑制GSK-3b介导的Snail降解,正调控转录活性并增强Snail蛋白的稳定性。进一步的研究显示,使用GANT-61的药理学抑制Gli 1显著逆转了EMT并抑制了体内转移。本研究为研究转移性NSCLC的潜在分子机制提供了新的视角,并促进了Gli 1作为转移性NSCLC新的治疗靶点。
Hh信号通路在胚胎发生过程中是活跃的,在器官发生、干细胞维持以及成体组织的维持和修复中起着至关重要的作用。Gli 1作为Hh信号通路的关键效应子,在乳腺癌、胶质母细胞瘤、前列腺癌和宫颈癌等多种癌症中发挥多功能调节作用。越来越多的证据表明,Gli 1在NSCLC的发生发展中起着重要作用。Gli 1在肺鳞状细胞癌中过表达,阻断Gli 1可增强PI 3 K抑制剂的抗肿瘤作用。抑制Gli 1表达可抑制LUAC 细胞的增殖,减轻细胞的干化,诱导细胞凋亡。我们先前的研究也证明了抑制Gli 1可减弱NSCLC 的肿瘤生长和血管生成。提示Gli 1有望成为NSCLC的治疗靶点。近年来,Gli 1在乳腺癌和胃癌的转移中发挥重要作用。然而,Gli 1的表达是否与NSCLC的转移有关及其机制尚不清楚。在本研究中,我们发现Gli 1是NSCLC转移的启动子。NSCLC组织中Gli 1表达增加,高Gli 1表达通常提示患者生存率低。进一步的研究表明,Gli 1可能通过正调控Snail的转录活性和蛋白稳定性,促进NSCLC的EMT和转移。这些结果提供Gli1在NSCLC转移中的作用的有力证据,并表明Gli1对NSCLC转移的治疗潜力。
实验证据表明Shh/Gli 1信号通路与EMT之间存在复杂的串扰。Shh/Gli 1信号通路的激活有助于胃癌、乳腺癌和肺癌中的EMT 。EMT细胞增加了非EMT细胞的间充质特征和侵袭性,部分原因是乳腺癌中Gli 1的非细胞自主激活,Gli 1抑制剂GANT-61治疗阻断了这种效应。Gli 1还可以通过抑制人食管鳞状细胞癌中的E-cadherin表达来诱导EMT 。相反,Gli 1已被证明是上皮分化的重要正调节因子,并且RNAi介导的Gli 1敲低促进胰腺癌细胞中的EMT 。肺癌组织中Gli 1表达与E-cadherin表达呈负相关,提示Gli 1可能参与肺癌EMT过程。然而,NSCLC的潜在机制及其相关性在很大程度上仍不清楚。在本研究中,我们证明了Gli 1促进EMT过程中的NSCLC。Gli 1过表达可增强NSCLC细胞的迁移、侵袭和EMT,Gli 1基因缺失和药物抑制可减弱NSCLC细胞的迁移、侵袭能力,逆转其EMT过程。进一步的研究表明,Gli 1以蜗牛依赖的方式促进EMT。本研究为Gli 1与EMT在NSCLC中的关系提供了有力的证据。
研究表明Gli 1通过经典Hh信号通路和非经典Hh信号通路发挥作用。在经典的Hh信号通路中,Gli 1活化发生在PTCH 1并抑制SMO。在非经典Hh信号通路中,Gli 1活化不依赖于Hh配体和SMO 。Gli 1已被证明通过MAPK/ERK信号通路非规范地激活,导致肺腺癌中的肿瘤生长和干性特征。在本研究中,发现GANT-61而不是环巴胺(SMO抑制剂)阻止NCI-H1299细胞中的EMT过程。因此,推测Gli 1主要通过非经典的Hh信号通路调节Snail的表达。Gli 1的非经典激活促进了Snail的转录活性,增强了其蛋白质的稳定性。研究提供了强有力的证据表明,非典型的Gli 1激活是至关重要的EMT和转移的NSCLC。至于介导非经典Gli 1激活的潜在机制,将在未来的研究中探索。
Snail是一种锌指转录因子,是EMT的重要因子,在许多恶性肿瘤中过度表达。Snail通过直接抑制E-cadherin转录和激活一系列间充质基因的转录来诱导EMT过程,这有助于侵袭特性,导致细胞迁移能力和肿瘤转移的增强。内源性Snail升高通常表明转移潜力增加。Snail是一种极不稳定的蛋白质,其蛋白质稳定性主要受泛素蛋白酶体途径的调控。GSK-3b依赖性Snail磷酸化已被认为是调节Snail降解的关键因素。虽然有研究证实Gli 1可能参与Snail在基底细胞癌、食管鳞状细胞癌和食管腺癌中的表达。然而,Gli 1调控Snail表达的机制以及Gli 1与Snail在NSCLC中的关系仍不清楚。在此,本研究发现Snail与Gli 1介导的对NSCLC EMT和转移的增强作用有关。进一步的研究表明,Gli 1通过促进Snail的转录活性,抑制GSK-3b介导的Snail降解,从而促进肿瘤的侵袭和转移。此外,我们的研究还表明,Gli 1表达与NSCLC患者组织中的Snail水平呈正相关。本研究为揭示Gli 1和Snail在NSCLC中的关系提供了新的证据。研究也为揭示Snail基因转录和稳定性调控的潜在机制提供了线索。
GANT-61是一种Gli 1/Gli 2抑制剂,并已被证明在胶质母细胞瘤、宫颈癌、乳腺癌中抑制细胞增殖、诱导细胞自噬和凋亡。此外,GANT-61已被证实可减弱TGF-β 1介导的A549细胞的EMT和细胞迁移。然而,GANT-61是否抑制NSCLC的侵袭和转移仍然很不清楚。因此,本研究证明GANT-61抑制NCIH 1299细胞的迁移、侵袭和逆转EMT。此外,GANT-61给药明显减少了肺和肝中的转移灶。在这方面,我们的研究提供了一个线索,GANT-61可能会发展成为一个抗转移剂的非小细胞肺癌。
结论
本研究证明Gli 1是NSCLC转移的启动子。进一步的研究表明Gli1通过促进Snail转录和增强其蛋白稳定性来驱动NSCLC转移。Gli1过表达提示患者生存率低。本研究不仅表明Gli1靶向治疗对侵袭性和转移性NSCLC患者是一种有希望的治疗方法,而且扩展了我们对NSCLC转移机制的理解。

























共0条评论