[导读] 作者:陈旭
临床情况
患者女性,57岁,发现乳腺外下象限结节1年,增大伴疼痛2月余,16年前曾行右侧副乳切除术,B超检查提示乳腺外下象限距乳头6cm处探及直径3cm的结节,分级为4a级,于我院行乳腺肿物切除术。
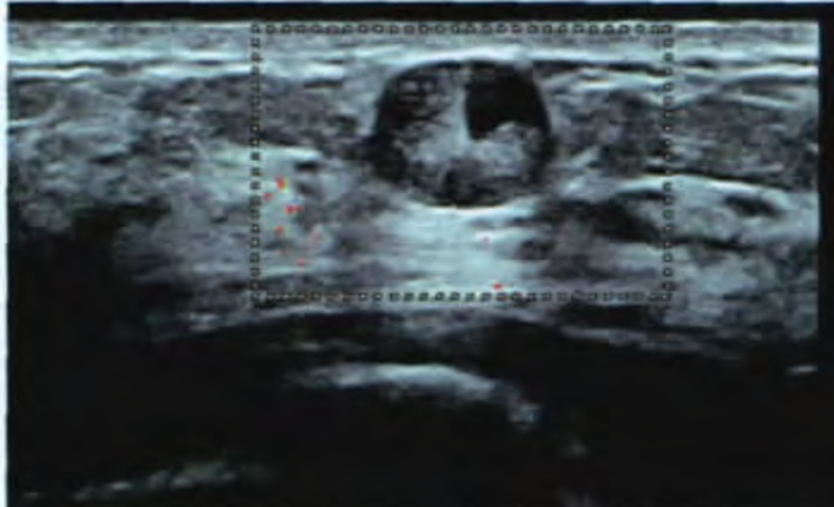 图1.超声见右乳外下方皮下3cm×1cm混合回声肿块,类圆形,边界清晰,后方回声增强,内部无明显血流信号,腺体层受挤压。
图1.超声见右乳外下方皮下3cm×1cm混合回声肿块,类圆形,边界清晰,后方回声增强,内部无明显血流信号,腺体层受挤压。
大体观察
右侧乳腺外下象限肿物:皮肤切除标本,体积:9×7.5×4.5cm,皮肤面积:7.2×3.5cm,切面距离皮下0.8cm处可见一灰褐灰黄质硬区,面积:3×2.3cm。
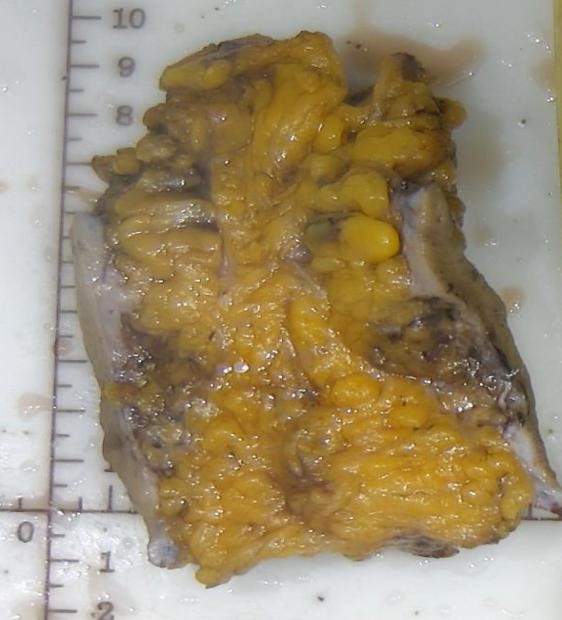
图2.大体标本所见。组织切面皮下可见灰黄灰褐色质硬区,与周围组织界限不清。
镜下所见
瘤细胞呈梭形,与周围组织界限不清,累及脂肪。瘤细胞排列呈席纹状、漩涡状及束状排列。细胞中度异型,可见小核仁,胞质嗜酸性,核分裂象平均5个/10HPF。
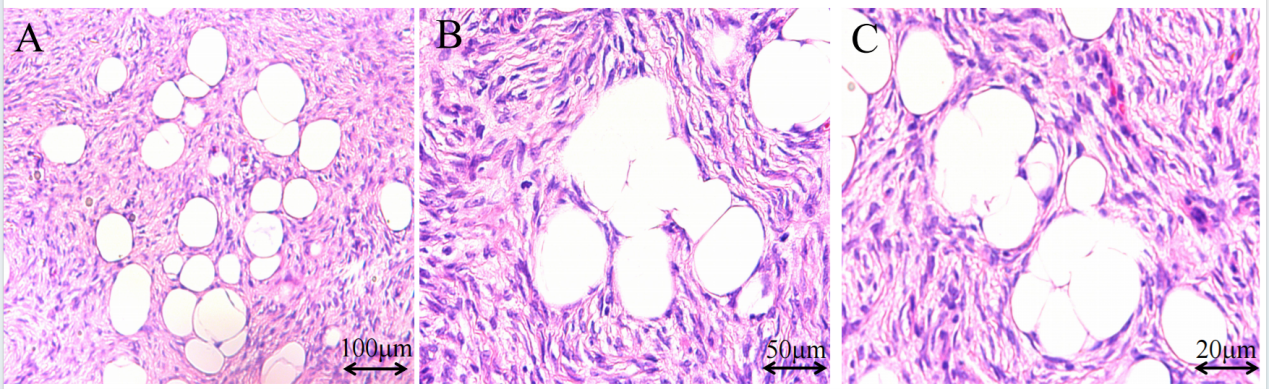
图3.组织学特点。(A)低倍镜下(10X),肿瘤细胞呈梭形,界不清,累及脂肪,呈“蜂窝状”改变。(B、C)高倍镜下,肿瘤细胞呈席纹样、流水样排列(B,20X),可见核分裂像(C,40X)。
免疫组化染色结果
(梭形细胞表达情况):CD34、Vimentin(弥漫+),CD68、SMA、STAT-6、Calponin、S-100、EMA(—),Ki-67(增殖指数约为10%-15%)。
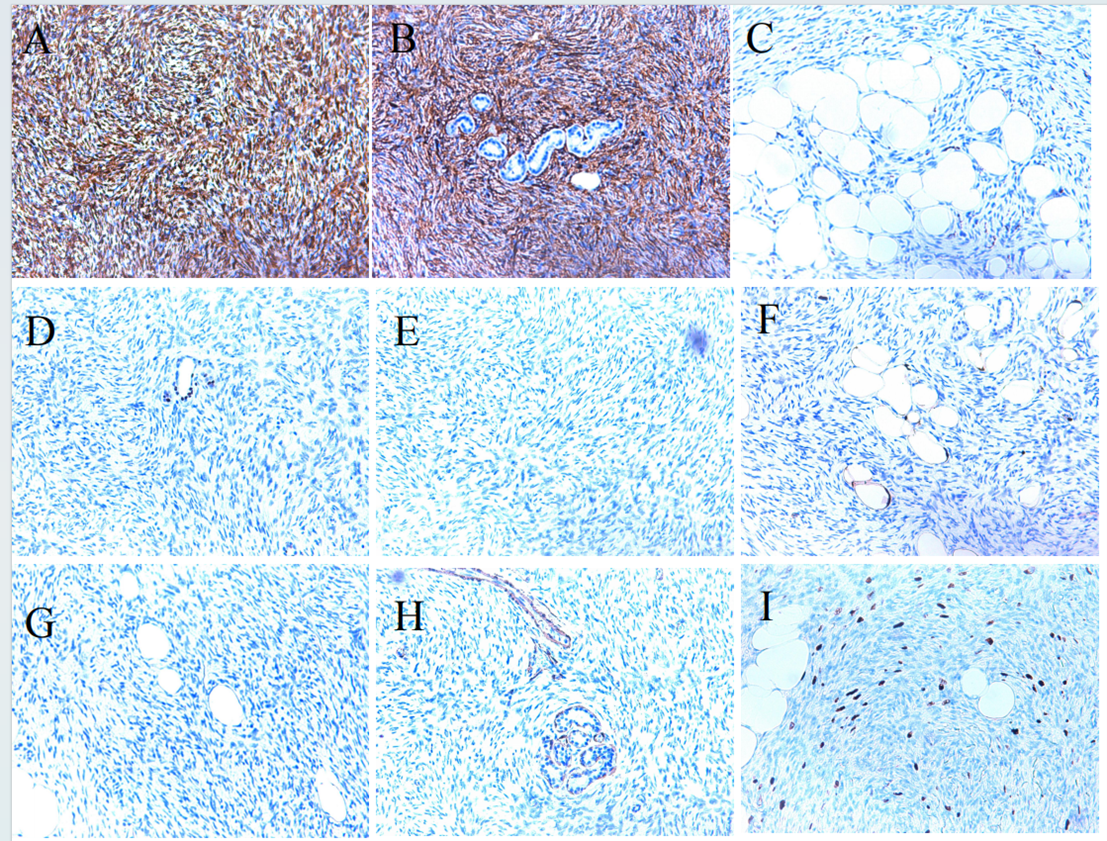
图4.免疫组化染色结果(20X)。(A)CD34;(B)Vimentin;(C)CD68;(D)SMA;(E)STAT-6;(F)S-100;(G)Calponin;(H)EMA;(I)Ki-67
分子遗传学检测结果
COL1A1/PDGFB基因融合阳性。
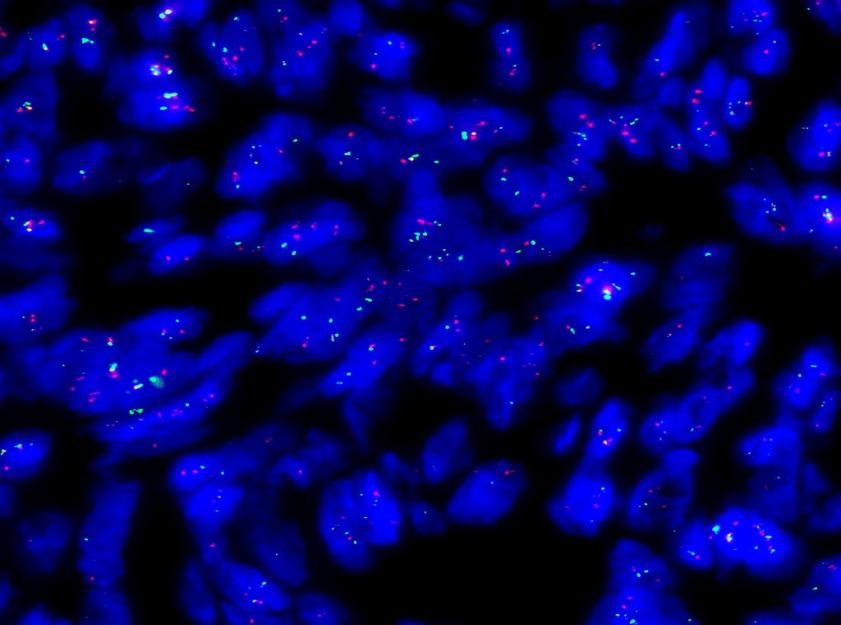
图5.FISH检测提示COL1A1/PDGFB基因融合阳性。
最终病理诊断
(右侧乳腺肿物)隆突性皮肤纤维肉瘤,经典亚型。
小结
临床特点
隆突性皮肤纤维肉瘤(DFSP于1924年由Ferrand等首次描述,Hoffman于1925年将其命名为DFSP,可发生于躯干(42%~72%)、肢体(16%~30%)及头颈部,发生于乳腺者罕见。临床表现为渐进性增大肿块,可伴表面皮肤受累,表面颗粒状,甚至皮肤破溃及溃疡,DFSP呈皮肤隆起、结节,可侵袭至筋膜、肌肉、骨,并可转移,病程1个月~10年不等。超声检查为富于血供的低回声病变,呈实性,乳腺X线检查,病灶呈结节状、高密度肿块,病变内无钙化及脂肪成分;CT检查为结节状软组织肿块,部分可呈多灶性占位。
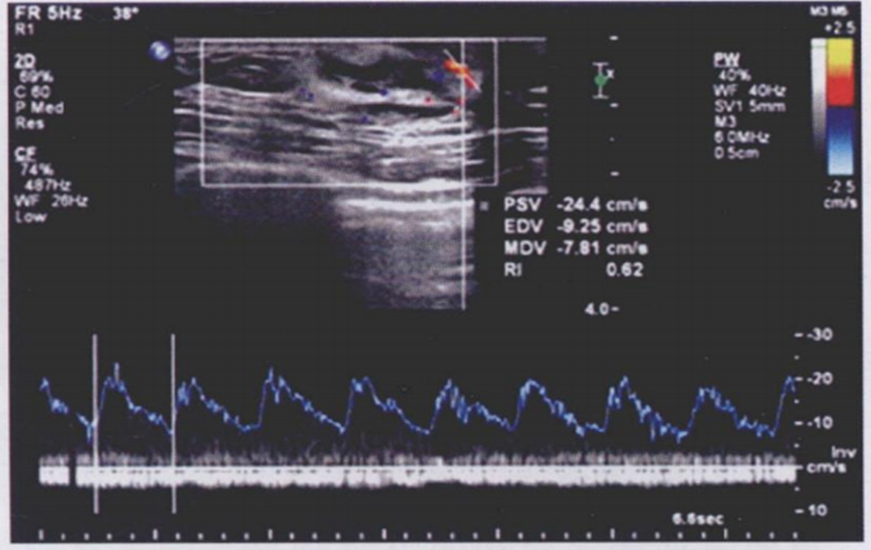 图6.右侧乳腺隆突性皮肤纤维肉瘤,呈以低回声为主的混合回声,周边见点条状血流信号,血流速度及阻力指数低。
图6.右侧乳腺隆突性皮肤纤维肉瘤,呈以低回声为主的混合回声,周边见点条状血流信号,血流速度及阻力指数低。
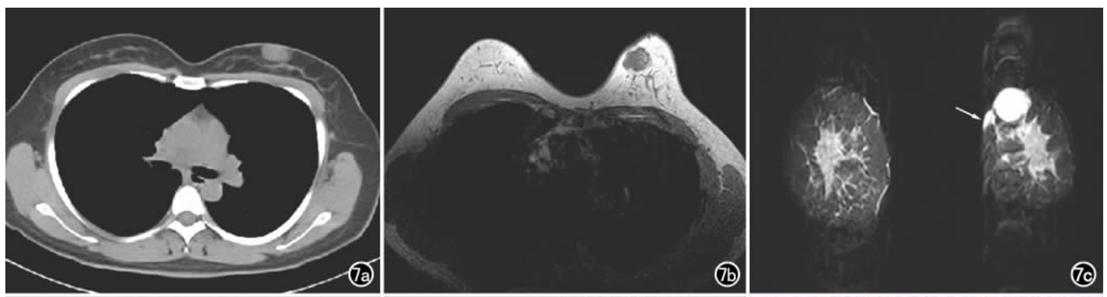 图7.乳腺DFSP影像学改变(a)胸部CT平扫示左乳皮下卵圆形稍低密度影,其内密度均匀,边界较清晰;(b)横轴面平扫T1WI示浅分叶状不均匀稍低信号肿块影;(c)冠状面T2WI抑脂序列图像示高信号肿块影,周围皮下可见卫星灶(箭头)。
图7.乳腺DFSP影像学改变(a)胸部CT平扫示左乳皮下卵圆形稍低密度影,其内密度均匀,边界较清晰;(b)横轴面平扫T1WI示浅分叶状不均匀稍低信号肿块影;(c)冠状面T2WI抑脂序列图像示高信号肿块影,周围皮下可见卫星灶(箭头)。
发病机制
DFSP发生的主要机制:(1)PI3K/AKT/mTOR及RAS/RAF/MAPK信号通路激活,导致细胞增殖、肿瘤形成。(2)PDGFRβ-AKT-mTOR信号通路激活,常见于乳腺外DFSP的发生发展。(3)CDKN2A/CDK4/RB1/TP53信号通路,与肿瘤侵袭性生长和基因组缺失有关,且更常见于乳腺DFSP。
病理学特点
肿瘤大体无包膜,界不清,切面灰白色、如有出血呈灰红色,实性、结节状或分叶状,质韧或质中。镜检表现为梭形细胞肿瘤,瘤细胞呈席纹状、漩涡状及束状排列,席纹状结构的中央可见血管; 细胞密度高,轻~中度异型,一般无瘤巨细胞及多核巨细胞,核分裂象多少不等,如纤维肉瘤样转化时核分裂象增加; 一般无凝固性坏死; 肿瘤呈浸润性生长,沿脂肪小叶及间隔生长,侵犯脂肪。
分型
经典型、色素型、黏液型(肿瘤含有大量黏液基质并伴增生血管)、肌样分化型、斑块型(表现为平坦的斑块样表现)。
免疫组化特点
DFSP瘤细胞特征性高表达CD34、GRIA2,CD34敏感性及特异性分别为94%及83%,GRIA2阳性率为75%。
分子遗传学特征
DFSP经典遗传学为t(17;22)(q22;q13) 、t(2;17)(q33;q25) 、t(9;22)(q32;q12.2) 、t(5;8)(q13-14;p21)和t(X;7)(q21.2;q11.2) ,其中90%以上的DFSP为t(17;22)(q22;q13)易位形成COL1A1-PDGFB融合基因。
鉴别诊断
①皮肤鳞状细胞癌的特殊类型梭形细胞癌、乳腺化生性癌
瘤细胞呈梭形,细胞异型不等,可有瘤巨细胞,核分裂象不等,束状、漩涡状及交错状排列,仔细查找乳腺原位癌、浸润性癌、皮肤鳞状细胞癌等是诊断线索; 免疫组化标记上皮标志物可明确诊断(GATA3、CKpan、CKH、CK5/6、CK14、p63及p40)。
②乳腺叶状肿瘤,包括良性、交界性及恶性
良性及交界性病变与DFSP较好鉴别,肿瘤内见有特征性受挤压裂隙状腺体及分叶状结构是诊断线索,评估肿瘤细胞异型性、边界、生长方式及计数核分裂象等是诊断关键; 广泛取材查找良性、交界性区域是诊断线索。瘤细胞一般不表达上皮标志物,CD34斑驳阳性。
③良性纤维组织细胞瘤
多数发生于皮肤,较少累及乳腺; 病理学上瘤细胞梭形、短梭形及胖梭形,胞质丰富,呈束状、漩涡状排列,核分裂象罕见,可见破骨样多核巨细胞及“杜顿”巨细胞等,伴炎症细胞浸润,常有出血、含铁血黄素沉积等,免疫组化标记瘤细胞CD68、CD163、Cathepsin-k、D2-40及Stromelysin-3阳性可资鉴别。
④乳腺型肌纤维母细胞瘤
瘤细胞呈束状、交织状等排列,瘤细胞呈梭形、上皮样等,核分裂象少见,可累及脂肪组织,间质可玻璃样变性及黏液变性; 免疫组化瘤细胞呈CD34、actin、desmin、CD10、Calponin、ER、PR、AR和BCL-2 阳性,遗传学显示70%~80%有RB1(13q14)基因缺失。
治疗及预后
目前治疗方法有手术(广泛手术切除、Mohs法手术)、放疗及靶向治疗等。DFSP一般参照纤维肉瘤的处理方法,放疗后5、10年有效率分别为98%和95% ,靶向治疗主要是PDGFB抑制剂伊马替尼;总有效率为 50%,DFSP对伊马替尼有效率为36%~57% ,耐药者推荐索拉菲尼、培唑帕尼,有效率为40%。DFSP推荐每半年复查1次,连续复查3年以上,患者预后良好。
参考文献
[1]黄海建,谢飞来,李柏成,等.乳腺隆突性皮肤纤维肉瘤21例临床病理及分子学特征[J].临床与实验病理学杂志,2023,39(07):788-792.
[2]Aripoli A, Lee M. Dermatofibrosarcoma protuberans of the breast[J]. Journal of Breast
Imaging, 2020, 2(4): 410-411.
[3]Marcoval J, Moreno-Vílchez C, Torrecilla-Vall-Llosera C, et al. Dermatofibrosarcoma Protuberans: A Study of 148 Patients[J]. Dermatology, 2024, 240(3): 487-493.
[4]冯海霞,顾龙,冯卫华,等.隆突性皮肤纤维肉瘤的影像表现及其病理基础[J].中国临床医学影像杂志,2019,30(09):660-664.
[5]林钱森,黄永础,许淑惠.隆突性皮肤纤维肉瘤的CT及MRI表现[J].医疗装备,2019,32(02):27-28.




















共0条评论