[导读] 编译整理:强子
EWSR1/FUS::NFATC2融合转录的肉瘤
分子生物学
对于EWSR1/FUS::非ETS家族基因融合的圆细胞肉瘤来说,EWSR1/FUS::NFATC2融合肉瘤可能是最常见、且相关表型了解最为详尽的类型。根据定义,该肿瘤最常见的是存在EWSR1(22q12.2)和NFATC2(20q13.2)的融合,一般是由于不平衡易位及共扩增所致。少数病例中是存在非扩增性的FUS::NFATC2融合。基因表达特点及甲基化特点研究已发现,伴EWSR1/FUS::NFATC2融合的未分化圆细胞肉瘤的确不同于Ewing肉瘤、EWSR1::PATZ1融合肉瘤、CIC重排肉瘤、BCOR改变的肉瘤、肌上皮肿瘤。
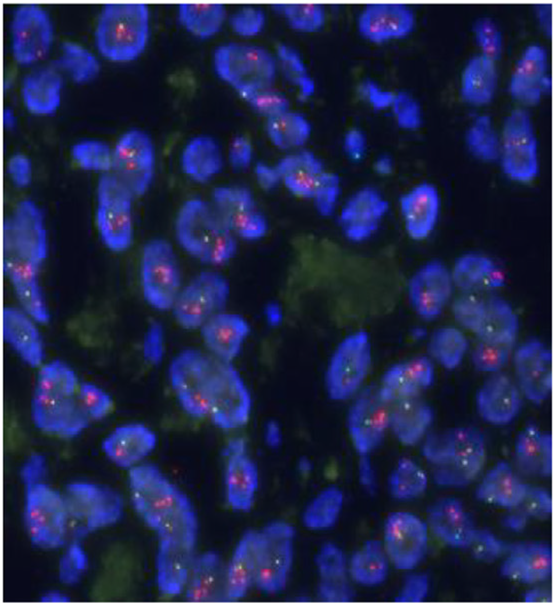
图7.一例EWSR1::NFATC2融合的肉瘤,EWSR1断裂探针FISH检测可见EWSR1重排及扩增。
NFATC2是转录因子家族成员之一,与T细胞分化和细胞因子活化有关。实体型恶性肿瘤及造血系统恶性肿瘤的发生机制中,均已发现有NFATC2的遗传学变异。目前认为,NFATC2的异常与肿瘤发生中多种生物学机制相关,如诱导肿瘤浸润、肿瘤抑制基因受抑制、肿瘤诱导T细胞无反应的出现等。
配体为EWSR1或FUS的NFATC2重排肉瘤在2019年世界卫生组织分类中是归为同一条目下的。不过,需要注意的是,聚类分析中这两组病变的转录是不同的。此外,最近有一项针对4例NFATC2重排肉瘤的比较基因组杂交分析表明,FUS::NFATC2融合的病例相比EWSR1::NFATC2融合的肉瘤来说,前者常有肿瘤抑制基因(如CDKN2A/B、TUSC7、DMD)的缺失、核型更为复杂。这些结果可能与肿瘤生物学相关,比如所有FUS::NFATC2融合肉瘤都被认为临床有侵袭性。
总之,上述研究提出了一个问题,那就是这些肉瘤应该统一的归为一类、还是应分为单独的病种?不过,相关病例报道的仍太少、以至于无法得出明确结论,尤其FUS::NFATC2融合的病例数过少。
多种分子生物学方法可用于确定EWSR1/FUS::NFATC2融合,如NGS、FISH、RT-PCR。形态学为未分化圆细胞肉瘤的情况下,FISH检测EWSR1重排且同时有扩增,高度提示EWSR1::NFATC2融合肉瘤。不过,一定要牢记的是,这一融合并不完全特异,因为EWSR1/FUS::NFATC2融合已报道于单纯性骨囊肿、骨骼的血管性肿瘤,但并无EWSR1的扩增。
鉴别诊断
EWSR1/FUS::NFATC2融合的未分化肉瘤鉴别诊断需考虑:未分化圆细胞肉瘤(如Ewing肉瘤、伴EWSR1::PATZ1融合的肉瘤、BCOR改变的肉瘤、CIC重排的肉瘤)、骨外黏液样软骨肉瘤、间叶性软骨肉瘤、肌上皮肿瘤、转移癌、血液系统肿瘤。
Ewing肉瘤与该组肿瘤的形态学及免疫组化均存在共同点,如小圆细胞形态,免疫组化表达CD99、NKX2.2、PAX7。不过Ewing肉瘤的结构不同,并无黏附性、条索状或巢状结构。Ewing肉瘤中玻璃样变黏液样或广泛纤维化/硬化的间质也少见。不过,EWSR1/FUS::NFATC2融合肉瘤间质极少的情况下,可能会因为类似Ewing肉瘤而诊断困难,此时免疫组化NKX3.1阳性则倾向于前者。另一个极有帮助的特点是FISH检测EWSR1扩增,结合一定的形态学背景下对EWSR1/FUS::NFATC2融合肉瘤非常特异。
EWSR1::PATZ1融合的肉瘤也会表现为小圆形、卵圆形或梭形细胞,且常伴有纤维性间质并伴细胞膜周围显著胶原积聚。该肿瘤几乎所有病例都共表达神经源性标记和肌源性标记,而NKX2.2和NKX3.1阴性。目前为止,这一类型肉瘤中尚未有EWSR1扩增的报道。后续会对这一瘤种详细介绍。
BCOR改变的肉瘤可能在临床上会与EWSR1/FUS::NFATC2融合肉瘤有相似之处,比如男性多见、发生于骨、患者年龄轻,且组织学和免疫组化也会有相似的地方。免疫组化BCOR对该肿瘤敏感,但并不特异;BCOR::CCNB3融合肉瘤中,大部分病例弥漫表达cyclin B3,不过这一标记在其他类型的BCOR改变肿瘤并不表达。此外,BCOR也可表达于部分EWSR1/FUS::NFATC2融合肉瘤,影响了其鉴别诊断中的作用;但FISH检测EWSR1可用于考虑或排除后者。
CIC重排肉瘤一般细胞形态分级较高,伴显著核仁,核分裂活性高,局灶有黏液样间质成分,免疫组化CD99结果不一,且表达ETV4。罕见情况下会表达NKX3.1、NKX2.2、AGGREGAN;不过,无EWSR1或FUS重排对于排除EWSR1/FUS::NFATC2融合肉瘤的意义最大。疑难病例中,FISH或靶向NGS可用于CIC融合的检测并做出诊断,当然这些方法在这一肿瘤中都存在敏感性的局限性。
骨外黏液样软骨肉瘤也可能会出现与EWSR1/FUS::NFATC2融合肉瘤相似的组织学特征,如肿瘤细胞在软骨黏液样间质中呈条索样或巢状生长。不过,该肿瘤一般并不表达CD99、NKX2.2、NKX3.1、AGGREGAN。此外,与EWSR1/FUS::NFATC2融合肉瘤不同,骨外黏液样软骨肉瘤一般表达神经内分泌标记;一般有NR4A3的重排。
间叶性软骨肉瘤中原始的圆细胞成分可能会表达NKX3.1及AGGRECAN,因此无明显软骨成分的小活检标本中,这两项标记可能并无鉴别意义。相反,EWSR1/FUS::NFATC2融合肉瘤一般阳性表达PAX7,但这一标记在间叶性软骨肉瘤一般为阴性。疑难病例中,检测特征性的HEY::NCOA2融合有助于诊断。
EWSR1/FUS::NFATC2融合肉瘤可能会逗点状表达某些标记,如AE1/AE3、CD138,此时要注意鉴别转移癌、肌上皮肿瘤、骨髓瘤/浆细胞瘤。常用于前列腺来源转移癌诊断的标记物NKX3.1在很多EWSR1/FUS::NFATC2融合肉瘤也会阳性;不过,CK和EMA在后者并不是前列腺癌中所见的弥漫阳性。
EWSR1/FUS::NFATC2融合肉瘤伴条索状或巢状生长、透明细胞或上皮样细胞、纤维性或玻璃样变间质、免疫组化表达CK/EMA的情况下,与肌上皮肿瘤的鉴别可能非常困难。更为麻烦的是,约50%的肌上皮肿瘤会有EWSR1重排、少数会有FUS重排,极为罕见的情况下还会有EWSR1扩增及AGGRECAN的弥漫表达。按照本文原作者所述,NKX3.1很有帮助,因为这一标记还未有在肌上皮肿瘤表达的报道。确定EWSR1或FUS融合的配体,可以明确做出鉴别。
预后及治疗
EWSR1/FUS::NFATC2融合肉瘤临床上可出现局部复发和/或转移,文献中曾报道转移至肺部、骨、皮肤。大部分患者可通过手术切除而达到疾病控制的目的,新辅助治疗的组织学疗效很差。
不同研究中的总体预后稍有差异。总体而言,EWSR1/FUS::NFATC2融合肉瘤约42%会出现局部复发或转移,与骨骼的Ewing肉瘤相似。关于FUS::NFATC2融合肉瘤的预后数据极少,但有研究提出其侵袭性更为显著。
有趣的是,有研究发现EWSR1::NFATC2融合肉瘤中的转录更多见为与炎症反应及免疫反应相关的基因,而FUS::NFATC2融合肉瘤中的转录则更多见为增生及耐药相关的基因。这些也解释了前述EWSR1::NFATC2融合肉瘤免疫治疗的可能性,且可以解释FUS::NFATC2融合肉瘤中核分裂活性高。
此外,还有研究对EWSR1::NFATC2融合肉瘤进行了多参数研究,发现,mTOR通路可能是治疗靶点。更为特异的是,该研究还发现TOP1、TP53、NF1、mTOR变异有助于明确EWSR1::NFATC2融合阳性标本。Ewing肉瘤中常有改变、且与预后不良相关的基因STAG2在所有EWSR1::NFATC2融合病例中都是没有改变的。这些数据都强化了此前EWSR1::NFATC2融合肉瘤性质独特的观点,且说明该肿瘤中有mTOR通路的活化。这一肿瘤中mTOR抑制剂是否可以作为潜在治疗靶点,还需要前瞻性临床研究来证实。
总之,EWSR1/FUS::NFATC2融合阳性的未分化圆细胞肉瘤少见,具有特殊形态学表现,且生物学行为方面可能具有侵袭性。由于这一瘤种对于Ewing肉瘤的化疗方案效果差,需要新型治疗方案,因此一定要将其区分出来。
——未完待续——
往期回顾:
系列文献学习-软组织病理新病种-EWSR1与非ETS基因融合的肉瘤(一)














共0条评论