[导读] 编译整理:强子
从组织学、到临床、甚至分子特征来说,软组织病理都是一组极为复杂的病变。并且随着研究的深入,新病种可以用层出不穷来形容。《Surg Pathol Clin》杂志曾组织刊发了一组软组织病理新病种的综述,具体涉及脂肪分化、成纤维分化、肌源性分化及组织学未分化的诸多病种。该组文献不仅可以为病理医师的日常工作提供指导意义,也可以作为未来研究的基础。为帮助大家更好的了解相关病种及知识点,我们将该组文献分次编译介绍给大家。本期介绍的是西班牙病理专家Machado等人撰写的EWSR1与非ETS基因融合(EWSR1::NFATC2、EWSR1::PATZ1)的肉瘤相关内容。
简介
肉瘤中检测早已明确的致癌基因融合具有重要临床意义,因为其具体临床行为和肿瘤生物学都会受到融合驱动的显著影响。不过,随诊相关驱动基因融合检出的增多,其特异性也不可避免的降低了:EWSR1就是一个间叶性肿瘤生物学行为中基因意义混乱的典型例子,目前这一基因相关的融合已在诸多、且仍在不断扩展的、形态学及临床特征均有所不同的良性及恶性肿瘤中检出。Ewing肉瘤是未分化小圆细胞肉瘤中的典型病种,该肿瘤具有EWSR1、罕见情况下为FUS与ETS基因家族任一成员(FLI1、ERG、ETV4、FEV)的融合:最为常见(约85%)的融合是EWSR1::FLI1,第二常见(约10%)的融合为EWSR1::ERG。
随着二代测序技术的发展,未分化小圆细胞肉瘤中已检出了新的分子异常:其中有些病种的特征已较为明确,如CIC重排肉瘤及BCOR改变的肉瘤;而伴EWSR1/FUS::非ETS基因家族成员融合者则明显少见的多。后面这种情况包括了伴EWSR1/FUS::NFATC2融合、及伴EWSR1::PATZ1融合的肉瘤:根据DNA甲基化分类,它们在表观遗传学方面都不同于典型的Ewing肉瘤。毫不奇怪,这些融合也曾见于其他无关肿瘤,也体现了这些遗传学事件特异性的逐渐降低。比如,EWSR1/FUS::NFATC2融合已见于骨的血管瘤及单纯性骨囊肿,而部分肾细胞肿瘤(肾脏甲状腺样滤泡癌【thyroid-like follicular carcinoma of the kidney】)及原发的中枢神经系统肿瘤都可能会有EWSR1::PATZ1融合。本文主要介绍的就是EWSR1与非ETS基因融合(EWSR1::NFATC2、EWSR1::PATZ1)的肉瘤。
EWSR1/FUS::NFATC2融合转录的肉瘤
背景
EWSR1::NFATC2融合的肉瘤最初报道于2009年,此后文献中也仅不足百例报道。该肿瘤在形态学、遗传学/转录特点等方面都不同于Ewing肉瘤,且对新辅助化疗效果很差。目前对1024例EWSR1重排肉瘤进行的最大规模多角度研究中,有14例伴EWSR1::NFATC2融合。甲基化、转录本、拷贝数分析等其他研究也发现伴EWSR1/FUS::NFATC2融合的未分化圆细胞肉瘤的确是不同于经典型Ewing肉瘤的独特病种。
临床及影像学所见
EWSR1::NFATC2融合的肉瘤是罕见肿瘤,主要发生于骨组织,但也有发生于软组织的个案报道。临床最常见部位是长骨的干骺端或骨干,而发生于软组织时则可累及四肢、腹膜后、胸壁、头颈部。男性患者显著多于女性,主要为年轻人至中年人,具有显著的局部复发和远处转移风险。该肿瘤对于Ewing肉瘤的化疗方案疗效差。
影像学上,发生于骨的肿瘤偶见境界清楚,但一般有显著的骨皮质外成分,并伴骨皮质蝶形凹陷(saucerization,一般是由于周围软组织的侵袭性病变逐渐累及骨皮质、引起骨重塑所致,表现为骨皮质的局部凹陷;国内一般习惯将这类毗邻软组织病变所致的骨皮质改变称为扇贝状凹陷)、或骨皮质扶壁型凹陷(buttressing,是指在骨的外侧缘可见楔形实性骨膜反应,骨膜反应下面的骨皮质无破坏、而超过骨膜反应范围的骨皮质则破坏消失)。软组织肿瘤有时也可境界清楚、生长缓慢,且有长期的病史。
大体及组织学特征
大体上,EWSR1::NFATC2融合的肉瘤大小范围宽泛,黄褐色,切面质实或肉质样。一般境界不清,且局灶有破坏、并侵入相邻软组织,但偶有境界清楚、或局限于髓腔内的情况。
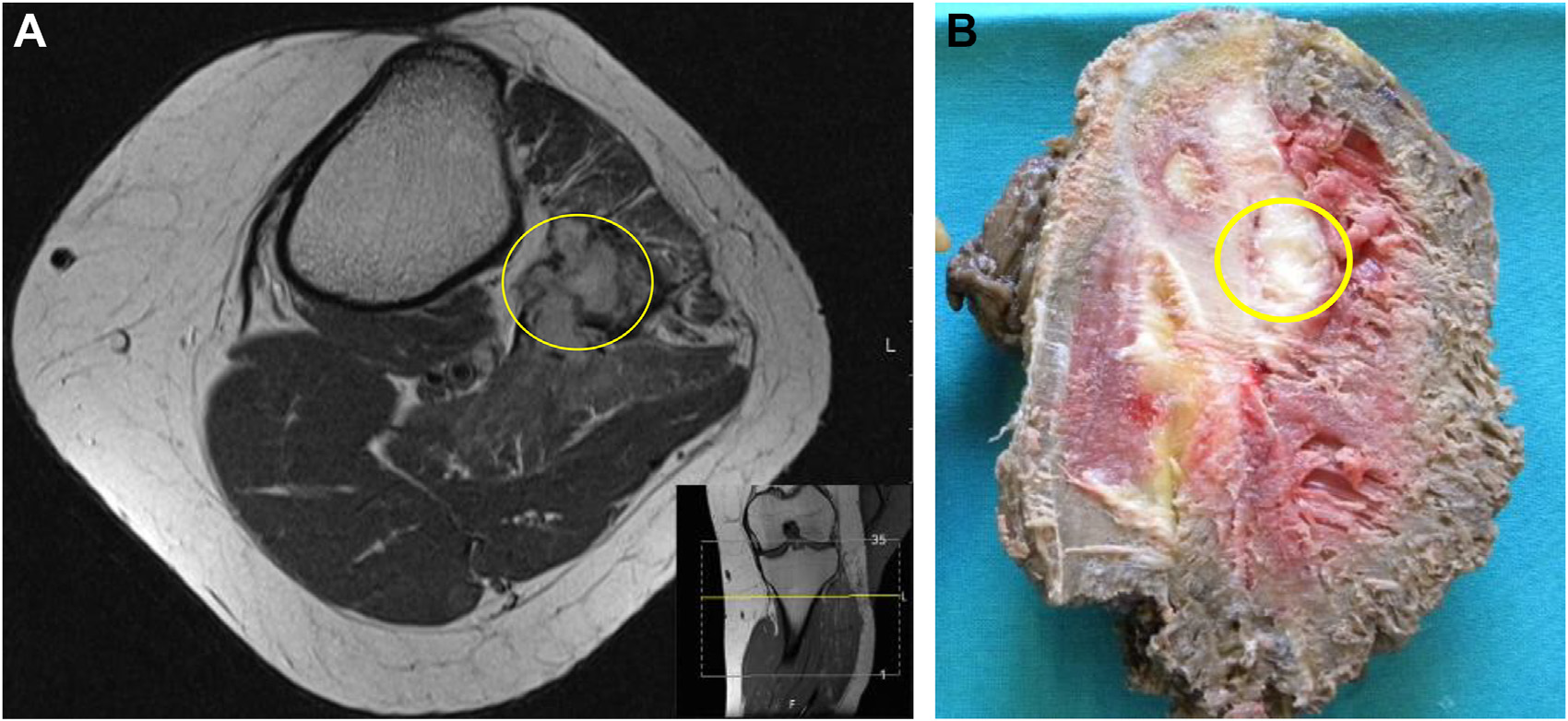 图1.EWSR1::NFATC2融合的肉瘤,MRI及大体中,可见肿瘤部分局限于腓骨的髓腔内,并扩展至周围软组织(黄圈所示)。
图1.EWSR1::NFATC2融合的肉瘤,MRI及大体中,可见肿瘤部分局限于腓骨的髓腔内,并扩展至周围软组织(黄圈所示)。
组织学上,EWSR1::NFATC2融合的肉瘤呈分叶状及片状生长,周围有浸润性。瘤细胞一般为形态单一的圆形至卵圆形、或上皮样细胞,细胞核多形性不一,胞质嗜酸性或透明。核分裂可非常显著,有时可见地图样坏死。结构呈相互沟通的条索状、簇状、筛状/假腺泡状,背景为程度不等的玻璃样变黏液、硬化性/纤维性/胶原性,或软骨黏液样表现的基质,常类似肌上皮肿瘤。罕见情况下,该肿瘤可呈中等程度的细胞核多形性、梭形细胞生长模式,甚至会有肿瘤性骨形成、和/或软骨分化。
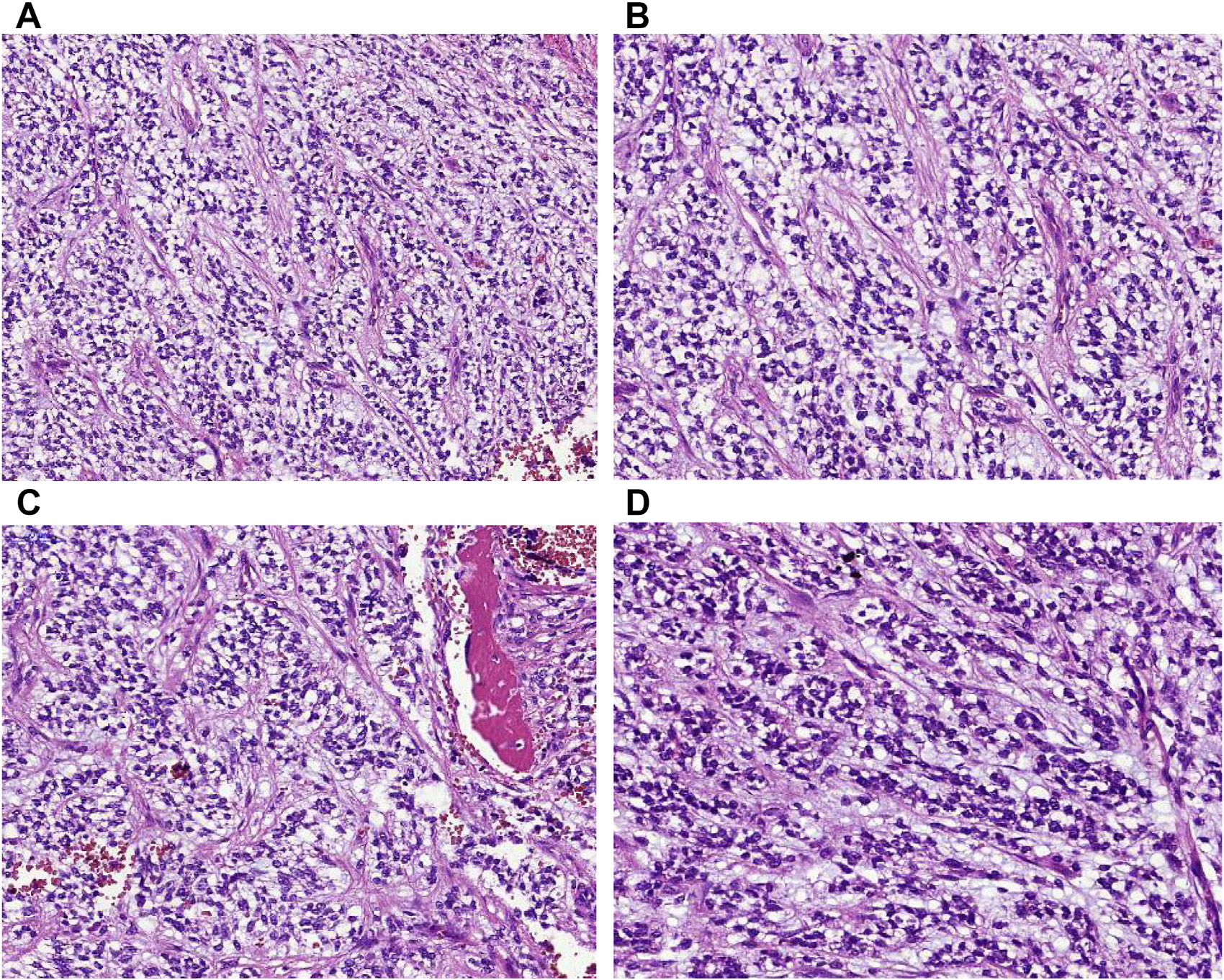 图2.(A-C)EWSR1::NFATC2融合肉瘤,结构上呈分叶状及片状,瘤细胞圆形/卵圆形至上皮样,胞质透明。(D)EWSR1::NFATC2融合肉瘤中的条索样结构及软骨黏液样间质。
图2.(A-C)EWSR1::NFATC2融合肉瘤,结构上呈分叶状及片状,瘤细胞圆形/卵圆形至上皮样,胞质透明。(D)EWSR1::NFATC2融合肉瘤中的条索样结构及软骨黏液样间质。
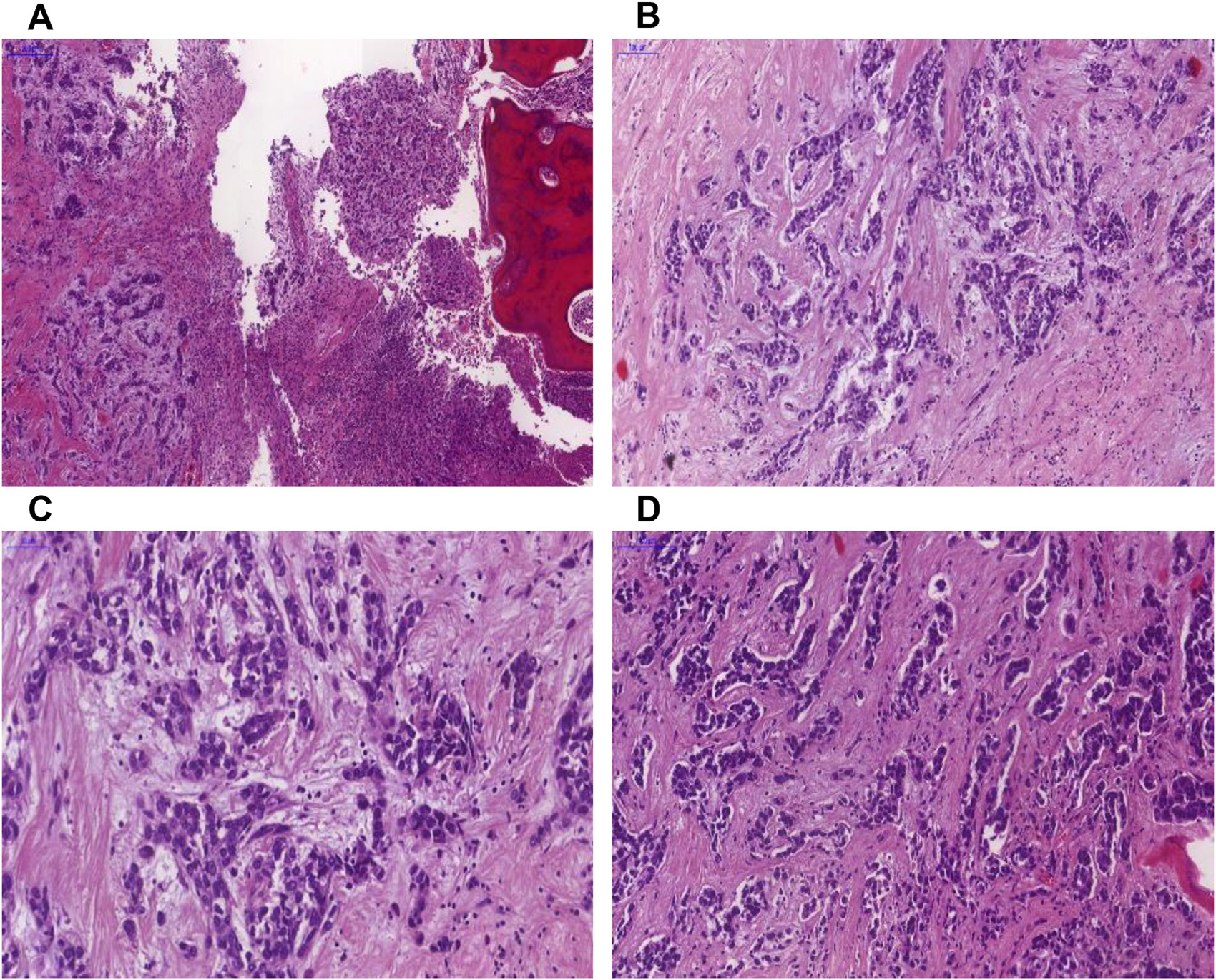 图3.EWSR1::NFATC2融合肉瘤,排列呈相互沟通的条索状、簇状,背景为大量玻璃样变的黏液样间质。
图3.EWSR1::NFATC2融合肉瘤,排列呈相互沟通的条索状、簇状,背景为大量玻璃样变的黏液样间质。
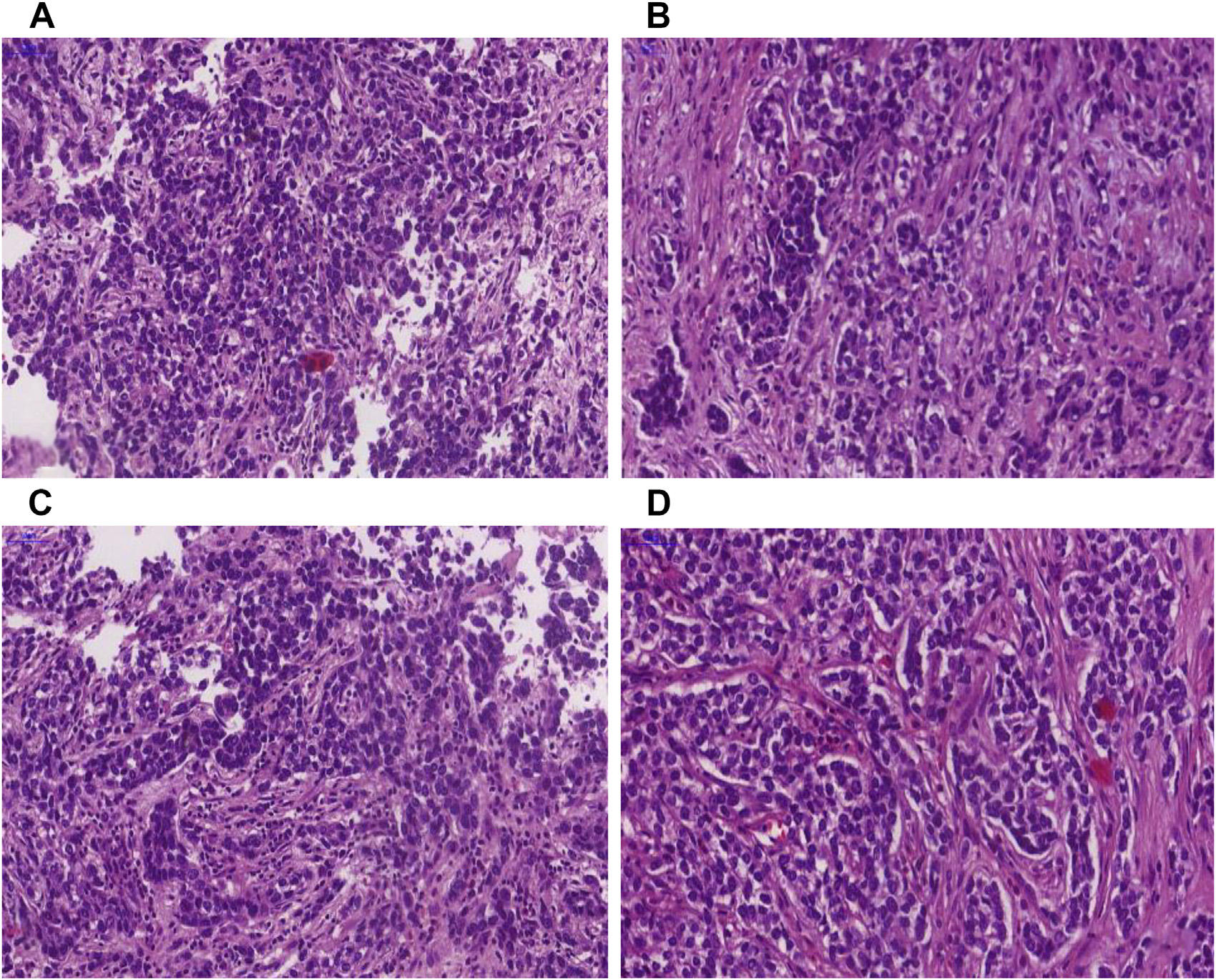 图4.EWSR1::NFATC2融合肉瘤,排列呈簇状及假腺泡状结构,间质为玻璃样变、纤维性表现。
图4.EWSR1::NFATC2融合肉瘤,排列呈簇状及假腺泡状结构,间质为玻璃样变、纤维性表现。
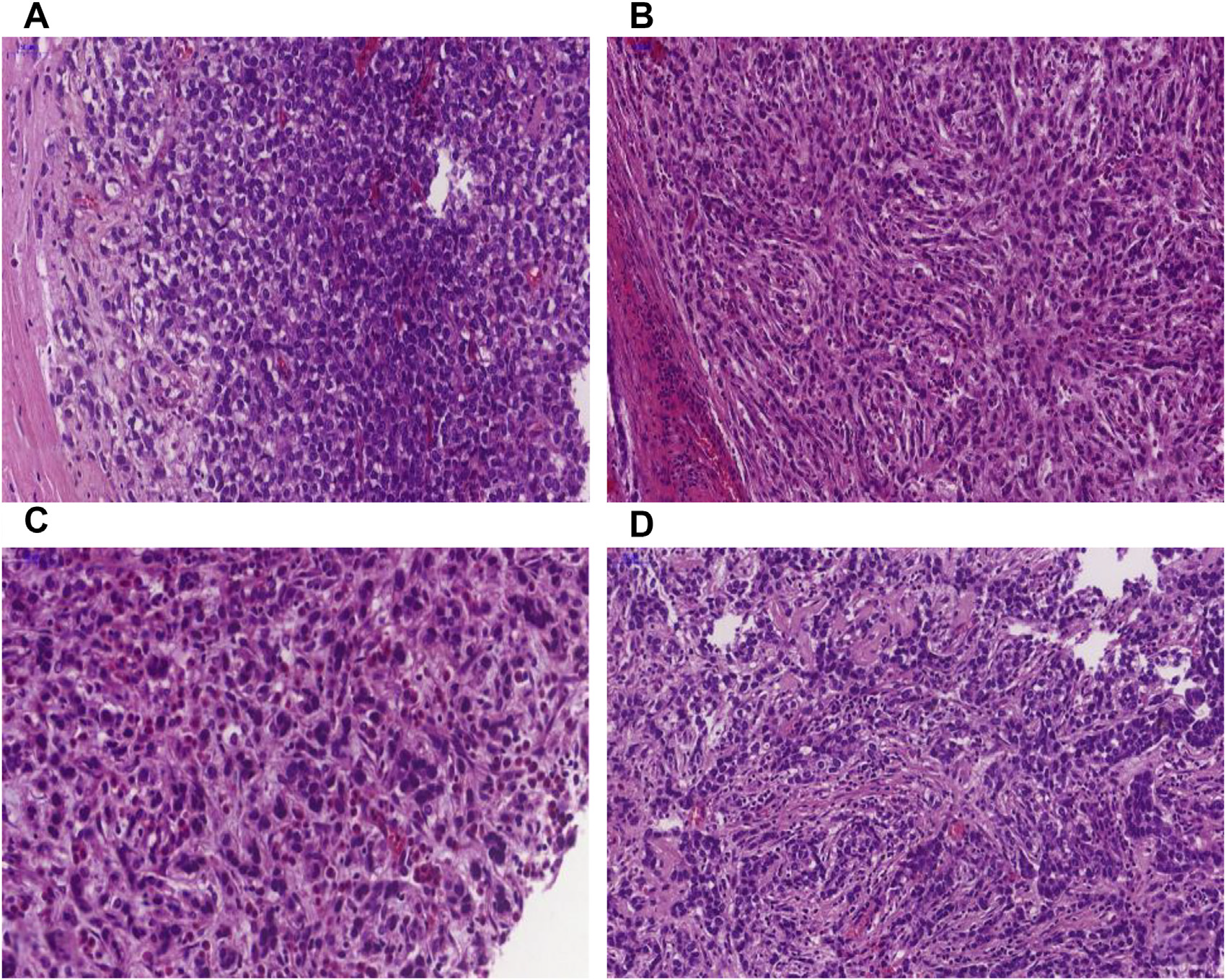
图5.EWSR1::NFATC2融合肉瘤:(A)少许间质组织,肿瘤细胞呈弥漫分布的实性片状;非常类似Ewing肉瘤;(B)少许间质组织,肿瘤细胞为卵圆形/梭形表现,排列呈弥漫的实性片状,非常类似BCOR改变的肉瘤;(C)多形性细胞;(D)假腺泡样结构及条索状排列,类似转移癌。
免疫组化特征
免疫组化方面,该肿瘤几乎总是会表达CD99,约半数病例中表现为弥漫性的细胞膜、胞质、核旁逗点状着色。NKX2.2和PAX7也是阳性,ETV4表达不一。AE1/AE3(逗点状)、EMA、CD138局灶阳性的情况也有过报道。RNA表达谱发现NKX3.1过表达的结果不一,但后续RNA原位杂交及免疫组化证实的确有过表达;因此,NKX3.1免疫组化可能可以用于诊断,因为这一标记可见于约80%的EWSR1::NFATC2融合肉瘤,而很多其他的圆细胞肉瘤中都是阴性,具体如Ewing肉瘤、CIC重排的肉瘤、BCOR改变的肉瘤。
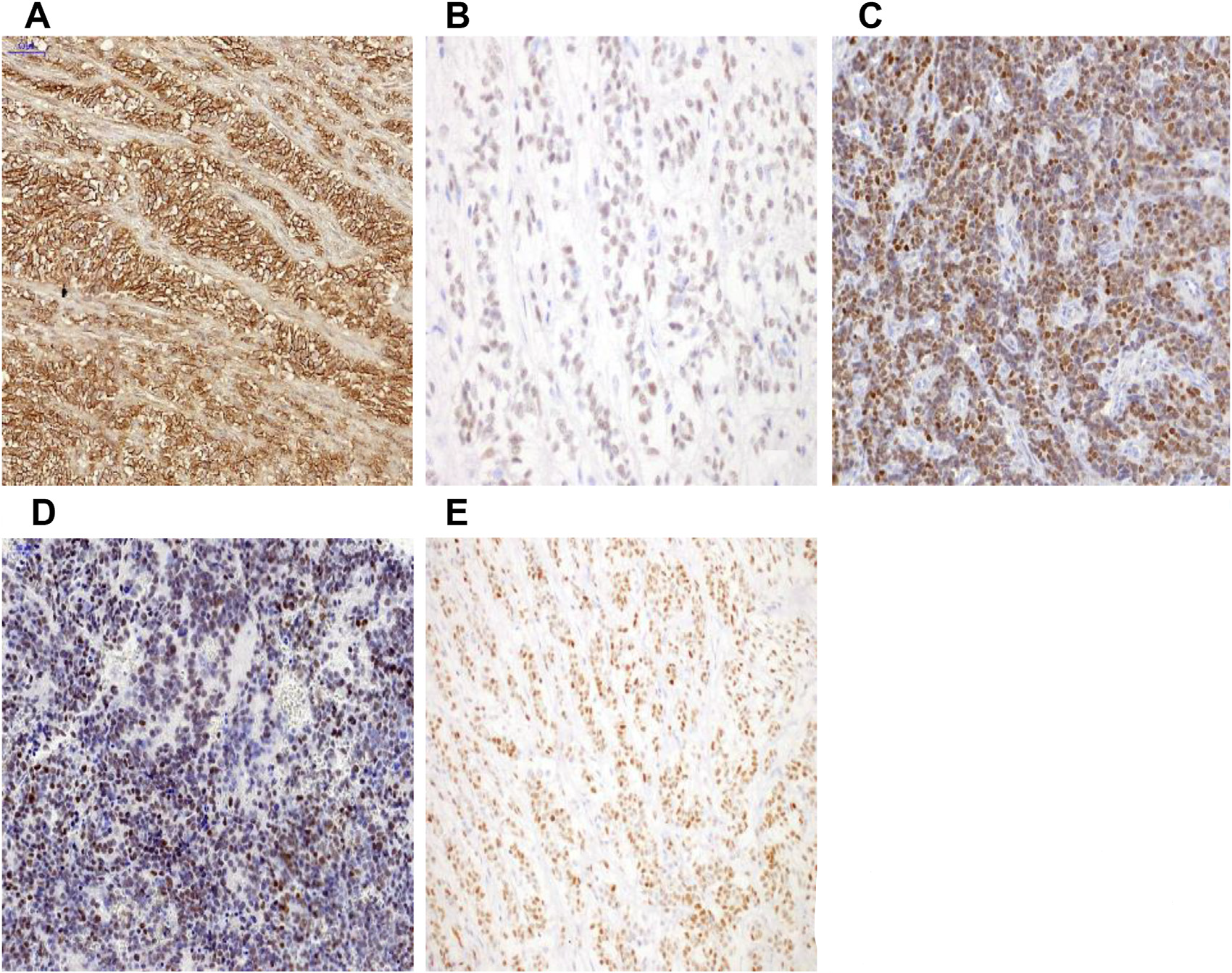
图6.EWSR1::NFATC2融合肉瘤免疫组化:(A)CD99细胞膜弥漫阳性;(B)NKX2.2细胞核中等程度阳性;(C)PAX7弥漫、强阳性;(D)NKX3.1弥漫、强阳性;(E)ETV4细胞核弥漫、强阳性,这一表现可能需要注意鉴别CIC重排的肉瘤。
EWSR1::NFATC2融合的肉瘤与FUS::NFATC2融合的肉瘤在免疫组化NKX2.2、PAX7、NKX3.1方面可能有显著不同:后一瘤种中一般并不表达这些标记,这也和FUS::NFATC2融合肉瘤中NKX3.1下游信号不同相符合。不过最近有研究发现,AGGRECAN是NFATC2重排肉瘤的敏感、且特异标记,并与具体融合配体无关,因为其在其他圆细胞肉瘤一般是不表达的。
总之,联合应用CD99、PAX7、NKX2.2、NKX3.1及AGGRECAN,可检出绝大部分EWSR1/FUS::NFATC2融合的肉瘤。
——未完待续——
点此下载原文献
参考文献
[1]Machado I, Llombart-Bosch A, Charville GW, et al. Sarcomas with EWSR1::Non-ETS Fusion (EWSR1::NFATC2 and EWSR1::PATZ1). Surg Pathol Clin. 2024;17(1):31-55.
doi:10.1016/j.path.2023.07.001



















共0条评论