[导读] 编译整理:强子
大体特征
大体上,该组肿瘤境界清楚,无包膜,呈结节状或多结节状。切面一般描述为灰白色至棕黄色,实性,部分囊实性,肉质样、胶冻状。可能会有出血区域,罕见情况下会有坏死。肿瘤大小中位数4cm,但从0.8cm至21cm均有过报道。
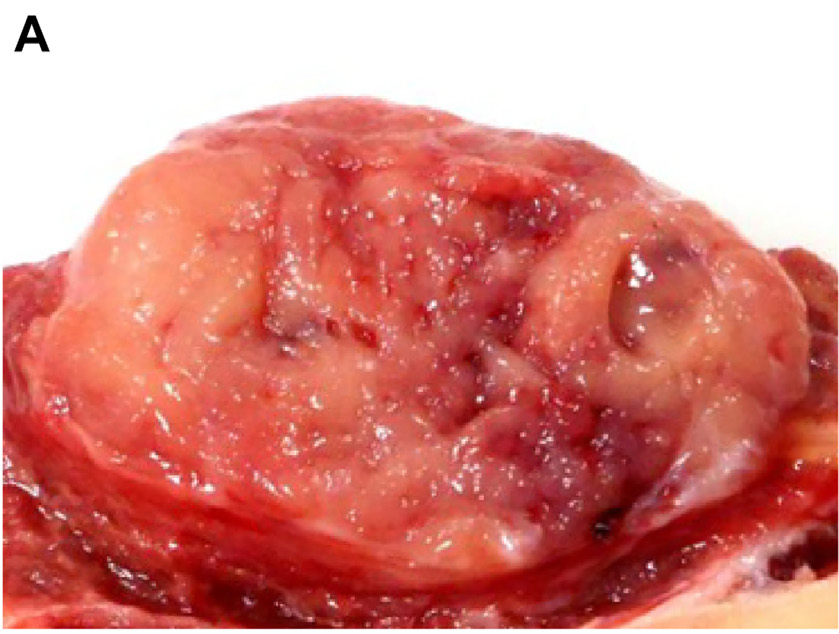 图1.本例为发生于胫骨、GLI1融合阳性的间叶性肿瘤。大体一般为境界清楚、结节状肿物,切面肉质样,局灶有出血。
图1.本例为发生于胫骨、GLI1融合阳性的间叶性肿瘤。大体一般为境界清楚、结节状肿物,切面肉质样,局灶有出血。
镜下特征
GLI1改变的间叶性肿瘤结构上一般呈多结节状、分叶状、或丛状。肿瘤分叶间常有宽大的纤维束分隔。尽管该肿瘤一般境界相对清楚,但常见浸润至周围组织。瘤细胞一般为形态单一的卵圆形至圆形、或略呈上皮样,排列呈实性或境界不清的巢状,其中有发育良好的分枝状毛细血管网。常见肿瘤细胞在血管周围积聚、突入扩张的血管腔,类似淋巴血管侵犯。部分病例中可见真正的血管侵犯。该肿瘤一般会有致密纤维性间质,常伴黏液样改变区域。
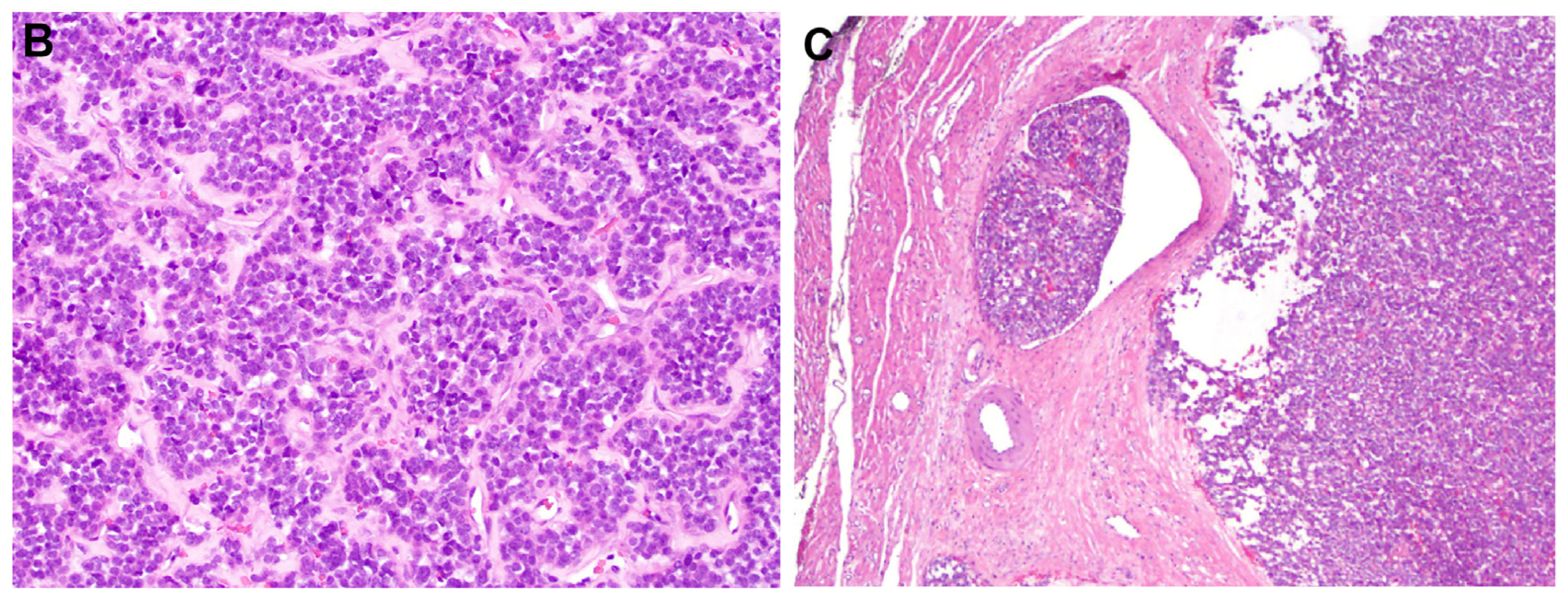 图2.GLI1改变的间叶性肿瘤,镜下肿瘤呈模糊的巢状排列,瘤细胞形态单一、圆形至卵圆形,伴显著血管网;部分病例中可见淋巴血管侵犯。
图2.GLI1改变的间叶性肿瘤,镜下肿瘤呈模糊的巢状排列,瘤细胞形态单一、圆形至卵圆形,伴显著血管网;部分病例中可见淋巴血管侵犯。
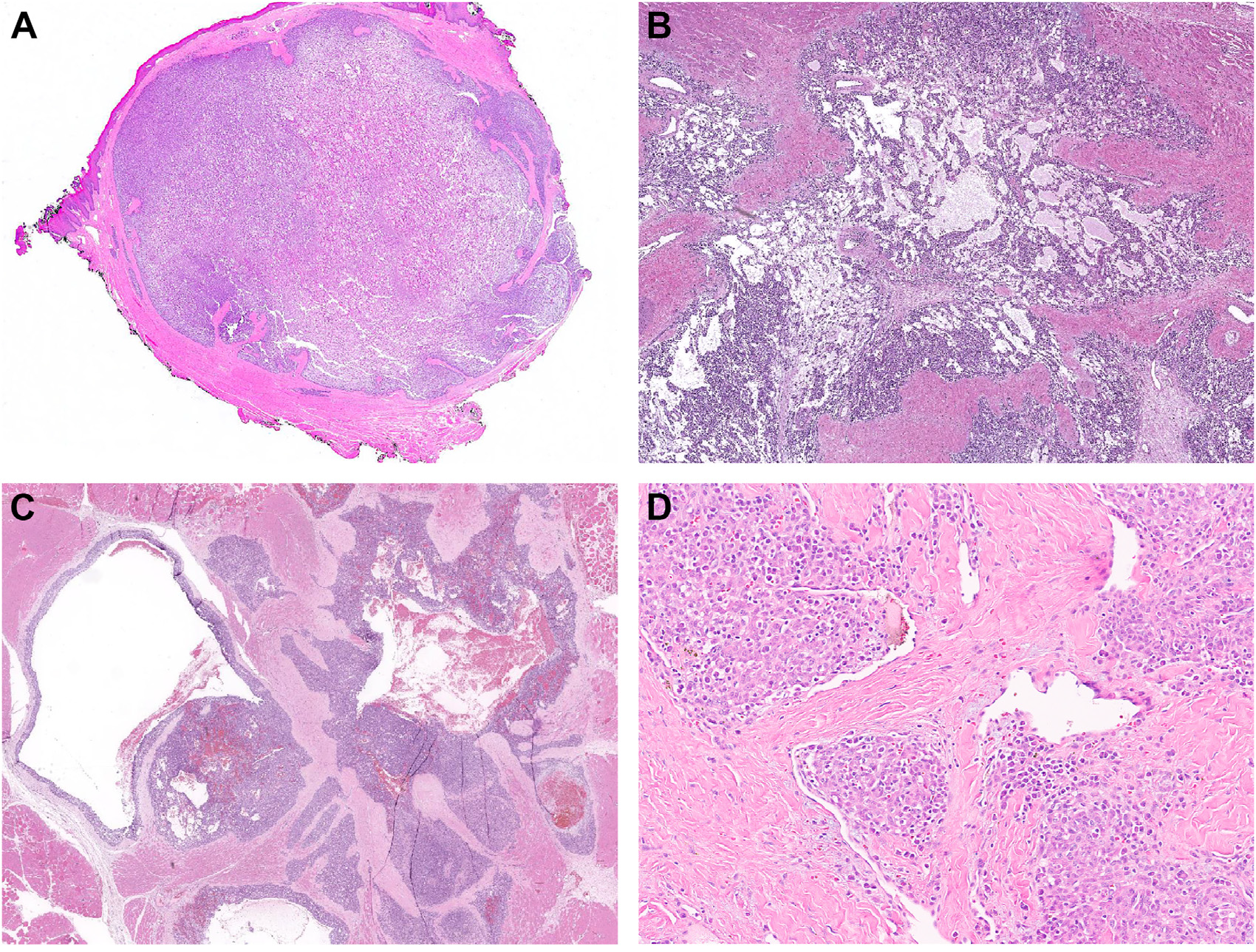 图3.GLI1改变的间叶性肿瘤结构谱系及间质改变:(A)该肿瘤一般呈结节状或多结节状;(B)常见粗大纤维束、黏液样改变、周围侵入相邻组织;(C)个别情况下,该组肿瘤可有显著囊性变;(D)肿瘤细胞突入血管腔的内皮下,也并不少见,且部分病例中可能类似淋巴血管侵犯。
图3.GLI1改变的间叶性肿瘤结构谱系及间质改变:(A)该肿瘤一般呈结节状或多结节状;(B)常见粗大纤维束、黏液样改变、周围侵入相邻组织;(C)个别情况下,该组肿瘤可有显著囊性变;(D)肿瘤细胞突入血管腔的内皮下,也并不少见,且部分病例中可能类似淋巴血管侵犯。
细胞方面,这类肿瘤的细胞核形态均一,圆形至卵圆形,染色质细腻至空泡状,有小而居中、或不明显的核仁。胞质量少至中等,透明至弱嗜酸性。偶见胞质内空泡,类似脂肪母细胞中所见。细胞核非典型或多形性一般并不存在,但也有多形性增加或非典型增强的罕见病例。该肿瘤的核分裂计数不一,最常见为1-2个/10HPF,但具体从罕见、至多于30个/10HPF均可出现。肿瘤坏死并不常见,但部分病例中的确存在。
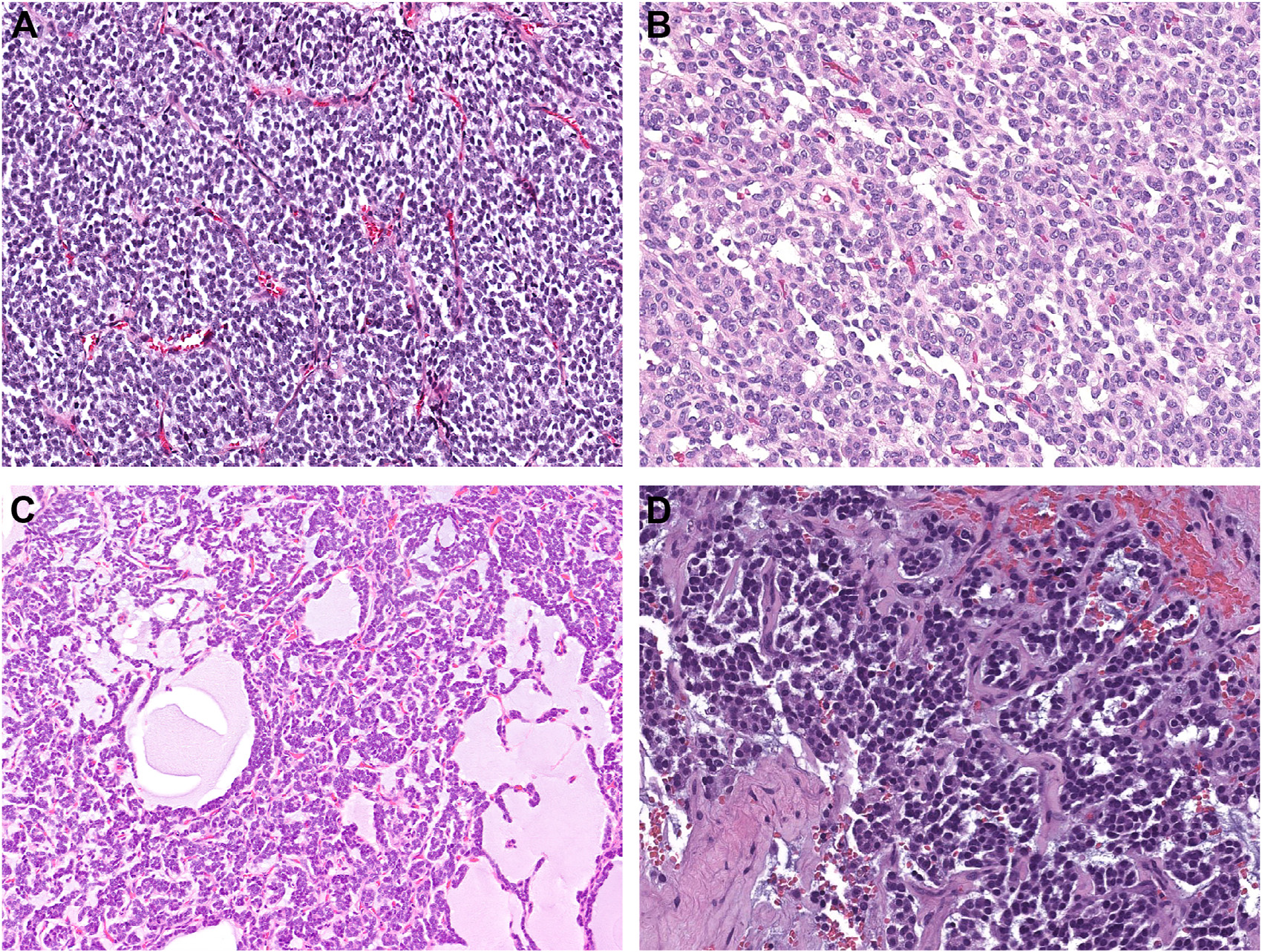 图4.GLI1改变的间叶性肿瘤形态特征:(A)瘤细胞一般为形态均一、圆形至卵圆形,常排列呈独特的巢状,细胞巢之间有致密毛细血管网;(B)部分病例中,肿瘤可呈实性生长,并无明确巢状结构;(C)该肿瘤可有多灶形态,如条索状、网状、囊性、裂隙样结构,常伴黏液样变的间质;(D)该组肿瘤的细胞核一般形态单一,多形性轻微。
图4.GLI1改变的间叶性肿瘤形态特征:(A)瘤细胞一般为形态均一、圆形至卵圆形,常排列呈独特的巢状,细胞巢之间有致密毛细血管网;(B)部分病例中,肿瘤可呈实性生长,并无明确巢状结构;(C)该肿瘤可有多灶形态,如条索状、网状、囊性、裂隙样结构,常伴黏液样变的间质;(D)该组肿瘤的细胞核一般形态单一,多形性轻微。
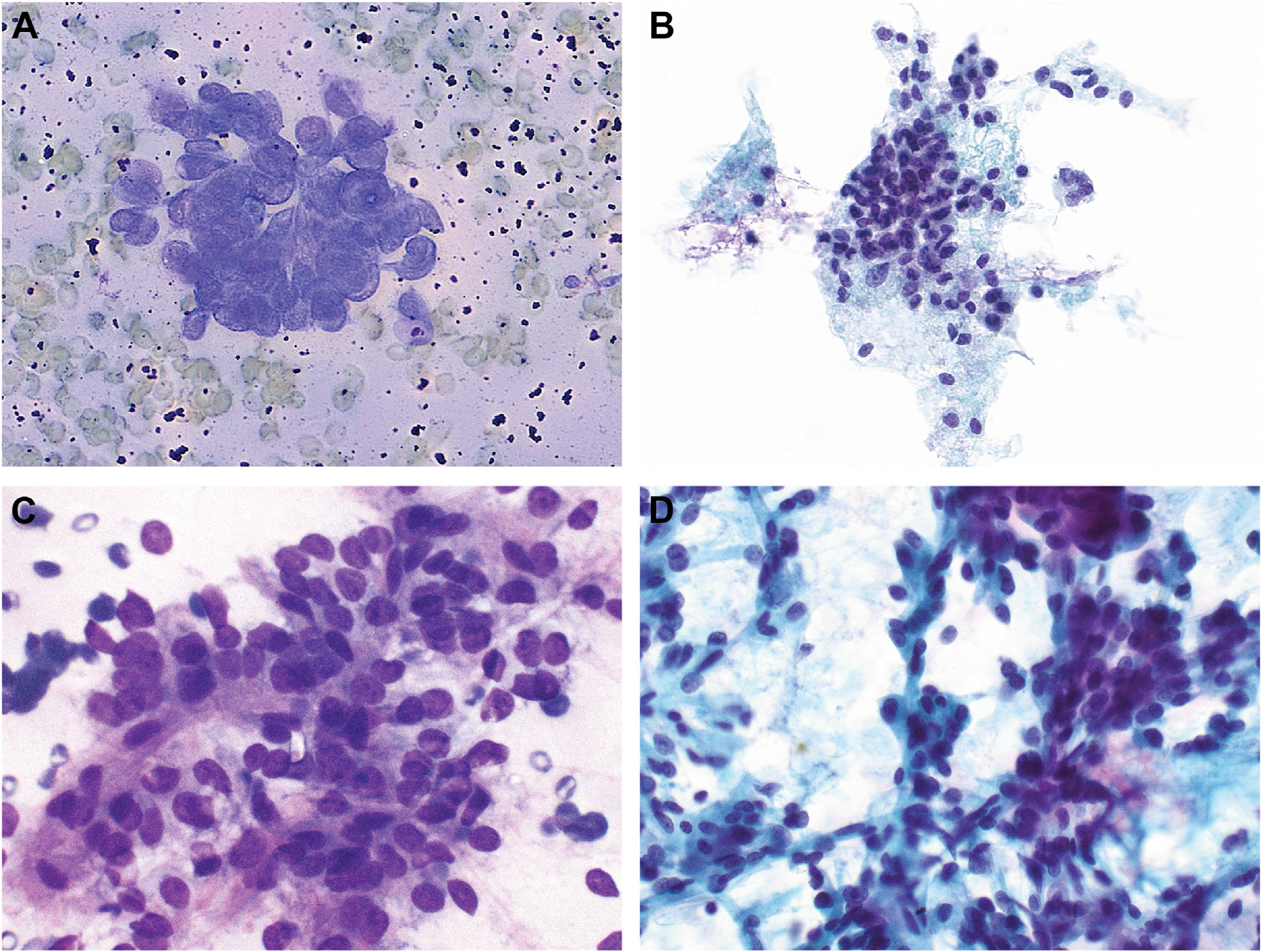
图5. GLI1改变的间叶性肿瘤细胞学特征:(A)Giemsa染色中,细胞为小圆形,胞质稀少,细胞核轻微铸型样;(B)ThinPrep染色中,为有黏附性的圆形至卵圆形细胞、排列呈片状;(C)本例为Giemsa染色,细胞圆形至卵圆形,伴少许纤维性间质;(D)ThinPrep染色中,背景可见显著毛细血管网。
GLI1改变的间叶性肿瘤最常见形态特点就是单一表现的圆形至卵圆形细胞、伴巢状结构及血管周围增生。文献中也提出了诸多少见结构模式,如实性、条索状、网状、梁状、假腺样、假乳头状、微囊性、裂隙样。罕见情况下,该肿瘤可表现为梭形细胞、或双相型细胞(即圆形至卵圆形细胞和梭形细胞)构成细胞丰富的束状。此外,该肿瘤还可有显著囊性变。
免疫组化特征
GLI1改变的间叶性肿瘤免疫组化结果不一,相对并无特异性。虽然最初描述的“伴t(7;22)易位的血管周细胞瘤”中阳性表达SMA,但后续研究并未发现总是表达SMA。CD56是最常见表达的标记。S100的表达可见于约半数病例,且程度不一,从局灶至弥漫均可出现;相反,SOX10总是阴性。
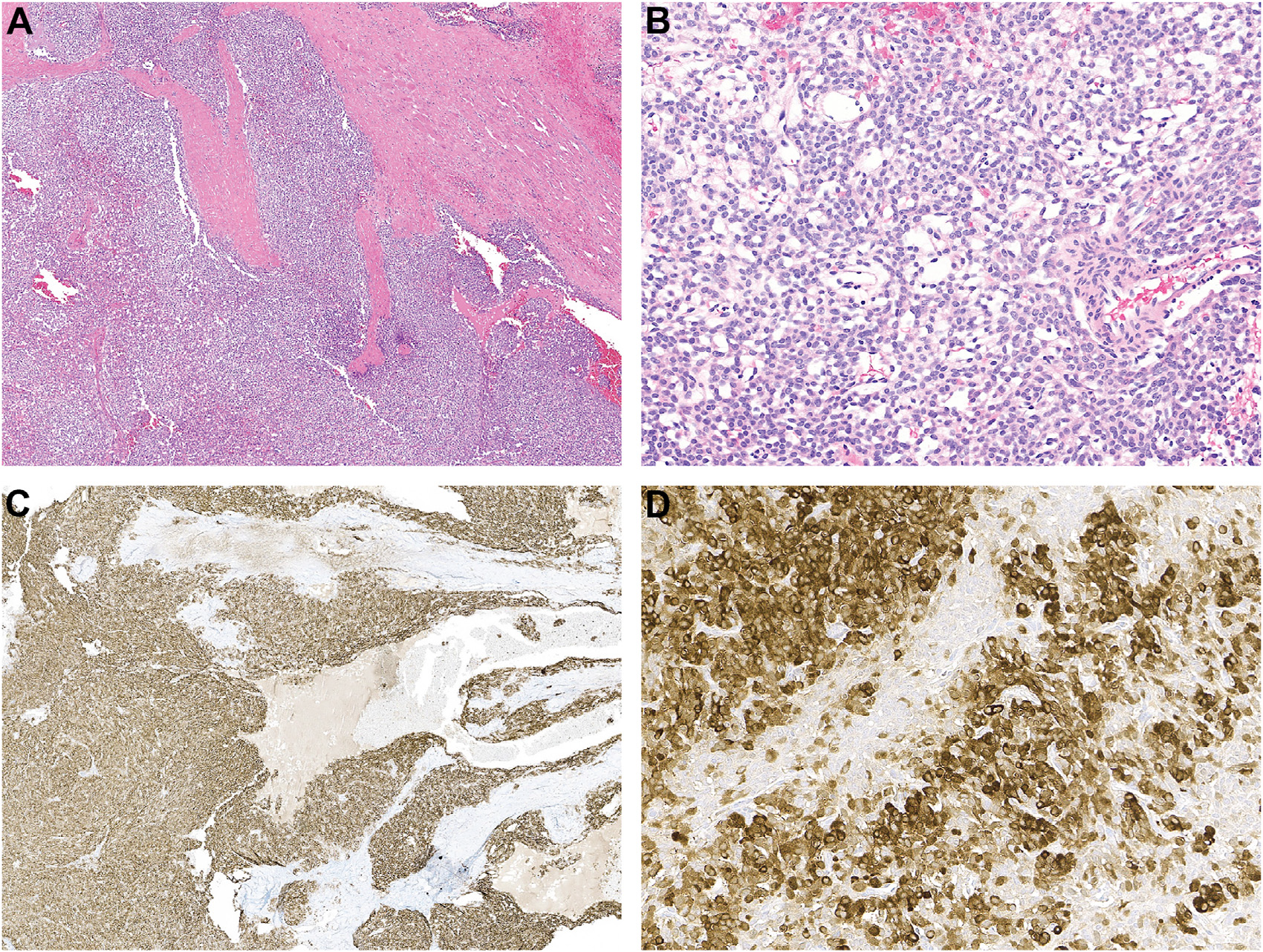 图6.一例舌部的GLI1改变间叶性肿瘤形态及免疫组化特征。(A)该肿瘤呈实性生长,伴粗大纤维束穿过;(B)部分区域的瘤细胞稍呈网状结构,伴水肿间质;瘤细胞形态单一,卵圆形,染色质分布均一,胞质稀少;(C)该肿瘤很多会表达CD56;(D)此外,部分肿瘤会表达S100,但可为局灶、或弥漫。
图6.一例舌部的GLI1改变间叶性肿瘤形态及免疫组化特征。(A)该肿瘤呈实性生长,伴粗大纤维束穿过;(B)部分区域的瘤细胞稍呈网状结构,伴水肿间质;瘤细胞形态单一,卵圆形,染色质分布均一,胞质稀少;(C)该肿瘤很多会表达CD56;(D)此外,部分肿瘤会表达S100,但可为局灶、或弥漫。
除表达CD56外,很多病例还会表达另一种相对非特异性的神经内分泌标记NSE;而Syn和CgA一般为阴性或仅局灶阳性。文献中还有诸多其他标记不同程度表达的记录,具体如EMA、cyclin D1、CD10、BCL-2、BCOR、D2-40。最近还发现部分病例弥漫、强阳性表达p16。GLI1改变的间叶性肿瘤并不总是表达肌上皮(GFAP、calponin)、血管(ERG、CD31)、肌源性(desmin、myogenin、MyoD1)分化的标记。CK一般总是阴性,仅少量局灶表达CK的病例报道。
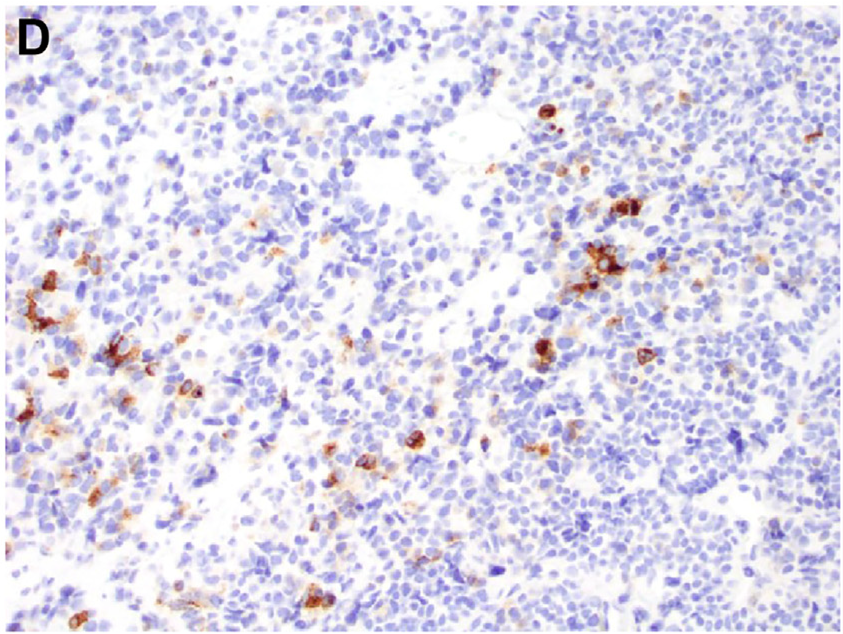
图7.GLI1改变间叶性肿瘤免疫组化常为非特异性,本例局灶表达Syn,也是一个不常见的特征。
GLI1扩增的病例中,相邻共扩增基因产物常见过表达,如MDM2、STAT6、CDK4。这些标记物的免疫组化阳性可能是指向GLI1扩增肿瘤的一个有力线索。
最近有研究提出,GLI1免疫组化可作为GLI1改变肿瘤的有用辅助标记。有一项研究提出GLI1免疫组化阳性对于GLI1改变(包括融合及扩增)间叶性肿瘤诊断的敏感性为91%、特异性为98%。GLI1一般位于细胞核和细胞质,但也可仅见于细胞核。
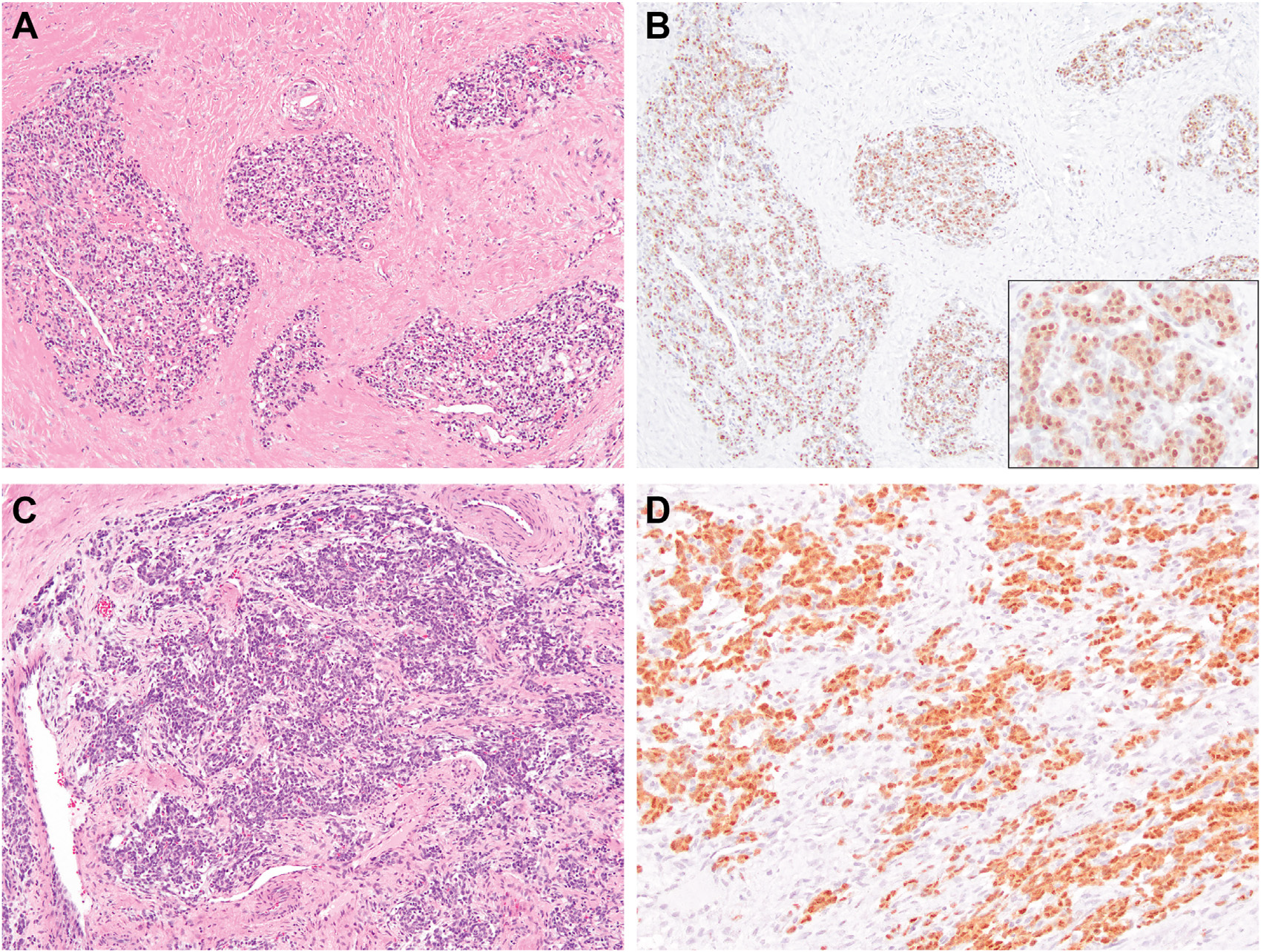
图8.GLI1免疫组化对于GLI1改变间叶性肿瘤的诊断很有帮助。(A)代表性的组织学表现,形态单一的瘤细胞呈巢状,其间有纤维条带分隔;(B)相应免疫组化,GLI1弥漫阳性,为细胞核和细胞质着色(插图所示)。(C)代表性的组织学表现,瘤细胞在纤维性间质背景中呈巢状及岛状;(D)相应免疫组化GLI1呈弥漫阳性。
分子病理特征
GLI1基因位于染色体12q13.3,编码锌指蛋白中Kruppel家族的转录因子,在Hedgehog信号通路中发挥重要作用。GLI1基因的融合及扩增导致GLI1 mRNA转录和蛋白水平均表达增加,进而激活肿瘤下游对肿瘤发生具有重要意义的靶点。
很大一部分GLI1融合阳性的肿瘤是ACTB基因5’端和GLI1基因3’端融合、形成ACTB::GLI1转录所致。不过,GLI1融合的配体较广泛,具体配体基因还在持续增多中,具体如MALAT1、PTCH1、APOD、DERA、SYT、NCOR2、HNRNPA1、TXNIP、NEAT、PAMR1。
尽管大部分病例中GLI1融合的都是3’端,但文献中已有两例GLI1是5’端融合的报道。有趣的是,这两个病例都发生于肾脏、且都是GLI1::FOXO4融合。该肿瘤的形态学特征稍有不同,比如非巢状生长,而是致密、玻璃样变的间质分割肿瘤细胞。目前还不清楚这类形态学差异是否是因为该组肿瘤中不同的融合所致。
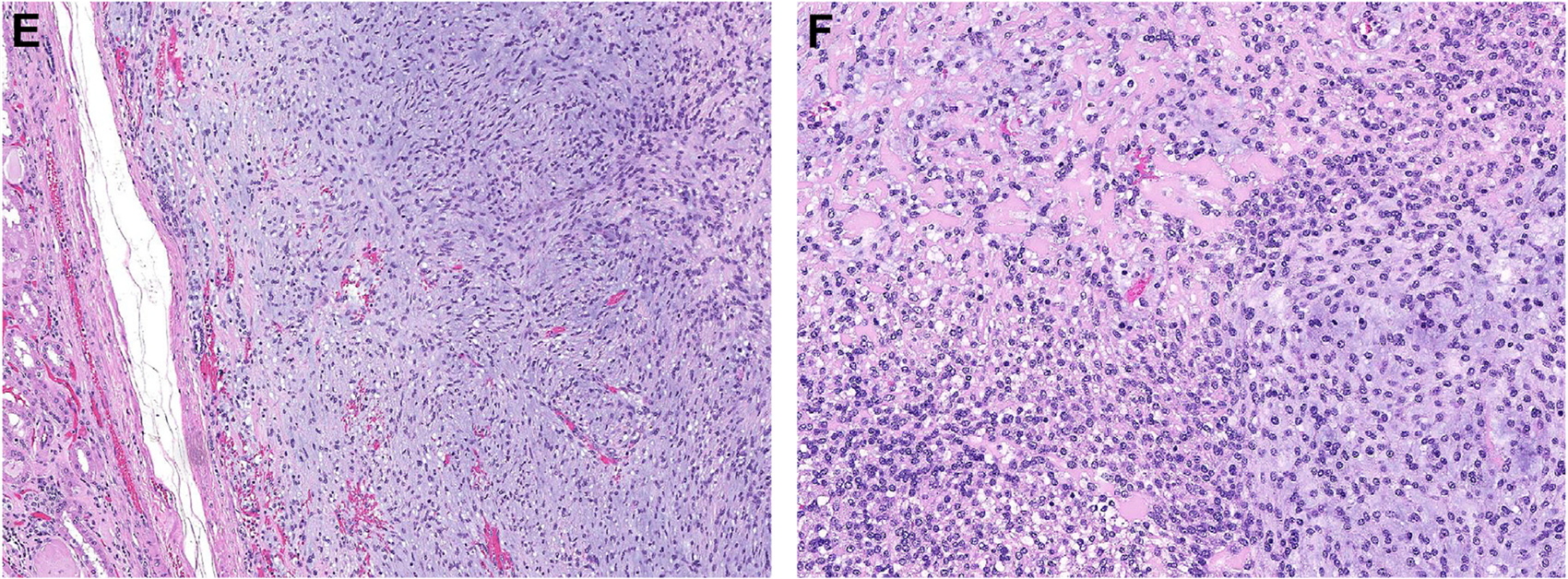 图9.GLI1重排间叶性肿瘤可发生于多个解剖部位,本例为肾脏肿瘤,低倍镜下呈结节状生长,间质有黏液样改变;在瘤细胞条索之间局灶可见间质致密玻璃样变。
图9.GLI1重排间叶性肿瘤可发生于多个解剖部位,本例为肾脏肿瘤,低倍镜下呈结节状生长,间质有黏液样改变;在瘤细胞条索之间局灶可见间质致密玻璃样变。
GLI1扩增的肿瘤是GLI1改变间叶性肿瘤中另一分子特征的部分,约占所有病例的1/3;其特点是高水平的GLI1扩增。GLI1的扩增常伴12q13-q15位置上相邻基因的共扩增,如DDIT3、CDK4、MDM2、STAT6、HMGA2、LRP1、FRS2、ARHGEF25、和/或TSPAN31。研究已证实,这一扩增可导致相应蛋白产物的过表达,可通过免疫组化检测出来。鉴于基因位置如此详尽,因此DDIT3、MDM2、CDK4的探针FISH检测可能可以用于GLI1扩增肿瘤的检测。目前还有既有GLI1融合证据、又有拷贝数获得的罕见病例报道。
——未完待续——
往期回顾:
系列文献学习-软组织病理新病种-GLI1改变的间叶性肿瘤(一)






















共0条评论