[导读] 作者:荣智利
[关键词]阑尾;杯状细胞腺癌;神经内分泌肿瘤;腺癌
阑尾杯状细胞腺癌(goblet cell adenocarcinoma,GCA)是一种具有腺样及神经内分泌特征的双向分化少见肿瘤,其生物学行为与腺癌相似,2019年第5版WHO消化系统肿瘤分类中将其单独列出并归为一种特殊类型腺癌,不再列入神经内分泌肿瘤。GCA临床表现缺乏特异性,常因急性阑尾炎或其他肠道病变手术切除偶然确诊。本文报道1例术前怀疑结核性肠梗阻的GCA患者,分析其临床特征、组织学形态、免疫表型及分子改变,以提高对该肿瘤的认识,避免漏诊、误诊。
1 资料与方法
1.1 临床资料 男性,51岁,反复腹痛伴恶心、呕吐5月余;腹部CT示回盲部肠壁水肿,小肠梗阻,梗阻点位于回肠远端近回盲部;患者有家族结核病接触史,72小时PPD8*8mm、结核感染双因子IFN-γ阳性,余结核相关病原学检查均阴性;查体慢性消瘦病容,腹部外形膨隆,触诊柔韧,全腹轻压痛,无反跳痛;期间行抗感染、诊断性抗结核治疗,症状可部分缓解。因患者症状未能完全缓解,CT示小肠梗阻征象较前加重,行剖腹探查术。术中见小肠扩张、直径约6cm,肠壁水肿增厚,小肠、盲肠、升结肠及腹膜等轻度粘连,回盲部见大小约3*3cm不规则隆起,触之较硬,术中改行回盲部切除+肠吻合术。
1.2 方法 标本4%中性甲醛固定,常规脱水、石蜡包埋,4μm厚切片,行HE染色及免疫组化全自动染色,所用抗体购自福州迈新生物技术开发有限公司。高通量基因变异检测(包括实体瘤靶向治疗相关基因87个、免疫治疗相关基因45个、拷贝数变异相关基因96个、DDR通路相关基因54个、基因融合/重排相关基因29个、化疗相关基因44个)、微卫星不稳定检测(包含519个微卫星位点)及PD-L1蛋白检测均由臻和科技公司完成。
2 结果
2.1 大体观察 回盲部标本:回肠长5cm,直径3cm,黏膜稍粗糙;盲肠长12.5cm,直径3.5cm-5cm,黏膜水肿,近回盲瓣区管壁增厚,黏膜粗糙呈暗红色,散在数十枚息肉样隆起,直径0.2cm-0.5cm,切面灰白灰褐、实性、质稍硬;阑尾长5cm,直径0.6cm-0.8cm,表面光滑,切面管腔各层次欠清,质硬;肠周脂肪组织内查见肿大淋巴结12枚,直径0.3cm-0.5cm。
2.2 镜下观察 阑尾管腔闭塞,黏膜上皮脱失,肿瘤细胞绕阑尾腔呈同心圆状弥漫浸润性生长,穿插于平滑肌束间并浸润至浆膜下脂肪组织(图1);肿瘤主要排列成小管状,可见杯状黏液细胞及潘氏细胞,胞浆粉染或透亮,胞核位于基底部,细胞异型性小,核分裂罕见,部分区伴细胞外黏液,呈低级别生长模式(图2);灶区纤维结缔组织增生,杯状细胞或印戒样细胞单个、簇状或片状排列,细胞异型明显,可见核分裂像,呈高级别生长模式区(图3);肿瘤侵犯整条阑尾,自阑尾开口区浸润至回盲瓣肠壁固有肌层;可见脉管内癌栓及神经侵犯;肠周肿大淋巴结查见癌转移1枚。回盲部余黏膜慢性炎(活动期),隐窝缩短、减少,多发糜烂、溃疡灶,多发炎性息肉形成,黏膜表面绒毛化,未见确切结核相关病理形态。
2.3 免疫组化、特殊染色及分子检测 肿瘤细胞PCK(+)、CK20(+)、CDX-2(+)、Syn(个别+)、CgA(灶区+)、CD56(灶区+)、Ki-67(+约5%)、P53(野生型表达)(图4-6)、MLH-1(+)PMS2(+)MSH2(+)MSH6(+);分子微卫星检测呈稳定型;PD-L1(22CS)蛋白表达TPS<1%、CPS<1%;高通量基因检测检出SMARCA4 变异。
2.4 病理诊断:阑尾杯状细胞腺癌(Ⅱ级),pTNM分期:pT3N1M0。
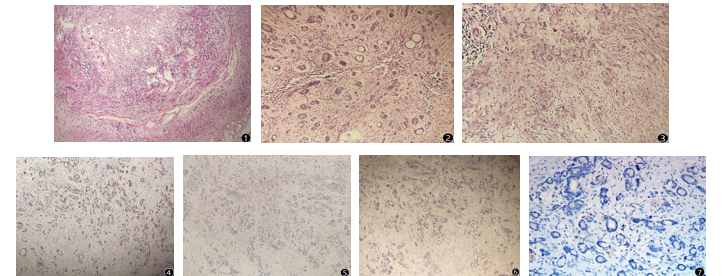
图1.管腔闭塞,肿瘤细胞呈同心圆状弥漫浸润性生长HEⅹ40
图2.低级别区,细胞排列成小管状,异型性低HEⅹ200
图3.高级别生长区,单个、成簇印戒样细胞浸润性生长,细胞异型性明显伴促纤维反应HEⅹ200
图4.CK20弥漫强阳性表达EnVision法HEⅹ100
图5.CgA局灶强阳性表达EnVision法HEⅹ100
图6.Ki67在杯状细胞腺癌中的表达EnVision法HEⅹ100
图7.PD-L1在杯状细胞腺癌中的表达(Dako 22C3)ⅹ200
3 讨论
3.1 临床特点 GCA是一种少见的消化系统恶性肿瘤,多发生于阑尾,发病年龄30-85岁,平均年龄50-60岁,性别报道不一致,多数认为男女之间无明显差异[1]。临床表现缺乏特异性,多以腹痛、急性阑尾炎就诊,部分因其它病症(如肠梗阻、肠套叠、胃肠道出血等)手术切除阑尾偶然发现,一般无类癌综合征。CT或内窥镜检查可显示阑尾肿胀、回盲部肠壁增厚、扩张或变形[2]。GCA可侵犯邻近结肠及回肠,常见转移部位是淋巴结、网膜及腹膜,女性患者可转移至卵巢,临床Ⅳ期患者83%可触及卵巢肿块[3]。本例患者因腹痛伴恶心、呕吐就诊,因有结核病接触史、PPD试验阳性及结核感染双因子IFN-γ阳性怀疑结核性肠梗阻行剖腹探查,术中肉眼查见回盲部病变行右半结肠手术偶然发现阑尾肿瘤,肿瘤侵犯整条阑尾,侵及回盲瓣固有肌层,回盲部黏膜呈慢性炎活动期改变伴多发溃疡及炎性息肉形成。
3.2 组织发生与发病机理GCA的组织学起源尚不明确,其腺上皮及神经内分泌细胞双向分化特征被认为是来源于肠隐窝基底部多潜能干细胞。与结直肠腺癌及神经内分泌肿瘤基因改变不同,GCA的发生与WNT信号通路基因(USP9X、NOTCH1、CTNNA1、CTNNB1和TRRAP)、染色质重组基因(ARID1A、ARID2、KDM6A和 KMT2D)[4-5]或胃印戒细胞癌相关基因(CDH1和RHOA)突变有关[6],微卫星不稳定(Microsatellite Instability,MSI)在GCA中罕见[7],高级别杯状细胞腺癌中有时可查见TP53突变[8]。本文患者微卫星呈稳定型;高通量基因变异检测查见SMARCA4基因变异,文献报道显示,SMARCA4可能通过激活PI3K-Akt信号通路促进结直肠癌发展[9],多发生于低分化癌或伴肉瘤样成分的肿瘤中[1],其与阑尾杯状细胞腺癌的相关性有待进一步研究。
3.3 病理特征 多数阑尾GCA无明显肿物,表现为阑尾壁弥漫性增厚,管腔可闭塞,少数可因炎症致阑尾穿孔及急性腹膜炎。显微镜下,肿瘤细胞于黏膜下呈特征性同心圆状浸润性生长,不累及阑尾黏膜,仅部分肿瘤细胞巢与隐窝基底部相连。2019版WHO消化系统肿瘤分类中明确提出,诊断GCA必须含有经典的低级别肿瘤成分。典型低级别组织形态为:杯状黏液细胞及数量不等内分泌细胞和潘氏细胞排列成小管状,部分肿瘤细胞成簇缺乏管腔,呈具有粘附性的杯状细胞团,可出现轻微结构混乱或管状融合,细胞异型性小,核分裂像少见,通常存在细胞外黏液,缺乏促纤维反应及坏死;可见周围神经侵犯,脉管侵犯少见。高级别组织形态为:肿瘤细胞呈单个、融合小管、筛状或实性片状排列;缺乏小管或簇状生长方式;细胞异型性明显,核分裂像常见;常见促纤维反应或坏死;神经、脉管侵犯常见;可能出现普通腺癌形态。GCA根据低级别成分比例采用三级分级系统[10]:低级别成分>75%为1级,低级别成分50%-75%为2级,低级别成分<50%为3级。本例病例无肿物形成,管腔闭塞,镜下呈特征性同心圆浸润性生长,主要呈低级别生长方式,灶区见印戒样细胞散在浸润的高级别生长区,诊断为杯状细胞腺癌(Ⅱ级)。
3.4 免疫表型 由于肿瘤细胞双向分化,GCA既可以表达普通腺癌标记CK7、CK20、CEA、CDX-2及MUC-2,特殊染色黏液细胞内分泌物AB/PAS呈阳性,也可表达数量不一的内分泌细胞标记CgA和Syn,但不同于NEN对CgA和Syn呈强弥漫性免疫反应,GCA中两种神经内分泌标志物呈点状或斑片状阳性表达,仅突出内分泌细胞数量的变化,非诊断所必需[11]。本例符合上述表达方式。
3.5 鉴别诊断 (1)神经内分泌肿瘤:肿瘤无分泌黏液的柱状细胞,CK20、CDX-2、MUC-2等腺上皮标记阴性,Syn、CgA神经内分泌标记弥漫阳性表达。(2)腺癌:瘤细胞异型性更明显,呈复杂管状或筛孔状排列,间质促纤维反应明显,但神经内分泌标记阴性。(3)印戒细胞癌:印戒样肿瘤细胞单个或片状浸润,常伴普通型腺癌成分,黏膜内存在原发病灶,缺乏低级别GCA生长区,神经内分泌标志常阴性;(4)混合性腺神经内分泌癌:免疫表型相似,但腺癌和神经内分泌癌成分独立存在,每种成分均大于30%,而阑尾 GCA的腺上皮和神经内分泌细胞参杂分布在同一群细胞或同一个腺体中,无明显的界限。
3.6 治疗及预后 阑尾GCA治疗以手术切除为主,但手术切除范围尚存争议,多数建议对病变局限、低级别Ⅰ期肿瘤行单纯阑尾切除术,对Ⅱ、Ⅲ、Ⅳ期患者行右半结肠切除术,女性患者在绝经期提倡预防性卵巢切除[1,12-13]。目前,还没有专门针对GCA的化疗方案,现行治疗方案类似于结直肠腺癌,晚期肿瘤患者接受5-氟尿嘧啶为基础的辅助化疗方案;对于腹膜转移的病例推荐用细胞减压术和腹腔内温热化疗。GCA预后与肿瘤分级及分期相关[14],多达1/3低级别GCA患者虽已出现肿瘤转移,但临床分级仅为Ⅰ期或Ⅱ期,其总生存时间为84~204个月,而50%-70%高级别GCA患者已属于临床Ⅳ期,总生存时间为29~45个月。
总之,阑尾GCA作为一种具有双向分化特征的肿瘤,其形态及生物学行为谱系较宽泛,尤其是高级别GCA具有恶性侵袭性生物学行为,第五版WHO已将其从神经内分泌肿瘤中分离出来,作为一类特殊类型单独描述,希望引起病理和临床医师的足够重视,探求更精准的治疗方式。
参考文献
[1] WHO Classification of Tumour Editorial Board. WHO classification of tumours. Digestive system tumours [M].5th ed. Lyon: IARC Press, 2019.
[2] Kato J,Maruta A,Shirakami Y,et al. Advanced appendiceal goblet cell carcinoids with intestinal obstruction: two case reports[J]. Clin J Gastroenterol, 2020, 13(6): 1205-1212. DOI: 10.1007/s12328-020-01232-2.
[3] Romeo M,Quer A,Tarrats A,et al.Appendiceal mixed adenoneuroendocrine carcinomas,a rare entity that can present as a Krukenberg tumor: case report and review of the literature[J].World J Surg Oncol,2015,13: 325.
[4] Jesinghaus M,Konukiewitz B,Foersch S,et al.Appendiceal goblet cell carcinoids and adenocarcinomas exgoblet cell carcinoid are genetically distinct from primary colorectal‐type adenocarcinoma of the appendix[J]. Mod Pathol,2018,31(5):829‐839.
[5]Wen KW,Grenert JP,Joseph NM,et al.Genomic profile of appendiceal goblet cell carcinoid is distinct compared to appendiceal neuroendocrine tumor and conventional adenocarcinoma[J].Hum Pathol,2018,77:166-174.
[6] Alsaad KO,Serra S,Chetty R.Combined goblet cell carcinoid and mucinous cystadenoma of the vermifor appendix[J].World J Gastroenterol,2009,15 (27):3431-3433.
[7] Dimmler A, Geddert H, Faller G. EGFR, KRAS, BRAF-mutations and microsatellite instability are absent in goblet cell carcinoids of the appendix[J]. Pathol Res Pract, 2014, 210(5): 274-278.
[8] Arai H, Baca Y,Battaglin F,et al.Molecular characterization of appendiceal goblet cell carcinoid[J]. Mol Cancer Ther, 2020, 19(12):2634-2640.
[9] Shanahan F, Seghezzi W, Parry D, Mahony D,Lees E. Cyclin E associates with BAF155 and BRG1, components of the mammalian SWI-SNF complex, and alters the ability of BRG1 to induce growth arrest [J] .Mol Cell Biol, 1999, 19: 1460-1469.
[10] Yozu M, Johncilla ME, Srivastava A, et al. Histologic and outcome study supports reclassifying appendiceal goblet cell carcinoids as goblet cell adenocarcinomas, and grading and staging similarly to colonic adenocarcinomas[J]. Am J Surg Pathol, 2018, 42(7): 898-910.
[11] Zhang K, Meyerson C, Kassardjian A, et al. Goblet cell carcinoid/carcinoma: an update[J]. Adv Anat Pathol, 2019, 26(2): 75-83.
[12] 曹钟,张淑坤,岑红兵,等消化系统杯状细胞腺癌22例临床病理学观察[J].中华病理学杂志,2022,51(10):1013-1018.
[13] 夏言,胡丹,刘艳,等. 阑尾杯状细胞腺癌的临床病理学特征及预后分析[J]. 中华普通外科杂志,2022,37(5):330-333.
[14] Coevoet D,Maenhoudt W,Beaurang J,et al.A goblet cell carcinoma of the appendix presenting as an acute appendicitis: a case report[J]. Acta Chir Belg, 2020, 120(2):124-128.














共0条评论