[导读] 译者:张波
摘要:目的 子宫内膜中肾样腺癌(Endometrial mesonephric-like adenocarcinoma,ML-AC)是近年来发现的一种子宫内膜腺癌亚型,其免疫表型与KRAS突变有关。目前,ML-AC的详细临床病理分析和预后数据有限。方法 对4例ML-AC进行组织病理学、免疫组化和分子生物学分析。对这些病例以及先前发表的病例的数据进行了临床病理学变量和临床随访信息的审查。结果 共确诊ML-AC 40例。ML-AC约占所有子宫内膜癌的1%。与其他类型的子宫内膜AC相似,阴道出血是主要的临床症状,平均年龄为60.0岁(范围31岁-91岁)。超过一半的患者在诊断时表现为局部晚期疾病(≥FIGO II期),在平均24.7个月(范围3-144.5个月)的随访期内复发或死于疾病。最常见的远处转移部位是肺。显微镜下,ML-AC呈现混合形态,并显示所谓的中肾和苗勒管标志物的共表达,表明肿瘤的苗勒管起源。使用不同的PD-L1抗体,所有检测病例的PD-L1免疫染色均为阴性。免疫组化上的错配修复蛋白染色和POLE突变提示子宫内膜癌的分子分类中存在拷贝数低的表型。几乎所有的病例都在密码子12处显示KRAS突变(大多数为G12V)。结论 子宫ML-AC是浸润性子宫内膜AC的一个独特亚型,与KRAS突变和特征性免疫组化表现有关。在临床上,ML-AC可能表现出侵袭性行为,具有高复发率和远处转移性(尤其是肺)的显著风险。
1 前言
中肾腺癌是一种独特的恶性肿瘤,主要发生在宫颈内,占该部位所有癌症的<1%。第二常见的部位是阴道。这些肿瘤特征性与中肾管的残留或增生有关,主要位于宫颈和阴道的侧壁。子宫体腺癌显示宫颈中肾AC的形态学和免疫组化特征,但与实际中肾残留物没有任何联系。最近,报告了一系列具有相似特征的子宫内膜和卵巢AC,这些肿瘤被称为中肾样腺癌(ML-AC)。分子分析表明,ML-AC的特征在于复发性KRAS突变以及独特的免疫组织化学特征和侵袭性临床病程。本研究的目的是增加子宫内膜ML-AC的形态学和免疫组化以及详细的分子情况,分析现有的文献,并提供进一步的临床特征数据。
2 材料与方法
本研究所有4个病例都是第二诊断意见,所有病例最初均被诊断为高分化子宫内膜样腺癌。由于组织学特征不明确,免疫组化染色结果与AC不一致,因此考虑具有第二种意见。故全面分析了所有病例的形态学和免疫组织化学特征,这些特征与中肾特征一致。此外,对所有病例进行了分子改变分析。本研究进一步对以前40例已发表的子宫内膜ML-AC病例的患者临床表现、治疗方法和预后数据进行了重新评价。
3 结果
3.1形态学特征
本研究4例病例的临床病理学特征总结见表1。所有病例均位于子宫内膜内,与中肾残留或增生的存在无关。平均肿瘤大小为4.3cm(范围3.2-5.5cm)。所有病例均表现出混合形态学特征(图1-3)。肿瘤具有高增殖活性,平均核分裂指数为26.5个/10个HPF(范围21-33个)(图4)。
表1.子宫内膜中肾样子宫内膜癌的临床病理特征
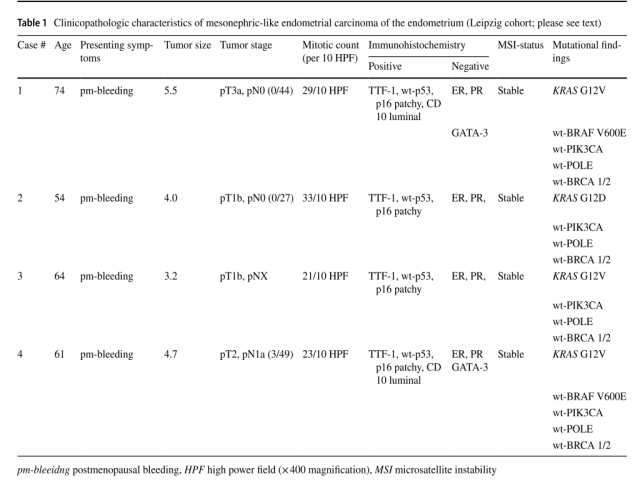
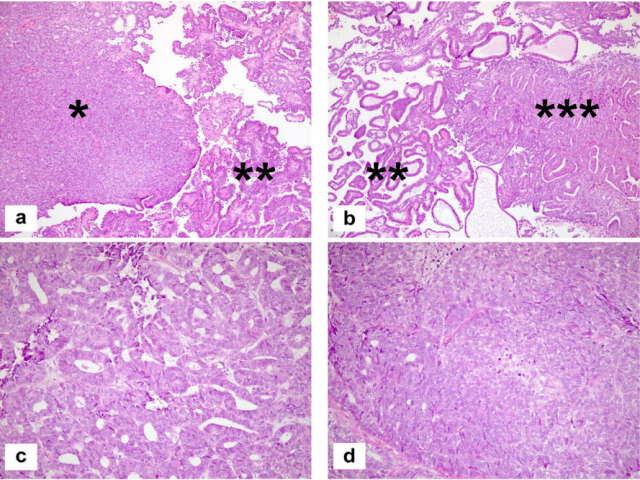
图1.例1术前部分切除的组织学特征。a、b具有不同肿瘤生长模式的碎片组织,实体状(*)、乳头状(**)和腺样(***)特征,c腺模式模仿高分化子宫内膜样癌,d实体腺生长模式模仿低分化子宫内膜样癌
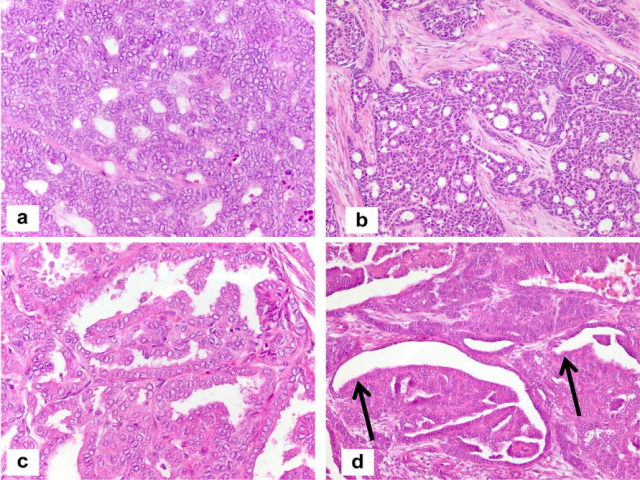
图2.例1子宫切除标本的组织学表现。a腺体生长模式类似于中分化子宫内膜样腺癌,b肿瘤内的筛状模式,c高倍镜下肿瘤细胞呈乳头状,胞浆嗜酸性,空泡状核低级别特征,d肿瘤呈腺样和乳头状。注意从立方上皮直接过渡到扁平上皮(箭头)
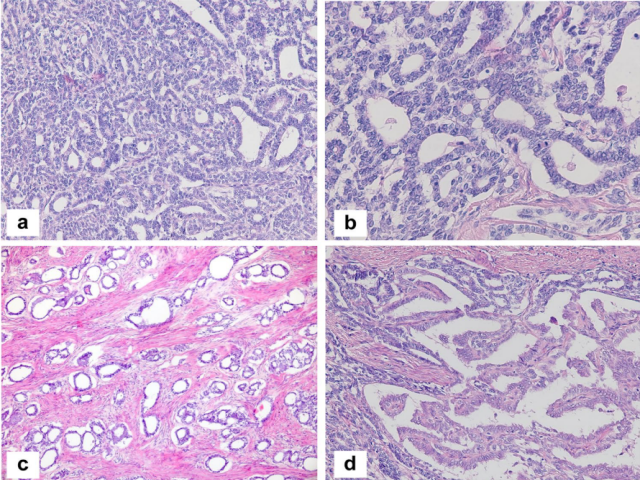
图3.病例2的组织学表现。a低倍镜下表现为管状腺体型,b高倍镜下表现为(a)类似于子宫内膜样癌,c在子宫肌层内浸润性生长的小腺管型,d高倍镜下表现为子宫内膜样腺体与乳头状特征,具有嗜酸性细胞质
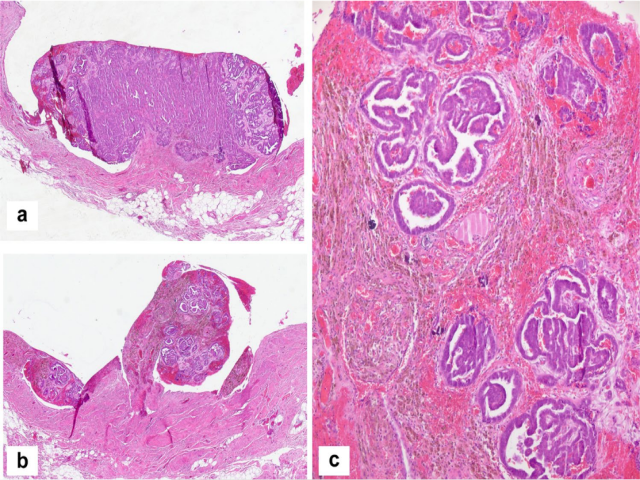
图4.病例1腹膜病变的组织学表现。a,b腹膜扩散的结节状外观和子宫切除术标本(图3)中所见的混合实性和腺乳头状生长模式,c腺乳头状模式高倍放大
3.2免疫组化结果
免疫组化显示TTF-1、CK-7、PAX-8、p53野生型,p16斑驳阳性,2例CD10管腔阳性。所有病例的ER和PR受体均为阴性,但错配修复蛋白(MLH 1,PMS-2,MSH-2,MSH-6)仍保留染色。所有病例均显示肿瘤和肿瘤相关炎性细胞内PD-L1(PD-L1的检测克隆:28-8、SP 142、22 C3)免疫染色阴性。代表性的组织病理学和免疫组织化学特征在(图5、6和7)。
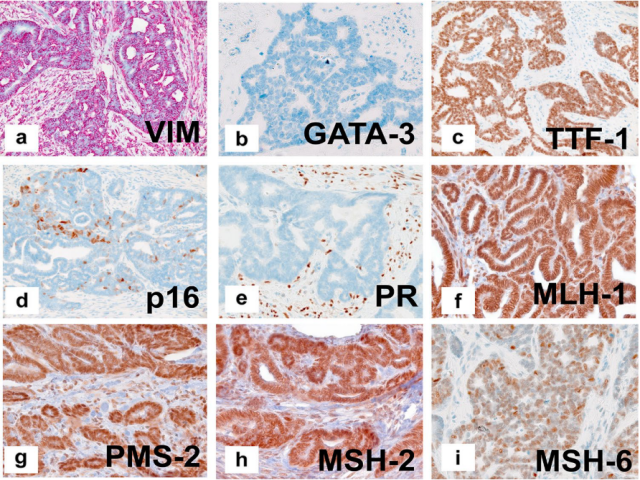
图5.例1术前分期切除肿瘤的免疫组织病理学表现。a vimentin的强弥漫阳性,b GATA-3阴性,c TTF-1的强和弥漫核阳性,d p16斑驳阳性,e瘤细胞PR阴性,f-i对所有四种错配修复蛋白保留核染色
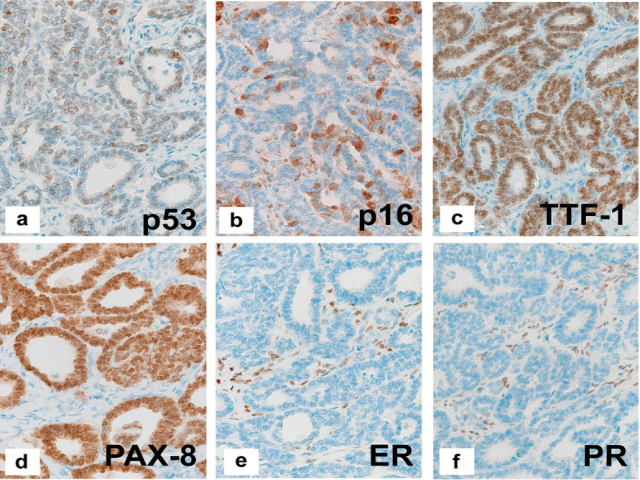
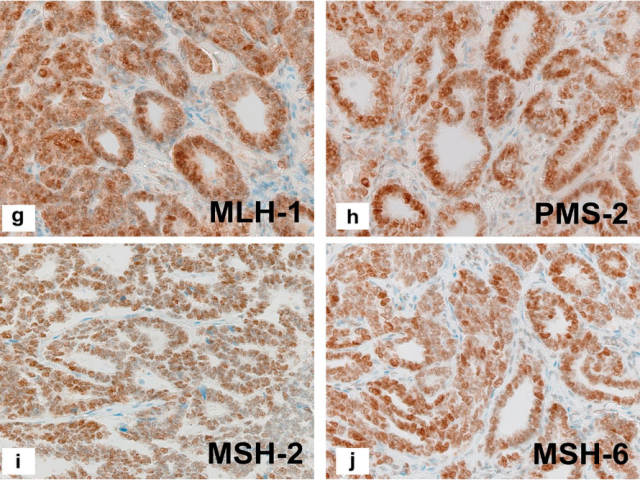
图6.病例2的免疫组织学表现。a p53野生型,定义为<75%的肿瘤细胞的中度核染色, b p16斑驳阳性,c TTF-1的强弥漫阳性,d PAX-8的强弥漫阳性,e瘤细胞ER阴性,f PR阴性,g-j所有四种错配修复蛋白均保留核染色
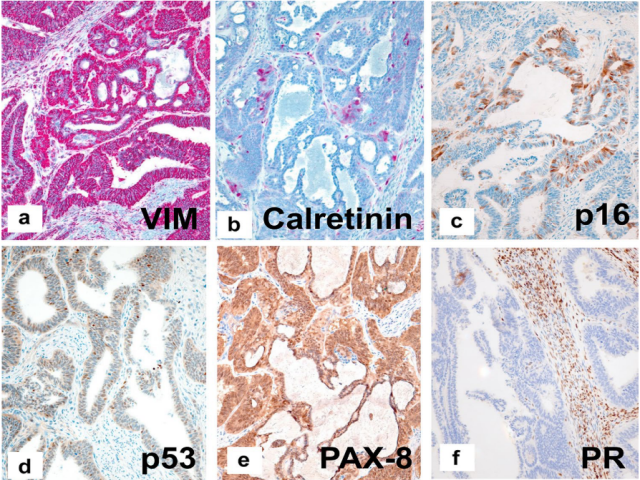
图7.病例3的免疫组织病理学表现。a vimentin的强弥漫阳性,b瘤细胞Calretinin局灶性弱阳,c p16斑驳阳,d p53野生型,f PAX-8的强弥漫阳性,g PR阴性
3.3分子改变
在分子水平上,所有病例在密码子12处具有特征性KRAS突变(图8)。3例显示G12 V-突变,1例显示G12 D-突变(表1)。4例所有病例均为PIK 3CA、POLE*和BRCA野生型。
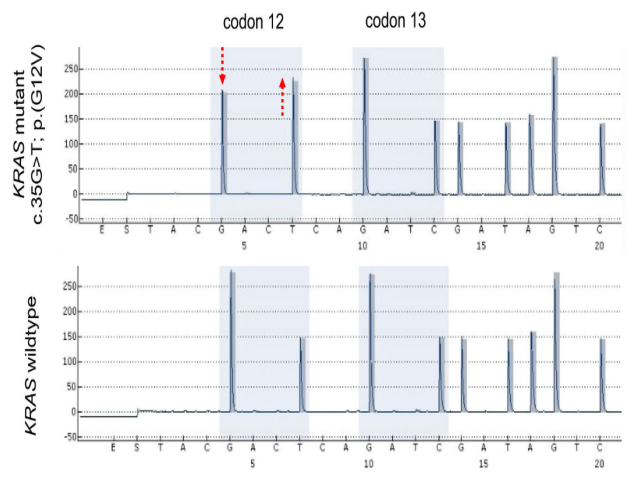
图8.病例1中KRAS基因外显子2中密码子12和13的正常和肿瘤物质的热裂解图比较。上图c.35G>T; p.(G12 V),在肿瘤组织中等位基因频率为58%。下图来自同一患者的正常组织的野生型KRAS序列。红色虚线箭头表示由突变等位基因引起的峰高偏移
3.4已发表病例的特点
回顾既往40例病例患者的平均年龄为60.0岁(范围31岁-91岁)。≤60岁者占48.6%,≤50岁者仅占8.6%。几乎所有病例均以阴道出血作为首个临床体征。52.4%的病例表现为局部晚期疾病,即首次诊断时≥ FIGO II期,1/3被诊断为淋巴结受累。平均随访时间为24.7个月(范围3-144.5个月),48.6%的患者无留存活,12.5%死于疾病,40.0%存活但有疾病证据。肺转移最常见。几乎所有的病例都是以全子宫切除术和双侧输卵管卵巢切除术为主。然后接受广泛的辅助治疗,包括放射治疗、阴道近距离放射治疗和/或腹部放射的不同方法)、单独化疗或放化疗。大体上,超过75%的子宫切除标本表现为子宫内膜肌层肿瘤浸润,先前发表病例的平均肿瘤大小为5.1cm,范围为1.5-14cm。
显微镜下,所有病例均表现出多种组织学特征,包括管状,腺状,实性,乳头状生长模式在整个肿瘤中混合出现。在4例病例中检测到类似于癌肉瘤的肉瘤特征的梭形细胞区,另外1例病例显示异源性软骨肉瘤外观,1例病例显示神经内分泌分化。核分裂计数每10个高倍视野平均有12.7个(范围为4-27)。
几乎所有肿瘤对至少两种已报道的“中肾样”标志物GATA-3、TTF-1和CD 10以及所谓的“苗勒管标志物”PAX-8和CK 7均呈阳性,ER完全阴性或仅局部可见且染色较弱。几乎所有病例的PR均为阴性。所有检查病例均为p53野生型染色,定义为< 75%的肿瘤细胞的弱至中度核染色和p16的斑驳状镶嵌样染色。只有少数先前发表的子宫ML-AC进行了分子水平上的分析。一些病例携带ARID-1A突变,极少数病例携带PIK 3CA改变。几乎所有检查病例均显示密码子12处存在KRAS突变。大多数突变发生在G12 V(11/19的检查病例),其次是G12 A,G12 C和G12 D。仅对1例病例进行了错配修复蛋白分析显示阳性染色。
4 讨论
在40例报告病例中,提示子宫内膜ML-AC是罕见的恶性肿瘤。研究显示,在对570例子宫内膜癌进行的形态学和分子学联合分析中,仅4例(0.7%)被诊断为ML-AC。Pors et al.基于1986年至2017年对585例子宫内膜癌的分析报告了相同的比例。
由于其罕见性,ML-AC的诊断可能具有挑战性,特别是在子宫内膜活检中。文献中报告的大多数病例和本研究所有病例最初被误诊为低度恶性子宫内膜腺瘤,仅罕见为具有透明细胞或高级别子宫内膜样癌特征。ML-AC目前被定义为具有混合形态的癌,表现出中肾癌的形态学特征,但除发生在宫颈和阴道外,子宫腔内并且没有令人信服的中肾残留物。
ML-AC特征性肉眼特征的证据有限,因为已发表的病例不包括详细的肉眼表现。肿瘤大小不等,范围从1.5cm到14cm以上,报告的中位大小为5.1cm。与本研究病例相似(表1),大约有一半先前发表的病例表现为最大尺寸超过4.0cm的巨大外生性肿瘤。切开表面与其他类型的子宫内膜腺癌无差异,但已注意到肿瘤中约有1/2是赘生物和/或伴有肿瘤坏死。除少数例外情况外,绝大多数病例至少显示出子宫内膜受累的显微镜证据。
组织学上,几乎所有报告病例的特征是同时存在不同生长模式的组合(见图1,2,3),包括腺体,管状,乳头状,筛状和肾小球样特征。罕见地描述了实体或梭形细胞形态,模拟肉瘤样生长模式。在1例病例中检测到神经内分泌特征,5例病例被诊断为癌肉瘤,包括1例具有软骨肉瘤形态的病例。分子分析显示,同一肿瘤内不同形态学区域的遗传改变相似。在一些肿瘤中,可见由较小的立方细胞直接转变为柱状细胞(见图2d和图9c)。即使在具有实体生长模式或肉瘤样特征的肿瘤中,细胞核特征通常为低度,最多为中度细胞学异常。与低级别的核特征相反,肿瘤细胞显示出高的核分裂活性,10个HPF中平均有26.5个核分裂像。文献中也报告了由高核分裂活性表明的高增殖活性,每10个HPF平均有12.7个(范围4-27个)核分裂。本研究病例发生在子宫内膜萎缩的背景下(图9a)。在子宫ML-AC中未观察到子宫内膜样癌和浆液性子宫内膜癌。尽管由于病例数量较少,数据有限,但所有病例中的转移瘤均表现出腺体模式,即使在子宫内膜肿瘤内具有混合和肉瘤模式的肿瘤中也是如此。
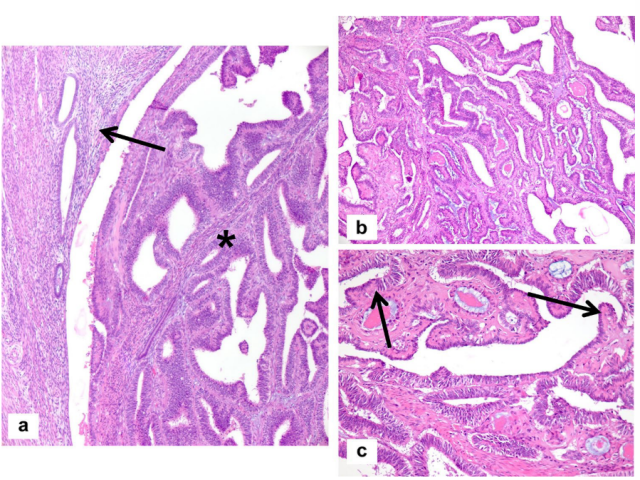
图9.病例3。ML-AC的外生性生长(*),以萎缩的子宫内膜为背景(箭头),b管状-乳头状生长模式,腺上皮细胞形态不同,c高倍镜下腺细胞表现为低级别的核和细胞形态,注意从立方上皮到扁平上皮的直接过渡(箭头)。
可能存在具有CK 7和PAX-8的一致阳性染色的特征性免疫表型以及ER阴性或可能非常局灶性和弱阳,PR的染色完全阴性。TTF-1的染色通常是弥漫性阳性,并且在大多数情况下存在CD 10的管腔阳性。GATA-3(~30%)和钙视网膜蛋白(~50%)的染色结果不太一致,可能仅局灶性存在。GATA-3在区分中肾癌与其他类型的子宫内膜和宫颈腺癌方面显示出最高的灵敏度(91%)和特异性(94%),而TTF-1(45%)、CD 10(73%)和钙视网膜蛋白(36%)的灵敏度较低,特异性极高(99%vs83%vs89%)。
如在绝大多数子宫内膜样腺癌中所见,存在p53野生型表达和p16斑片状染色。主要鉴别诊断特征总结见表2。
表2.ML-AC与子宫内膜浆液性癌和子宫内膜样癌的组织学、免疫组化和分子特征比较
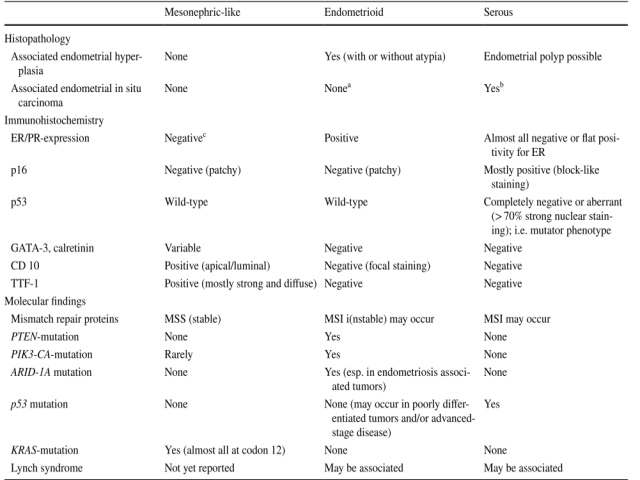
备注:a可能与非典型增生有关; 子宫内膜上皮内瘤变(EIN)b浆液性子宫内膜原位癌(SEIC)可能发生在子宫内膜息肉和/或萎缩性子宫内膜内cER染色可能呈非常局灶性和弱阳,但PR染色几乎总是阴性
分子水平上,在几乎所有检查的ML-AC中,均在密码子12中发现了激活KRAS突变。近2/3的病例显示G12 V的KRAS改变,但也报告了G12 A、G12 C和G12 D的突变。在同一肿瘤的腺体和肉瘤样成分中观察到KRAS基因的相同分子改变以及转移性病灶中。KRAS突变可能代表妇科疾病中的特征性分子改变,子宫颈、阴道、子宫内膜和卵巢中具有中肾特征的肿瘤,因为它们见于大多数检查病例中。本研究所有病例在免疫组化上均表现为p53野生型染色和错配修复蛋白的保留染色。在分子分析中没有POLE突变。
错配修复蛋白的免疫组化表达(MLH-1、PMS-2、MSH-2和MSH 6)在文献中获得的病例中很少进行检测,未检测任何病例的POLE突变,从已发表的形态学和免疫组化细节以及本研究病例的综合分析中可以得出,根据TCGA/ProMisE分类,子宫体的大多数ML-AC为低拷贝数的子宫内膜癌。
子宫内膜ML-AC的形态学鉴别诊断包括子宫体受累的宫颈中肾型AC和子宫内膜AC的不同形态亚型。“真正的”宫颈中肾型AC的区别取决于肿瘤完全或主要位于宫颈或子宫体内。这可以通过对子宫切除标本的详细分析或术前CT和/或MRI的放射学检查结果的局部评估来确定。在组织学上,宫颈中肾AC通常与中肾残留/增生相关,主要位于宫颈侧壁。在子宫内膜的ML-AC中,肿瘤主要位于子宫内膜中,随后侵入子宫肌层。宫颈受累发生在<10%的报告病例中。区别于其他亚型的子宫内膜AC可能是具有挑战性的,需要详细的组织病理学分析,包括结合免疫组化和分子方法。形态学分析需要适当的取样,我们建议完整处理最大尺寸≤ 3 cm的肿瘤。在较大的肿瘤中,根据国际妇科病理学家协会(ISGyP)的建议,我们主张在所有初始切片上特征不明确的子宫内膜腺癌中,每厘米最大肿瘤尺寸包埋一个组织块。子宫内膜ML-AC的发病机制仍有争议。尽管ML-AC与子宫颈中肾腺癌在形态上具有惊人的相似性,但它们与子宫侧壁的中肾残留/增生没有任何关联。从理论上讲,在诊断时,延伸至子宫峡部(子宫下段)的既存中肾残留物可能已被肿瘤过度生长,但几乎所有报告的子宫ML-AC病例主要累及子宫内膜。只有非常罕见的例外病例涉及子宫肌层而无子宫内膜延伸与宫颈中肾AC相反。
几乎所有ML-AC均显示TTF-1阳性染色,而仅约10%的宫颈和阴道中肾癌显示阳性染色。ML-AC Calretinin呈阴性,而40%的宫颈和阴道中肾癌呈阳性。子宫颈中肾残留物的TTF-1呈阴性,但所有病例的GATA-3和半数研究病例的CD 10均呈阳性染色。几乎所有子宫颈的子宫内膜样癌和浆液性子宫内膜癌以及所有HPV相关宫颈腺癌均显示GATA-3和TTF-1联合阴性。子宫ML-AC可表现为CK 7和PAX-8的阳性免疫染色,这些标记物通常报告在苗勒管腺癌中呈阳性。
在一项对大量子宫内膜癌的分析中,发现20.3%(116/570)的子宫内膜癌携带KRAS突变,其中大多数突变位于密码子12(63.8%;74/116例病例)。与这些结果相似,几乎所有检查的子宫内膜ML-AC均在密码子12处显示KRAS突变。子宫ML-AC很少与PIK 3-CA突变相关,据报告PIK 3-CA突变也发生在子宫内膜样癌中。考虑到上述免疫组化数据和分子结果,ML-AC表现出更多的相似子宫内膜癌,而不是子宫颈的原型中肾癌。ML-AC是具有中肾表型的苗勒氏源性的发病理论可能还得到以下事实的支持:混合ML-AC与神经内分泌癌或癌性肉瘤在两种组分中均存在遗传改变,这表明了干细胞理论。
根据这些数据并加上最近报告的信息,大多数病例在50岁和60岁时被诊断出来,平均年龄为60岁(范围31-91岁)。阴道出血是最常见的症状。这两个特征也是子宫内膜癌其他形态学亚型的典型特征。高血压和糖尿病以及与子宫内膜样癌相关的既定流行病学因素与ML-AC密切相关。与本研究4例病例中的2例一致,超过一半的已发表病例(52.4%)表现为局部晚期疾病(诊断时≥FIGOII期)。
绝大多数病例接受了经腹全子宫切除术和双侧输卵管卵巢切除术。在子宫ML-AC中报告了多种辅助治疗方法,包括单独或联合放疗或化疗。有限的数据表明,对含铂化疗的疾病进展缓解。提取有限的已发表的治疗数据,目前尚无推荐的子宫ML-AC辅助治疗方法。
在初次诊断时,约5%的宫颈中肾AC存在远处转移,32%的FIGO I期患者发生复发性疾病,即使在切除后无残留疾病。这种复发率基本上是高于FIGO I期宫颈鳞状细胞癌(11%)和普通型腺癌(16%)。子宫内膜ML-AC的无进展生存期范围为4-10个月(中位7个月)。与子宫内膜癌的其他组织学亚型相比,大量子宫内膜ML-AC患者发生肺部病变,作为最常见的远处转移部位。频繁肺部受累的原因尚不清楚,可能与频繁的瘤周血管受累和肿瘤生物学相关。在平均24.7个月的随访时间内,12.5%的患者死于该病,40%的患者存活并有疾病证据。据报道,免疫组织化学TTF-1表达与不良预后相关。
在子宫内膜癌组织学中,与野生型肿瘤相比,KRAS突变肿瘤通常与更长的无病生存期相关。这与子宫内膜ML-AC的现有数据相反,后者显示KRAS突变与所有检查病例的高复发率相关。在单变量分析中,大肿瘤尺寸(>4cm)、浸润性生长、晚期FIGO分期、存在肿瘤坏死、高有丝分裂活性(>10/10HPF)和存在淋巴血管受累与远处转移性疾病显著相关。在所有患者中,这些不良因素中有四个或更多与转移性疾病相关,而这些因素中少于三个的患者在随访期间没有复发的证据。
综上,子宫ML-AC可能是苗勒起源,在组织病理学、免疫表型和分子水平上代表了中肾特征。TTF-1、CD 10、ER/PR、p53和p16的免疫组化组化可用于ML-AC的正确诊断大多数病例。基于现有的突变分析和免疫组化结果,根据TCGA/ProMisE分类,几乎所有子宫ML-AC都属于拷贝数低的子宫内膜癌组。临床病理分析表明,子宫ML-AC代表了子宫内膜癌的一种侵袭性亚型,在超过50%的病例中,在初次诊断时表现为局部晚期疾病。此外,它们与疾病复发的巨大风险相关,并且经常显示肺部受累是最常见的远处扩散部位。
点此下载原文献

























共0条评论