一、临床资料
患者男性,49岁。半年前无明显诱因出现右侧腋窝包块,大小约2x2cm,无红肿热痛、瘙痒,活动后稍感气促,无发热、畏寒、盗汗、头晕、头痛等不适,未予重视,未治疗。此后包块逐渐增大至约6x5cm,质硬,无红肿热痛,活动度差,右上肢无肿胀。行右侧腋窝包块穿刺活检,穿刺组织中见肿瘤细胞弥漫成片分布伴坏死,部分区域似有星空现象,免疫组化:CD20、PAX-5、CD10、BCL6阳性,MUM-1、CD3、BCL2、CD21阴性,c-myc(60%+)、Ki-67(90%+)。EBER阴性,荧光原位杂交技术(FISH)检测到MYC基因分离重排,流式细胞免疫荧光检测到单克隆B淋巴细胞,符合CD5阴性CD10阳性成熟B淋巴细胞免疫表型。最终诊断:(右侧腋窝包块)高级别B细胞淋巴瘤,NOS。后行骨髓穿刺活检及胸水细胞学检查,均查见恶性肿瘤细胞累及,免疫组化结果与右侧腋窝包块免疫组化结果一致。患者及患者家属拒绝治疗,明确诊断2个月后,患者去世。
二、讨论
侵袭性B细胞淋巴瘤是一组具有高度恶性生物学行为的异质性非霍奇金B细胞淋巴瘤。根据WHO(2022)造血与淋巴组织肿瘤(第5版)分类,该组淋巴瘤中发病率高且常需要相互鉴别诊断的包括弥漫大B细胞淋巴瘤,非特指型(DLBCL—NOS)、Burkitt淋巴瘤(BL)和高级别B细胞淋巴瘤(HGBL)。这些类型淋巴瘤在形态学、免疫表型和遗传学改变上存在不同程度的交叉与重叠,需以形态学为基础,选择合适的免疫组化标记,并采用荧光原位杂交方法检测MYC、BCL-2、BCL-6重排和染色体11q等遗传学异常,有时甚至需要行二代基因测序(NGS)检测才能作出最终诊断。
WHO(2017)造血与淋巴组织肿瘤(第4版)分类中BL包括地方型、散发型和免疫缺陷相关型,而第5版将BL分为EBV阳性和EBV阴性。主要原因是BL分子特征与流行病学背景和地理位置无显著相关性,而与EBV感染状态相关。EBV阳性BL与EBV阴性BL分子特征明显不同,因此分子分型取代流行病学分型更合理。
第5版将伴MYC和BCL2重排的HGBL、伴MYC、BCL2和BCL6重排的HGBL共同归类为伴MYC和BCL2重排的DLBCL/HGBL(DLBCL/HGBL—MYC/BCL2),删除伴MYC和BCL6重排的HGBL诊断术语,将该类型根据瘤细胞形态的不同分别归入不同类型:如瘤细胞呈DLBCL样形态,则诊断为DLBCL—NOS;如瘤细胞呈BL样、母细胞样或介于DLBCL与BL之间形态(所谓的灰区形态),则诊断为高级别B细胞淋巴瘤,非特指(HGBL—NOS)。因此,第5版中HGBL—NOS范围相对扩大,为什么取消伴MYC、BCL2和BCL6重排的HGBL和伴MYC和BCL6重排的HGBL?最新研究显示,无论伴或不伴BCL6重排,DLBCL/HGBL—MYC/BCL2的免疫表型和基因突变谱具有同质性,常呈生发中心来源B细胞(GCB)免疫表型,高频出现BCL2、KMT2D、CREBBP、EZH2、TNFRSFl4和MYC基因突变。其突变特点相似于滤泡性淋巴瘤和分子分型为EZB亚型的DLBCL。伴MYC和BCL6重排的HGBL代表更多样化的异质性谱系,瘤细胞常呈non—GCB免疫表型,具有可变的基因表达谱和突变谱,比如PIM1和CD79B突变,类似non—GCB亚型的DLBCL,与DLBCL/HGBL—MYC/BCL2显著不同。此外,新分类还将伴11q异常的Burkitt样淋巴瘤更名为伴11q异常的高级别B细胞淋巴瘤,因为最近研究证实11q异常的HGBL突变谱除基因组不平衡与BL相似外,罕见ID3-TCF3复合物(BL的分子标志)基因变异,更类似于GCB亚型的DLBCL。
1、Burkitt淋巴瘤肿瘤细胞形态相对一致、中等大小,镶嵌状或铺路石样排列,细胞质边界呈方形,核圆形,染色质细团块状,有多个靠近中心位置的嗜碱性核仁,核分裂象多,“星空”现象明显。免疫表型:广谱B细胞标记物(CD20、CD19和CD22等)阳性,CDl0和BCL6阳性,BCL2阴性或弱阳性,C—MYC高表达(>80%);罕见病例C—MYC蛋白完全阴性,但FISH检测显示C—MYC基因存在易位,可能是由于MYC mRNA表达较弱或遗传多态性所致,Ki67增殖指数大于95%。遗传学改变为IG::MYC融合阳性,其中80%为t(8;14)(q24;q32)易位,导致MYC::IGH,少见为t(8; 22)(q24;q11)、t(2;8)(p12;q24)易位,分别导致MYC::IGL、MYC::IGK。是否存在非IG::MYC融合的BL目前尚不确定,需谨慎诊断,要排除HGBL或DLBCL。日常工作中,根据EBV原位杂交检测EBER阳性或阴性,可将BL分别诊断为EBV阳性BL或EBV阴性BL。诊断BL的必要标准和值得获取的标准,其中必要标准包括:肿瘤细胞形态单一、中等大小、常具有嗜碱性胞质和多个小核仁;CD20和CDl0阳性,BCL2阴性或弱阳性,Ki67指数>95%,常有>80%瘤细胞强表达C—MYC,有MYC断裂或IG::MYC易位证据。值得获取的标准包括:“星空”现象和瘤细胞黏附性生长;BCL6和CD38阳性,TDT阴性;排除 BCL2和BCL6易位。
2、伴MYC和BCL2重排的DLBCL/HGBL肿瘤细胞弥漫性生长,形态多样,可呈DLBCL样、BL样、母细胞样或介于DLBCL与BL之间的灰区形态。瘤细胞表达广谱B细胞抗原,88%-98%的病例CDl0阳性,75%-89%的病例BCL6阳性,17%-42%的病例MUMl阳性。因此,绝大多数病例瘤细胞呈GCB免疫表型。大部分病例表达C—MYC(78%-86%)和BCL2蛋白(90%-95%),71%-81%的病例双表达C—MYC和BCL2蛋白,两者阳性阈值分别为≥40%和≥50%。Ki67常高表达(50%-100%,平均90%),但偶尔Ki67增殖指数低也不完全排除该诊断。约2%的病例瘤细胞可不同程度表达TDT,需结合形态学、CD20和CD34等免疫组化标记和临床病史,甚至流式细胞学检查等与B淋巴母细胞淋巴瘤/白血病鉴别。诊断性分子异常是需获得MYC和BCL2重排证据,可伴或不伴BCL6重排。需要注意的是,有MYC和BCL2重排的B细胞淋巴瘤不等于就是DLBCL/HGBL—MYC/BCL2。在少数的滤泡性淋巴瘤、B淋巴母细胞淋巴瘤/白血病罕见存在MYC和BCL2重排,应诊断为对应的实体,而不诊断为DLBCL/HGBL—MYC/BCL2。
目前,没有绝对特异可靠的指标来预测一个呈DLBCL形态的侵袭性B细胞淋巴瘤是否为DLBCL/HGBL—MYC/BCL2。因此,所有DLBCL—NOS在诊断前均推荐常规行MYC、BCL2和BCL6易位检测,至少要行MYC易位检测,但可能由于缺乏检测平台和(或)检测费较高等因素,在实际工作中并不能做到常规行上述检测。
3、伴11q异常的高级别B细胞淋巴瘤(HGBL-llq)瘤细胞形态与DLBCL/HGBL—MYC/BCL2有重叠,可呈BL样、母细胞样或介于DLBCL与BL之间的灰区形态。免疫表型:瘤细胞表达广谱B细胞标记物,CDl0和BCL6阳性,Ki67高表达(≥90%),BCL2常阴性,极少数阳性或弱阳性,C—MYC可变性表达。诊断性分子异常是MYC、BCL2、BCL6易位均阴性、llq23.3获得和11q24.1-端粒缺失,其中11q24.1-端粒缺失对诊断具有高的特异性,而11q23.3获得也可发生在少数的BL、HGBL—NOS和DLBCL—NOS等侵袭性B细胞淋巴瘤中。因此,当形态学、免疫表型符合HGBL-11q、又无MYC易位的病例,11q23.3获得阴性、11q24.1-端粒缺失阳性可诊断为HGBL-1lq;反之,仅有llq23.3获得,而无llq24.1-端粒缺失,诊断HGBL-11q要谨慎,需鉴别HGBL—NOS等其他侵袭性B细胞淋巴瘤。
4、HGBL-NOS代表一类异质性的侵袭性成熟B细胞淋巴瘤,肿瘤细胞弥漫性生长,可呈母细胞样、介于DLBCL与BL之间的灰区形态或BL样,常有“星空”现象。免疫表型:瘤细胞表达广谱B细胞标记物,大多数病例表达CDl0、BCL6和BCl2,不恒定表达MUMl;因此,大部分病例为GCB免疫表型,少量病例为non—GCB免疫表型,Ki67表达常>40%,大约一半的病例双表达C—MYC和BCL2。遗传学改变上一些病例存在MYC变异,包括8%-58%有MYC易位、32%的病例有MYC扩增。少数病例存在MYC扩增和IGH::BCL2易位或MYC和BCL2共扩增。分别有10%-18%、12%-18%病例存在BCL2和BCL6易位。HGBL—NOS必须排除HGBL—MYC/BCL2和HGBL-11q,形态学又不符合DLBCL—NOS诊断要求,才诊断为该类型。此外,伴MYC重排的HGBL—NOS需要与BL鉴别,两者在形态学、免疫表型和MYC易位上有重叠,必要时可根据基因突变普加以鉴别,在BL中存在ID3、TCF3、SMARCA4和CCND3突变,而在HGBL—NOS中常缺乏上述基因突变。
5、DLBCL—NOS是最常见的淋巴瘤类型,诊断时需要排除特殊类型大B细胞淋巴瘤。瘤细胞以大细胞为主,可有中等大小细胞,常见形态为中心母细胞样、免疫母细胞样或间变形态,其余少见的形态可呈印戒细胞样、梭形或排列呈花环状、腺泡状等。免疫表型上瘤细胞表达广谱B细胞标记物,但偶尔可能缺乏一种或多种B细胞标记物。小部分病例异常表达CD5,少数病例异质性表达Cyclin D1,但无CCNDl基因易位。大部分病例Ki67高表达(>80%),罕见病例可能相对低表达(约40%)。诊断DLBCL—NOS需要根据细胞起源进一步区分不同亚型。使用基因表达谱(GEP)进行分型是公认的金标准。然而,由于其检测设备不可普及、检测费用昂贵等因素在临床实践中应用受限。根据CDl0、BCL6和MUM1免疫组化表达来判断细胞起源的Hans分型方法已广泛用于实践诊断中。CDl0、BCL6和MUMl阳性阈值均为≥30%肿瘤细胞着色被定义为阳性。亚型判断标准:CDl0阳性、无论BCL6和MUM1阳性还是阴性或BCL6阳性、CDl0和MUMl阴性属于GCB亚型,其余均为non—GCB亚型。瘤细胞可不恒定表达C—MYC和BCL2,当瘤细胞C—MYC阳性≥40%,同时BCL2≥50%时,界定为双表达DLBCL,多见于non—GCB亚型,当C—MYC阳性阈值≥70%时更具有可重复性。
DLBCL—NOS是一类遗传学异常高度异质性的淋巴瘤。目前,整合其基因突变、易位及拷贝数改变等遗传学异常的分子分型,已用于临床研究中指导临床治疗及预测预后。但与病理诊断相关的分子事件主要涉及MYC、BCL2、BCL6、IRF4等基因易位情况。分别有8%-14%、20%-30%、30%的DLBCL—NOS存在MYC、BCL2和BCL6易位,其中当同时存在MYC和BCL2基因易位时,应诊断为DLBCL—MYC/BCL2(即双打击DLBCL),若仅其中某一个基因易位或MYC和BCL6共易位,仍诊断为DLBCL—NOS。需强调的是,当存在MYC易位,肿瘤细胞呈GCB免疫表型,同时BCL2蛋白阴性或弱阳性时,不能误诊为BL,因为肿瘤细胞形态不符合BL的形态学要求,应诊断为DLBCL—NOS。当免疫表型CDl0、BCL6和MUMl同时阳性或CDl0阴性、BCL6和MUMl阳性、但伴有滤泡样结构形成时,应行IRF4重排检测,以鉴别伴IRF4重排的大B细胞淋巴瘤。
侵袭性B细胞淋巴瘤诊断思路与策略:如上所述,5种不同类型的侵袭性B细胞淋巴瘤在形态学、免疫表型和遗传学改变上均存在不同程度的交叉与重叠,需以形态学为基础,结合免疫表型及FISH检测基因易位等做最终诊断。该组淋巴瘤病理诊断可总结为四个步骤。(1)HE形态学判断:当形态学已初步判断为侵袭性B细胞淋巴瘤时,需进一步仔细辨别瘤细胞是呈BL样、DLBCL样、母细胞样还是介于DLBCL与BL之间的灰区形态,对HE形态学的准确把握是区分该组淋巴瘤具体类型的重要基础。(2)免疫组化标记及原位杂交检测:诊断该组淋巴瘤最基本的免疫组化标记物应包含CD20 CD79a、CD3、CD5、CD21、CDl0、BCL6、MUM1、BCL2、C—MYC、CyclinD1、TDT和Ki67,同时行原位杂交检测EBER辅助判断EBV状态。(3)FISH检测基因易位:以形态学为基础,结合免疫组化标记结果,合理选择需要检测的探针,包括MYC、BCL2、BCL6、11q23.3和11q24.3等。(4)必要时行NGS检测:遇到特殊病例,如免疫组化检测显示C—MYC蛋白阴性,但FISH检测提示MYC存在易位,可通过NGS检测基因突变情况,从而获得更多诊断依据。
侵袭性B细胞淋巴瘤因形态学、免疫表型及遗传学改变均存在交叉,给病理诊断带来一定的困难,较容易误诊,但不同类型其治疗方案不同,预后亦不同,因此要求做到精准诊断,使患者获益。
1、右侧腋窝包块图片

图1.弥漫增生的肿瘤细胞,淋巴结正常结构消失
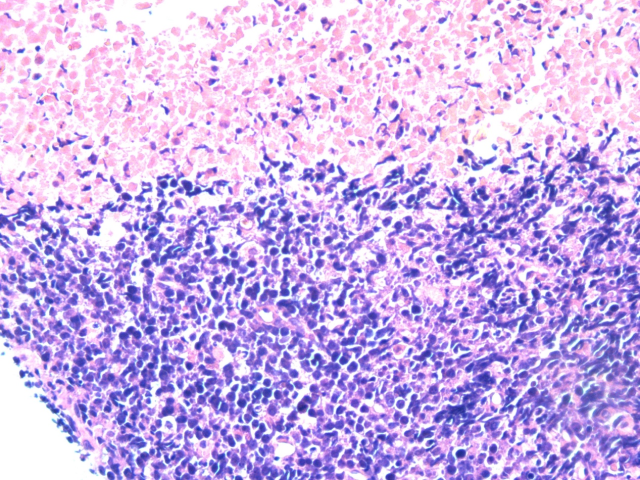
图2.大片坏死
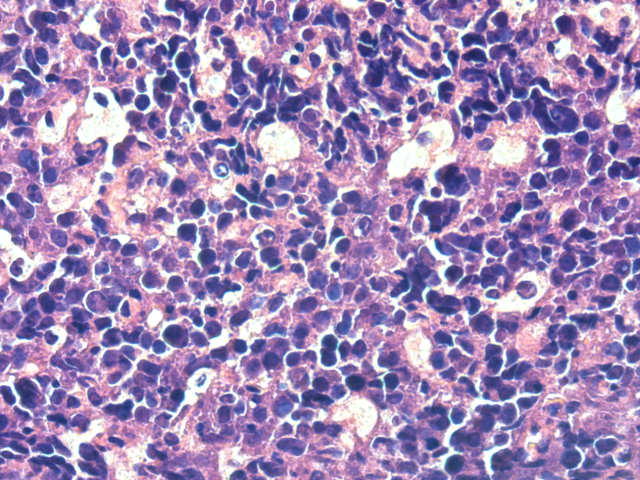
图3.“星空”现象
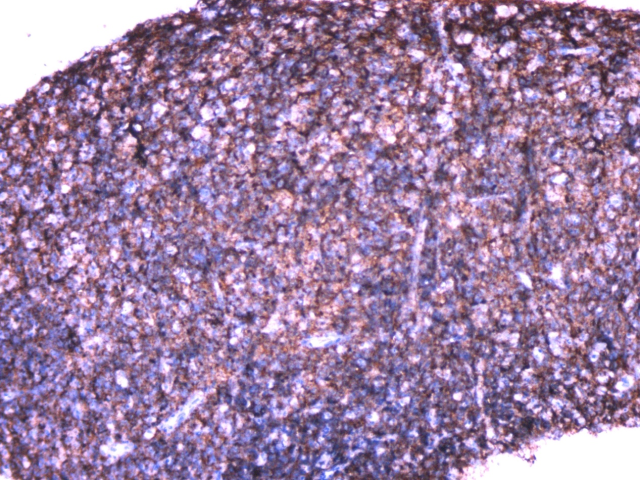
图4.免疫组化CD20(+)
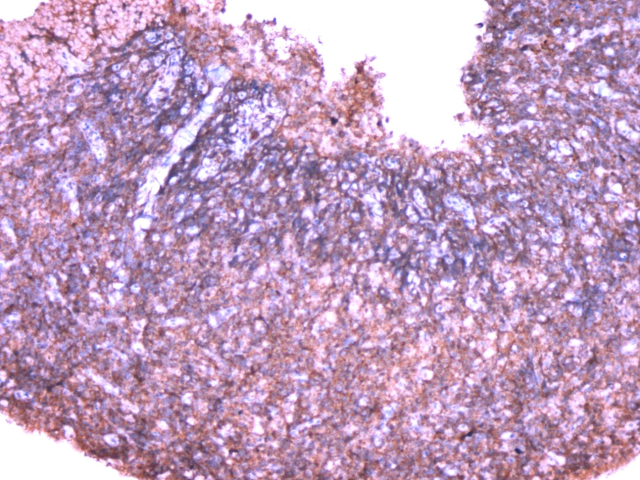
图5.免疫组化CD10(+)
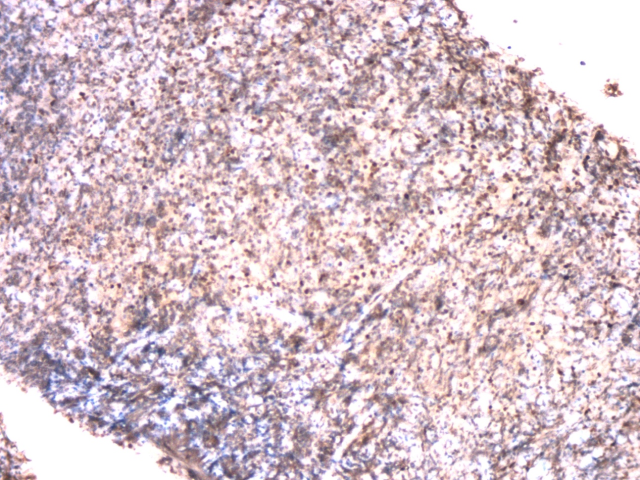
图6.免疫组化BCL6(+)
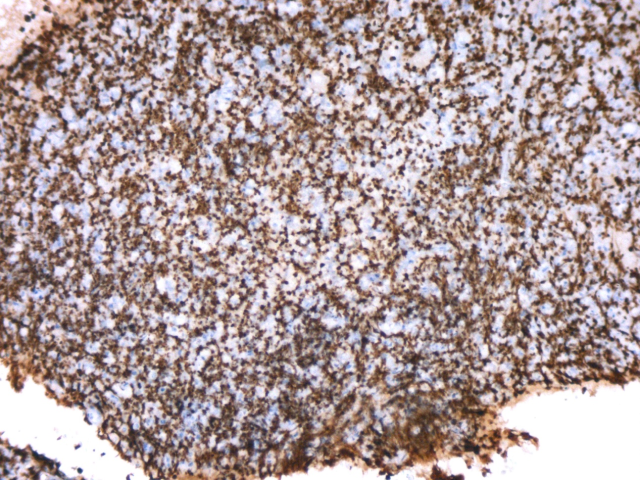
图7.Ki67(90%+)
2、骨髓穿刺图片
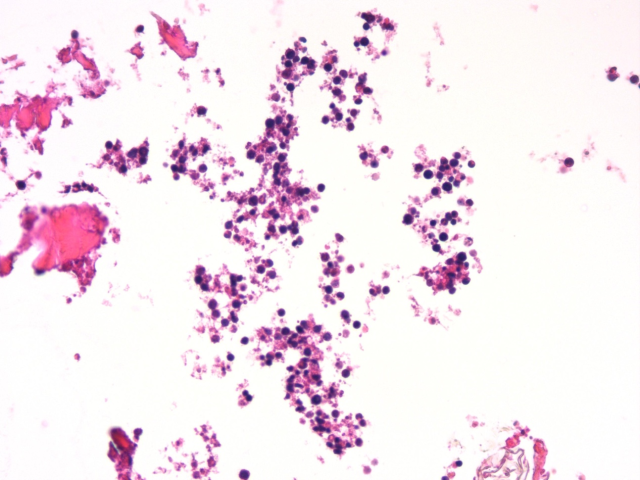
图1.肿瘤细胞中等大小,细胞核圆形

图2.肿瘤细胞团
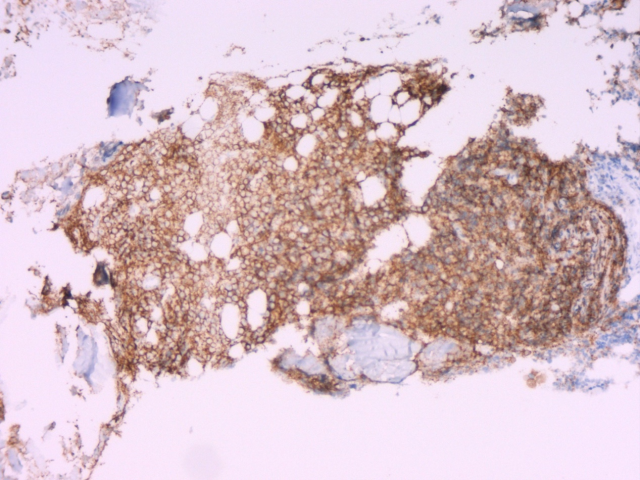
图3.免疫组化CD20(+)
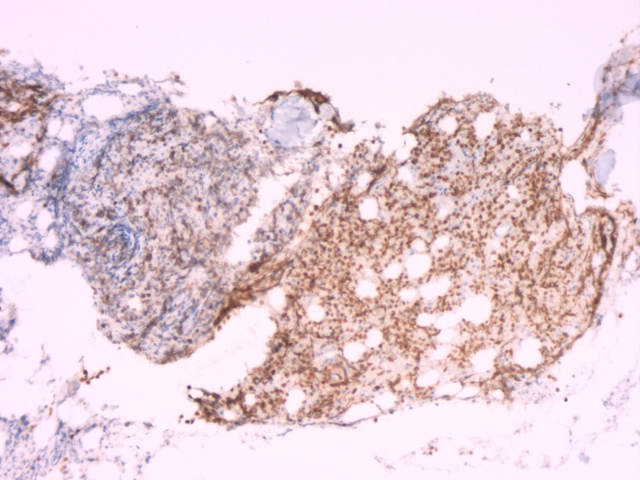
图4.免疫组化PAX-5(+)
3、水细胞学图片

图1.少量肿瘤细胞
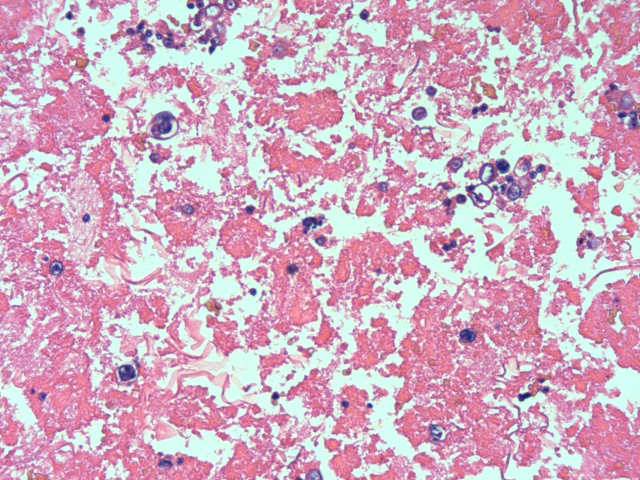
图2.肿瘤细胞异型性明显

图3.免疫组化PAX-5(+)



























共0条评论