病史摘要
患者男性,70岁。3个月前无明显诱因出现左侧腋窝下包块,呈蚕豆大小,边界清楚,活动度差,无红肿热痛等不适症状,患者未重视,未及时检查及治疗。此后,左侧腋窝下包块逐渐增大,目前大小约5x4cm,伴有疼痛,质地硬,边界清楚,表面光滑,活动度差,局部皮肤无红肿、破溃、出血,无发热、畏寒、盗汗、乏力等症状。多次于诊所及药店购买药物(具体名称不详),服用后包块大小及疼痛较前无好转。双侧颈部淋巴结+双侧腋窝淋巴结+双侧腹股沟淋巴结彩超提示上述淋巴结低回声结节影,考虑病变淋巴结?右侧腹股沟淋巴结考虑为淋巴结。胸部CT提示双侧颈部、双侧腋窝及纵隔内淋巴结占位性病变,淋巴瘤可能性大。全腹CT提示腹腔、盆腔、左侧腹股沟占位性病变,淋巴瘤可能性大。遂行左侧腋窝下包块切除术。
病理检查
巨检:(左侧腋窝下包块)灰黄色结节一个,大小约2.5x2x0.8cm,切面灰黄色,质软。镜检:淋巴结正常结构被大片弥漫增生的异型小淋巴细胞取代,小淋巴细胞比正常淋巴细胞稍大,细胞核呈圆形,核仁不清,胞质稀少,核分裂象较少见。免疫组化:CD5、CD20、CD23、CD79a、BCL-2、MUM-1阳性,CD3、PAX-5、CyclinD-1、TDT、CD43、EBER、CD10、BCL-6、CD34、CD99、SOX11阴性,Ki-67约10%阳性。病理诊断:(左侧腋窝下包块)慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)。后行骨髓穿刺活检,可见肿瘤组织累及,免疫组化结果与左侧腋窝下包块活检免疫组化结果一致。确诊后行PET/CT检查提示淋巴瘤浸润双侧耳前、耳后、双侧腮腺、双侧咽旁间隙、颈部、双侧锁骨上窝、双侧腋窝、纵隔(1-5区、7区)、双肺门、前心隔角、食管裂孔疝、腹腔、腹膜后、左上腹膜外间隙、右上臂肱二头肌及肱三头肌间隙、双侧肩背部皮下多组淋巴结,淋巴瘤浸润脾脏。患者及患者家属放弃治疗。
讨论
慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)是主要发生在中老年人群的一种具有特定免疫表型特征的成熟B淋巴细胞克隆增殖性肿瘤,以淋巴细胞在外周血、骨髓、脾脏和淋巴结聚集为特征,是一种低度恶性B细胞非霍奇金淋巴瘤。2001年WHO造血和淋巴组织肿瘤分类认为SLL和CLL是同一个疾病的不同时相,两种疾病统称为CLL/SLL。CLL与SLL的主要区别在于前者主要累及外周血和骨髓,而后者则主要累及淋巴结和骨髓SLL,约20%的SLL进展为CLL。该病发病率随患者年龄增长逐渐增高,60-80岁年龄段为发病高峰期,中位发病年龄为72岁,男女比例为2:1。临床表现包括发热、盗汗、体重减轻、疲乏、自身免疫溶血性贫血,感染、肝、脾、淋巴结肿大,结外浸润,以及与血细胞减少入贫血或者血小板减少有关的症状,部分患者可没有症状。
目前,已被阐明的CLL/SLL发病机制包括:①细胞遗传学改变:例如del(13q)、del(11q)、del(17p),12号染色体三体等染色体变异,以及TP53,共济失调毛细血管扩张突变基因,髓样分化因子88,NOTCH-1,剪切因子3B亚基1,锌指MYM型蛋白3,丝裂原活化蛋白激酶1, F框/WD-40域蛋白7及DEAD框家族解旋酶等基因的异常表达。②相关信号通路异常:涉及B细胞受体信号通路的异常,例如布鲁顿酪氨酸激酶,脾酪氨酸激酶,zeta链缔合蛋白70,Src家族激酶及磷脂酰肌醇-3激酶相关信号通路成员基因的异常表达;CLL/SLL亦涉及Toll样受体-9信号通路异常。另有研究提示Wnt信号通路异常、白细胞介素-10的过量分泌、浆细胞样树突状细胞的低水平表达以及NFAT2的表达水平均可能参与了CLL/SLL发生。
在诊断上,CLL的诊断需要满足以下标准:外周血单克隆B淋巴细胞计数≥5×109/L,且持续≥3个月(如具有典型的CLL免疫表型、形态学等特征,时间长短对CLL的诊断意义不大);外周血涂片检查中,特征性淋巴细胞数量显著增高;CLL细胞典型的免疫表型为CD19+、CD5+、CD23+、CD10-、FMC7-、CD43+/-、CCND1-;同时,表面免疫球蛋白、CD20及CD79b弱表达。SLL与CLL是同一种疾病的不同表现。SLL的临床特征包括:淋巴结和(或)脾、肝大;无血细胞计数减低;外周血单克隆B淋巴细胞计数<5×109/L。CLL的确诊依赖流式细胞术检测结果,而SLL需要淋巴结活组织检查确诊。CLL/SLL有3种不同的细胞成分:小淋巴细胞、幼淋巴细胞和副免疫母细胞。病变以小淋巴细胞为主,这些细胞比正常淋巴细胞稍大,染色质呈块状,核圆形,偶尔见小核仁,核分裂象极少见。幼淋巴细胞中等大,染色质疏松,小核仁。副免疫母细胞体积中到大,核圆形和椭圆形,染色质疏松,中位嗜酸性核仁,胞质嗜碱性。生长方式包括弥漫性、假滤泡性、肿瘤形成和副免疫母细胞性,后两型常出现在病情进展过程中。用免疫荧光原位杂交可以检查出约80%的病例存在异常核型。12号染色体出现三倍体的情况可见于20%的病例,13q14基因缺失可以达50%的病例。存在12号染色体三倍体的病例多数没有Ig可变区基因的突变,而存在13q14异常的病例常常有突变。11q22-23基因缺失常见于20%的病例。 大约50%的CLL有免疫球蛋白重链可变区体细胞突变,将CLL分为IgVH基因突变组和非突变组,发现突变组患者的生存期明显长于未突变组。CD38是可以通过流式细胞术检测到的CLL表面蛋白,CD38的表达与Ig VH非突变有关,但并不完全一致。根据外周血淋巴细胞计数明显升高、典型的淋巴细胞形态及免疫表型特征,大多数CLL/SLL患者容易诊断,但仍需与滤泡淋巴瘤、套细胞淋巴瘤、边缘区淋巴瘤、淋巴浆细胞淋巴瘤等进行鉴别。
不是所有的CLL/SLL都需要治疗,对于无治疗指征的患者,临床可遵循观察和等待的原则,每2-6个月随访1次,随访内容包括临床症状及体征,肝、脾、淋巴结肿大情况和血常规等。当疾病进展时,如出现B症状、一般状况下降、脾和淋巴结肿大、进行性淋巴细胞增多、对皮质类固醇反应不佳等症状时,则需根据TP53缺失和(或)突变、年龄及身体状态进行分层治疗。一线治疗方案包括伊布替尼、泽布替尼、氟达拉滨+环磷酰胺+利妥昔单抗、苯达莫司汀+利妥昔单抗、奥布替尼、维奈克拉+利妥昔单抗/奥妥珠单抗、氟达拉滨+利妥昔单抗、氟达拉滨+环磷酰胺等。目前,应用于CLL/SLL治疗的新型靶向药物奥法木单抗、奥妥珠单抗、阿仑单抗、依鲁替尼、维奈托克等抗肿瘤活性好,对治疗后失败或复发的患者有较好的缓解率,已在临床应用。自体造血干细胞移植有可能改善患者的无进展生存,但并不延长总生存期,不推荐采用。异基因造血干细胞移植目前仍是CLL的唯一治愈手段,但由于CLL主要为老年患者,仅少数适合移植,近年来随着新型靶向药物的使用,异基因造血干细胞移植的使用时机需谨慎考虑。对于临床上疑有Richter综合征转化的患者,应尽可能进行活检明确诊断,组织学转化在组织病理学上分为弥漫大B细胞淋巴瘤与经典型霍奇金淋巴瘤,需根据转化的组织学类型以及是否为克隆相关决定治疗方案。完成治疗达到完全缓解或部分缓解的患者,应该定期进行随访,包括每3个月血细胞计数及肝、脾、淋巴结触诊检查等。此外还应特别注意第二原发肿瘤的出现。
一、左侧腋窝下包块活检图片
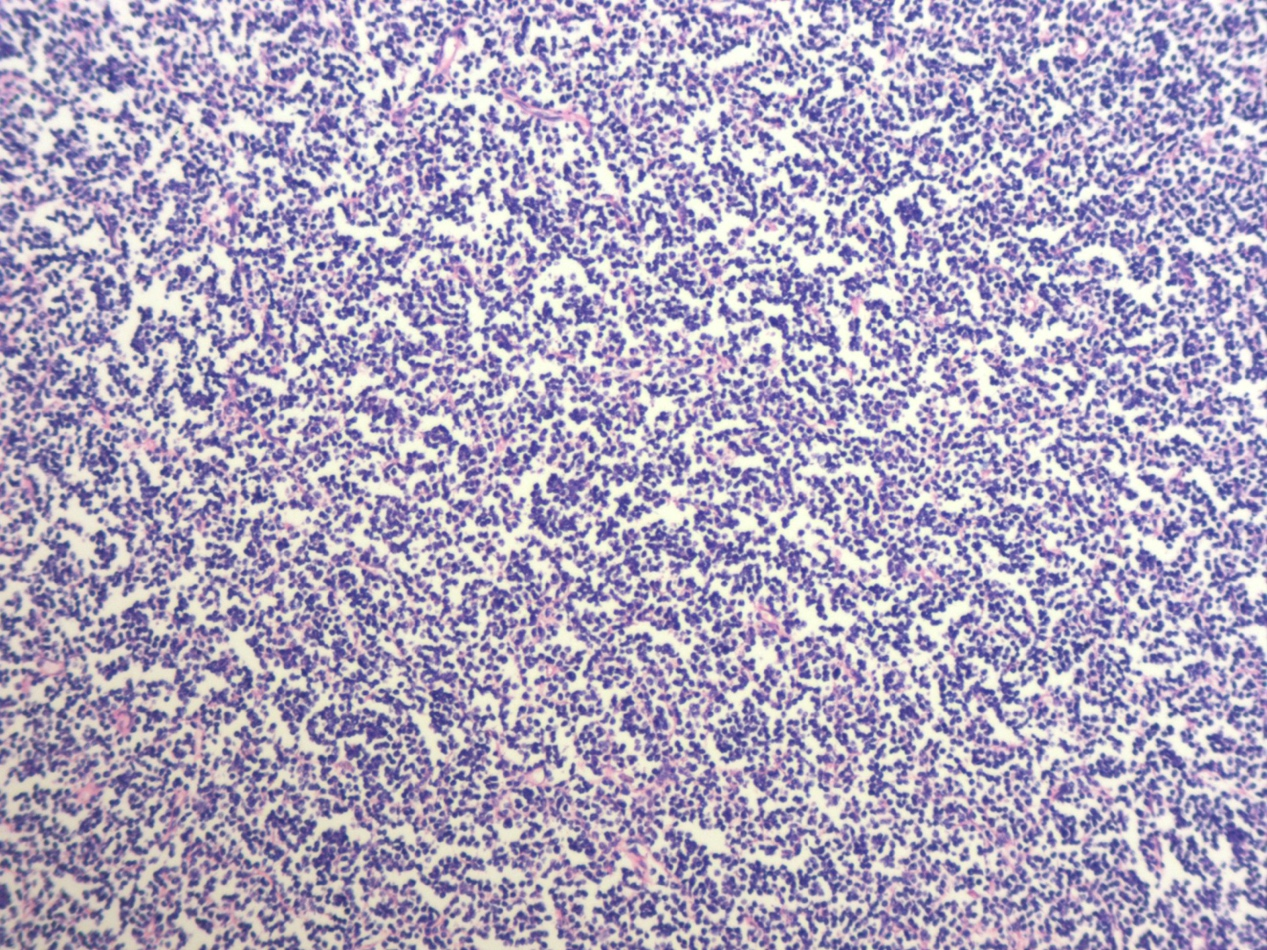 图1.病变弥漫,淋巴结正常结构被破坏
图1.病变弥漫,淋巴结正常结构被破坏
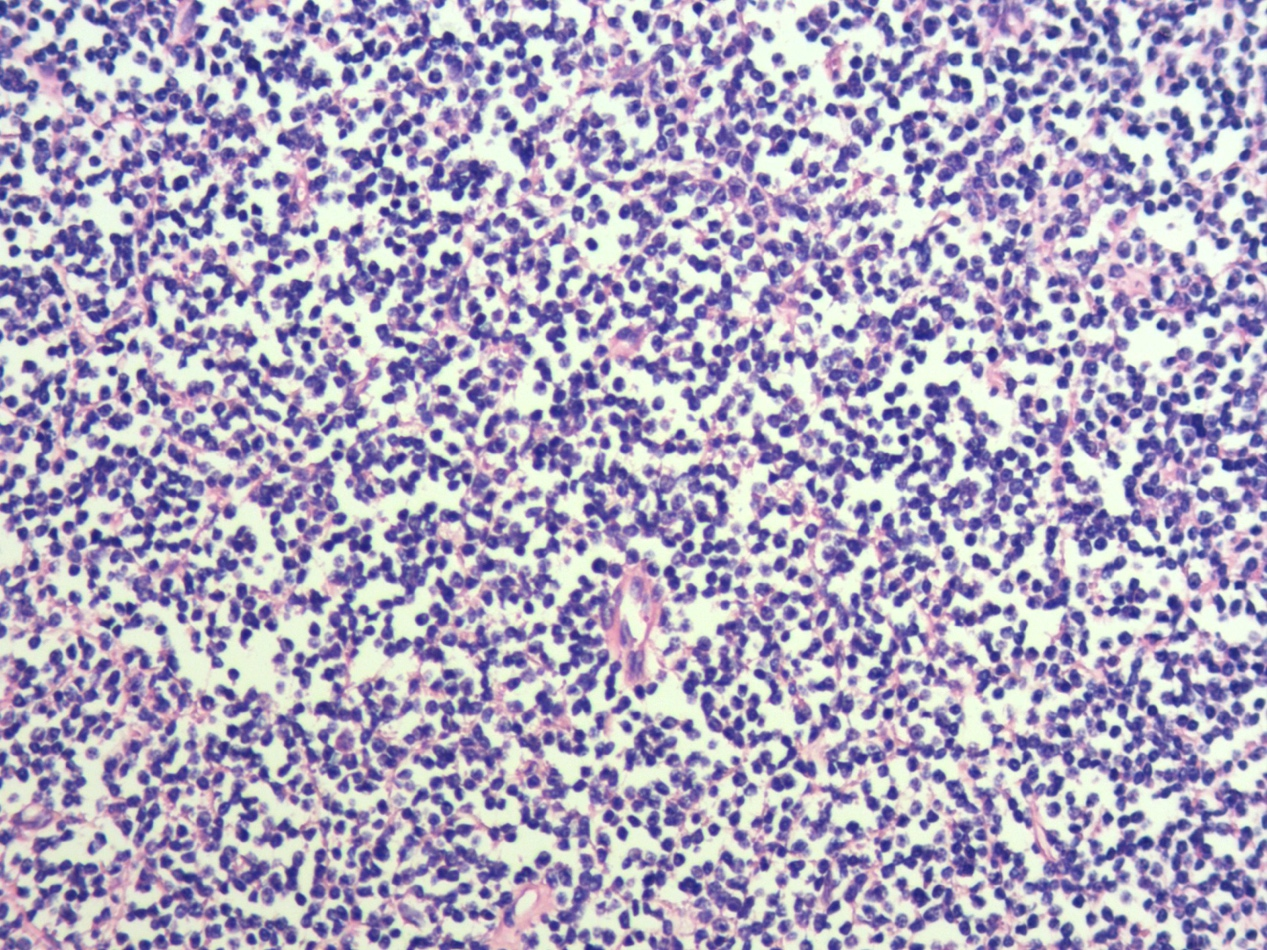 图2.肿瘤性淋巴样细胞小,核圆形或不规则,胞质少
图2.肿瘤性淋巴样细胞小,核圆形或不规则,胞质少
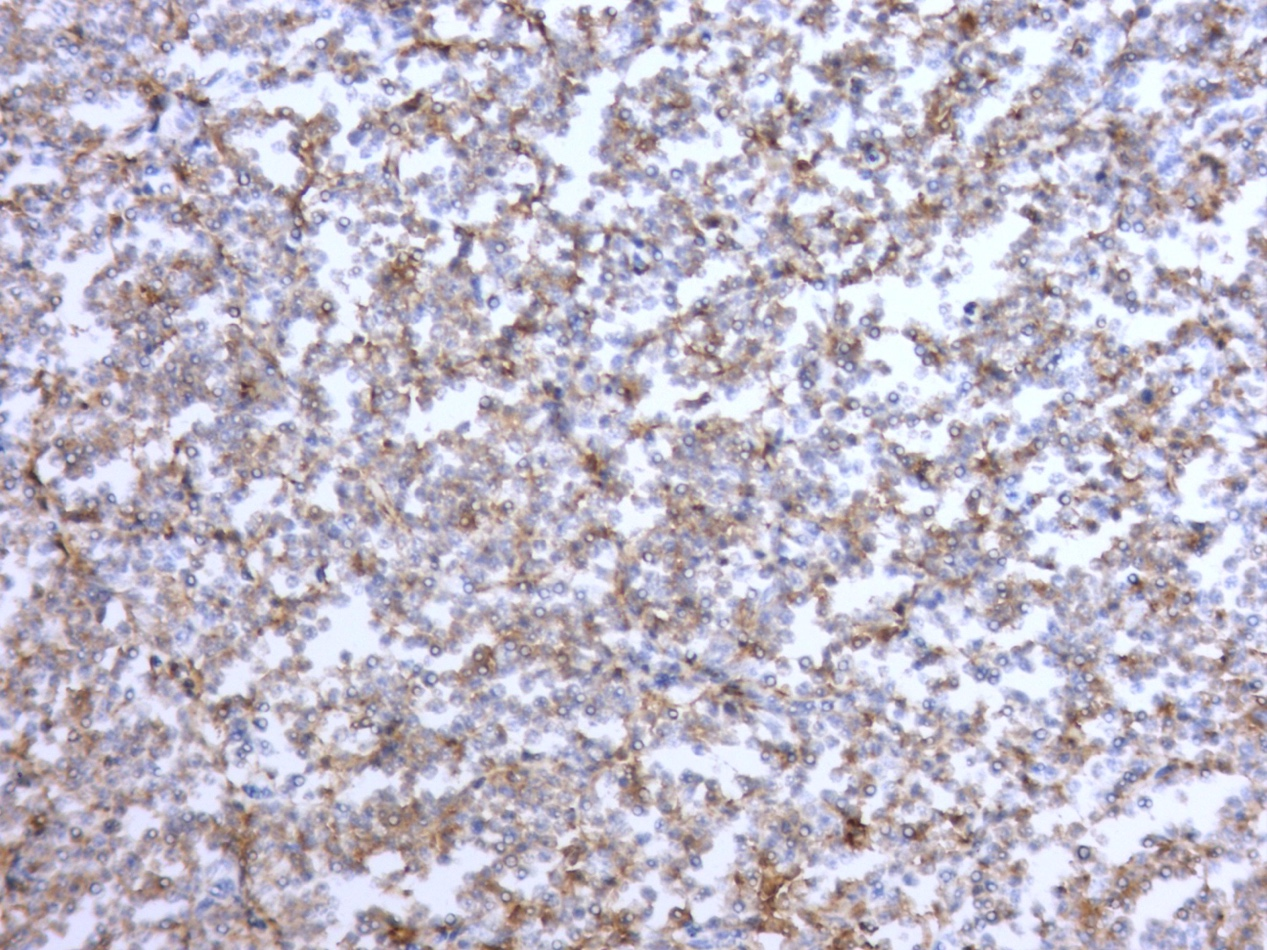 图3.CD23(+)免疫组化
图3.CD23(+)免疫组化
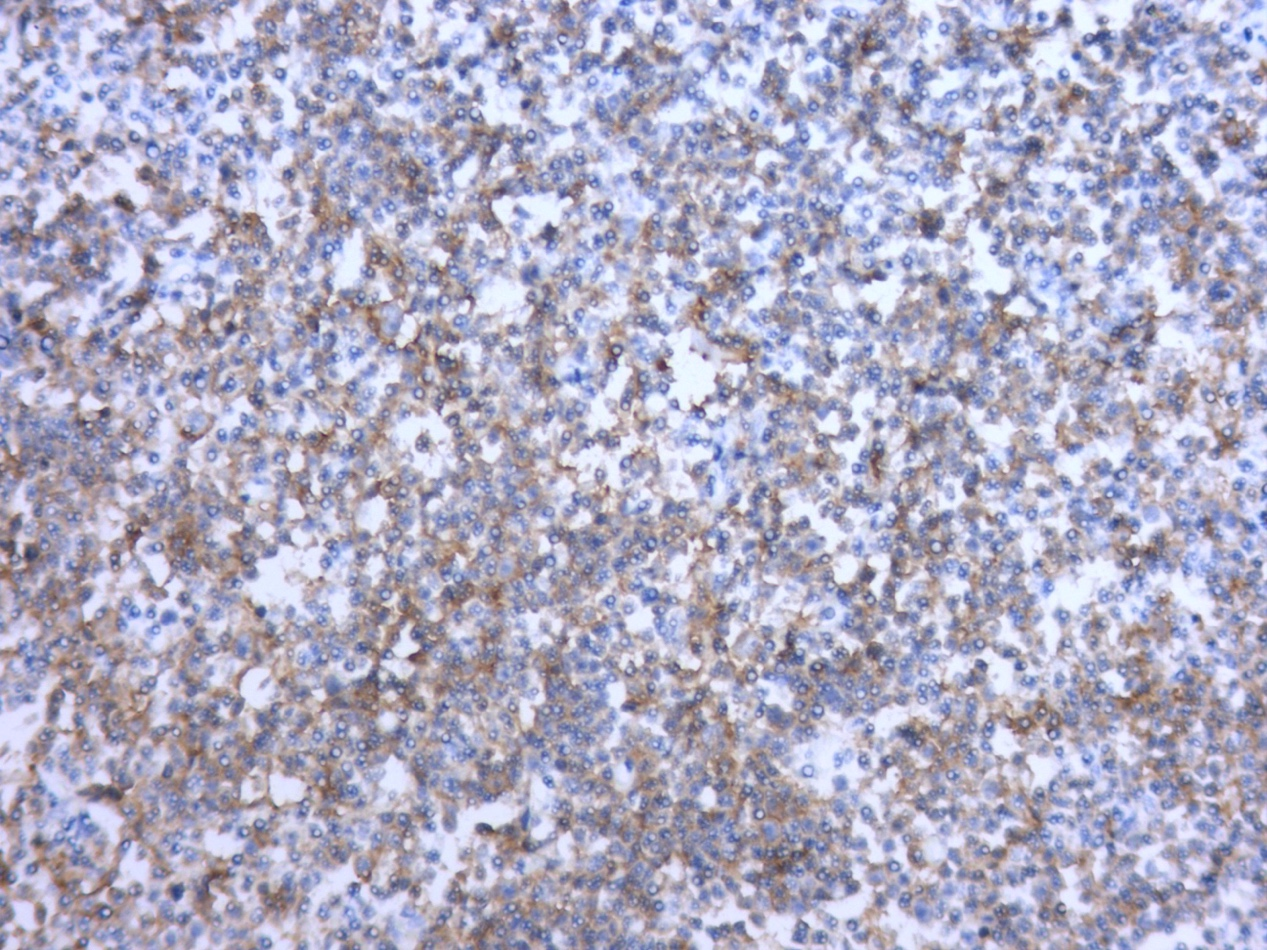 图4.CD20(+)免疫组化
图4.CD20(+)免疫组化
二、骨髓穿刺活检图片
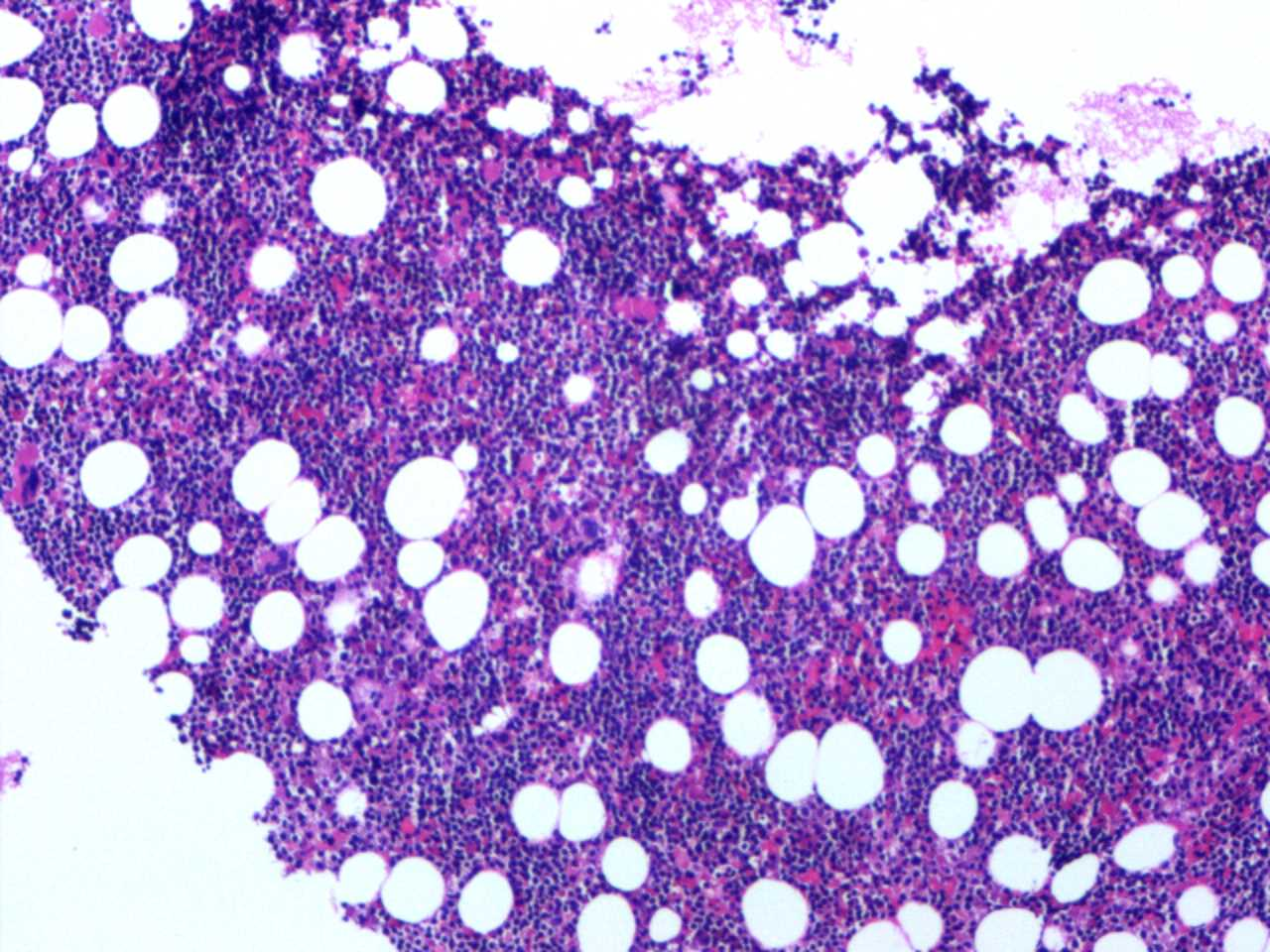 图1.病变弥漫,骨髓正常结构被破坏
图1.病变弥漫,骨髓正常结构被破坏
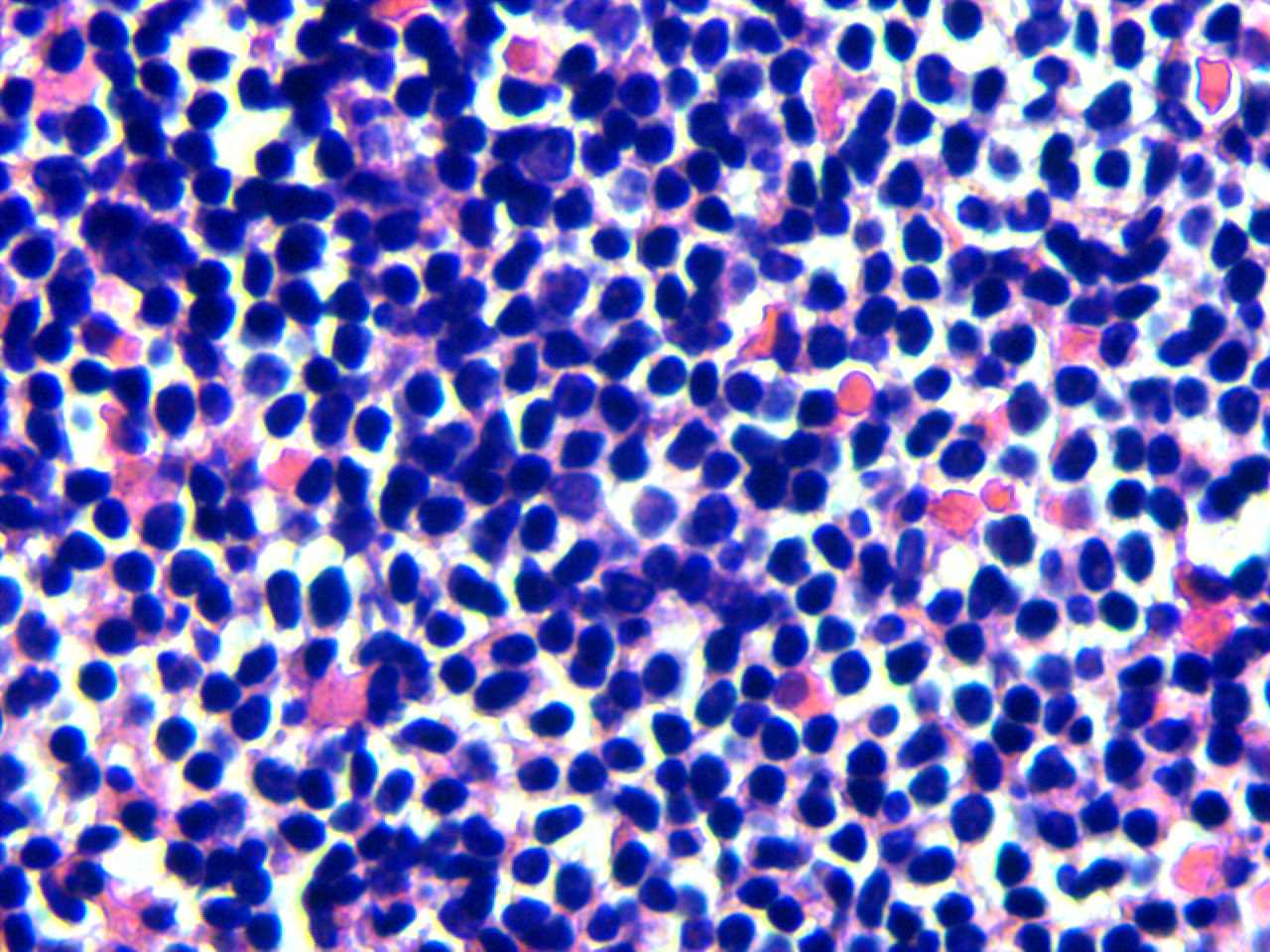 图2.肿瘤性淋巴样细胞小,核圆形或不规则,胞质少
图2.肿瘤性淋巴样细胞小,核圆形或不规则,胞质少
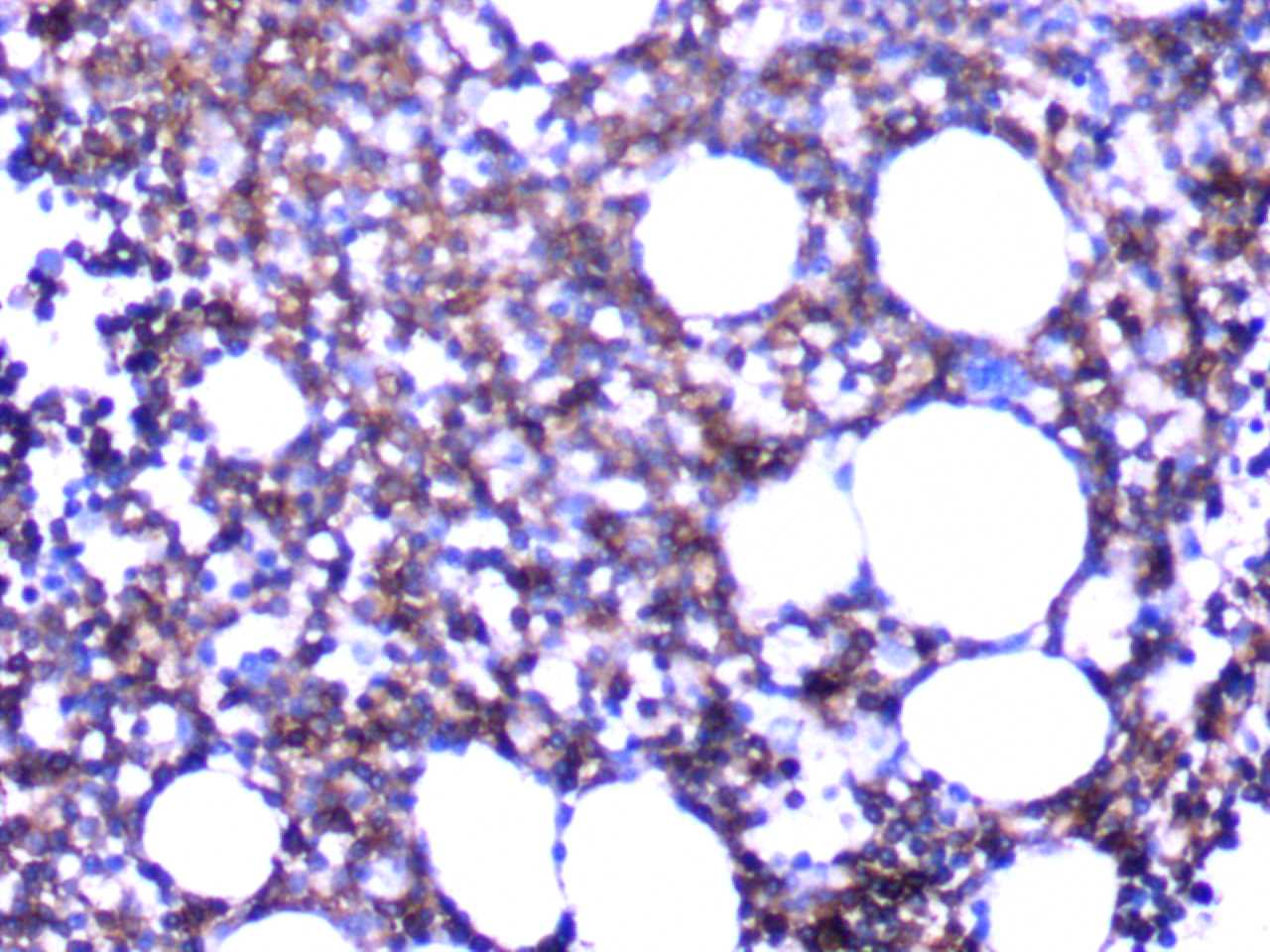 图3.CD23(+)免疫组化
图3.CD23(+)免疫组化
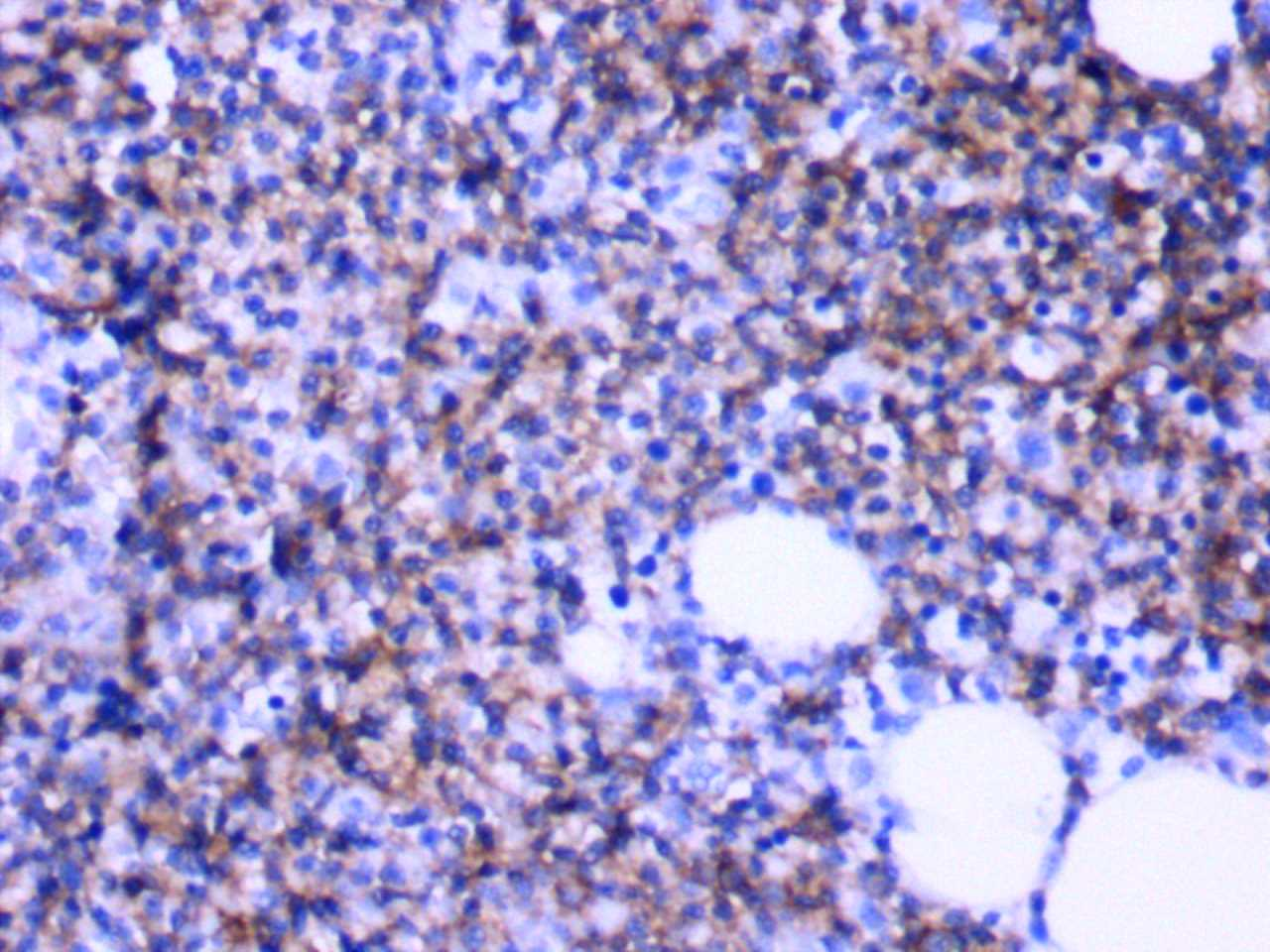 图4.CD20(+)免疫组化
图4.CD20(+)免疫组化





















共0条评论