摘要
食管癌和胃癌分别位列全球最常见癌之第五和第八。食管、胃食管交界处和胃发生的腺癌,统称为胃食管腺癌(GEA)。通过不断深入的分子研究,借助生物标记物检测,已用于定义GEA亚组,提高了有所选择的患者生存率,如HER2和Claudin18.2过表达的患者。免疫检查点抑制剂(ICI)已经彻底改变了包括GEA在内的癌症的治疗方式,但除了PD-L1表达之外尚无其他可用的生物标记物。8%~22%的非转移性GEA患者中观察到错配修复缺陷和/或高微卫星不稳定性(dMMR/MSI-H),3%~5%的转移性GEA患者也是如此,但存在异质性。对于晚期dMMR/MSI-H癌症,应推荐ICI用于一线治疗。对于非转移性dMMR/MSI-H癌症患者,越来越多的证据表明,围手术期化疗和标准辅助化疗可能不会获益。在非转移性dMMR/MSI-H癌患者中,ICI方案(不加围手术期化疗)的治疗活性很有前景,因此必须识别这个独特的亚组。我们建议对所有GEA患者诊断时进行MMR/MSI检测。
背景
通过定义性重现性基因组模式对GEA进行分子分类,这些分子分类中包括错配修复缺陷(dMMR)/高度微卫星不稳定性(MSI-H)亚组。在8%-22%的非转移性GEA和3%-5%的晚期疾病患者中观察到dMMR/MSI-H,但年龄和解剖学部位存在变异。与结直肠癌(CRC)类似,与错配修复正常(pMMR)/微卫星稳定(MSS)的疾病相比,dMMR/MSI-H提示预后更好。GEA和CRC的临床试验证实了在dMMR/MSI-H肿瘤中免疫检查点抑制剂(ICI)治疗获益,并且免疫治疗正在迅速发展。最近,在dMMR/MSI-H癌症中使用新辅助ICI已经获得支持证据。在非转移性GEA中,新辅助免疫治疗与较高的病理反应率和令人鼓舞的无事件生存率相关。
MMR生物学
DNA聚合酶在复制DNA的过程中实现了惊人的高度保真,复制错误率只有1/10万个聚合核苷酸。为了进一步降低错误率,DNA聚合酶具有一种内在的校对机制,可以识别和纠正复制错误,将错误率降低2个数量级,低达1/1000万个核苷酸。在DNA聚合酶完成新合成的DNA链后,MMR蛋白再加一层保护,通过检测、切除和修复剩余的错误(如插入、缺失和替换)。这个过程类似于文字处理中的自动更正功能。
MMR机制有几种蛋白质成分,可以简化如下。MSH2与MSH6结合,形成异二聚体,称为MutSalpha,负责识别错配和启动修复(图1)。MutSalpha在错配位点结合双链DNA,并招募其他蛋白质结合伙伴。MLH1与PMS2形成异二聚体,称为MutLalpha。MutLalpha再与MutSalpha结合,形成三聚物。通过这种结合,激活了PMS2的内切酶活性,从而诱导单链DNA断裂,最终从子代DNA链上切除不匹配的核苷酸,然后整合正确匹配的核苷酸。MMR酶将DNA复制的初始错误率降低到大约1/10亿个核苷酸。
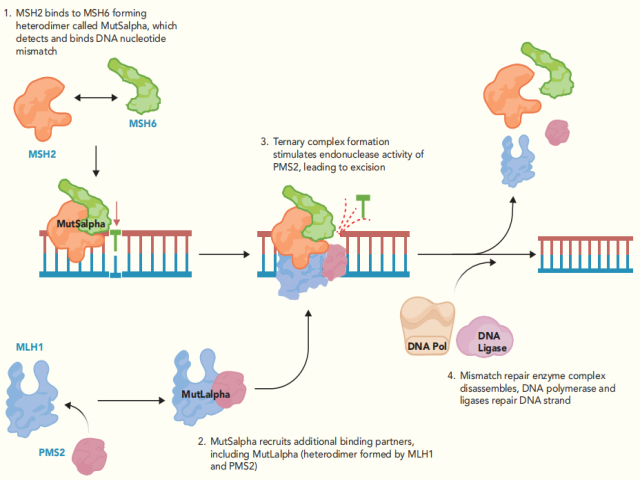
图中文字:
1.MSH2结合MSH6形成异二聚体,称为MutSalpha,它检测并结合DNA核苷酸错配
2.MutSalpha招募其他结合伙伴,包括MutLalpha(MLH1和PMS2形成的异二聚体)
3.三聚物形成,激活PMS2的内切酶活性,导致剪切
4.MMR复合体解聚,DNA聚合酶和连接酶修复DNA链
图1 正常细胞错配修复机制,重点显示MSH2、MSH6、LMLH1和PMS2的作用
dMMR/MSI-H GEA的临床病理学特征
MMR机制缺陷,可导致过量突变的积累,基因组的不稳定性增加,从而促进肿瘤的启动和增殖。在最大宗研究中,胃癌的dMMR/MSI-H频率位列第三,为19%。大约1.63%的食管癌为MSI-H,提示解剖学部位具有高度变异性。MMR缺陷可以是遗传性(Lynch综合征或家族聚集模式),也可以是散发性。
散发性病例是由MMR蛋白的功能缺失点突变或表观遗传沉默引起的,大多数GEA高突变病例都是散发性。临床上,dMMR/MSI-H GEA主要集中在老年、女性、早期(淋巴结阴性、很少内脏转移)和更远端位置(中远端胃)。组织病理学相关性包括较高的肿瘤细胞多形性、非典型生长模式、黏液特征、显著的淋巴细胞浸润和肠型(图2)。dMMR/MSI-H肿瘤更频繁地编码非自身免疫原性新抗原,从而促进肿瘤内细胞毒性淋巴细胞的募集。这是通过PD-L1和其他检查点配体的表达增加引起的,这些配体抑制免疫微环境的肿瘤破坏。
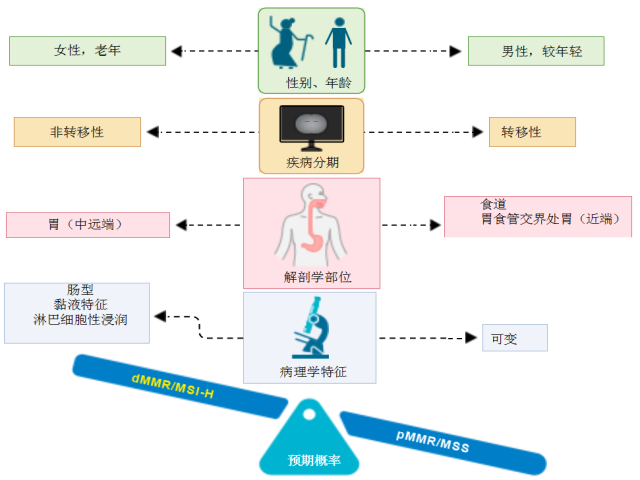
图2 dMMR/MSI-H胃食管腺癌中最常见的临床病理学特征
MMR/MSI检测
我们建议使用2023年ASCO推荐的方法。免疫组化(IHC)显示MLH1、PMS2、MSH2和MSH6失表达,可将样本归类为dMMR。逆转录酶PCR(RT-PCR)检测到微卫星片段中异常高频率的重复成分。5个标准化位点上的微卫星长度(Bethesda组合)决定了微卫星的状态。二代测序(NGS)也可以检测MSI,同时还能提供肿瘤突变负荷和其他潜在相关改变。大多数NGS检测使用组织活检或切除标本,它仍然是肿瘤分子分析的金标准。缺点是必需组织标本和检测时间长。在血浆中检测低率的等位基因突变的敏感性可能较低。循环肿瘤DNA检测(液体活检)已成为一种越来越可靠的NGS检测方法。
dMMR/MSI-H异质性是一种罕见的现象,应该加以考虑,特别是在快速进展或对ICI原发性耐药性的患者。然而,也有许多其他所谓的ICI耐药机制。因此,迄今为止还没有足够的证据支持在这种罕见的临床情况下不同的管理模式。
进展期dMMR/MSI-H GEA的临床管理(略)
非转移性疾病患者dMMR/MSI-H预后意义(略)
非转移性dMMR/MSI-H GEA和围手术期化疗或新辅助化疗(略)
非转移性dMMR/MSI-H肿瘤患者使用ICI(略)
结论和未来方向
GEA的治疗前景正越来越多地转向利用生物学上的理解来改善患者的预后。这一目标的核心是生物标记物的检测,我们预计多种生物标记物最终将影响早期管理。在确定的生物亚组中,dMMR/MSI-H GEA具有独特性。该亚组占晚期疾病患者的3%-5%,占非转移性肿瘤患者的8%-22%。该亚组的特点是预后良好,从围手术期化疗和/或辅助标准化疗中获益较少(如果有的话),同时对基于免疫治疗的方法的敏感性增加。这些差异性特征强调,在所有GEA患者中必须常规检测MMR/MSI状态,包括非转移性疾病患者。基于ICI的方法在非转移性GEA中获得了良好结果,使我们能够探索患者社区管理的常见问题,包括是否可以安全地放弃手术。
不断发展的工具,包括分子成像、无细胞DNA和内窥镜改进,可能最终使我们能够为dMMR/MSI-H GEA患者常规地提供非手术选择,我们急切地等待正在进行的研究的数据。尽管与非ICI方法相比,dMMR/MSI-H亚组中ICI的临床活性非常令人鼓舞,但耐药生物学仍然是一个治疗挑战。未来的临床和转化工作应集中于解决耐药性机制,以改善临床结果。虽然GEA仍然是一种难治的癌症,但目前和未来的合作研究和临床试验为患者带来了新的希望。















共0条评论