[导读] 译者:张波
摘要:子宫平滑肌瘤(Uterine leiomyoma,UL)是一种常见的良性肿瘤,有时仅根据形态学很难与子宫炎性肌纤维母细胞瘤(inflammatory myofibroblastic tumor,IMT)鉴别。IMT是一种肌纤维母细胞/纤维母细胞肿瘤,通常认为在子宫中罕见。其临床表现通常无特异性。大多数IMT具有间变性淋巴瘤激酶(ALK)的基因组重排,而迄今为止尚未在UL中检测到ALK基因异常。本文分析了2263个UL,其中9个(0.4%)有酪氨酸激酶活性。其中7份样本为ALK免疫阳性:6份样本具有ALK融合基因,1份样本过表达ALK转录物跳过外显子2-3,此外,1份样本具有RET融合基因,1份样本具有PDGFRB融合基因。虽然未发现复发性体细胞突变,但1例患者存在ALK种系突变。7例肿瘤呈平滑肌瘤样形态,1例瘤细胞轻度疏松,1例瘤细胞纤维状生长。6例肿瘤有轻至中度淋巴细胞浸润,3例未检测到淋巴细胞浸润。均未表现出侵袭性行为。除ALK强阳性(7/9例肿瘤)外,肿瘤的蛋白表达谱与UL相同,与其他间叶性子宫肿瘤不同。在基因表达水平上,这些肿瘤与已知的UL亚类没有完全分离。然而,维生素C代谢和上皮-间质转化途径在这些病变中独特地富集。
1.前言
UL是一种常见于绝经前妇女的良性平滑肌肿瘤,在白人中的发生率为70%。常见的症状包括腹痛、压迫和异常月经出血。 UL的分子特征相对较好,可分为几个亚型,它们具有不同的相互排斥的驱动因素变化,表现出不同的表达模式:MED12突变(占UL的70%),HMGA2过表达(10%~15%),双等位FH失活(1%)和SRCAP复合体突变(2%)。HMGA1的过度表达有时也会导致肌瘤发生,尽管它的作用不太清楚。染色体改变相对常见,包括7q的反复缺失和复杂的染色体重排。
IMT是一种比较罕见的肿瘤,偶尔也会累及泌尿生殖道。子宫IMT的常见症状也包括腹痛、压迫和异常出血;局部复发和远处转移也已被证实。对子宫间叶性肿瘤的系统性研究表明,高达0.3%的子宫间叶性肿瘤可被认为符合IMT的当前诊断标准。高达90%的子宫IMT是由影响间变性淋巴瘤激酶(ALK)的基因融合驱动的。在这些融合中,含有酪氨酸激酶结构域的ALK的3′端与高度表达基因(如TIMP 3、TNS 1或IGFBP 53)的5′端融合。除ALK外,其他酪氨酸激酶基因RET、ROS 1和NTRK 3也可能作为3′尾基因发挥作用,尽管很少。PDGFRB 3′融合在子宫外IMT中检出,在子宫IMT中未检出。到目前为止,尚未在UL中检测到影响ALK或其他酪氨酸激酶的融合基因。
IMT有3种典型的生长模式:黏液样、束状/致密和胶原化/纤维状。肿瘤也可能表现出不同生长模式的混合。典型的IMT特征包括不同程度的免疫细胞浸润、狭窄而细长的血管和不同程度的非典型性。UL与束状的IMT鉴别可能很难,因为典型的IMT特征(如炎症)可能非常少量,只存在于一小部分肿瘤中。UL和子宫IMT通常均表达肌纤维母细胞标志物(如结蛋白)。两者也都通常表现为雌激素(ER)和孕激素受体(PR)阳性。
ALK免疫组织化学(immunohistochemistry,IHC)已被用作子宫病变鉴别诊断的工具。大多数IMT为ALK免疫阳性,而其他子宫病变(包括UL)和正常子宫组织通常为ALK免疫阴性。与荧光原位杂交不同,IHC还可以检测染色体内重排诱导的过表达。然而,ALK IHC将错过含有影响ALK以外基因的融合的病例。RNA测序可用于鉴定ALK免疫阴性样本中的替代融合转录物。
正确诊断子宫病变和识别酪氨酸激酶融合是至关重要的,因为使用酪氨酸激酶抑制剂(如克唑替尼)治疗可能是治疗侵袭性IMT患者的有效替代方案。目前IMT的诊断是基于组织病理学结果,包括梭形细胞松散或致密的纤维束,伴有炎性浸润和ALK过表达(IHC显示)和/或ALK(或其他罕见)驱动因子抑制的证明。在本研究中,利用RNA测序来表征最初基于形态学诊断为UL的肿瘤的融合基因景观。其中9个肿瘤具有典型的与IMT相关的酪氨酸激酶融合基因,这些肿瘤在本文中被称为UL样IMT。利用组织病理学方法、拷贝数分析和RNA测序对肿瘤进行全面表征,并将受影响的分子途径与已知的UL亚型进行比较。
2.材料和方法
本研究前瞻性采集了6个不同医疗机构的子宫切除术患者的UL样本。诊断时患者年龄范围为36 - 48岁,中位数为43岁。最常见的临床症状是异常大量出血和痛经。随访期间(范围:41-91个月),无复发或转移。在9例UL样IMT中,5例为孤立性,4例至少与1个UL同时发生。UL样IMT的直径范围为2.5 - 9 cm,中位数为4.5 cm,通常位于粘膜下。其中1例患者(My 6274)在子宫切除术前接受醋酸乌利司他(Esmya)治疗3个月,据报告,这可缩小肿瘤大小。
使用福尔马林固定石蜡包埋切片(5 μm)进行IHC染色。总共22个肿瘤进行ALK染色,包括具有ALK融合(n=6)、ALK del 2 -3(n=1)、RET融合(n =1)、MED 12突变(n=5)和无融合基因的中等ALK表达(n=9)。染色强度评分为−、+、++或+++。还记录了信号的定位(核膜、核周、颗粒状染色质、弥漫性染色质)。所有ALK IHC阳性样本(n=7)以及RET融合样本均通过CD 10、ER、PR、结蛋白、钙调蛋白、平滑肌肌动蛋白、BCOR、细胞周期蛋白D1、HMB 45、C-KIT、DOG 1、CD 34、MIB 1、p53和FH的IHC染色进一步表征。MIB 1评分为每10个HPF的细胞数,其他染色评分为−、+、++或+++。从HE切片中分析ALK IHC阳性样本和具有RET和PDGFRB融合基因的样本的形态学特征。肿瘤类型被分类为黏液样、纤维样或平滑肌瘤样,细胞构成比例分为细胞减少、正常细胞或细胞过多。此外,还估计了样本的核形结构、核不典型性、核仁、核分裂计数(每10 HPF)、非典型核分裂、细胞凋亡、基质类型、坏死、炎症、血管、上皮样特征、营养不良变化和肿瘤边界类型。为了计算UL样IMT和UL之间的肿瘤大小差异,使用R软件包geepack(1.3-1)中的广义估计方程模型来评估来自同一患者的非独立肿瘤。假设了可交换的相关结构、二项随机分量和logit链接函数。
使用Illumina HiSeq对276例肿瘤和162例正常人进行RNA测序。使用HISAT 2(v2.1.0)将测序读数与GRCh37参考基因组进行比对。使用GATK(v.3.5或v.4.0)流水线进行变体调用。使用DESeq2(v1.22)进行差异表达分析和聚类。为了考虑离群值,计算所有基因的最大Cook距离,并且从差异表达分析中手动移除大于所有基因的95%分位数的基因。用SIFT 和Polyphen2评估RNA测序变体的影响。使用FusionCatcher v1.00对276个RNA测序样品进行融合(图1)。使用Inflamity Pathway Analysis进行典型途径分析,使用来自2项比较的500个最差异表达的基因(基于错误发现率):UL样IMT(n= 8)与子宫肌层比较以及UL样IMT与子宫肌层和UL亚型(MED12、FH和HMGA2)比较。仅HMGA1过表达或未知驱动事件的UL由于其异质性而未被考虑。使用Illumina Infinium HumanCore-24或HumanOmni 2.5-8对总共2263个肿瘤及其相应的正常子宫肌层进行单核苷酸多态性阵列分析。用Illumina GenomeStudio软件提取数据,用PennCNV调整GC波(v1.2.0)。使用BAF分割调用等位基因不平衡(AI)片段(v.1.2.0),通过将所有AI片段的长度相加,计算每个样本的AI总长度(丢失、获得、杂合性丢失),其中镜像B等位基因频率≥ 0.56。
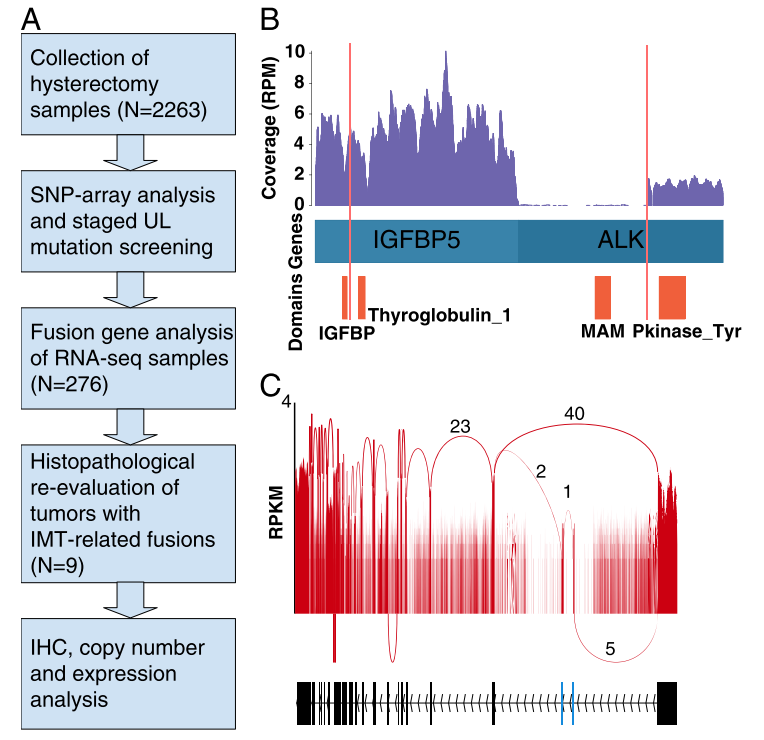
图1.A,研究的工作流程。①子宫切除术样本采集(N=2263)②SNP-阵列分析和分阶段UL突变筛查③RNA-seq样品的融合基因分析(N=276)④伴有IMT相关融合的肿瘤的组织学再评价(N=9)⑤IHC,拷贝数和表达分析
图1.B,样本My 6483 m1上的IGFBP 5-ALK融合。红色垂直线代表融合断点。C,样品My 6130 m1含有替代的框内ALK转录物ALK del 2 -3,其中外显子2和3(以蓝色突出显示)被跳过。弧处的数字表示支持外显子连接的读段的数目。覆盖率显示在y轴中。Pkinase_Tyr表示酪氨酸-激酶结构域; RPM,每百万个映射读数的读数; RPKM,每百万个映射读数的每个激酶的读数; SNP,单核苷酸多态性。
表1.UL样IMT融合基因

3. 结果
3.1融合基因的检测
研究的工作流程如图1A所示。在RNA测序的样本中,6个肿瘤具有带有ALK尾的融合转录物,并且从融合点开始显示ALK过表达(图1B)。此外,1个肿瘤过表达了跳读外显子2和3的框内ALK转录物(ALK del 2 -3)(图1C)。一个样品具有SORBS 1-RET和1个IGFBP 5 -PDGFRB融合基因(表1)。这组肿瘤(n=9)被称为UL样IMT样品。所有融合基因都经过Sanger验证。最常见的ALK断裂点位于外显子19的起始处。仅1份样本(My 6290 m3)未保留外显子19编码的ALK跨膜结构域。TNS 1和IGFBP 5在2个样品中各自是ALK的融合基因,TIMP 3和TNC在1个样品中各自是ALK的融合基因。在所有病变中,9例(0.4%)为UL样IMT。在未显示已知UL驱动基因事件(MED 12、HMGA 2、FH或SRCAP)的肿瘤中,6.6%(9/137)为UL样IMT。
3.2组织形态学特征
形态学上,与UL的最初诊断一致,UL样IMT大多数(7/9)为平滑肌瘤样。所有肿瘤均具有UL典型的肉眼外观,切面质硬旋涡状,规则边缘无出血或坏死。1例肿瘤(My 6228 m1)细胞较疏松,1例(M18 m1)呈纤维状生长(图2)。在9个肿瘤中,6个具有至少轻度的淋巴细胞炎性浸润,并且这些肿瘤中的2个具有>20个淋巴细胞/HPF。5例肿瘤为细胞或细胞过多,1例(M18 m1)为细胞过少。其中三个样本显示出轻度的核异型。然而,所有样本均显示低有丝分裂计数,无非典型核分裂、凋亡或坏死。
对所有具有ALK融合基因的样品(n = 6)和ALK del 2 -3样品(n = 1)进行ALK蛋白的IHC染色。所有这些都是阳性的,范围从部分细胞的强阳性到强的整体阳性(图3)。携带ALK del 2 -3(My 6130 m1)的样本在RNA水平上存在中度ALK过表达,但在IHC中显示强阳性。在RNA-seq中具有全长ALK转录物的中度过表达的UL是IHC阴性的(n = 9)(图3)。对所有可用的IMT(n= 8)进行ER和PR染色,所有IMT均显示这2种标志物阳性。1个肿瘤(M18 m1)无法进行IHC染色。除了My 6483 m1外,所有样品的平滑肌标志物结蛋白和钙调蛋白均为阳性,My 6483 m1对结蛋白呈强阳性,但对钙调蛋白呈阴性。还对样本进行了CD 10、BCOR、细胞周期蛋白D1、CD 34、HMB 45、C-KIT(CD 117)和DOG 1染色。结合组织形态学,这些阴性染色结果排除了包括子宫内膜间质肉瘤,血管周围上皮样肿瘤,胃肠道间质瘤和皮肤纤维肉瘤样肿瘤(COL 1A 1/PDGFB易位相关肉瘤)的诊断。所有样本均为FH非缺陷型,MIB 1评分范围为1 - 15/10个HPF,并具有野生型p53表达。

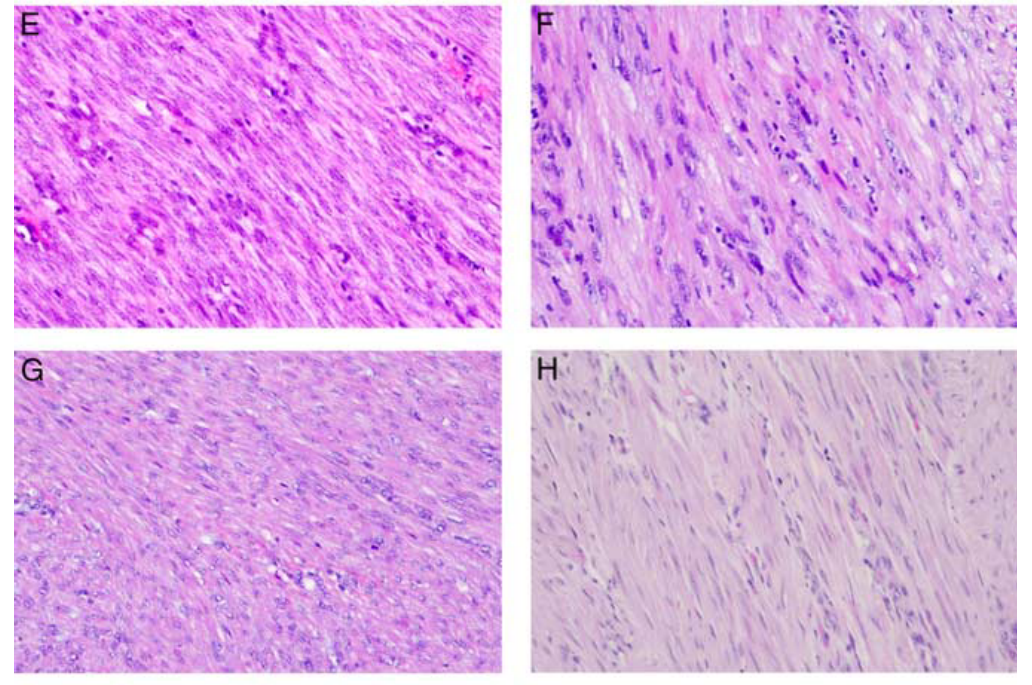
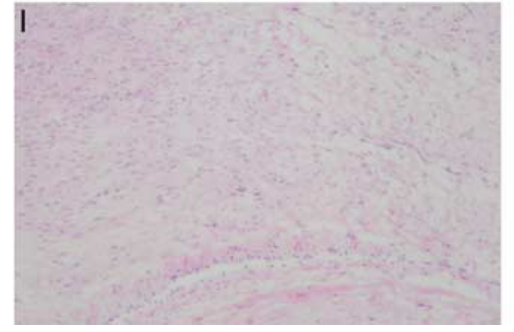
图2.IMT样本的形态学特征(HE染色)。A,My6290m3(TNS1-ALK)。B,My6428 m3(TNS1-ALK)。C,My6274m1(IGFBP5-ALK)。D,My6483m1(IGFBP5-ALK)。E,My6093m1(TIMP3-ALK)。F,My6228m1(TNC-ALK)。G,My6130m1(ALK del 2 -3)。H,My6047m6(SORBS1-RET)。I,M18m1(IGFBP5-PDGFRB)。观察到的炎症主要是淋巴细胞,范围从不显著(My 6130 m1,My 6428 m3)到强烈(My 6228 m1)。

 图3.ALK IHC。A,My 6290 m3(TNS 1-ALK融合,+ALK IHC [100%细胞])。B,My 6428 m3(TNS 1-ALK,++ ALK IHC [80%的细胞])。C,My 6274 m1(IGFBP 5-ALK,+ALK IHC [10%细胞])。D,My 6483 m1(IGFBP 5-ALK,+ALK IHC [30%细胞])。E,M6093 m1(TIMP 3-ALK,+ALK IHC [100%细胞])。F,My 6228 m1(TNC-ALK,+ALK IHC [50%细胞])。G,My 6130 m1(ALK del 2 -3转录物,+在ALK IHC中[10%的细胞])。H,My 6229 m4,在RNA水平上具有中度ALK表达但ALK IHC阴性的UL样本。
图3.ALK IHC。A,My 6290 m3(TNS 1-ALK融合,+ALK IHC [100%细胞])。B,My 6428 m3(TNS 1-ALK,++ ALK IHC [80%的细胞])。C,My 6274 m1(IGFBP 5-ALK,+ALK IHC [10%细胞])。D,My 6483 m1(IGFBP 5-ALK,+ALK IHC [30%细胞])。E,M6093 m1(TIMP 3-ALK,+ALK IHC [100%细胞])。F,My 6228 m1(TNC-ALK,+ALK IHC [50%细胞])。G,My 6130 m1(ALK del 2 -3转录物,+在ALK IHC中[10%的细胞])。H,My 6229 m4,在RNA水平上具有中度ALK表达但ALK IHC阴性的UL样本。
3.3突变与AI
UL样IMT中AI的总长度具有非常高的变异性,每个样本范围为0 bp至329 Mbp。样本具有很少的复发AI片段。3份样本在chr 2重叠ALK(2 p23)中存在广泛拷贝数变化。一个ALK融合样本(My 6290 m3)经历了染色体碎裂和2号染色体的完全粉碎(图4A)。在2个样品中检测到2号染色体的更进一步重排,包括获得和丢失:My 6428 m3和My 6228 m1(图4 B)。在5′融合基因中,TNS 1和IGFBP 5也位于2号染色体。My 6228 m1和My 6428 m3在9号染色体上有较大的染色体增益;TNC是My 6228 m1中ALK的融合基因,位于9号染色体上。My 6047 m6在20号染色体上有整条染色体增加,而My 6483 m1和My 6228 m1分别在20号染色体上有短片段的杂合性缺失和染色体增加。此外,基于RNA测序数据和Sanger验证,发现患者My 6274在外显子29中携带杂合种系ALK错义突变;Gly 1552 Trp,G>T(rs771570579)(图4C)中报告。
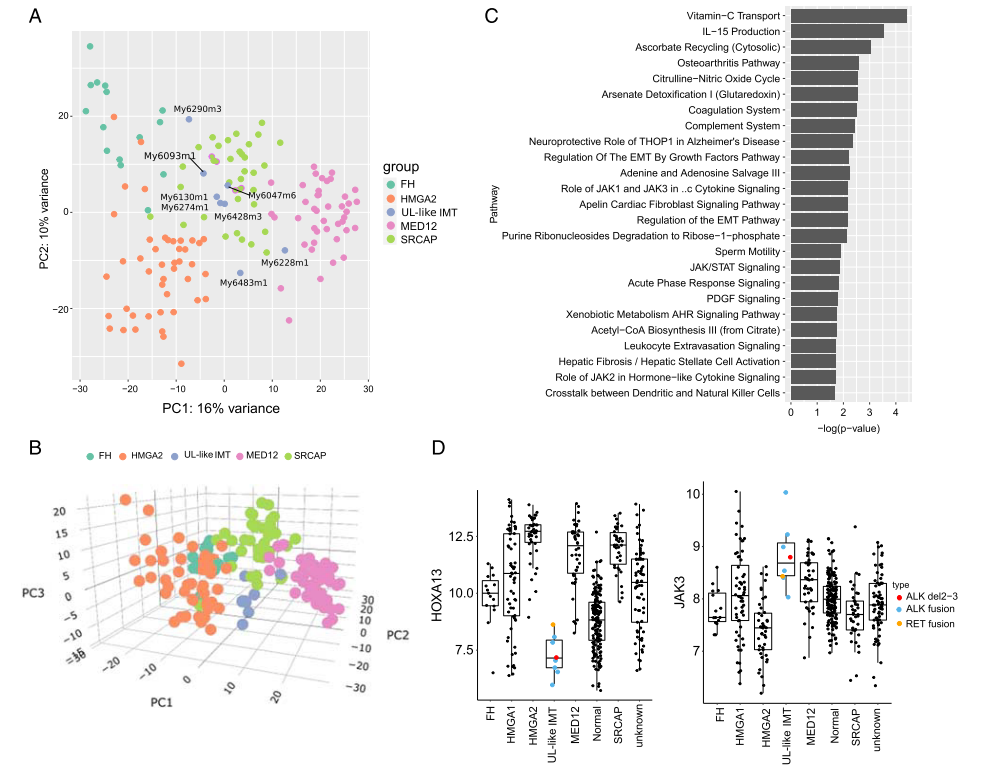 图4.A,主成分分析基于500个最易变的基因。B,显示PC 1至PC 3的500个最可变基因的主成分分析。C,与正常子宫肌层、MED12、HMGA2、FH和SRCAP肿瘤相比,IMT中最丰富的经典通路。D,HOXA 13(左)和JAK 3(右)在IMT、正常子宫肌层和不同UL亚型上的表达。
图4.A,主成分分析基于500个最易变的基因。B,显示PC 1至PC 3的500个最可变基因的主成分分析。C,与正常子宫肌层、MED12、HMGA2、FH和SRCAP肿瘤相比,IMT中最丰富的经典通路。D,HOXA 13(左)和JAK 3(右)在IMT、正常子宫肌层和不同UL亚型上的表达。
3.4UL样IMT中激活的通路
在主成分分析和无监督分层聚类中,UL样IMT倾向于与UL亚型分离,尽管分离不完全。特别是SRCAP UL与UL样IMT有些相似(图1A和1B)。当将UL样IMT与正常子宫肌层以及MED12、HMGA2、FH和SRCAP UL进行比较时,存在维生素C转运的显著激活和抗坏血酸盐再循环的失调。上皮间质转化(EMT)相关途径也在UL样IMT中富集(图4C)。JAK-STAT信号传导,一种可以激活EMT的途径,也在UL样IMT中富集,并且在基因水平上JAK 3过表达(图4D)。在UL样IMT与子宫肌层的比较中,多种细胞外基质(ECM)相关途径富集。当分析在子宫肌瘤发生中重要的基因时,在大多数UL中显著上调的HOXA 13 32在所有研究的UL样IMT中下调(图4D)。HMGA 2在UL的HMGA 2亚型中独特地过表达,显示轻微的也在UL样IMT和HMGA 1中的过表达,其上调也可被归类为UL驱动事件,在多种UL样IMT中显示高表达。在所有肌瘤亚型中上调的SATB 2在UL样IMT中表现出异质性表达模式。
4. 讨论
在这项研究中,分析了一组2263例最初诊断为UL病例的形态学特征。总的来说,这些病变中有9例(0.4%)携带IMT相关酪氨酸激酶融合基因,被称为UL样IMT。基于ALK IHC和IMT提示形态学特征,0.3%的子宫肌瘤被重新分类为IMT。所有解剖部位的IMT复发率约为25%。预测子宫IMT行为的组织病理学标准描述不完全。直径(>7cm)、显著的核分裂、淋巴管浸润、高核分裂计数(>10/10HPF)和肿瘤坏死与不良结局相关。本系列中的一个肿瘤较大(9cm),但未观察到其他不良预后因素。IMT复发的风险与肿瘤切除的完整性有关。子宫IMT通常行全子宫切除术切除。平滑肌瘤样IMT的明显良性行为可能会引起人们对正确诊断该实体的重要性的质疑。由于迄今为止描述的平滑肌瘤样IMT数量相对较少,并且随访时间有限,因此不可能进行真实的风险评估。值得注意的是,1例患者接受了选择性PR调节剂醋酸乌利司他(一种可用于治疗UL的药物)治疗,患者为孤立性肿瘤并在治疗期间缩小。
具有全长ALK转录物中度过表达的UL未显示ALK免疫阳性。然而,本研究分析中的一种肿瘤表达了一种跳读外显子2和3的框内ALK变体转录本,并且在一个细胞亚组中具有强ALK IHC阳性。这种转录变体以前曾在神经母细胞瘤中报道过,这是另一种肿瘤类型,其中ALK过表达与肿瘤发生有关。Antonescu等人检测到6例ALK融合阴性IMT伴阳性IHC,并提出了ALK激活的可能替代机制。尽管还需要进一步的研究,但观察到的ALK del 2 -3转录本可以解释此类病例子集中的ALK激活。
与子宫IMT的典型情况一样,除1例(My6290m3)ALK融合病例外,其余36例均保留ALK跨膜结构域。其中一个样本(My6093m1)显示出罕见的连接TIMP 3的外显子1与ALK的外显子12的融合。通常,ALK断裂点位于外显子19,不常见断裂点的可能作用仍有待研究。所有样本均具有相似的颗粒状细胞质ALK染色模式。ALK的融合基因在样本集中变化,包括新的融合基因腱生蛋白-C(TNC)。TNC编码ECM蛋白,并且其在平滑肌组织中高度表达。TNC以前与转移和组织重塑有关,并且据报道它是非小细胞肺癌中NRG 1的融合基因。本文报道的其他ALK融合基因以前曾在IMT中报道过。除ALK外,本文数据集中的2种肿瘤还存在其他酪氨酸激酶融合。SORBS 1-RET融合基因在肺癌中有特征性表达,但在IMT中没有。PDGFRB融合基因先前已经被在腹膜和肺的IMT中有报道,但在子宫IMT中没有报道。有趣的是,IGFBP5(此处为PDGFRB和ALK的融合基因)被认为在UL中发挥作用,其中编码切割IGFBP5的蛋白质的基因过表达。总之,这项研究突出了子宫ITM融合基因景观的异质性。
在UL中,染色体断裂很少发生,而更细微的染色体改变相对常见,特别是在MED12野生型病变中。在IMT中,在少数转移性肿瘤中检测到复杂的染色体重排,包括染色体断裂。在本研究中,1例ALK IHC强阳性的肿瘤(My6290m3)显示携带ALK的2号染色体的明显染色体断裂。然而,肿瘤没有表现出攻击性行为,具有正常的细胞结构,低有丝分裂计数,边界清楚,p53免疫组化染色正常。未检测到UL典型的染色体改变,如7q缺失。
在当前研究中,1例患者发生ALK种系突变。这提出了一个有趣的可能性,即IMT的生殖系易感性。有趣的是,突变携带者的母亲被诊断出患有低级别子宫内膜癌。种系ALK突变与家族性神经母细胞瘤和髓母细胞瘤有关。这些突变影响蛋白质的酪氨酸激酶结构域。在本研究数据集中,ALK种系突变位于基因的C末端,其可能的意义需要进一步研究。
通过同时比较UL样IMT与UL和正常子宫肌层,我们观察到UL样IMT中激活的EMT和JAK-STAT通路。先前已经表明,EMT也在EML 4-ALK融合的肺癌中被激活。类似地,JAKSTAT通路与ALK过表达的肺癌有关。因此,ALK过表达在这些不同的肿瘤类型中引起类似的下游效应。维生素C代谢相关途径也在UL样IMT中被激活,并且这些途径中的许多基因(如GJB 2)与癌症有关。维生素C代谢也已显示在MED 12 UL中在基因表达和代谢组学水平上发生改变,并具有维生素C抗氧化作用激活的预测效应。在聚类中,UL样IMT样本显示与SRCAP突变的肿瘤最相似,可能是因为在SRCAP UL中观察到中度ALK过表达。当比较UL样IMT与正常子宫肌层时,ECM相关通路出现。UL的特征在于ECM的异常沉积和许多相关途径的失调,表明ECM是所有研究的肿瘤类别中的关键因素。
与UL的最初诊断相一致,大多数(7/9)酪氨酸激酶融合阳性肿瘤的形态学特征为平滑肌瘤样,呈束状生长模式。此外,3例肿瘤没有炎症,使得基于形态学特征的IMT诊断是不可能的。虽然在这里收集的样本和最初诊断为IMT的样本之间的确切数字很难比较,但似乎在子宫中,经典IMT可能不如UL样IMT常见。平滑肌标志物desmin和caldesmon在所有肿瘤中均呈强阳性,但My 6483 m1的caldesmon染色为阴性。如前所述,本研究的UL样IMT样本也为ER和PR阳性。这些标志物通常在苗勒管衍生肿瘤中呈阳性,但在子宫外IMT中不呈阳性。这表明子宫和子宫外IMT的细胞来源可能不同。
本研究中的肿瘤均由妇科病理学经验丰富的病理学家检查,所有肿瘤均主要归类为普通型或富于细胞性平滑肌瘤。它们被鉴定为UL样IMT只是因为肿瘤进行了分子分析,尽管其中大多数(7/9)仅通过ALK IHC发现。然而,在常规诊断中,对所有UL进行ALK IHC是不切实际的。具有粘液样特征和/或显著炎症浸润的病例应接受ALK IHC。它也可能是有益的一部分,用于诊断子宫间叶肿瘤与不寻常的形态学特征的一组标记物。目前关于这些酪氨酸激酶阳性UL样肿瘤的临床行为的信息不足,需要对随访时间较长的大型材料进行研究。
本文描述的酪氨酸激酶融合阳性肿瘤与普通UL的形态学和免疫特征(大多数情况下ALK除外)之间的相似性,提出了正确分类这些肿瘤(IMT或UL)的问题。最新的WHO肿瘤分类:女性生殖器肿瘤(第五版,2020)对IMT的定义如下:“原发性:具有粘液样和束状生长的温和梭形细胞;淋巴浆细胞性炎症; ALK IHC表达(罕见例外)。理想:ALK重排。”该定义强调了形态学的重要性,ALK重排是次要标准,这是合理的,因为ALK重排并非见于所有IMT,ALK重排可见于多种其他肿瘤类型。在数据分析中,基于最可变的基因的表达水平,没有看到UL和UL样IMT的完美分离。相反,子宫肌瘤发生的重要基因,如HOXA 13,在UL和UL样IMT之间差异表达。需要比较UL和IMT的分子特征与侵袭性临床病程和/或明确的IMT形态,以正确分类UL样IMT。
点此下载原文献





















共0条评论