[导读] 作者:游乐园
患者男性,34岁。患者3周前无明显诱因出现肛门部疼痛且迁延不愈,局部皮肤红肿、皮温较高、压痛明显,不伴里急后重,不伴大便带血、腹痛、腹泻、畏寒、发热等不适,无其它特殊不适。专科体检:截石位6点钟方向可见大小约12×11×10cm包块,不可推动、未扪及明显波动感,局部红肿、质硬、皮温高,皮肤表面可见脓点形成,尚未破溃、未见流血流脓。辅助检查:B超浅表包块示膝胸卧位肛门6点钟方向混合回声,考虑肛周脓肿可能。盆腔MRI示直肠下段及肛管直肠下段及肛管左后壁旁呈大团片状影,最大层面约为13.8cm×5.34cm×4.76cm,周围脂肪间隙模糊呈异常信号。血常规:淋巴细胞数0.25(109/L)↓,血红蛋白96.00(g/L)↓,白细胞2.76(109/L)↓,血小板107(109/L)↓,红细胞3.36(1012/L)↓;流式细胞(CD4/CD8/CD3):T淋巴细胞(CD3)绝对值214(细胞个数/uL)↓,CD4百分比4(%)↓,CD4绝对值9(细胞个数/uL)↓,CD8绝对值196(细胞个数/uL)↓;HIV-1病毒载量(RT-PCR)6.35E+5(拷贝/ml)↑;白蛋白低于30g/L;肿瘤标志物、肝肾功、电解质未见明显异常;隐球菌抗原、马尔尼菲抗原、结核抗体均为阴性。考虑:1、肛周脓肿;2、肛瘘;3、人类免疫缺陷病毒阳性;4、肿瘤尚不能完全除外。入院后给予肛周脓肿切开引流术+复杂肛瘘挂线术,术中尽可能清除坏死组织及脓液,术后予以头孢哌酮钠舒巴坦钠抗感染治疗,胸腺法新及核糖核酸用于增强免疫力,高乌甲素止痛,白蛋白输注等对症支持治疗,密切观察病情变化。术后第四天,患者诉腹胀,可忍受,肛门有排气排便,完善腹部立卧位片,提示肠梗阻,予以禁食水、胃肠减压、营养支持等对症处理,诉腹胀减轻,排少量稀大便,小便正常。查体:腹部无明显压痛、反跳痛、肌紧张,叩诊鼓音,无移动性浊音,肠鸣音弱,1次/分。后复查腹部X线片仍可见多个长短不一气液平面,提示肠梗阻未完全解除;腹部B超示右侧腹见前后径约2.7cm的无回声区,左侧腹见前后径约3.0cm的无回声区,下腹部见前后径约1.7cm的无回声区。经感染科、消化内科及肿瘤科会诊,行肠镜检查及全身骨扫描。
病理检查 巨检:(肛周)褐色组织一堆,总体积约5.5×3.2×1.0cm,切面褐色、质软。(直肠)灰红组织三粒,最大径约0.3-0.4cm。镜检:送检组织原有正常结构被破坏,肿瘤细胞弥漫浸润或呈结节状生长,中等偏大,免疫母样或浆母细胞样,细胞核圆形或卵圆形,胞质丰富嗜碱性,核仁明显,可见星空现象,核分裂象易见。免疫组化:CD38、CD138、MUM-1、EBER、P53、c-MYC阳性,CD20、PAX-5、CD3、CD5、CD10、BCL-6、BCL-2、CD21、CK、CyclinD-1阴性,Ki-67增殖指数约90%。病理诊断:浆母细胞性淋巴瘤。
患者有HIV/AIDS的既往病史,未进行抗逆转录病毒治疗,CD4水平极低,导致免疫力低下,生命体征不稳,为快速降低HIV-RNA,予以3TC/TDF/DTG+ABT联合抗HIV治疗,并同时予以ECHOP(依托泊苷、多柔比星脂质体、长春新碱、环磷酰胺、甲强龙)方案化疗,拟定疗程5天。第一个疗程结束10日后,患者出现发热、极度乏力、贫血貌、纳差、腹泻、精神极差、甲床紫绀、肢端冰凉、呼吸急促,血压74/45mmHg,予以心电监测、无创呼吸机辅助呼吸、多巴胺升血压、复方电解质等补液抗休克、葡萄糖注射液提高渗透压。抢救2小时后,患者出现意识丧失、血压快速下降、对光反射消失、呼之无反应,患者父母放弃抢救及治疗。
讨论 浆母细胞性淋巴瘤(PBL)是一种罕见的CD20阴性侵袭性高级别B细胞淋巴瘤,最初被认为是具有浆母细胞分化的弥漫性大B细胞淋巴瘤的一个亚型,目前,WHO将PBL作为一种独特的成熟B细胞淋巴瘤,归于免疫缺陷相关非霍奇金淋巴瘤,占HIV相关淋巴瘤的2%[4]。Delecluse等于1997年首次在16例高度恶性弥漫性大B细胞淋巴瘤的口腔报告中报道该疾病,16名患者中有15名患者HIV阳性[1]。此后不久,越来越多的HIV阴性病例被报道,多与自身免疫性疾病、器官移植、恶性肿瘤病史、年龄增加有关,部分病例可无免疫抑制的证据。PBL发病机制复杂,目前认为与病毒感染及一系列分子信号通路异常有关,其起源细胞被认为是浆母细胞,一种源自活化B细胞的前体浆细胞,HIV和EBV感染是影响该病发生的主要危险因素[1]。EBV被国际癌症研究机构(IARC)归类为人类致癌物,是一种γ疱疹病毒,在口咽上皮中感染静止期的B细胞,使其转化为淋巴母细胞,病毒糖蛋白gp350/220与细胞表面分子CD21相互作用,改变信号通路,将潜伏蛋白下调,不表达病毒蛋白,使受感染的细胞逃避免疫识别,同时EBV还可通过病毒编码的微RNA(miRNA)感染T细胞及NK细胞,抑制白细胞介素12(IL12)的释放,降低CD4/CD8T淋巴细胞及NK细胞对感染的免疫控制,故EBV可在记忆B细胞中建立终生的潜伏感染[5-7],据报道,EBV在75%的HIV相关病例中呈阳性,尽管大多数人携带病毒后并没有临床症状,但EBV的长潜伏期和再激活会导致各种淋巴组织增生性病变,且与一般人群相比,EBV更有可能在因HIV、医源性免疫抑制或年龄增加导致免疫系统受损的个体中引起血液系统恶性肿瘤[8]。HIV利用宿主CD4T淋巴细胞趋化因子受体进入宿主细胞,在宿主细胞基因组中进行自我整合及自我复制,CD4T细胞数量急剧降低,宿主免疫反应出现异常,同时它对树突细胞、单核细胞及其他淋巴细胞具有趋向性,从而导致HIV相关淋巴组织增殖性疾病的风险显著增加[9]。HIV刺激淋巴细胞释放IL-6、IL-10、TNFα、IFNα,这些细胞因子的过度表达有助于B细胞的激活、分化[12]。B淋巴细胞个体发生的染色体易位和突变也可能促进肿瘤的发生,BCL-2、BCL-6、MYC是常见的易位目标,多与免疫球蛋白重链相关,使原癌基因片段转移到免疫球蛋白基因下游的位点,而不是原始调控区域,导致基因表达及蛋白质表达增加,影响细胞周期及存活,其抗凋亡作用有利于转化细胞的存活,有助于致癌作用[10-11]。PBL好发于男性,男女比例约为3:1,中位发病年龄为50岁[13],口腔是最常见的部位,其他部位包括胃肠道、鼻腔、泌尿生殖道、中枢神经系统、皮肤、肺、肝脏、眼眶等,淋巴结受累较少见,临床常表现为局限性肿块,影像学检查无特异性,临床分期晚,进展快,侵袭性强,患者生存率低[2-4]。
目前认为PBL的起源细胞是终末分化的B细胞,显示浆细胞免疫表型,在这一分化过程中出现的不同的形态学和免疫表型与其他淋巴造血系统淋巴瘤鉴别诊断困难,故PBL的诊断并不容易。在组织学上,肿瘤细胞弥漫生长,形态较单一,呈免疫母细胞样或浆母细胞样,细胞核圆、染色质粗、核仁明显、丰富的嗜碱性细胞质,常见星空现象和大量凋亡小体,有丝分裂活跃,可见大片坏死。PBL的特征性免疫表型是表达一种或多种浆细胞标志物包括:CD38、CD138、MUM1、BLIMP1(B淋巴细胞诱导成熟蛋白1)、×BP-1(×-盒结合蛋白1),B细胞抗原的缺失,包括CD20和PAX5,CD45、CD79α弱表达或缺失,Ki-67增殖指数高,反映了它们的侵袭性,75%的病例表达EBER,少数病例有Bcl-2、MYC重组及Ig轻链和重链基因克隆性重排[4,14]。
PBL临床罕见,易与以下几种疾病混淆。(1)免疫母细胞型弥漫大B细胞淋巴瘤:组织学形态与PBL相似,但免疫表型不同,通常表达CD20、PAX5、CD45。(2)浆细胞性骨髓瘤(PCM):组织学形态及免疫表型与PBL相似,但PCM无免疫抑制病史,EBER阴性,血清电泳检测到单克隆免疫球蛋白,尿液含有本-周氏蛋白,影像学有溶骨性破坏。(3)其他:ALK阳性弥漫大B细胞淋巴瘤、原发性渗出性淋巴瘤、伯基特淋巴瘤、HHV阳性的大B细胞淋巴瘤:与PBL的主要鉴别点包括HIV、EBV的感染,受累部位、免疫抑制状态,B细胞、浆细胞、白细胞共同抗原的免疫表型,谨慎、明智的使用免疫标记及完整的临床病史对于支持PBL的诊断非常有用,尤其是对于HIV阴性的患者[4]。
该疾病的罕见性意味着随机研究并不常见,单中心或小系列研究提供了有关疾病特征的部分数据,确诊时通常为晚期(III期或IV期),预后较差,中位总生存期为6-19个月[15-16],HIV阳性和HIV阴性患者之间没有明显差异,不良预后主要取决于高龄、机体状态、国际预后指数(IPI)评分、化疗反应、EBV阳性状态、MYC基因重排、是否进行抗逆转录病毒治疗[17],PBL尚没有特定的标准治疗方法,缺乏治疗选择的前瞻性临床试验,现在多根据小型回顾性病例报告进行治疗。CHOP(环磷酰胺、多柔比星、长春新碱和泼尼松)被认为是不够的,现多采取EPOCH(依托泊苷、环磷酰胺、多柔比星、长春新碱和泼尼松)、hyper-CVAD(超分割环磷酰胺、多柔比星、长春新碱和地塞米松)、CODO×-M/IVAC(环磷酰胺、多长春新碱、剂量的甲氨蝶呤/异环磷酰胺、依托泊苷和大剂量阿糖胞苷)等强化化疗方案,一些老年患者并不能耐受强化治疗方案,但对年轻患者是有效的[18]。抗骨髓瘤药物如硼替佐米和来那度胺联合CHOP或强化化疗方案可实现PBL的完全和持久的缓解,多用于难治性复发患者[19]。有报道免疫抑制剂替雷利珠单抗联合来那度胺可成功治疗难治性PBL,一名76岁女性患者,有EBV感染史,HIV、CMV等血清学均为阴性,患者接受了CHOP加硼替佐米治疗方案,一周后症状没有改善,于第二周开始使用抗PD-1抗体替雷利珠单抗联合来那度胺,治疗18个月后,患者仍处于完全缓解状态,在整个治疗过程中,她的肝、肾和甲状腺功能保持正常[21]。这是首个用免疫抑制剂加来那度胺成功治疗的难治性PBL病例,虽然只是一个案例报告,但它增加了目前有限的PBL文献,为PBL的治疗提供了新的方案,作用机制及治疗方法的的推广,仍需进一步的研究,需要更大的患者群体,但免疫抑制剂加来那度胺或许可使部分PBL患者获益。自体干细胞移植(ASCT)、异基因造血干细胞移植(allo-HSCT)在巩固治疗或挽救治疗时可能会改善结果,虽然有个案报道一名52岁HIV阴性男性患者,行异基因造血干细胞移植后无病生存4年[20],但总体而言,其治疗PBL的疗效仍不理想,复发后患者的生存率非常低。
由于PBL病例罕见,可用数据非常少,且现有疗法疗效低,PBL患者的结局通常是不理想的,因此,需要新的治疗方式及药物来改善PBL患者的预后,前瞻性临床试验以得出明确的结论是有必要的。
参考文献:
[1]Delecluse HJ,Anagnostopoulos I,Dallenbach F,et al.Plasmablastic lymphomas of the oral cavity:a new entity associated with the human immunodeficiency virus infection[J].Blood,1997,89(4):1413-1420.
[2]Cao C,Liu T,Lou S,et al.Unusual presentation of duodenal plasmablastic lymphoma in an immunocompetent patient: A case report and literature review[J].Oncol Lett,2014,8(6):2539-2542.
[3]Tille JC,Pelte MF,Schwartz J,et al.Plasmablastic lymphoma clinically presenting in the urinary tract[J].Ann Diagn Patho,2012,16(3):219-23.
[4]Swerdlow SH,Campo E,Pileri SA,et al.The 2016 revision of the World Health Organization classification of lymphoid neoplasms. Blood. 2016,127(20): 2375–2390.
[5]Liudmila S Chesnokova,Ru Jiang,Lindsey M Hutt-Fletcher.Viral Entry[J]. Curr Top Microbiol Immunol,2015,391:221-35.
[6]David A Thorley-Lawson.EBV Persistence--Introducing the Virus[J].Curr Top Microbiol Immunol,2015,390:151-209.
[7]Graham S Taylor,Heather M Long,Jill M Brooks,et al.The immunology of Epstein-Barr virus-induced disease[J].Annu Rev Immunol,2015,33:787-821.
[8]Castillo J J, Bibas M, Miranda R N.The biology and treatment of plasmablastic lymphoma[J]. Blood, 2015,125(15):2323–2330.
[9] Etienne Mahe,Catherine Ross,Monalisa Sur.Lymphoproliferative Lesions in the Setting of HIV Infection: A Five-Year Retrospective Case Series and Review[J].Patholog Res Int,2011 Mar 30;2011:618760.
[10] Copie-Bergman C,Cuillière-Dartigues P,Baia M,et al. Myc-IG Rearrangements are Negative Predictors of Survival in DLBCL Patients Treated With Immunochemotherapy: A Gela/Lysa Study[J].Blood,2015 Nov 26;126(22):2466-74.
[11] Reddy A,Zhang J,Davis NS,et al.Genetic and Functional Drivers of Diffuse Large B Cell Lymphoma[J].Cell,2017 Oct 5;171(2):481-494.
[12]Veronica Bordoni,Alessandra Sacchi,Rita Casetti,et al.Impact of ART on dynamics of growth factors and cytokines in primary HIV infection[J]. Cytokine, 2020 Jan;125:154839.
[13]Castillo J,Pantanowitz L,Dezube BJ.HIV-associated plasmablastic lymphoma:lessons learned from 112 published cases[J].Am J Hematol,200883(10):804-809.
[14]Delecluse H J,Anagnostopoulos I,Dallenbach F,et al.Plasmablastic lymphomas of the oral cavity: a new entity associated with the human immunodeficiency virus infection[J].Blood,1997,89(04):1413–1420.
[15]Castillo JJ, Winer ES, Stachurski D,et al.Clinical and pathological differences between human immunodeficiency virus-positive and human immunodeficiency virus-negative patients with plasmablastic lymphoma
[J].Leuk Lymphoma,2010,51(11):2047-53.
[16]Julie Morscio,Daan Dierick×,Jan Nijs,et al. Clinicopathologic comparison of plasmablastic lymphoma in HIV-positive, immunocompetent, and posttransplant patients. Single-center series of 25 cases and meta-analysis of 277 reported cases[J].Am J Surg Pathol,
2014,38(7):875-86.
[17]Jorge J Castillo,Eric S Winer,Dariusz Stachurski,et al.Prognostic factors in chemotherapy-treated patients with HIV-associated plasmablastic lymphoma[J].Oncologist,2010,15(3):293-9.
[18]Castillo JJ, Bibas M, Miranda RN.The Biology and Treatment of Plasmablastic Lymphoma[J].Blood,2015,125(15):2323–30.
[19]Castillo JJ,Guerrero-Garcia T,Baldini F,et al.Bortezomib Plus EPOCH Is Effective as Frontline Treatment in Patients With Plasmablastic Lymphoma[J].B Br J Haematol,2019,184(4):679–82.
[20] Chunmeng Rong,Li×ia Sheng,An Wu,et al. Allogeneic hematopoietic stem cell transplantation in a patient with HIV-negative recurrent plasmablastic lymphoma: A case report[J]. Medicine (Baltimore),2021,100(7):e24498.
[21] Lili Cheng, Qi Song, Mengke Liu,et al. Case Report: Successful Management of a Refractory Plasmablastic Lymphoma Patient With Tislelizumab and Lenalidomide[J].Front Immunol,2021, Jul 12;12:702593.
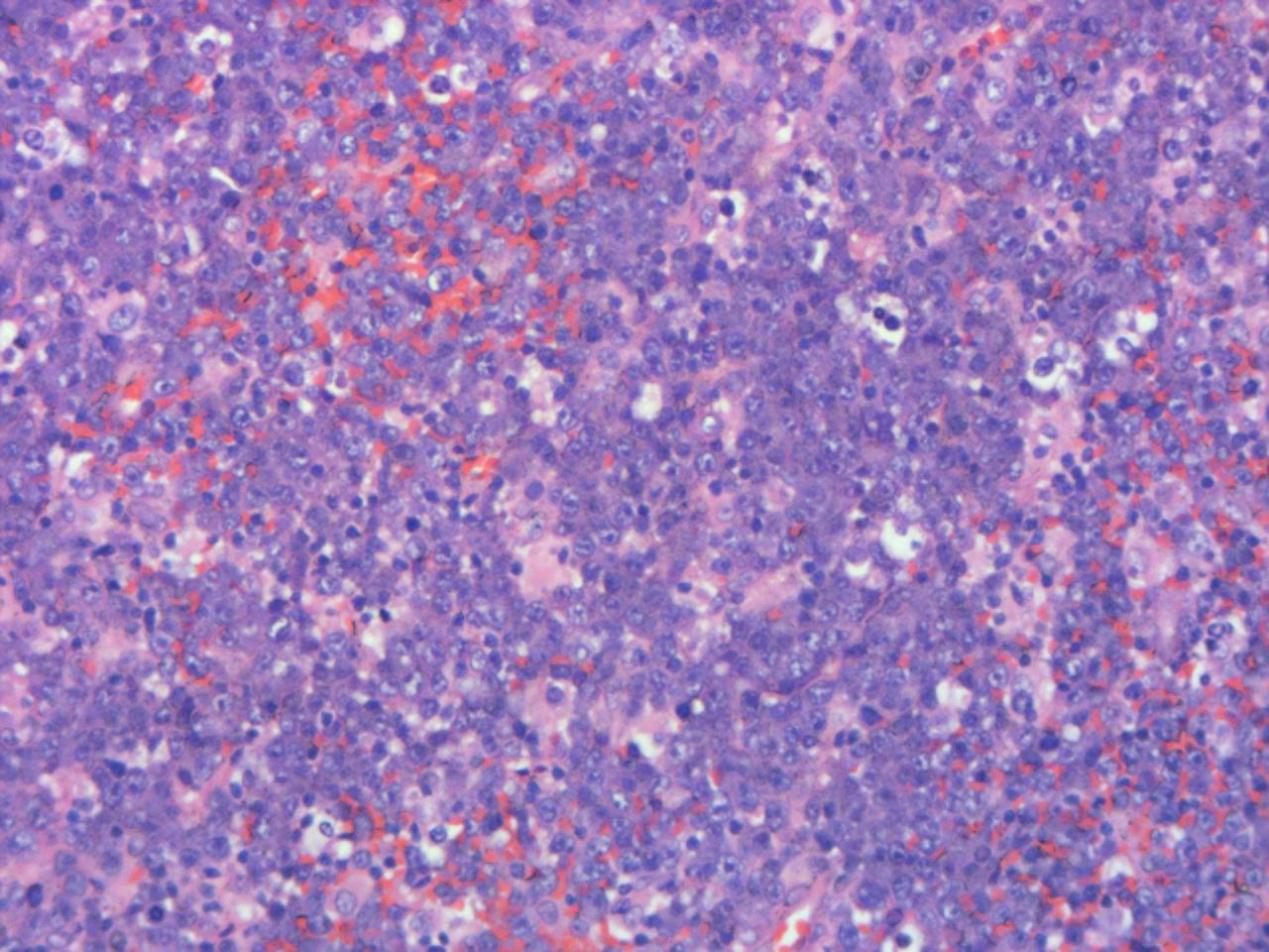 图1.肿瘤细胞胞质丰富,染色质空泡样,中位核仁,星空现象
图1.肿瘤细胞胞质丰富,染色质空泡样,中位核仁,星空现象
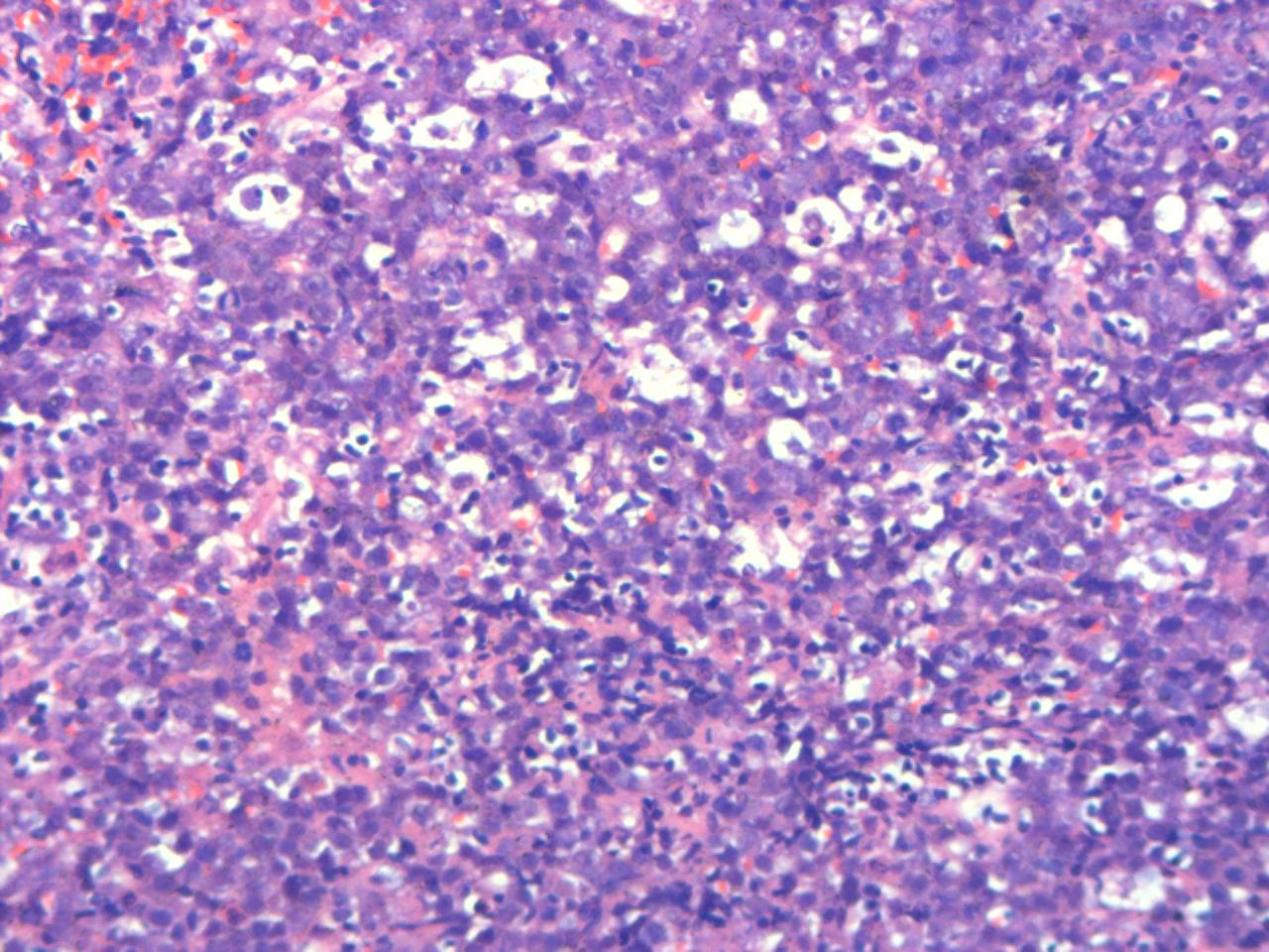 图2.图1相同区域的更高倍率图
图2.图1相同区域的更高倍率图
 图3.肿瘤细胞CD20(-)
图3.肿瘤细胞CD20(-)
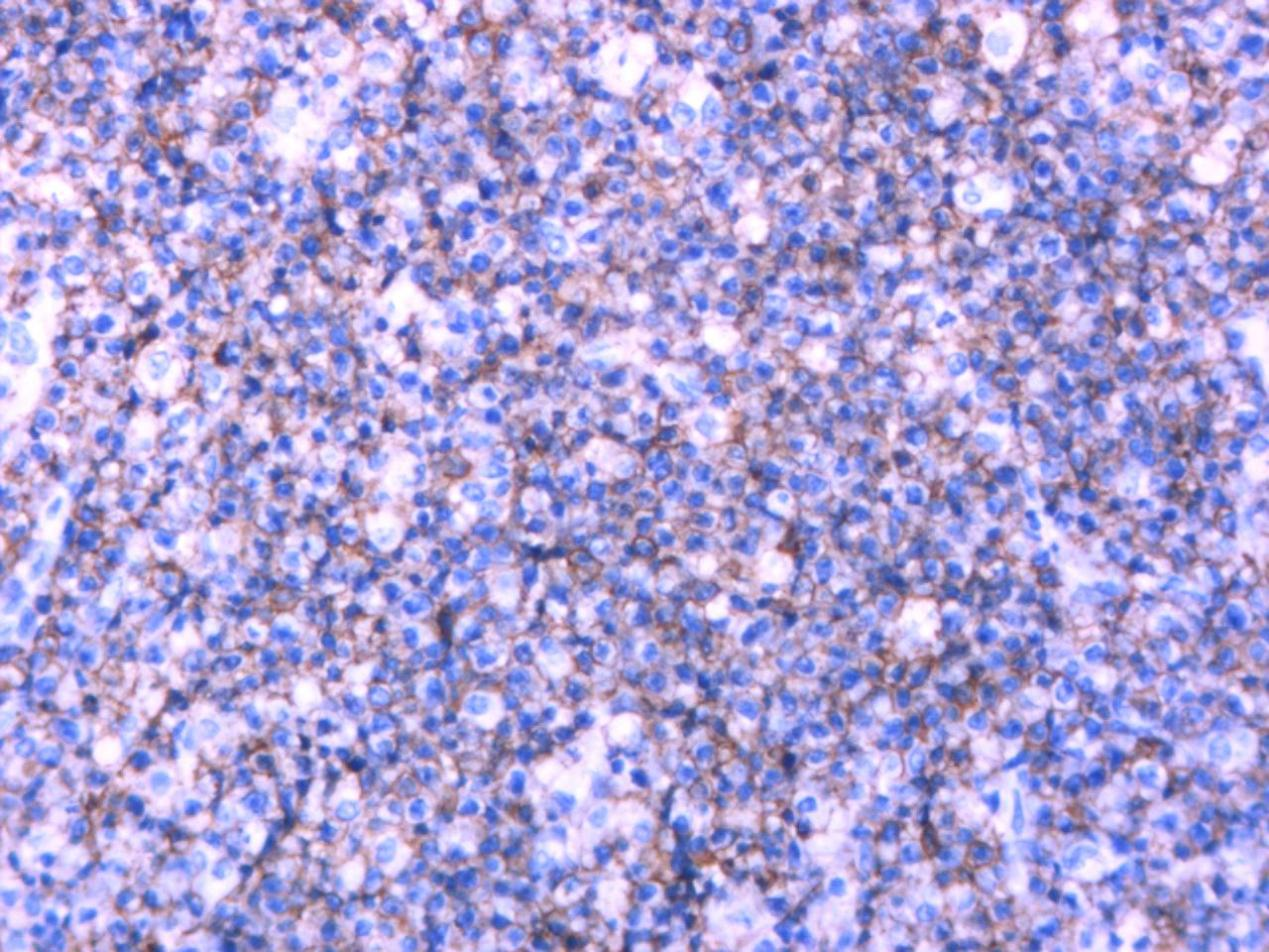 图4.肿瘤细胞CD38(+)
图4.肿瘤细胞CD38(+)

















共0条评论