[导读] 译者:慧海拾穗
【定义】
按照传统惯例,当外周血和骨髓为主要受累部位时,使用术语白血病(T-ALL);当主要受累部位是淋巴结、胸腺或其他淋巴结外部位时,则使用术语淋巴瘤(T-LBL)。当同时涉及骨髓和非骨髓部位时,这种区别就变得任意了,尽管许多治疗方案使用骨髓出现>25%的母细胞来定义白血病。
【ICD-O编码】
9837/3 T急性淋巴母细胞白血病/淋巴瘤,NOS*
【ICD-11编码】
2A71&XH7T28前体T淋巴母细胞肿瘤和前体T细胞淋巴母细胞白血病
【相关术语】
可接受:前体T淋巴母细胞白血病/淋巴瘤;T细胞急性淋巴母细胞白血病(T-ALL)
【亚型】
无
【部位】
根据定义,T-ALL总是累及骨髓,几乎总是累及外周血。与B-ALL不同的是,在骨髓累及情况下出现的白血病并不常见。T-LBL经常表现为纵隔(胸腺)包块,尽管任何淋巴结或结外部位都可能受累,包括皮肤、扁桃体、肝脏、脾脏、中枢神经系统和睾丸。在这些髓外部位出现而没有淋巴结或纵隔受累是罕见的。
【临床特征】
T-ALL通常表现为高白细胞计数,通常伴有大的腹部或其他组织肿块。淋巴结和肝脾肿大很常见。对于给定的白细胞计数和肿瘤负荷,与B-ALL相比,T-ALL通常显示出正常骨髓造血相对较少。T-LBL常表现为前纵隔肿块,常表现为快速生长,有时表现为呼吸紧急情况。据报道,可有胸膜和/或心包渗出液。
【流行病学】
T-ALL约占儿童ALL病例的15%;它在青少年中比在年幼儿童中更常见,在男性中比在女性中更常见。T-ALL约占成人ALL病例的25%。T-LBL约占所有LBL的85-90%;与白血病一样,它最常见于青春期男性,但也可能发生在任何年龄组。
【病因学】
未知
【发病机制】
T-ALL/LBL发病机制涉及致癌和肿瘤抑制剂途径中遗传/表观遗传学改变的多步骤累及,以及核糖体功能障碍,以及与T细胞发育相关的致癌miRNA或长链非编码RNA表达失调。这些改变影响负责细胞生长、存活和分化的基因。最常见的是影响NOTCH1通路突变、转录因子向TCR基因染色体区域的易位,以及表观遗传调控因子(EZH2、SUZ12和EED)和染色质修饰因子(PHF6、KDM6A和USP7)的突变。其他遗传异常包括参与JAK-STAT信号通路的基因(IL7R、JAK1、JAK3和STAT5B)、PI3K-AKT信号通路(PI3K和PTEN)、RAS-MAPK信号通路(HRAS、KRAS和PTPN11)和细胞周期调节基因(CDKN2A、CDKN2B、CDKN1B、RB1、CCDN2、CCND3、CTCF和MYB)的缺失。文献报道了一组共享同一TR基因重排的单卵双胞胎的T-ALL病例,这表明最早的遗传改变源于子宫内。
【组织病理学】
镜下表现
T-ALL/LBL中的淋巴母细胞在形态学上与B-ALL/LBL不可区分。在涂片或印片上,母细胞有少量的嗜碱性无颗粒或很少空泡的细胞质,从小到中等圆形或不规则或卷曲的细胞核,具有高N:C比,染色质浓缩,无明显核仁,到较大的母细胞,染色质细腻,核仁相对明显。偶尔,T-ALL的母细胞可能类似于更成熟的淋巴细胞,因此需要进行免疫表型研究来区分这种疾病和成熟( 外周 ) T细胞白血病/淋巴瘤。在骨髓活检切片中,母细胞浸润在正常骨髓成分之间并取代正常骨髓成分,并显示出高的N:C比、薄核膜、细腻染色质和不明显的核仁。淋巴结通常显示结构完全消失和包膜受累,尽管可以看到仅副皮质部分受累,保留生发中心。虽然细胞核和细胞质在T-LBL中通常不那么明显,但可能存在类似伯基特淋巴瘤的星空现象。在胸腺中,胸腺上皮细胞网广泛破坏和替换,皮质/髓质结构丧失,周围脂肪组织渗透性浸润。细针穿刺或渗出液的细胞学涂片表现为富于细胞的散在单一形态的未成熟淋巴细胞,其细胞形态类似于上述。在某些病例中可以看到细胞质伪足(手镜细胞)。常见淋巴结小体、细胞凋亡、大量核分裂象和可染小体巨噬细胞。细胞化学染色仍然经常用于急性白血病的分型,特别是在资源有限的情况下,但需要进行免疫表型鉴定才能确定谱系。淋巴母细胞对MPO总是呈阴性,但当存在颗粒时,可能会染上浅灰色和淡苏丹黑B。非特异性酯酶可能表现出多灶点状或高尔基体染色,这种染色受到氟化钠的不同抑制。在某些病例中,PAS显示粗糙的块状细胞质染色。
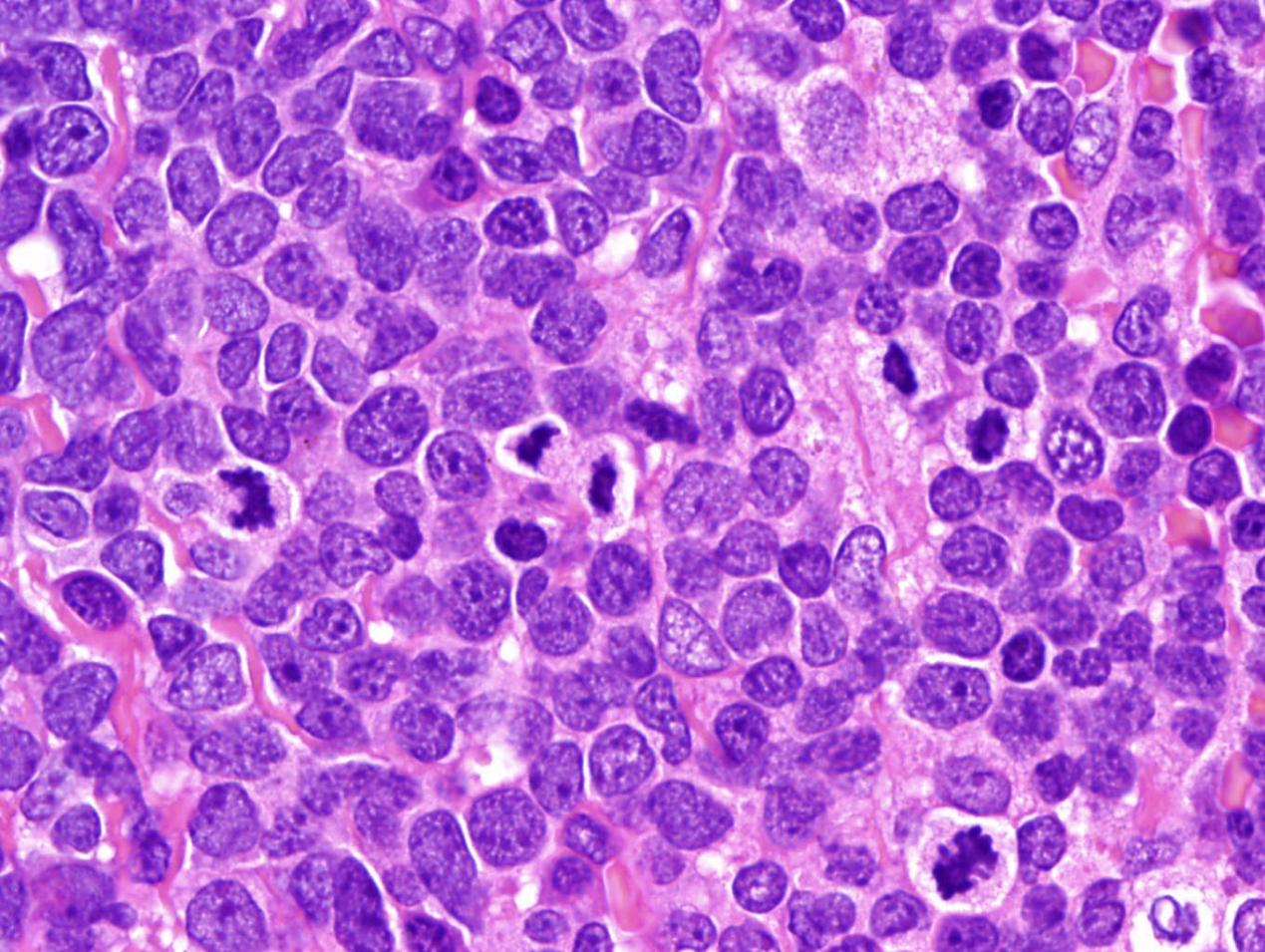
诊断:
(纵膈穿刺组织)T淋巴母细胞白血病/淋巴瘤
说明:
中等大小的非典型淋巴细胞显示出不规则的细胞核轮廓、小的核仁和细腻散在的染色质。可见几个核分裂象。
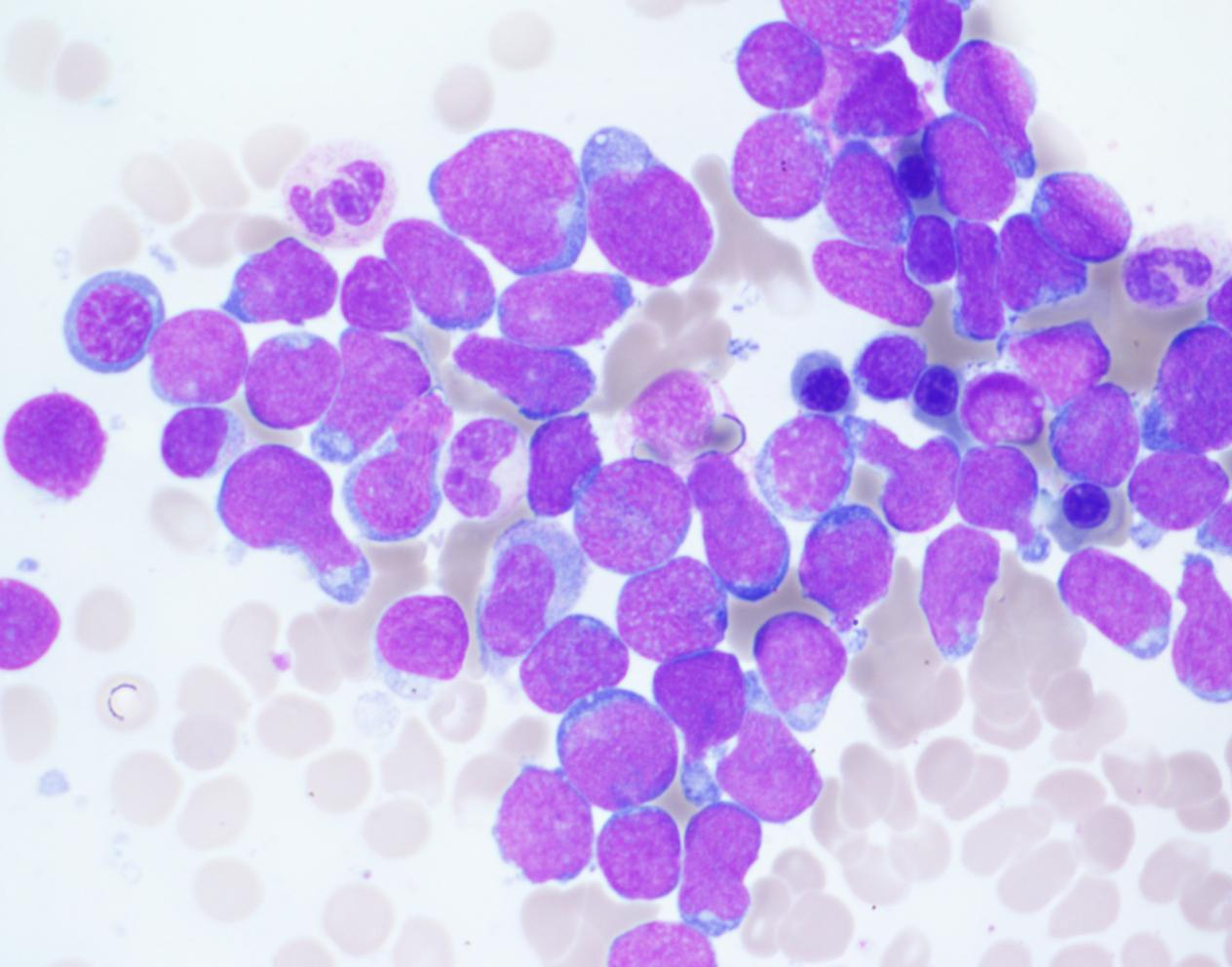
诊断:
T淋巴母细胞白血病的组织病理学
说明:
骨髓涂片(Wright Giemsa染色):淋巴母细胞可能表现出轻微的大小变化,特别是在最初风干的涂片上。T-ALL的形态与B-ALL难以区分。两者都可能表现出细胞质稀少的偏心取向(称为“手镜细胞”)。
免疫表型
在84-97%的病例中,T-ALL/LBL中的淋巴母细胞表达T系相关抗原胞质CD3(cCD3)、CD7和CD5。其中,cCD3是最具谱系特异性的,并定义了T谱系分化,表面CD3(sCD3)也是如此,与成熟T细胞相比,其表达频率较低,通常低表达。CD7的表达通常是均匀的,并且高于成熟的T细胞,但可能低表达,甚至不表达。CD5的表达通常低于成熟T细胞,并且可能非常低或不存在,特别是在更原始的早期胸腺前体(ETP)类型中。CD2也在大多数病例中表达。
与T细胞不成熟相关的抗原表达模式通常存在,并且不完全概括了早期T细胞成熟的阶段。这包括CD45的表达总是低于成熟淋巴细胞,尽管没有B-ALL/LBL中常见的那么低。
T淋巴细胞的祖细胞性质通过CD1a、CD34(1/3的病例)、CD117和/或CD99以及TdT的表达来证明,TdT存在于大多数病例中
T-ALL/LBL先前被分为四种免疫表型亚型,对应于正常胸腺内T细胞分化的阶段:(1)祖T/T-I,(2)前T/T-II,(3)皮质T/T-III,以及(4)髓质T/T-IV。
许多以前被归类为祖T或前T的病例现在符合早期T前体ALL(ETP-ALL;见下一节)的标准。CD4和CD8经常(约占T-ALL/LBL的46%)共表达,通常与CD1a共表达,CD10可能在高达40%的病例中呈阳性,这是常见胸腺细胞或成熟皮层阶段的特征。
髓质T期表达CD4或CD8,通常伴有sCD3。一些研究表明,T细胞分化的这些阶段与存活之间存在相关性。
T-ALL往往比T-LBL具有更不成熟的免疫表型,但这两组重叠。
这些免疫表型的成分对T-ALL并不是完全特异性的,因为CD4和CD8的共表达也可以在T细胞前淋巴细胞白血病中看到,而在外周T细胞淋巴瘤中CD10阳性(最常见的血管免疫母细胞T细胞淋巴瘤) 。
在29-48%的病例中,存在TAL1核染色,但这并不一定与TAL1基因改变的存在相关。
与LMO2阴性的胸腺细胞相比,LMO2在大多数病例中达。CD56在与ETP T-ALL重叠的病例亚组中表达,并且其本身并不提示NK细胞分化。
在至少10%的病例中观察到CD79a的异质性,通常是弱表达,偶尔可以看到CD19的表达,因此两者都不能单独定义B谱系分化。
一种或多种髓系相关抗原,如CD13或CD33,在19-32%的病例和c-KIT中表达(CD117 ))在一部分病例中可见表达,可能与FLT3的激活突变有关,因此单独表达并不意味着髓系分化。HLA-DR在大多数病例中呈阴性。
鉴别诊断
T-ALL/LBL的主要鉴别诊断包括胸腺瘤和其他急性白血病亚型,包括髓外表现。
在富于淋巴细胞的胸腺瘤中,通常存在较大的上皮细胞,核分裂象少和较多的核染色质空泡状。特别是,免疫组织化学染色突出了角蛋白阳性上皮细胞的“连锁”模式,让人想起正常的胸腺结构,这在T-LBL中是不存在的。当通过流式细胞术分析时,淋巴细胞显示出正常的胸腺细胞成熟模式,尽管通常偏向于普通胸腺细胞成熟阶段,这与多克隆TCR基因重排一起有助于诊断。胸腺增生和异位胸腺是罕见的,但可以使用类似的标准将其与T-ALL/LBL区分开来。
流式细胞术极大地促进了T-ALL/LBL与其他急性白血病亚型的区分。ETP-ALL是T-ALL/LBL的不同亚群,其由一种或多种髓系/干细胞标志物如CD13、CD33、CD34、CD117或HLA-DR的表达所定义的原始免疫表型,无CD1a和CD8,CD5低或不表达。T-ALL/LBL与MPAL、T/髓系的区别在于缺乏MPO表达和单核细胞分化。急性未分化白血病与T-ALL的不同之处在于缺乏细胞质CD3表达,注意部分T-ALL/LBL显示出细胞质CD3淡染,主要为ETP-T-ALL型。
具有显著嗜酸性粒细胞成分或相关骨髓增生特征的T-LBL病例可能代表骨髓/淋巴肿瘤伴嗜酸粒细胞增多症和明确的基因重排。需要进行分子检测来确定诊断。
部分T-ALL/LBL显示表面CD3表达,并且与成熟T细胞淋巴瘤或白血病如T-PLL或AITL的区别基于形态学、免疫表型特征和分子遗传学的组合。成熟的T细胞淋巴瘤/白血病缺乏未成熟的抗原,例如CD34、TdT或CD1a,并且通常显示CD7弱表达,而不是在T-ALL/LBL中看到明亮的CD7。NOTCH1突变的检测有利于T-ALL/LBL,而TCL1表达或重排支持T-PLL。
NK-ALL/LBL的定义是罕见且有问题的。正常NK细胞缺乏sCD3,通常表达CD2和CD7,未成熟亚群可以表达CD5和细胞质CD3(ζ和ε链),这是一种与T-ALL/LBL重叠的免疫表型。尽管CD56是NK细胞的特征,但也存在于与ETP ALL重叠的T-ALL/LBL亚群中。在NK细胞和部分T-ALL/LBL中,特别是ETP型中,都观察到克隆性TCR重排的缺失。其他NK细胞相关抗原如CD94和CD161没有被充分研究用于此目的。因此,目前尚不清楚NK-ALL/LBL是否存在,以及如何将其与T-ALL/LBL区分开来,尤其是ETP型。
惰性T淋巴母细胞增生是在胸腺外部位,主要是淋巴结中T淋巴母细胞的良性多克隆增生。大多数病例表现为T淋巴母细胞的局灶性聚集,没有淋巴结结构的消失,然而已经报道了广泛的淋巴结受累,在形态学上与T-LBL区分可能很困难,尤其是在粗针穿刺活检中。惰性T淋巴母细胞增生的流式细胞术免疫表型显示出各种正常T成熟阶段,再加上多克隆TCR基因重排和免疫组织化学缺乏LMO2表达,有助于将其与T-ALL/LBL区分开来。
【诊断分子病理学】
(1)抗原受体基因
T-ALL/LBL在超过90%的病例中显示出TCRB和/或TCRG基因的克隆重排,并且在大约20%的病例中同时存在IGH基因重排。缺乏可识别的克隆性TCR重排的部分病例在很大程度上是免疫表型原始的,对应于ETP-ALL。值得注意的是,TCR基因也可以在B-ALL和急性髓细胞白血病中重排,因此对于急性白血病的谱系分配来说是不可靠的。克隆TCR重排序列可用于监测治疗后的残留病灶。
(2)细胞遗传学异常与癌基因
在50-70%的病例中发现异常核型。最常见的重现性细胞遗传学异常是14q11.2的α和δTCR基因、7q34的β基因和7p14.1的γ基因与各种伴侣基因的重排。在大多数病例中,这些易位通过与TCR基因位点之一的调控区并置而导致伴侣基因的转录失调。最常见的相关基因包括T谱系转录因子TLX1、TLX3、TAL1、TAL2、LMO1、LMO2、LYL1、NKX2-1、2,5、OLIG2和HOXA。可能参与易位的其他转录因子包括MYC和MYB,
在50-70%的病例中发现异常核型。最常见的重现性细胞遗传学异常是14q11.2的α和δTCR基因、7q34的β基因和7p14.1的γ基因与各种伴侣基因的重排。在大多数病例中,这些易位通过与TCR基因位点之一的调控区并置而导致伴侣基因的转录失调。最常见的相关基因包括T谱系转录因子TLX1、TLX3、TAL1、TAL2、LMO1、LMO2、LYL1、NKX2-1、2,5、OLIG2和HOXA。可能参与易位的其他转录因子包括MYC和MYB,以及细胞质酪氨酸激酶LCK。
在许多病例中,易位只能通过分子遗传学研究来检测,而不是核型分析。例如,在约20-30%的T-ALL病例中,TAL1基因位点失去控制,但只有大约3%的病例可以通过核型检测到 (1;14 )( p33;q11.2 ) 易位。更常见是TAL1上游的神秘插入或缺失事件导致失去控制。T-ALL中的其他重要重排涉及MLLT10、KMT2A、ABL1和NUP98。
有人提出,T-ALL可根据导致异常表达的特定易位分为四个不同的、不重叠的遗传亚组(1)TAL或LMO基因,(2)TLX1,(3)TLX3,以及(4)HOXA基因,导致T细胞成熟停滞在胸腺细胞发育的不同阶段。TLX1组的预后似乎相对较好。另一组以LYL1过表达为特征,可能更接近于ETP-ALL。最近,根据基因改变和基因表达,提出了T-ALL的八个亚组:TAL1、TAL2、TLX1、TLX3、HOXA、LMO1/LMO2、LMO2/LYL1和NKX2-1。在该研究中,ETP-ALL病例通常属于LMO2/LYL1组。
缺失也发生在T-ALL中。最重要的是del( 9p),导致肿瘤抑制基因CDKN2A的缺失( 细胞周期蛋白依赖性激酶CDK4的抑制剂 ), 细胞遗传学约30%的检出率,分子检测率更高。这导致细胞周期失去G1控制。T-ALL中缺失或失活的其他肿瘤抑制剂包括BCL11B、LEF1、WT1、NF1 ETV6、RUNX1和GATA3,但最后三种与ETP-ALL表型相关。
T-ALL的信号通路失调发生在NOTCH1、PI3K-AKT、JAK-STAT、RAS-MAPK和ABL激酶通路中。超过75%的病例显示NOTCH1通路激活,这可能是由激活涉及细胞外异二聚结构域的突变引起的 / 或NOTCH1的C末端PEST结构域(50%的病例)和/或通过NOTCH1负调节因子FBXW7的功能缺失突变(30%的病例)。NOTCH1的直接下游靶点似乎是MYC,它有助于肿瘤细胞的生长。
表观遗传失调通过PHF6、SUZ12、EZH2、TET2、H3F3A、KDM6A、EED、SETD2和DNMT3A的突变发生。
尽管大多数研究都集中在T-ALL上,但T-LBL病例显示出总体相似的遗传发现和通路失调。
NOTCH1和/或FBXW7突变与更好的临床结果相关,而6q杂合性缺失、PTEN突变和KMT2D突变与更差的结果相关[1]。
【基本和理想的诊断标准】
(1)基本的:T系造血祖细胞的存在,主要由表面和/或细胞质CD3的表达来定义,具有异常的免疫表型。
(2)理想的:外周血或骨髓中异常T祖细胞或母细胞的数量超过20%,或累及髓外部位。
然而,与髓系肿瘤不同,诊断T-ALL/LBL不需要血液或骨髓中一定数量的母细胞。在实践中,当母细胞<20%时,应谨慎诊断,因为没有令人信服的证据表明将治疗推迟到母细胞达到20%会对结果产生不利影响。
【分期】
无
【预后和预测】
儿童和青少年的长期反应率接近85%,成人接近60%。与B-ALL不同,年龄、遗传学、诱导结束时的白细胞计数和微小残留病灶与预后较差有关。结果最重要预测因素是巩固结束时的微小残留病灶。除了多药化疗外,地塞米松-内阿糖的使用和增加静脉注射甲氨蝶呤和天冬酰胺酶与改善疗效有关。预防性CNS放疗似乎不需要。复发性T-ALL的结果仍然很差,至少部分原因是治疗选择有限。在成人方案中,T-ALL的治疗与其他类型ALL相似。成人T-ALL的预后可能比B-ALL好,尽管这可能反映出不良细胞遗传学异常的发生率较低。与其他淋巴瘤一样,T-LBL的预后取决于患者的年龄、疾病分期和乳酸脱氢酶水平。
参考文献
[1] WHO Classification of Tumours Editorial Board. Haematolymphoid tumours [Internet; beta version ahead of print]. Lyon (France): International Agency for Research on Cancer; 2022. (WHO classification of tumours series, 5th ed.; vol. 11).















共0条评论