[导读] 译者:张波
摘要:EB病毒(EBV)与各种肿瘤包括鼻咽癌和淋巴组织增生性疾病相关。目前对EBV相关的上皮和淋巴肿瘤了解颇多,但对EBV相关的间叶性肿瘤却知之甚少。本文综述了EBV相关间叶性肿瘤的临床特点、病理特征、病理生理学、预后因素和目前的治疗方法。通过使用PubMed数据库进行广泛的文献检索,确定三种不同的EBV相关间叶性肿瘤:EBV相关平滑肌肿瘤(EBV-SMT),炎性假瘤样滤泡树突状细胞肉瘤和EBV相关骨肉瘤。
1.前言
大约15-20%的人类恶性肿瘤是由七种主要的致癌病毒引起,这些病毒属于两类:DNA病毒(如Epstein-巴尔病毒(EBV)、卡波西肉瘤相关疱疹病毒(KSHV)、乙型肝炎病毒(HBV)、人乳头瘤病毒(HPV)和默克尔细胞多瘤病毒(MCPyV))和RNA病毒(包括人嗜T淋巴细胞病毒1(HTLV-1)和丙型肝炎病毒(HCV))。EBV属于疱疹病毒的γ亚科,这是一组嗜淋巴细胞病毒。在20世纪50年代,Denis Burkitt在东非发现了Burkitt淋巴瘤,并提出了蚊子传播的病毒和人类癌症之间的联系。1965年,安东尼·爱泼斯坦和同事建立了伯基特淋巴瘤细胞系,发现疱疹病毒样颗粒。Werner和Gertrude Henle后来证实这种病毒与其他人类疱疹病毒不同,将其命名为EBV 。
EBV在自然界中普遍存在,并且可以通过暴露于口腔分泌物感染大约95%的人群。在大多数情况下,这种感染不会表现出任何明显的症状。然而,当它影响青少年和年轻人时,可以引起传染性单核细胞增多症的病症。EBV是一种线性双链DNA病毒,包含100多个基因,但只有一个特定的子集在病毒生命周期中发挥作用。这些包括非编码RNA(EBER 1、EBER 2、microRNA)、核抗原(EBNA1、EBNA2、EBNA3A、EBNA3B、EBNA3C、LP)和潜伏膜蛋白(LMP1、LMP2A和LMP2B)。这些基因子集以各种组合表达,并被分类为三个主要的潜伏期程序:(1)潜伏期0:抗原阴性感染。(2)潜伏期I:EBNA 1的表达。(3)潜伏期II:EBNA 1、LMP 1、LMP 2A和LMP 2B的表达。(4)潜伏期I/II:潜伏期I和II之间的表达模式。(5)潜伏期III:所有EBNA蛋白、microRNA以及LMP 1、LMP 2A和LMP 2B的表达。
如图1所示,在初始感染期间,经口传播的病毒通过EBV糖蛋白gp 350/220与B细胞补体受体(CD 21)结合进入休眠的B细胞。随后,另一种病毒糖蛋白gp 42与HLA II类分子结合,导致病毒内化。感染后,病毒通常在位于口咽淋巴组织中的幼稚B细胞内采用潜伏期III程序,该程序允许受感染的细胞在这些组织内增殖。然后,被病毒转化的B细胞减少病毒抗原的表达(潜伏期I/0),停止其增殖,并作为记忆B细胞在血流中循环。这些记忆B细胞作为潜伏感染EBV携带者的主要储存库。负责这种转化为记忆B细胞的确切机制仍不清楚。一种可能的途径涉及生发中心(GC)反应,而另一种途径可能是非GC途径。这些记忆B细胞重新激活进入裂解周期,可能由浆细胞分化触发,导致病毒体的产生。随后,这些病毒体可引发新的潜伏性B细胞感染,在远端上皮表面建立新的病毒复制位点,或持续再感染口咽上皮。这一理论得到了以下事实的支持,即病毒已在远离口咽的各种位置发现,如母乳,宫颈上皮和精液,这意味着B细胞可能将病毒运输到这些部位。此外,当停止EBV靶向治疗时,可以在口咽分泌物中检测到与治疗前相当的病毒水平。
潜伏的EBV基因也通过抑制细胞凋亡和使免疫逃逸参与肿瘤发生。Lajoie等人的一项研究表明,LMP 1诱导了shelterin蛋白(如TRF 2)的下调。这些蛋白质对于DNA复制和保护染色体末端是重要的。当shelterin蛋白表达水平降低时,胞质分裂被破坏,导致在EBV相关霍奇金淋巴瘤的Reed-Sternberg细胞中观察到多核化。图1说明了EBV潜伏期程序和EBV相关恶性肿瘤之间的联系。免疫缺陷相关的淋巴组织增生性疾病,如移植后淋巴组织增生性疾病,表现出潜伏期III。霍奇金淋巴瘤、NK/T细胞淋巴瘤、血管免疫母细胞性T细胞淋巴瘤和鼻咽癌表现出潜伏期II。胃癌和伯基特淋巴瘤的潜伏期为I。潜伏期0以其休眠状态为特征,未知与恶性肿瘤相关。尽管世界上大多数人感染了EBV,但大多数人不会发生EBV相关的恶性肿瘤。这导致了其他因素在肿瘤发展中也起着重要作用的建议。例如,伯基特淋巴瘤细胞不仅携带EBV基因组,而且还发生染色体易位,导致MYC癌基因异常过表达。在一项体外用EBV将B细胞转化的实验中,发现在小鼠中存在初始低克隆能力和不能形成肿瘤。然而,在引入改变的MYC癌基因后,这些EBV转化的细胞表现出增强的细胞生长。这些发现意味着病毒通常在致癌过程中起着引发剂的作用,支持癌症发展是多个事件而不是单个事件积累的结果。
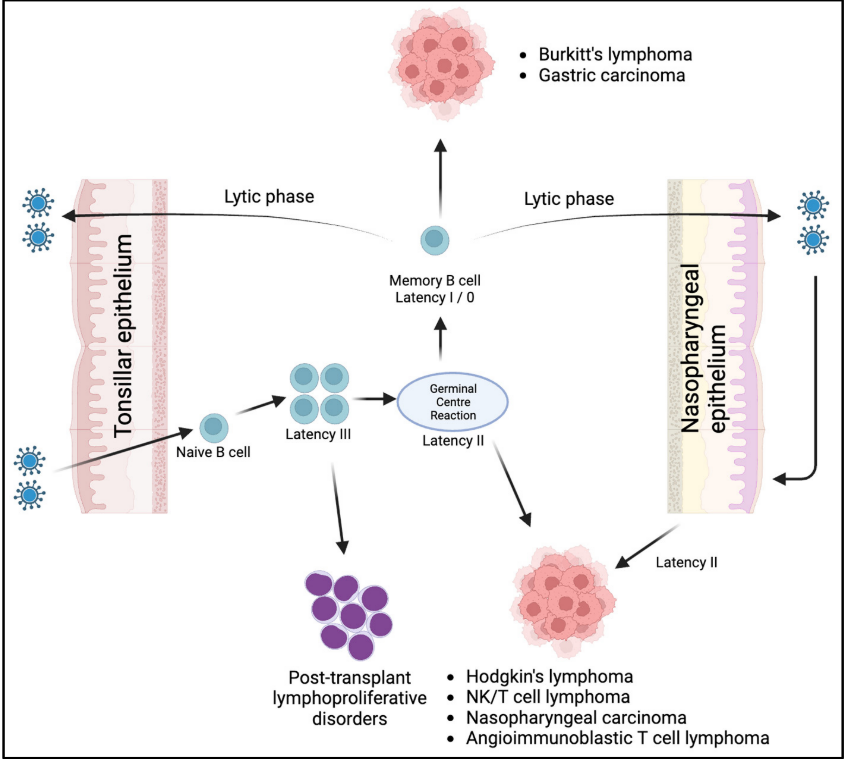 图1.EBV的生命周期及其相关的潜伏期程序导致不同类型肿瘤的发生。
图1.EBV的生命周期及其相关的潜伏期程序导致不同类型肿瘤的发生。
2.EBV相关平滑肌肿瘤(EBV-SMT)
在过去的50年中,EBV-SMT已被记录在免疫系统受损的个体中。免疫抑制患者中恶性平滑肌肿瘤的第一个报告可以追溯到1970年,当时Pritzker等人进行了最初的观察。在20世纪90年代,EBV和这些恶性平滑肌肿瘤之间的联系被建立起来,并称之为EBV-SMT。
根据现有文献,EBV-SMT代表免疫系统减弱个体中发生的平滑肌肿瘤亚组。这种情况可以表现在任何年龄,从1.5到63岁,并且主要发现于患有无法控制的HIV的女性患者、器官移植后接受免疫抑制治疗的患者或患有先天性免疫缺陷病症的个体中。EBV-SMT几乎可以影响任何器官,包括内脏部位、中枢神经系统、脊柱或外周软组织。这些肿瘤可以同时或在不同时间出现在单个或多个部位,但不表现出转移行为。Deyrup等人的一项研究检查了19例多器官受累患者的EBV-SMT,发现在每种情况下肿瘤在遗传上都是不同的,这表明多器官疾病是由多个原发性肿瘤引起的,而不是转移。此外,已经观察到与HIV感染相关的EBV-SMT倾向于具有更高的中枢神经系统受累的可能性。
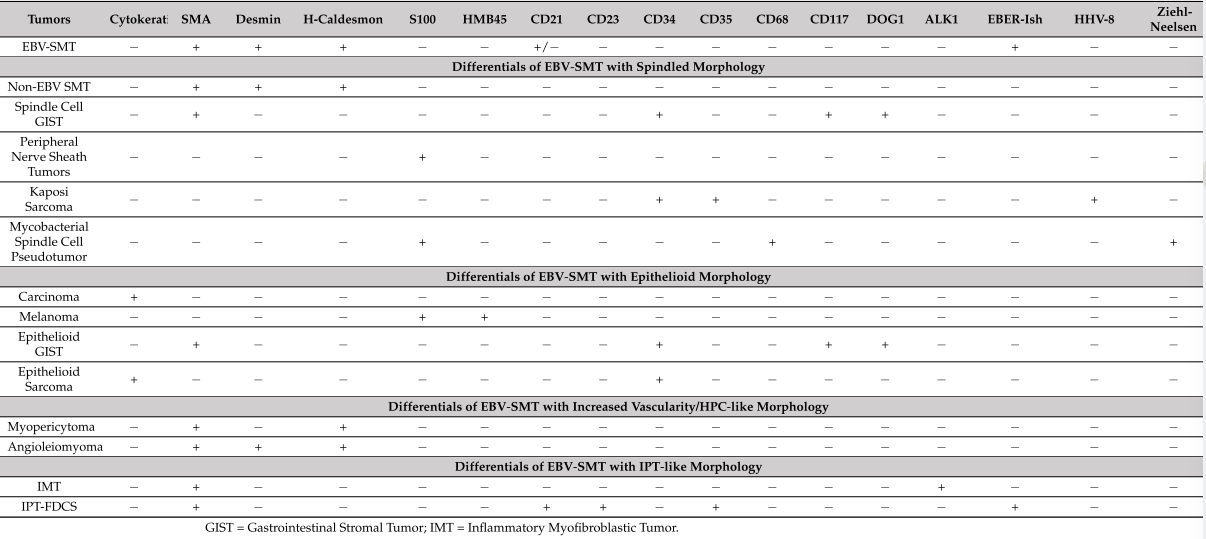
组织学上,如表1所示,EBV-SMT与典型平滑肌瘤具有几个共同特征。这些特征包括边界清楚的梭形细胞和“雪茄形”核的束状结构,以及中等数量的嗜酸性细胞质。在某些情况下,如Suwan等人所报告的,这些肿瘤细胞可表现出上皮样形态。值得注意的是,EBV-SMT内可能存在较高级别区域,显示核异型、坏死或有丝分裂活性增加,每10个高倍视野中有多达20个有丝分裂像,Ki-67增殖指数高达24% 。背景间质偶尔可显示胶原性或粘液样变化。EBV-SMT的独特特征包括存在原始小的圆形肿瘤细胞,其具有深染的圆形细胞核和有限的双嗜性细胞质,以及肿瘤内淋巴细胞浸润。其他值得注意的特征可能包括类似血管外皮细胞瘤(HPC)的血管分布增加和炎性假瘤(IPT)的外观等。
在Debiec等人描述的个案中,EBV-SMTs显示两个独立的区域:一部分具有常规平滑肌成分,另部分具有IPT样成分。有趣的是,分子分析显示了两个相关的异常克隆,一个具有ALK基因缺失,另一个具有der(3)染色体上ALK激酶结构域的3 ′端易位,分别对应于平滑肌和IPT组分。尽管存在这些分子差异,但这两个区域显示出相同的细胞遗传学改变,表明为单一克隆群体。值得注意的是,在IPT组分中无法证明ALK激活。Sprangers等人的另一份病例报告也未在具有IPT样形态的EBV-SMT中检测到任何ALK基因重排(FISH)。因此,这些发现可能表明,EBV-SMT的肿瘤发生除了直接的ALK激活还可能涉及其他EBV诱导的机制。
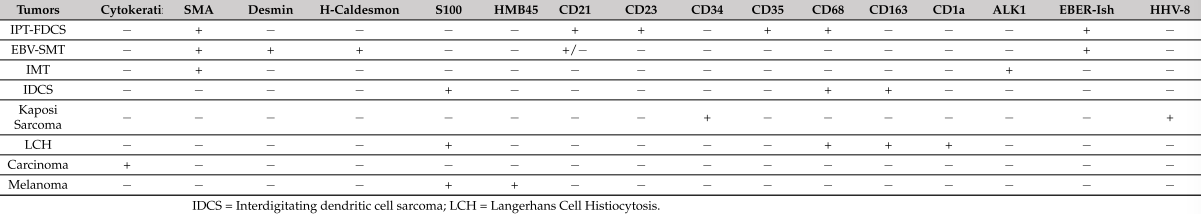
EBV-SMTs通常对平滑肌标志物呈阳性,如平滑肌肌动蛋白(SMA)、结蛋白和h-钙调蛋白。EBV编码的RNA(EBERish)的原位杂交通常也呈阳性,而CD 21染色可能显示不同的阳性。在EBV-SMT累及淋巴结的病例中,也展示了先前描述的关键免疫组化特征的表现(见图3)。由于EBV-SMT中存在不同的形态学模式,应考虑几种鉴别诊断。幸运的是,这些差异可以通过免疫组化和特殊组织化学染色的组合有效地排除,如表1所示。此外,对肿瘤块进行彻底取样以揭示经典区域可以有助于确认EBV-SMT诊断,特别是当仅观察到原始圆形细胞成分时。
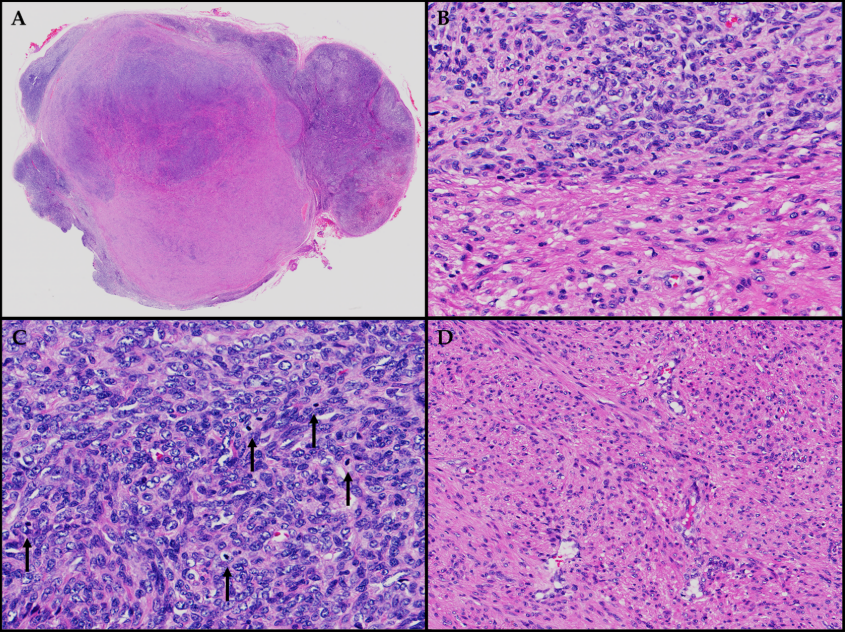 图2.苏木精和伊红染色。(A)一个淋巴结累及边界清楚的EBV-SMT。(B)两组不同的肿瘤细胞,其中一组类似于典型的平滑肌瘤,而第二组表现出核染色质增加,核染色质与胞质(NC)的比率较高。(C)有丝分裂像的数量局灶性增加,特别是在具有较高NC比率的肿瘤细胞组中(由黑色箭头指示)。(D)血管分布明显增加,其特征是肿瘤内存在纤细的薄壁血管。
图2.苏木精和伊红染色。(A)一个淋巴结累及边界清楚的EBV-SMT。(B)两组不同的肿瘤细胞,其中一组类似于典型的平滑肌瘤,而第二组表现出核染色质增加,核染色质与胞质(NC)的比率较高。(C)有丝分裂像的数量局灶性增加,特别是在具有较高NC比率的肿瘤细胞组中(由黑色箭头指示)。(D)血管分布明显增加,其特征是肿瘤内存在纤细的薄壁血管。
目前,已经提出了关于EBV进入这些肿瘤前体细胞机制的各种解释。EBV-SMT与血管相关的组织学检查提高了病毒偏好血管平滑肌的可能性。一些研究人员已经证明,在某些患有EBV-SMT的HIV阳性个体中,EBV可以结合的受体CD 21的存在允许EBV进入平滑肌细胞,这可能导致潜伏感染和随后的肿瘤发展。有趣的是,也有器官移植后EBV-SMT其中CD 21是缺失的情况。考虑到在EBV-SMT中存在瘤内淋巴细胞,已经提出了另一种理论,涉及平滑肌细胞和受感染的B淋巴细胞之间的融合事件发生在肿瘤增殖之前。根据Wah等人基因集富集分析表明,在EBV-SMT中,参与宿主对病毒感染应答的基因拷贝数增加,这表明肿瘤免疫微环境可能已经启动了感染的细胞转化和肿瘤生长。然而Soares等人使用免疫组织化学进行的研究也挑战了这种融合假说,其中他们发现大多数肿瘤内淋巴细胞是CD3+和CD8+,并且这些淋巴细胞中没有一个是EBERish阳性的,这表明这些淋巴细胞可能是反应性的,并且在EBV进入宿主细胞中可能没有显著作用。在进入宿主细胞后,EBV-SMT肿瘤发生的潜在分子机制似乎涉及由EBV-LMP 2A触发的Ake/哺乳动物雷帕霉素靶(mTOR)信号通路的再激活,这种再活化导致MCY的过表达,这反过来又促进细胞增殖和肿瘤的形成。
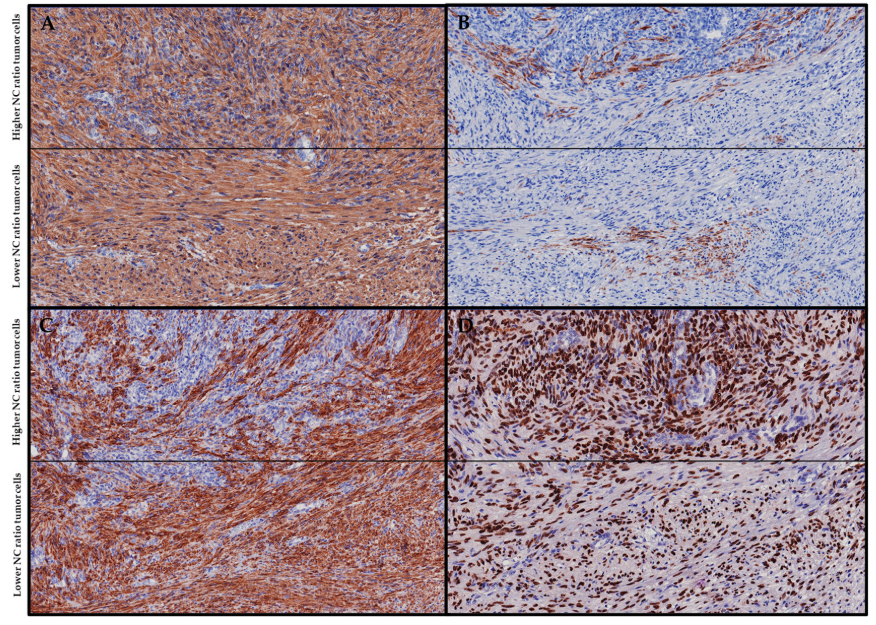 图3.免疫组化(A)两个肿瘤组分,表现出较高和较低的NC比,均表现出弥漫性SMA阳性。(B)两个肿瘤组分均显示斑片状结蛋白阳性。(C)在具有较高NC比的肿瘤组分内观察到斑片状h-钙调蛋白阳性,而具有较低NC比的肿瘤组分显示弥漫性h-钙调蛋白阳性。(D)两个肿瘤组分均显示弥漫性EBER阳性。
图3.免疫组化(A)两个肿瘤组分,表现出较高和较低的NC比,均表现出弥漫性SMA阳性。(B)两个肿瘤组分均显示斑片状结蛋白阳性。(C)在具有较高NC比的肿瘤组分内观察到斑片状h-钙调蛋白阳性,而具有较低NC比的肿瘤组分显示弥漫性h-钙调蛋白阳性。(D)两个肿瘤组分均显示弥漫性EBER阳性。
在2020年最新的WHO分类中,SMT被分为不同的组别类型:(1)良性肿瘤,如平滑肌瘤(LM);(2)中间肿瘤,包括EBV-SMT和恶性潜能不确定的SMT;(3)恶性肿瘤,包括平滑肌瘤(LMS)。将EBV-SMT归类为中间肿瘤是由于其生物学行为的不确定性。例如,EBV-SMT的组织学分级不能作为可靠的预后指标。Purgina等人的一项综合综述分析了64例已发表的EBV-SMT病例,发现诊断为“SMT”和“LMS”的病例之间的临床结局无差异。然而,某些不良临床特征,如累及多个器官和颅内区域,已被证明与EBV-SMT的总生存期降低相关。Wah等人最近进行的一项基因组研究显示,EBV-SMT表现出与LM相似的拷贝数改变负荷,但低于LMS。这种分子差异与EBV-SMT、LM和LMS之间观察到的临床行为差异一致。尽管EBV-SMT在基因组学方面与平滑肌瘤更紧密,但肿瘤也显示致癌蛋白质(如RUNX 1、CCND 2和ETS 2)的拷贝数增加,表明这些肿瘤中存在潜在的恶性潜力。由于EBV-SMT生物学行为的不确定性,许多专家建议避免使用“LMS”这一术语,而建议使用“SMT”这一术语。
表1.不同的免疫组织化学染色以区分EBV-SMT与其他肿瘤的鉴别诊断
尽管目前没有普遍接受的EBV-SMT的标准治疗方案,但已经提出了几种方法:(1)手术切除:手术切除肿瘤仍然是主要的治疗选择之一,特别是对于单灶性疾病的患者。值得注意的是,在接受手术切除的患者中没有疾病复发的报告。虽然多灶性疾病具有挑战性,但仍然可以考虑手术切除,特别是当肿瘤有症状或涉及颅内结构时。在这种情况下完全手术切除可能会提高生存率。(2)免疫重建:鉴于EBV-SMT的多灶性及其与免疫缺陷的相关性,许多报告提出优先考虑免疫系统恢复作为基本治疗方法。对于HIV感染者,建议使用抗逆转录病毒治疗来恢复免疫功能。对于器官移植受者,建议减少免疫抑制药物以增强免疫应答。在患有先天性免疫缺陷疾病的个体中,可以考虑选择骨髓移植作为增强免疫功能的手段。(3)mTOR抑制剂:鉴于mTOR途径在肿瘤发生中的关键作用,人们对使用mTOR抑制剂如西罗莫司治疗EBV-SMT感兴趣。一些报告已表明使用西罗莫司后疾病得到控制和消退。(4)其他治疗方式:偶尔使用化疗和放疗;然而,这种通常被认为对治疗这些肿瘤无效。联合EBV导向的抗病毒治疗以抑制EBV复制可增强疾病控制并可能导致更好的结局。此外,还为移植后平滑肌肿瘤(PTSMT)患者探索了一种新的治疗方法,这涉及EBV特异性T细胞的过继细胞转移(ACT)。一项病例研究报告了一名20岁的患者疾病稳定和EBV病毒血症减少,该患者接受了心脏移植并发生了PTSMT 。
3.炎性假瘤样滤泡树突状细胞肉瘤(IPT-FDCS)
IPT-FDCS是一种与EBV感染相关的独特肿瘤,与其他炎性假瘤(IPT)相反。IPT的概念于1903年首次描述,涵盖各种疾病,包括感染性、自身免疫性或反应性纤维炎性过程。另一方面,炎性肌纤维母细胞瘤(IMT)与这一异质性IPT组不同,并被归类为中间肿瘤,这主要是由于鉴定出复发性基因重排。值得注意的是,一些较早的报告可能将脾和肝IPT-FDCS不准确地分类为IMT或其他IPT。同样,一些脾脏和肝脏EBV-SMTs可能被错误地报告为IPT-FDCS、EBV相关IPT或EBV相关IMT。这种错误分类可能是由于肿瘤内SMA阳性的非特异性表达,以及可能其来自各种细胞来源,包括成纤维细胞、成肌纤维细胞、纤维组织细胞、成纤维网状细胞以及滤泡树突状细胞和平滑肌细胞。
FDCS是2017年“WHO肿瘤分类”中包含的一种罕见实体,最初于1986年被描述为一种罕见的间叶性肿瘤,由淋巴组织中发现的FDC引起。这种肿瘤分为两种亚型:传统FDCS和IPT-FDCS。IPT-FDCS于2001年首次鉴定,代表FDCS的一种独特亚型,其始终表现出EBV阳性。已知FDCS会影响7至82岁的广泛年龄范围的个体,在中年人中流行。当比较这两种亚型时,EBV相关的IPT-FDCS通常发生在年龄较大的人群中,平均年龄为60.7岁,而非EBV相关的传统FDCS往往影响稍微年轻的个体,平均年龄为45.3岁。IPT-FDCS也显示女性略占优势,比例为2.2:1,而非EBV相关的常规FDCS显示男性占优势,比例为3:2。大多数IPT-FDCS病例报告发生在肝脏和脾脏,淋巴结、胃肠道和肺中记录了一些特殊病例。
相比之下,传统FDCS可发生在淋巴结和淋巴结外部位,包括口腔、软腭和扁桃体。所有病例的IPT-FDCS表现出共同的组织学特征,包括以各种模式排列的梭形细胞,如束状、螺旋状或席纹状模式。这些FDC显示出以T淋巴细胞密集浸润为特征的IPT样形态,这将它们与传统FDCS区分开来,传统FDCS通常仅存在分散的淋巴细胞。血管周围淋巴细胞袖和嗜酸性粒细胞、浆细胞和中性粒细胞的混合也经常可见。有丝分裂象通常罕见,有些病例可能包含坏死灶、出血、非干酪上皮样肉芽肿或血管内纤维蛋白凝块。其细胞形态为椭圆形至细长形核,核染色质分散,核仁不明显,胞浆嗜酸性,胞质边缘为合胞体。偶尔,可以观察到双核或多核细胞以及具有核假包涵体的细胞。先前描述的重要组织学特征也在涉及IPT-FDCS的淋巴结的病例中呈现(参见图4A-C)。
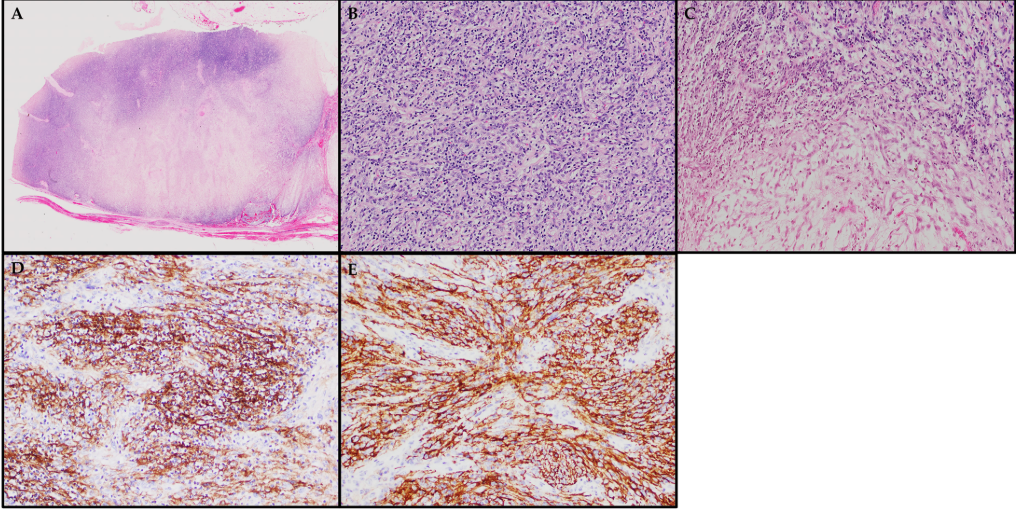 图4.苏木精-伊红染色及免疫组化。(A)累及边界清楚的IPT-FDCS的淋巴结,包括两个不同的细胞过多和细胞过少区域。(B)细胞过多区域,包括梭形细胞束和混合的致密淋巴细胞浸润。(C)多细胞区与少细胞粘液样区的并列。(D,E)来自不同FDCS病例的肿瘤梭形细胞,分别显示出CD21和CD35的阳性表达。
图4.苏木精-伊红染色及免疫组化。(A)累及边界清楚的IPT-FDCS的淋巴结,包括两个不同的细胞过多和细胞过少区域。(B)细胞过多区域,包括梭形细胞束和混合的致密淋巴细胞浸润。(C)多细胞区与少细胞粘液样区的并列。(D,E)来自不同FDCS病例的肿瘤梭形细胞,分别显示出CD21和CD35的阳性表达。
免疫组化染色在确诊IPT-FDCS中起着至关重要的作用。这些肿瘤始终显示典型FDC标志物阳性,如CD 21、CD 35、CD 23、clusterin、podoplanin、CXCL 13和CAN.4,这有助于将其与其他实体肿瘤区域鉴别开(见图4D、E)。一些作者还报告了通过全转录组测序对较新标志物的阳性反应,如滤泡树突细胞分泌蛋白(FDCSP)和serglycin(SRGN)。还注意到claudin 4、CD 68和肌成束蛋白的染色强度不同。值得注意的是,较早的病例报告记录了SMA阳性,现在认为SMA可能代表所谓的EBV-SMT和IMT。TdT染色突出显示约45%的病例中肿瘤内存在未成熟T淋巴母细胞增殖。当含量丰富时,可能与副肿瘤性自身免疫性多器官综合征有关。EBERish在92.1%的IPT-FDCS病例中呈阳性,EBV-LMP 1在90%的病例中可见,而传统FDCS通常不存在这些标志物。虽然许多病例在CD 3和CD 20阳性的淋巴细胞中表现出EBER阳性,但许多专家认为这些病例可能归因于EBV感染的淋巴细胞或同时存在淋巴组织增生性疾病。双标记技术提供了额外的支持,这些EBV标志物主要检测滤泡树突状细胞本身,而不是仅仅在相邻的EBV感染的淋巴细胞的背景。鉴于IPT-FDCS的潜在鉴别诊断范围广泛,以下一组免疫组化染色对于准确区分它们至关重要(见表2)。
表2.不同免疫组织化学染色以鉴别IPT-FDCS与其他形态相似肿瘤的图示
虽然常规FDCS与免疫疾病中的滤泡树突状细胞增殖有关,例如Castleman病的透明血管变体,但IPT-FDCS中的潜在肿瘤发生仍然在很大程度上未知。在许多其他EBV相关的上皮、淋巴和间质肿瘤中,肿瘤的发展与免疫抑制状况有关,例如不受控制的HIV、移植患者的医源性免疫抑制和先天性免疫功能低下状态。在这种情况下,免疫系统的抑制可以触发EBV潜伏相关基因的激活,最终导致肿瘤的发展。然而,在先前报告的任何IPT-FDCS病例中均未观察到该机制。
这代表了正在进行的研究和调查的一个活跃领域,需要进一步的研究来揭示促进IPT-FDCS发展的潜在机制。与经常复发和潜在转移的传统FDCS相反,IPT-FDCS通常显示无痛临床病程。根据Wu等人进行的研究,大多数患者仅通过手术干预就取得了成功的治疗结果。只有一小部分病例(15.8%)在初次治疗后出现局部复发或远处转移。然而,包括Kaplan-Meier和多变量分析在内的分析研究未能在患者年龄、性别、肿瘤大小和形态学特征等因素与疾病预后之间建立显著相关性。在大多数IPT-FDCS病例中,手术切除肿瘤后观察到了良好的结局。复发并不常见,转移的情况仅在极少数病例中记录。
手术切除被认为是治疗IPT-FDCS的首选。鉴于其典型的惰性行为,在管理这种类型的肿瘤时,辅助治疗的作用仍不清楚。然而,由于复发的可能性,建议定期监测。
4.EBV相关骨肉瘤
关于EBV与骨肉瘤之间相关性的现有文献有限,只有一项由Mardanpour等人进行的回顾性队列研究报告。该研究探讨了骨肉瘤中EBV的存在及其对预后的潜在影响。
这项研究包括48名免疫功能正常的患者,他们都是伊朗人,平均年龄为17.43岁。在这些患者中,33例(69%)为男孩,15例(31%)为女孩,男女比例为2.2:1 。所有病例的组织学特征与传统骨肉瘤一致。该研究还发现,48例骨肉瘤病例中仅6例在肿瘤细胞中表现出EBV编码的小RNA 1(EBER 1)和潜伏膜蛋白1(LMP 1)的共表达。
在所有病例中,手术切除肿瘤时均未给予新辅助化疗或放疗。重要的是,作者观察到EBER 1和LMP 1的同时存在与不利的临床特征有关,包括淋巴结转移,远处转移和晚期肿瘤阶段。在平均45 ± 12个月的随访期内,该研究发现,EBER 1和LMP 1检测呈阳性的个体与这些标志物检测呈阴性的个体相比,结果明显较差。具体而言,EBER 1和LMP 1阳性患者的5年总生存率为54%,而这些标记物阴性患者的5年总生存率为85%。同样,EBER 1和LMP 1阳性患者的5年无进展生存率为41%,而没有这些标志物的患者为81%。此外,EBER 1和LMP 1阳性患者的无病生存期明显短于这些标志物检测阴性的患者。
虽然这项研究为骨肉瘤患者EBV标志物的预后意义提供了有价值的见解,但在EBV感染的背景下促进骨肉瘤发展的潜在机制尚未得到解决。有趣的是,在这项关于EBV相关性骨肉瘤的研究中,重点主要是免疫功能正常的患者,显示男性的发生率较高。相反,其他关于EBV相关软组织肿瘤的研究,如EBV-SMT,集中在免疫缺陷患者中,显示女性中的频率较高。这些发现表明,除了特定的肿瘤类型外,免疫状态和人口统计学因素都可能影响这些肿瘤的生物学行为。由于样本量和局限于特定的地理区域,因此,进一步更大的样本量和不同的地理位置研究是必要的。
5. 结论和未来方向
虽然此综述文章提供了全面的概述,并提出了对罕见间叶性肿瘤的最新见解,但对这些病例中驱动肿瘤发生的潜在机制的了解仍然有限。这种缺乏对病理生理学的理解解释了这些肿瘤缺乏标准化治疗指南的原因。这些肿瘤的病理生理学中的几个关键问题需要进一步探索鉴定间叶性肿瘤中的特定EBV毒株:
(1)最近的基因组研究揭示了不同的EBV毒株对不同的淋巴和上皮细胞具有特异性亲和力。在间叶肿瘤中研究这些特定的毒株可以为病毒的遗传多样性提供有价值的见解。
(2)解码病毒进入间充质细胞的机制:关于EBV如何感染宿主组织,包括CD21受体的参与,已经提出了各种假设。B细胞和非淋巴样细胞(包括间充质细胞)中存在CD21,这一理论支持CD21介导的进入是EBV感染的机制。然而,确切的病毒进入机制由于在建立用于体外研究的间充质组织细胞系方面的挑战,间充质细胞仍然未知。因此,应该集中精力开发培养间充质细胞系组织的技术,从而全面研究EBV如何与这些细胞结合。
(3)识别肿瘤信号传导途径中的潜在生物标志物:尽管EBV相关上皮或淋巴肿瘤的分子机制已被充分理解,但关于EBV如何诱导间叶性组织中的肿瘤发生的知识仍存在差距。理解这些疾病过程的重要性通过发现mTOR信号通路参与EBV-SMT来例证。这一发现导致了mTOR抑制剂如西罗莫司的利用,证明了它们在治疗EBV-SMT患者中的有效性。因此,正在进行的研究工作对于确定肿瘤信号通路中的潜在生物标志物至关重要,为这些患者群体的治疗提供了有希望的靶点。
除了对EBV相关间叶性肿瘤的病理生理学缺乏了解外,还缺乏涉及这些间叶性肿瘤患者的随机对照试验进一步使标准化方案的建立复杂化。在制定标准化的治疗策略之前,必须注意的是,治疗的选择应根据患者的病情,包括疾病的程度、整体健康状况和潜在免疫缺陷的存在,并应与多学科医疗团队协作探讨。
这篇综述文章的目的是提供一个全面的参考,提供目前对EBV相关间叶性肿瘤各个方面的见解。然而,重要的是要注意,我们目前对这种情况下的病理生理学的理解仍然不完整。因此,希望这篇综述论文不仅能作为一个有价值的信息库,还能作为一个催化剂,用于前瞻性的体外和体内研究,以弥补现有的知识差距,最终为塑造未来的治疗方法做出实质性贡献。
点此下载原文献



















共0条评论