[导读] 作者:游乐园
艾滋病,即获得性免疫缺陷综合征(AIDS),其病原体为人类免疫缺陷病毒(HIV),亦称艾滋病病毒,表现为各种机会性感染及肿瘤。卡波西肉瘤(KS)是一种较为少见的以梭形细胞增生和血管瘤样结构为特征的恶性肿瘤,与感染人疱疹病毒8(HHV8)有关,KS在普通人群中发病率较低,但在艾滋病人群中发病率较高,是AIDS患者常见的机会性肿瘤。当AIDS患者合并出现机会性感染时,部分患者血常规检查可表现为白细胞减少、贫血及血小板减少,但有少部分患者是以单纯血小板减少为主要首发临床表现而就诊,经过长时间诊疗未明确病因,进一步检查提示HIV抗体阳性。本文报道1例AIDS患者,在未启动抗HIV治疗情况下长时间使用激素后诱发KS的病例 。
1.临床资料
患者,男,55岁。2018年5月,患者在某市三甲医院体检发现血小板减少,骨髓穿刺检查见巨核细胞成熟障碍,考虑特发性血小板减少,其后开始泼尼松治疗,初始剂量1mg·kg-1·d-1,最大剂量为 80mg/d,使用剂量根据医嘱逐渐减量。2019年1月,患者无明显诱因出现间断咳嗽咳痰,痰为少量白色粘痰,无畏寒、发热、喘累、气促、恶心、呕吐等不适,就诊于某县三甲医院,考虑肺部感染,予以莫西沙星抗感染治疗,病情有所好转。2019年3月患者再次咳嗽咳痰,无其他不适,再次就诊于某县三甲医院,检查发现HIV抗体阳性,建议上级传染病专科医院治疗,患者遂来我院感染科就诊。
查体:体温36.7℃、呼吸22次/min、脉搏 85次/min、血压110/76mmHg,发育正常,营养中等,神清语晰,双肺呼吸音低,未闻及明显干湿啰音,腹部平坦,质软,全腹未触及包块,于我院就诊前3个月鼻尖、额部逐步出现皮肤破损,破损最大径0.5-1.8cm不等。
实验室检查:血常规白细胞6.71×109/L,中性粒细胞百分比72.1%,淋巴细胞百分比15.6%,红细胞 4.3×1012/L,血红蛋白129g/L,血小板30×109/L。流式细胞检查示CD4+T细胞计数56/μL,HIV RNA 32000拷贝/mL。乙型肝炎、丙型肝炎、巨细胞病毒、梅毒、真菌、痰分枝杆菌培养均阴性。胸部CT检查示双肺感染性病变。
综合患者临床表现及医技检查,入院初步诊断:1、卡波西肉瘤;2、细菌性肺炎;3、AIDS;4、血小板减少。入院后给予抗细菌、止咳、升血小板药物治疗。鼻尖、额部皮肤破损为进一步明确诊断,行局部组织活检,结果显示异型增生的梭形细胞交叉束状分布,裂隙状血管,红细胞外渗,慢性炎症细胞浸润,结合免疫组化结果,符合艾滋病相关型卡波西肉瘤(AIDS-KS)。患者在2018年5月发现血小板减少,开始使用泼尼松进行治疗,2019年3月来我院就诊时确诊为AIDS晚期,其泼尼松使用剂量为15mg/d,已连续使用激素10个月,综合以上结果,我们推断患者在2018年5月已经感染HIV,但未及时诊断及治疗,患者在HIV病毒未控制,全身处于免疫抑制情况下长期使用激素,导致出现KS,遂将患者的泼尼松逐渐减量,同时启动抗反转录病毒治疗(ART),控制由HIV感染所导致的免疫抑制,方案为拉米夫定/富马酸替诺福韦/依非韦伦。随着激素用量减少,患者皮肤黏膜出现了散在出血点,予以白细胞介素-11升血小板及激素冲击治疗,出血症状较前好转,复查血小板计数为199×109/L,调整为口服泼尼松20mg/d序贯治疗,动态监测血小板计数,血小板计数为219×109/L。针对AIDS-KS予以多柔比星脂质体进行化疗,共5次化疗,化疗同时行ART,化疗后随访3年,患者一般情况良好,现已停用激素及升血小板药物,仅服用抗HIV治疗药物,未再出现皮肤黏膜病变或血小板减少。
2.讨论
艾滋病,即获得性免疫缺陷综合征(AIDS),其病原体为人类免疫缺陷病毒(HIV),亦称艾滋病病毒。AIDS是影响公众健康的重要公共卫生问题之一。截至2020年底,全球现存HIV/AIDS患者3770万,当年新发HIV感染者150万,其中2750万人正在接受抗反转录病毒治疗[1]。卡波西肉瘤(KS)是AIDS指征性疾病,且为AIDS患者常见的机会性肿瘤之一,其发生与人类疱疹病毒(HHV-8)感染有关。在AIDS流行前,KS是一种罕见疾病,随着AIDS的流行,KS发病率增长了约20倍,但随着ART的广泛应用,AIDS-KS的发病率由15.2%下降至4.9‰,但《中国艾滋病诊疗指南(2021年版)》指出艾滋病相关肿瘤主要有非霍奇金淋巴瘤和KS,故KS仍是AIDS患者中常见的肿瘤之一。
KS是由HHV-8引起的一种罕见的多中心性血管性低度恶性肿瘤,1872年,Moritz Kaposi在一篇题为《皮肤特发性多发性色素肉瘤》的文章中首次描述了这种疾病,他在文章中提出了5例病例,每个病例都与老年男性有关,并涉及皮肤的疼痛病变,即斑块和结节,这后来被称为经典型KS[2]。后来,在AIDS流行期间,KS出现了一种新的变体,其特点是具有侵袭性,这就是流行性KS,即AIDS-KS。在非洲,越来越多的KS病例出现了地方性变异,这种变异表现为全身性淋巴结病,在儿童人群中显著增加,被称为非洲地方型KS。已知的KS第四种变体是移植后和医源性的,最近,在长期糖皮质激素治疗和生物疗法的背景下,KS医源性变异的病例报告数量有所增长,激素诱导的免疫抑制是KS发生的独立危险因素。有文献报道,从糖皮质激素治疗开始到KS发生的间隔时间为3-36个月,平均13.7个月[3]。如前所述,KS可分为4种形式:经典型、非洲地方型、AIDS相关型、医源性免疫抑制型(移植后)。所有四种变异都涉及HHV8,但仅感染病毒本身不足以引起KS,肿瘤的发生尚需要免疫系统受损(无论是通过药物治疗还是通过艾滋病等疾病)、遗传易感性和地域环境因素的综合作用[4]。感染可通过唾液、密切接触、血液、血液制品、实体器官捐赠、母体感染胎儿发生。
KS的临床表现是异质性的,一些患者患有惰性疾病,而另一些患者则患有侵袭性疾病。经典型KS通常发生在60岁以上的老年男性,是惰性的,皮肤病变是最常见的表现形式,内脏受累是罕见的[5]。非洲地方型KS有两种亚型:一种好发于儿童,以淋巴结病变、内脏受累和侵袭性进展为特征,另一种好发于40岁以上的男性,表现为惰性,下肢皮肤病变是常见的[6]。AIDS相关型极具侵袭性,CD4T细胞下降是该型发生的风险因素。医源性免疫抑制型(移植后)KS发生在患者接受免疫抑制导致先前HHV8感染的再激活,或患者接受受感染的器官时,在可能的情况下,中断免疫抑制KS可消退[7]。KS的临床病程分为斑片状期、斑块期和结节期。在斑片状期,皮肤可见小的红色扁平病变,组织学检查在KS病变中可见血管扩张,形状异常,伴红细胞外渗和水肿。在斑块期,片状病变融合形成斑块性病变,此期血管周围可见梭形细胞增殖。在结节期,可观察到褐色结节和隆起性病变,组织学检查见肿瘤细胞呈梭形、多灶性、交叉束状排列,可见较多裂隙状血管,其内见多量红细胞,周围见含铁血黄素沉着、淋巴细胞及浆细胞浸润,胶原束之间可见狭窄的细胞索,有时为梭形细胞束[8]。KS的4种分型均表现出相似的组织学特征,并无明显差异。免疫组化CD34、CD31、HHV-8、Fli1、D2-40、VEGF、FactorⅧ、ERG等抗体标记有助于诊断。鉴别诊断:(1)血管肉瘤;临床表现与KS不同,镜下由交通状不规则血管组成,也可含有实性梭形细胞成分,免疫组化HHV-8阴性可进行鉴别诊断。(2)纤维肉瘤:由梭形细胞组成,肿瘤细胞间无裂隙状血管,无红细胞外渗。(3)血管瘤:细胞无异型性,无核分裂,血管排列方式与KS不同。
AIDS-KS治疗方案主要包括以下几个方面:需尽早启动ART,进行免疫重建,部分风险较低的早期患者仅进行ART治疗病变就能消退,而风险较高的患者通常需要ART联合化疗[9]。化学治疗主要包括阿霉素、博莱霉素、长春碱类、依托泊甙,多西他赛、紫杉醇、多柔比星脂质体等药物。免疫治疗和抗血管治疗包括干扰素(IFN)、白介素(IL)Ⅱ、抗血管增生药物。部分患者尚需要外科治疗、冷冻治疗及激光治疗等局部治疗。与其他类型的KS相比,AIDS-KS的病变部位更加多样,疾病进展更加迅速,恶性程度更高。该病预后取决于机体的免疫功能、疾病所处的不同阶段、有无机会性感染等相关因素。AIDS-KS如不得到及时治疗,2年内病死率在50%以上。
临床上引起血小板减少的病因很多,包括生成减少、破坏过多、分布异常等,仅靠血小板计数或外周血细胞形态检查不能完全明确诊断。详细地了解病史、分析临床表现以及进行必要的实验室检查对及时诊断非常重要。血小板减少不是一个独立的疾病,引起该症状的病因很多。主要分为造血系统疾病和非造血系统疾病,造血系统疾病中以特发性血小板减少性紫癜(ITP)最多见,而非造血系统疾病中艾滋病的发病率逐年增多,应引起临床医生的足够重视[10]。单纯以血小板减少为首发表现的艾滋病的临床表现无特异性,与ITP相似,如骨髓象提示增生活跃或增生明显活跃、巨核细胞增多伴成熟障碍,若不做HIV抗体检查则可能会误诊为lTP。HIV感染相关性血小板减少的机制主要有:HIV感染后体内产生抗血小板抗体,形成免疫复合物导致肝脾等单核巨噬系统对血小板破坏增多而发病,检查发现,有血小板减少的HIV感染者多存在淋巴结、肝、脾的肿大;HIV感染后诱导骨髓造血细胞凋亡或直接破坏巨核细胞或影响巨核细胞血小板的有效生成;继发性肿瘤如卡波西肉瘤和淋巴瘤时,肿瘤细胞直接浸润骨髓或分泌肿瘤坏死因子使血小板生成减少;造血原料如维生素B12和叶酸缺乏将导致无效造血,容易引起贫血、粒细胞减少症及血小板减少[11-12]。
血小板减少[无原因的贫血(血红蛋白<80g/L)、中性粒细胞减少(<0.5×109/L)或慢性血小板减少(<50×109/L)]是成人HIV感染者进展为AIDS临床3期的标志[8]。目前,5%-15%的HIV感染者以血小板减少作为初次就诊的患者日益增多,所以掌握AIDS的临床和血液学特点能帮助临床医生在日常工作中更好地认识该病,特别是单纯以血小板减少为首发表现的病例,骨髓象表现不具有特异性时行HIV检测,将有助于准确诊断并避免误诊和漏诊。对于HIV相关性血小板减少的治疗,原则上与非HIV感染成人中特发性血小板减少性紫癜一致,尽快提高血小板计数,预防严重出血。其中对于血小板计数>30×109/L,且无出血表现的患者,可予观察和随访;若出现血小板重度减少,血小板计数≤30×109/L,则应进行紧急治疗。另外,对于有出血症状的患者,不论血小板减少情况如何,都应积极治疗,否则均应优先考虑给予抗HIV治疗。目前,糖皮质激素仍是血小板减少患者的一线治疗首选,大剂量地塞米松起效快,安全性高,口服或静脉给药无效者在2周内可重复1个疗程;常规剂量泼尼松使用剂量为1mg·kg-1·d-1,最大剂量为80mg/d,起效后应尽快减量,至6-8周停用,2周内泼尼松治疗无效的患者应尽快减停,维持治疗剂量不宜超过5mg/d,无论选择哪种糖皮质激素作为一线治疗,治疗的时限都必须限定在6-8周之内,但同时都应给予抗病毒药物,预防病毒再激活[10]。一些机制可以潜在地解释糖皮质激素与KS的关系,糖皮质激素是一种抗炎药,可以抑制大多数炎症,糖皮质激素抑制自然杀伤细胞的活性,而这些细胞在抗癌中发挥重要作用,糖皮质激素引起免疫监视的畸变,通过调节糖皮质激素受体的表达和HHV-8的激活,上调KS细胞生长因子的肿瘤抑制素M和IL-6,阻断自分泌抑制因子β,导致了肿瘤的发生[13]。一项针对145例AIDS-KS患者的研究表明,其中50例发生卡波西肉瘤相关免疫重建炎症综合征(KS-IRIS),与未发生KS-IRIS组相比,KS-IRIS组使用糖皮质激素的频率更高(54.9%比36.47%),17例患者死亡,其中接受糖皮质激素治疗组病死率是未接受糖皮质激素治疗组的4倍,表明糖皮质激素的使用与KS患者死亡密切相关,KS-IRIS患者禁用糖皮质激素,因为激素可刺激KS梭形细胞增生导致病情加重,进而威胁生命。糖皮质激素治疗在临床上也与其他类型的KS相关,如医源性免疫抑制型(移植后)KS,在大多数情况下,停止免疫抑制疗法会导致KS缓解,但对于HIV感染者来说不会。
该患者在来我院治疗之前已于两家不同的三甲医院就诊,临床考虑特发性血小板减少,进行长达10个月的激素治疗,且为连续使用,患者来我院就诊时已是AIDS晚期且出现了KS,综合该病例的发展过程,临床医师应提高对AIDS临床相关症状的警惕,结合流行病学史、临床特征和实验室血液检查等进行综合诊断,遇到长期不明原因的血小板减少患者,应常规排查HIV感染,一旦发现感染应及早启动抗HIV治疗。此外,针对HIV抗体阳性的血小板减少患者,应在评估风险和益处后,规范使用糖皮质激素,预防诱发KS。
注:作为一名病理医师,有幸参与了该病例的多学科讨论,使我对卡波西肉瘤的认识不仅仅局限于显微镜下的组织学特点,了解了卡波西肉瘤的发生发展、危险因素、临床特点、治疗及预后等方面,获益匪浅,故撰写此文供大家学习,如有不妥之处,请各位老师批评指正。
参考文献
[1]中华医学会感染病学分会艾滋病丙型肝炎学组,中国疾病预防控制中心.中国艾滋病诊疗指南(2021年版)[J].协和医学杂志,2022,13(2):203-226.
[2]Sternbach G, Varon J. Moritz Kaposi: Idiopathic pigmented sarcoma of the skin[J].J Emerg Med,1995,13(5):671–674.
[3] Kwang H C,Jae H B,Jun Y L,et al. Kaposi sarcoma after corticosteroid therapy for idiopathic thrombocytopenic purpura[J].AnnDermatol.2009,21(3):297-299.
[4] 杨洪亮,张志蓉,艾比拜·杰力力,等.卡波西肉瘤流行病学特征、发病机制及治疗的研究进展[J].中国慢性病预防与控制,2020,28(10):798-800.
[5] Lu H N, Amirian E S, Scheurer M E.The interaction between smoking status and highly active antiretroviral therapy (HAART) use on the risk of Kaposi’s sarcoma (KS) in a cohort of HIV-infected men[J]. Br J Cancer . 2013,108(5):1173-1177.
[6]El-Mallawany N K,Villiera J,Kamiyango W,et al.Endemic Kaposi sarcoma in HIV-negative children and adolescents: An evaluation of overlapping and distinct clinical features in comparison with HIV-related disease[J]. Infect Agent Cancer.2018,13:33.
[7]Hitomi F,Takayuki K,Hideki H,et al. Pathology of Kaposi's sarcoma-associated herpesvirus infection[J].Front Microbiol,2011,2:175.
[8] World Health Organization. Consolidated guidelines on the use of antiretroviral drugs for treating and preventing HIV infection:recommendations for a public health approach[M].2nd ed. Geneva:WHO,2016.
[9]曾妍茗,欧阳净,何小庆,等.艾滋病相关性卡波西肉瘤诊治的研究进展[J].中华传染病杂志,2020,38(12):837-840.
[10]中华医学会血液学分会血栓与止血学组.成人原发免疫性血小板减少症诊断与治疗中国指南(2020年版)[J].中华血液学杂志,2020,41(8):617-623.
[11]Franchini M,Veneri D,Lippi G.Thrombocytopenia and infections[J].Expert Rev Hematol,2017,10(1):99-106.
[12] Suja S,Saravanan T,Karthikeyan S.Profile of hematological abnormalities and its correlation with absolute CD4 count and human immunodeficiency virus viral load in human immunodeficiency virus- infected patients in a tertiary care hospital[J].Indian J Sex Transm Dis AIDS,2020,41(2):156-161.
[13] Mónica F S,María C I,Yuria A T,et al. Steroids are a risk factor for Kaposi's sarcoma-immune reconstitution inflammatory syndrome and mortality in HIV infection[J]. AIDS.2016,30(6):909-914.
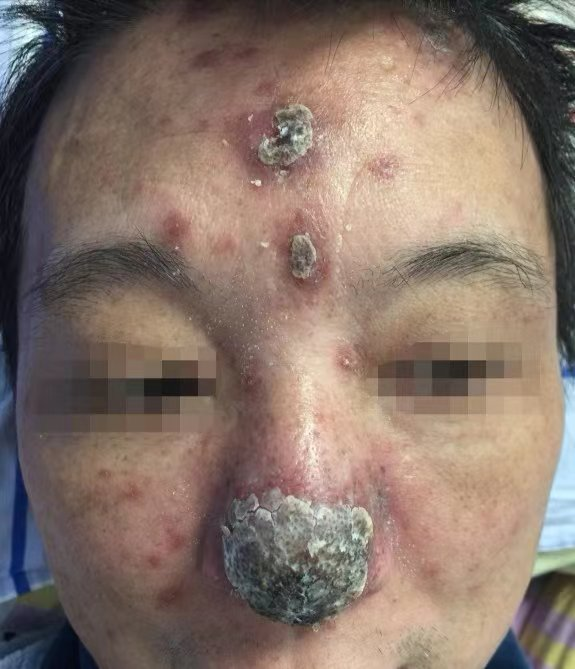
图1.患者入院时临床表现
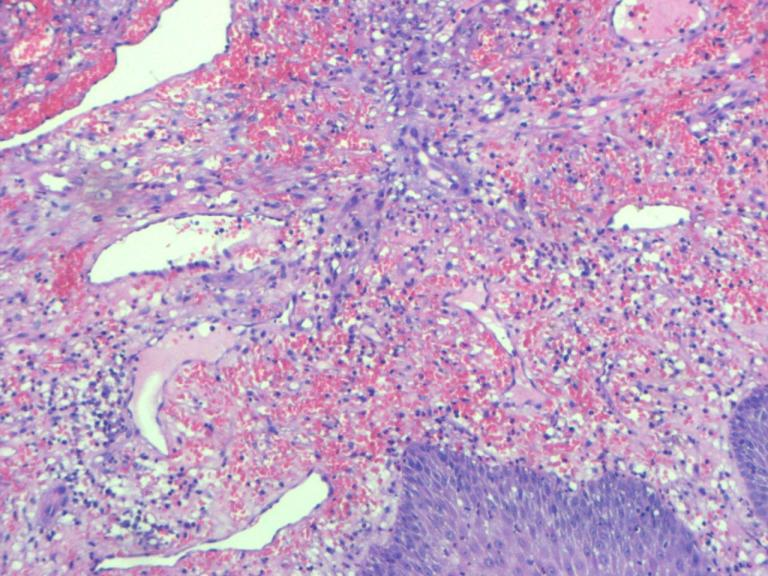
图2.慢性炎症细胞浸润,红细胞外渗,裂隙状血管
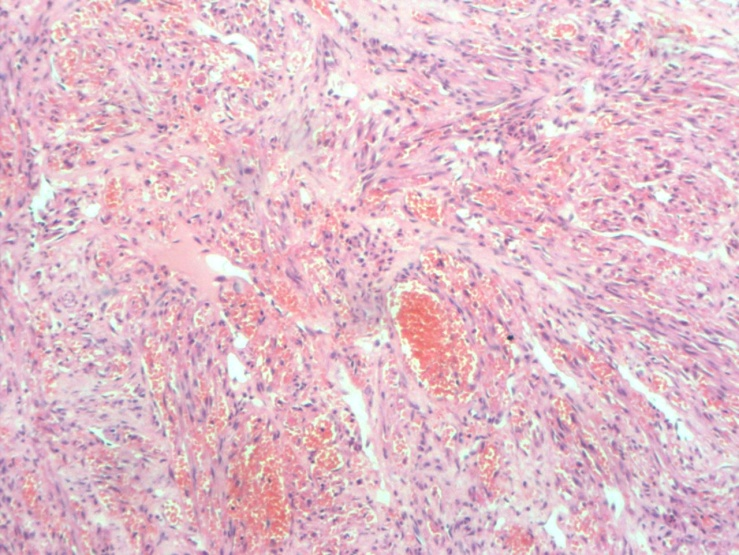
图3.异型增生的梭形细胞交叉束状分布
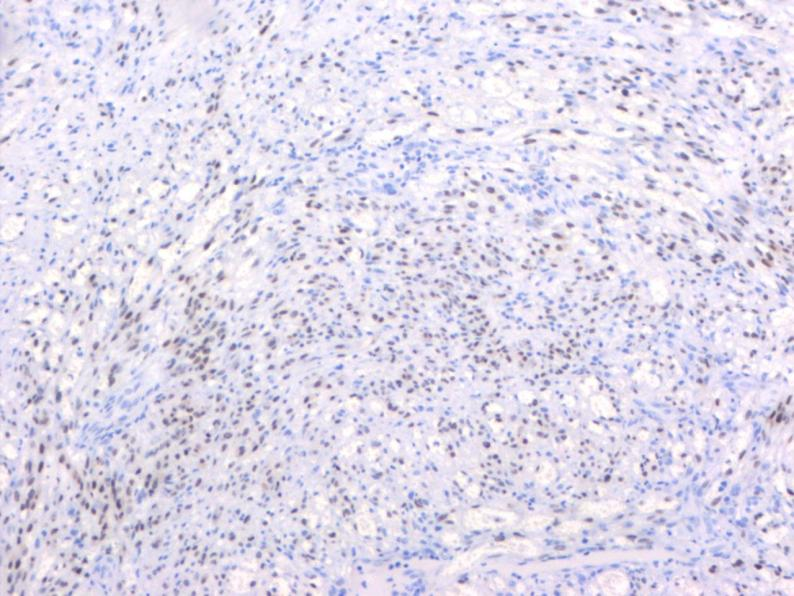 图4.异型增生的梭形细胞HHV8阳性,EnVision两步法
图4.异型增生的梭形细胞HHV8阳性,EnVision两步法
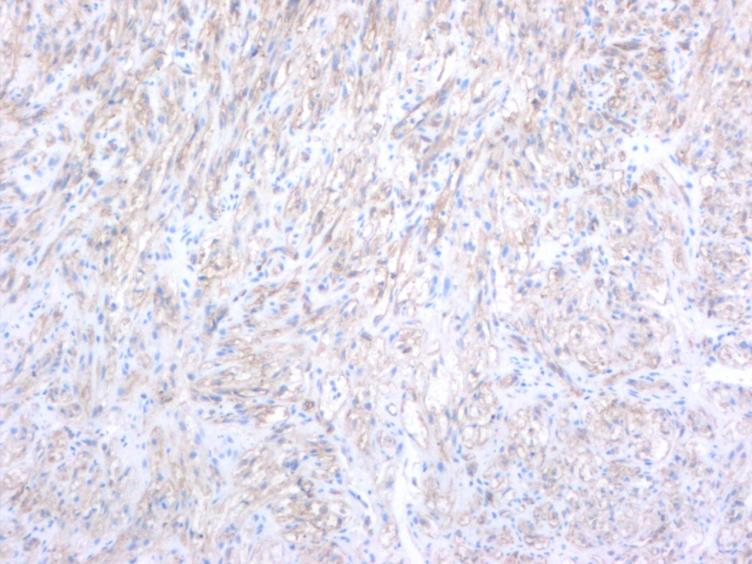 图5.异型增生的梭形细胞CD34阳性,EnVision两步法
图5.异型增生的梭形细胞CD34阳性,EnVision两步法


















共0条评论