EB病毒编码的LMP1在鼻咽癌肿瘤微环境中的作用:从功能到治疗
摘要 鼻咽癌(NPC)与EB病毒(EBV)感染密切相关,其特征还表现为淋巴细胞的严重浸润。EBV编码的潜伏膜蛋白1(LMP 1)被认为在NPC发病机制中发挥重要作用,因为其能够激活多个细胞信号通路,这些信号通路共同促进细胞增殖和存活、血管生成、侵袭性和有氧糖酵解。LMP 1还影响细胞-细胞相互作用、抗原呈递以及细胞因子和趋化因子的产生。在这里,我们讨论了LMP 1如何调节局部免疫反应,有助于建立NPC肿瘤微环境,且还讨论了靶向LMP 1蛋白作为EBV驱动的恶性肿瘤的新疗法的策略。
1.前言
鼻咽癌(Nasopharyngeal Carcinoma,NPC)是一种发生于鼻咽粘膜上皮的恶性肿瘤。鼻咽癌在西方国家是一种罕见的癌症,但在东南亚、中国南部和地中海盆地的发病率很高。根据国际癌症机构的数据,2018年全球报告了约129,000例新的NPC病例。超过70%的新病例报告在中国南方和东南亚,而只有1.7%的病例在美国发现。根据世界卫生组织(WHO)分类,NPC分为三种组织病理学亚型:I型角化鳞状细胞癌,II型非角化鳞状细胞癌和III型基底样鳞状细胞癌。II型非角化型NPC分为分化型和未分化型。角化型鼻咽癌在西方国家比较常见(约75%),而在中国南方和东南亚,非角化型肿瘤占鼻咽癌的97%以上。非角化型NPC与EBV感染密切相关,无论其地理分布、种族起源和当地患病率如何。因此,EBV被认为是NPC发病机制中的关键致病因素。
2.宿主中的EBV感染
NPC与EBV的相关性最早是通过血清流行病学研究发现的。在NPC患者的血清中一致地检测到针对几种EBV复制抗原升高的IgA抗体滴度。随后,在NPC患者中检测到循环细胞外游离EBV DNA水平升高。由于EBV DNA水平与NPC肿瘤分期和总生存期密切相关,因此循环细胞外游离EBV DNA的检测已成为生物标志物的金标准。在NPC组织中,一致地检测到克隆的EBV基因组和EBV编码的潜伏基因产物。在浸润性癌和高度异型增生病变中可以检测到EBV,但低度异型增生和正常鼻咽上皮EBV均为阴性。这些发现提示潜伏性病毒感染发生在肿瘤细胞克隆性扩增之前,早期基因改变可能使癌前细胞易受EBV潜伏性感染。EBV编码的潜伏病毒基因的表达可能赋予生长和存活优势,促进遗传改变的EBV感染克隆的扩增。EBV可以在体外有效地转化静息B细胞,这种作用依赖于病毒潜伏基因表达,并模拟病毒在体内促成各种B细胞恶性肿瘤的能力。
EBV是一种普遍存在的病毒,感染了全球95%以上的人口。免疫不耐受宿主(未感染宿主)中的原发性EBV感染刺激针对潜伏抗原和裂解抗原的强烈细胞毒性T细胞(CTL)应答,其控制EBV转化的B细胞的扩增。EBV在血液和咽部淋巴组织之间循环的记忆B细胞库中建立终身潜伏感染。在口咽部B细胞和/或上皮细胞中,从潜伏性感染周期性地转变为溶解性感染,导致病毒在喉部脱落。
在大多数人中,原发感染和长期携带病毒都是无症状的;然而,EBV与许多人类恶性肿瘤有关。除鼻咽癌外,EBV感染还与地方性Burkitt淋巴瘤(BL)、霍奇金淋巴瘤(HL)、移植后淋巴组织增生性疾病(PTLD)和部分胃癌(GC)有关。在EBV潜伏感染过程中,EBV采取不同的潜伏形式(潜伏I、潜伏II和潜伏III),不同的潜伏基因表达谱不同。在体外,EBV有效地感染和转化原代B细胞,产生永生化的淋巴母细胞系(LCLS)。LCLS和PTLD都表现出III型潜伏期,所有潜伏基因包括核蛋白(EBNA-1、-2、-3a/3b/c和-Lp)、膜蛋白(LMP-1、-2a、-2b)和非编码RNA(EBER1、EBER2和BART RNAs;BHRF1和BART miRNAs)都有表达。HL和NPC表现为II型潜伏期,表达EBNA1、LMP1、LMP2a/2b、EBER1/2RNAs、BART RNAs和miRNAs。地方性白血病以I型潜伏期为主,表达EBNA1、LMP2a/2b、EBER1/2RNAs、BART和miRNAs。
3.LMP1在NPC中的表达
在NPC中表达的EBV编码的基因产物中,潜伏膜蛋白1(LMP 1)特别令人感兴趣,因为LMP 1是一种特异性的蛋白质它在体内和体外显示致癌特性。LMP 1蛋白在NPC组织中的表达是可变的。采用传统的免疫组化显色法,LMP 1在NPC中的检出率在20%-60%之间。然而,在几乎所有癌前或侵袭前NPC组织样品中检测到LMP 1蛋白,表明LMP 1在NPC发病的早期阶段中起作用。有趣的是,发现LMP 1阳性肿瘤比LMP 1阴性肿瘤更具侵袭性,并且易于侵入淋巴结。LMP 1表达还与介导侵袭、血管生成和转移的蛋白质的表达显著相关,例如NPC肿瘤中的Twist、MMP 9、c-Met、Ets-1。此外,LMP 1阳性的NPC组织与淋巴结转移和较差的总生存期(OS)显著相关。LMP 1也是NPC预后不良的一个强风险因素。现在公认LMP 1是一种有效的癌症驱动因素,参与NPC进展的不同阶段。然而,一些NPC样本中LMP1蛋白表达的缺乏引起了关于LMP1在NPC发展中的贡献问题。虽然这个问题仍然存在争议,但最近的一项研究比较了灵敏的免疫荧光染色方法与传统的免疫组化方法,证实了所有原发性NPC样本中存在LMP1蛋白,染色水平为弱至中等。这与传统的免疫组化染色形成对比,在传统的免疫组化染色中,在相同的NPC组织中观察到LMP1蛋白表达的完全缺乏或仅为弱水平。这些发现表明,非常低水平的LMP1蛋白表达传统的免疫组化方法是无法检测到的,但可能足以引起生物学效应并促进肿瘤的进展。事实上,我们以前的研究表明,非常低水平的LMP1(几乎无法检测到)足以激活NFkB信号传导,这是一种有助于LMP1介导的细胞生长和存活的关键途径。相比之下,NPC细胞中高水平的LMP1表达诱导生长抑制,并且还增加了对顺铂诱导的细胞凋亡的敏感性。因此,NPC细胞中低水平的LMP1表达可能是LMP1介导其致癌和转移作用的关键。
4.LMP1介导的信号通路及其相关的致癌作用
LMP 1是一种完整的膜蛋白,包含一个短的N末端胞质结构域、六个跨膜跨环和一个长的C末端胞质尾区,该尾区含有两个称为C末端激活区的信号传导结构域CTAR-1和CTAR-2。LMP 1作为CD 40的组成型活性病毒模拟物发挥作用,CD 40是肿瘤坏死因子(TNF)受体超家族的成员。通过其两个C-末端激活区(CTAR区),LMP 1激活许多信号级联。这些包括NF-kB、PI 3 K-AKT、ERK-MAPK、JNK、JAK-STAT和p38/MAPK信号传导途径。总的来说,这些途径协调各种下游细胞靶点的表达,这些靶点有助于LMP 1的致癌活性(图1)。
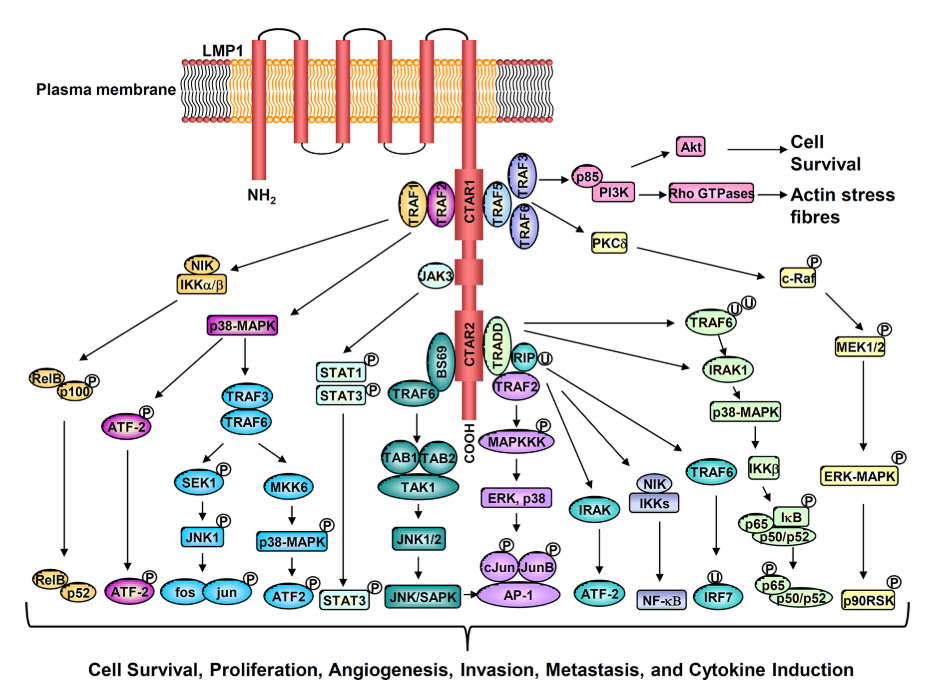 图1.LMP1激活多种细胞信号传导途径可促进细胞存活、增殖、血管生成、侵袭、转移和细胞因子产生.
图1.LMP1激活多种细胞信号传导途径可促进细胞存活、增殖、血管生成、侵袭、转移和细胞因子产生.
在EBV驱动的B细胞永生化、LMP 1转基因小鼠中淋巴瘤发生和表皮增生的诱导以及已建立的啮齿动物成纤维细胞系的恶性转化中对LMP 1的绝对需要,强调了该蛋白质的致癌潜力。与这种致癌功能一致,LMP 1已被证明发挥多种多效性作用,这些包括抑制小鼠胚胎成纤维细胞的衰老;阻断上皮细胞分化;诱导上皮间质转化(EMT)、细胞增殖和非贴壁依赖性生长;上调抗凋亡蛋白以增加细胞存活;诱导血管生成和转移因子以促进增加细胞运动性和侵袭性生长;以及能量代谢失调。LMP 1还通过诱导一组免疫相关蛋白介导许多免疫调节作用,以保护病毒感染的肿瘤细胞免受免疫攻击。
在这篇综述中,我们描述了LMP1在NPC中的病理作用,重点介绍了它在肿瘤微环境(TME)的形成和维持中的作用。我们还将讨论针对LMP1蛋白或对抗NPC免疫抑制TME的潜在治疗方法。
5.基质细胞与EBV感染NPC细胞在肿瘤微环境中的相互作用
在EBV血清阳性的健康个体中,CD8+T细胞对LMP1的反应很弱,相反,它们偏振于特定的EBV裂解抗原和EBNA3蛋白家族(3a,3b,3c)。EBV在静息记忆B细胞中的持久性在免疫上是沉默的,因为细胞无法引发强大的免疫反应。然而,病毒的重新激活和生长转化受到细胞毒性T淋巴细胞(CTL)和针对裂解和潜伏的EBV抗原的抗体的控制。众所周知,NPC患者具有免疫活性,不会死于EBV诱导的淋巴增生性疾病,通常与严重的免疫抑制有关。与肿瘤相关的EBV蛋白(EBNA1、LMP1和LMP2)特异的循环中的CD4+和CD8+记忆T细胞大部分是完整和有功能的,尽管它们的频率略低于健康献血者。相反,从NPC患者分离的自然杀伤(NK)细胞可以被有效地激活和扩增,以发挥细胞溶解活性。然而,NPC患者的EBV特异性免疫反应似乎不能消除肿瘤细胞。
6.NPC的淋巴细胞浸润
除了EBV的一致存在外,NPC的特征在于肿瘤内存在CD45+肿瘤浸润性淋巴细胞(TIL),导致NPC最初归类为淋巴上皮瘤样癌。肿瘤通常含有大量EBV阴性的非恶性浸润的主要由CD 8+和CD 4+T细胞以及自然杀伤(NK)细胞、B细胞、肥大细胞和各种类型的骨髓细胞(包括单核细胞、巨噬细胞和嗜中性粒细胞)的亚群组成的白细胞。存在几种具有已知免疫抑制功能的浸润细胞类型,包括CD 4+CD 25+Foxp 3+T调节细胞(TCFs)、髓源性抑制细胞(MDSC)和肿瘤相关巨噬细胞(TAM)。尽管TIL在肿瘤微环境(TME)中占基质细胞的很大比例,但它们似乎对NPC肿瘤细胞没有抑制作用。研究表明,从NPC活检中分离的浸润性EBV特异性CTL缺乏细胞毒性活性,并且不能响应于自体EBV永生化淋巴母细胞系(LCL)的刺激而产生IFN-g。这些发现表明,TME内大量TIL的存在不能抑制病毒感染或肿瘤生长,并且可能无意中通过许多机制促进肿瘤生长和进展,原因在于TIL可能受到癌细胞分泌的细胞因子、免疫检查点蛋白和外泌体的影响。
7.LMP1抗原决定簇的免疫抑制作用
研究表明,LMP1阳性NPC肿瘤含有比LMP 1阴性病例更显著的淋巴细胞浸润,暗示LMP 1在促进淋巴细胞浸润到NPC TME中的作用。然而,LMP 1免疫原性差,产生弱的体液和细胞免疫应答。在健康的EBV血清阳性个体中,CD 8+T细胞应答通常不针对LMP 1。相反,应答针对其他EBV裂解抗原和强免疫原性EBNA 3蛋白家族。LMP 1缺乏免疫原性可能与LMP 1蛋白表位的免疫抑制作用有关。先前的研究已经表明,纯化的LMP 1蛋白或源自LMP 1第一次跨膜的肽(LALLFWL)刺激抑制性T细胞(所谓的调节性T细胞或T细胞)分泌高水平的IL-10,其抑制有丝分裂原、抗原和CD 3/CD 28刺激的T效应细胞增殖、NK细胞的细胞毒性和抗原诱导的IFN-γ分泌。因此,似乎针对LMP 1和其他肿瘤抗原的CD 4+Th 1和CD 8+细胞毒性应答在NPC中受到抑制,从而导致免疫抑制性TME,其不仅有利于病毒持续存在,而且还支持肿瘤细胞生长和存活。
8.LMP 1对NF-kB和STAT 3信号的激活作用
慢性感染和炎症被认为有助于癌症的发展。鼻咽上皮细胞的EBV感染激活NF-kB和STAT 3途径,导致许多炎性细胞因子和趋化因子的分泌增加。这些,反过来,招募一个大的免疫浸润,这可能会无意中促进肿瘤进展。
NF-kB和STAT 3是参与形成TME的两个重要信号通路。通过诱导促炎细胞因子和趋化因子,肿瘤细胞可以与TME的细胞组成相互作用并影响TME的细胞组成。我们先前的研究已经表明,单独的LMP 1或EBV潜伏感染显著上调鼻咽上皮细胞中的NF-κ B和STAT 3信号通路。对原发性NPC肿瘤进行的研究证实了这些发现,其中在肿瘤细胞中通常检测到组成型活性NF-kB和STAT 3信号传导途径。有趣的是,基因组分析表明,在NPC中驱动异常NF-kB激活的体细胞突变与LMP 1的表达相互排斥。LMP 1通过其CTAR 1和CTAR 2结构域参与TRAF、TRADD和RIP激活NF-kB。LMP 1诱导经典IKK依赖性和非经典NIK依赖性NF-kB途径。NF-κ B家族转录因子影响多种细胞过程,包括细胞增殖、凋亡、肿瘤发生和炎症。因此,由LMP 1或内在体细胞突变介导的NF-kB活化对于NPC进展是必不可少的。
9.LMP1调节肿瘤微环境中基质细胞的反应促进肿瘤进展
通过激活NF-kB、STAT 3和其他信号通路,LMP 1可以诱导参与慢性炎症反应的多个下游靶点的表达(图1)。其中包括多种白细胞介素(IL-1、IL-6、IL-8、IL-10、IL-18、TNF-α),趋化因子(MCP-1/CCL 2、MIP-1a/CCL 3、MIP-1b/CCL 4、RANTES/CCL 5、MIP-3a/CCL 20、MDC/CCL 22)、IP-10/CXCL 10;粘附分子(LFA、ICAM-1、CD18);抗原加工和呈递蛋白(MHC I类、II类和TAP)、环氧合酶-2(COX-2)、血管内皮生长因子(VEGF)、缺氧诱导因子1-a(HIF-1 a),所有这些都涉及免疫逃避、细胞生长、糖酵解、血管生成、侵袭、转移和上皮-间质转化(EMT)(图2)。
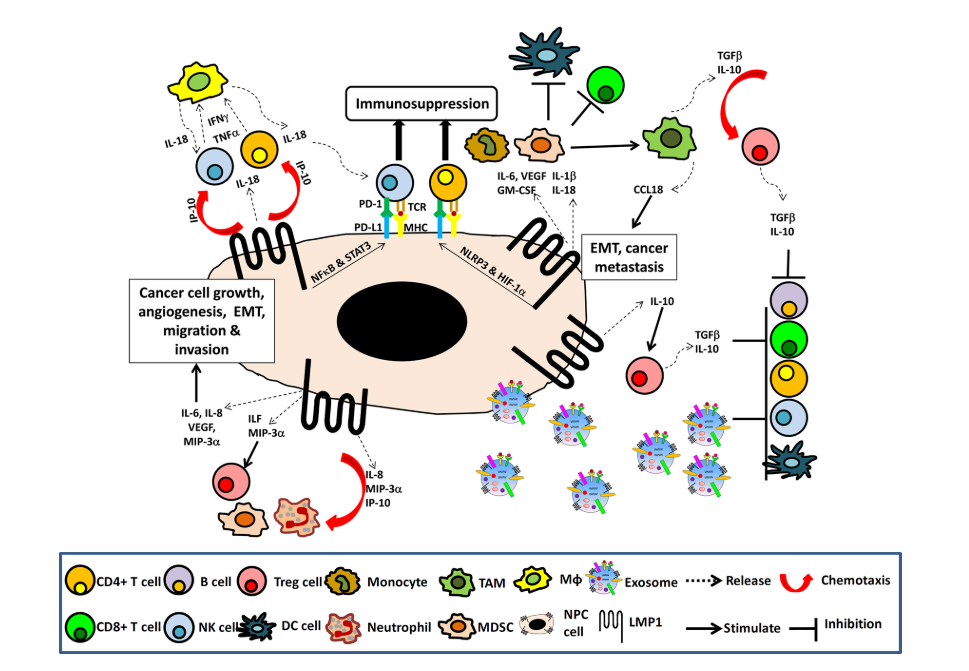 图2.NPC免疫微环境示意图说明了癌细胞中LMP 1诱导NF-κ B和STAT 3信号传导途径和多种免疫细胞因子,导致癌细胞生长、血管生成、EMT、迁移和侵袭以及淋巴细胞、NK细胞、巨噬细胞
图2.NPC免疫微环境示意图说明了癌细胞中LMP 1诱导NF-κ B和STAT 3信号传导途径和多种免疫细胞因子,导致癌细胞生长、血管生成、EMT、迁移和侵袭以及淋巴细胞、NK细胞、巨噬细胞![]() 、嗜中性粒细胞、MDSC、TcB对肿瘤部位的趋化性。TGF β和IL-10的存在,沿着LMP 1上调PDL-1和PD-1,以及含LMP 1的外泌体释放到肿瘤TME中以诱导TME、MDSC和TAM的扩增,其产生促进肿瘤逃避的免疫抑制性TME。
、嗜中性粒细胞、MDSC、TcB对肿瘤部位的趋化性。TGF β和IL-10的存在,沿着LMP 1上调PDL-1和PD-1,以及含LMP 1的外泌体释放到肿瘤TME中以诱导TME、MDSC和TAM的扩增,其产生促进肿瘤逃避的免疫抑制性TME。
10.LMP1诱导免疫调节分子在NPC TME中产生炎性浸润
当在NPC细胞中表达时,LMP 1可以刺激许多免疫调节分子的表达。这些因子中的许多是有效的化学引诱物,其将T细胞和巨噬细胞两者募集到TME。该大家族的成员包括LIF、IL-6、IL-8、IP-10、MDC、MIP-1a、MIP-1b、MIP-3a、NAP-2、RANTES和panGROs。有趣的是,许多这些细胞因子包括LIF,IL-6,IL-8,IP-10和TNF α,VEGF和MIP-3a,与健康对照相比,在NPC患者的血浆中以高水平存在。研究表明,IL-6、IL-8、IP-10和MIP-3a的高水平与晚期NPC患者的EBV DNA载量相关,而IL-8、VEGF、MIP-3a的高水平以及高EBV DNA载量的患者预后较差。
IL-6是一种促炎细胞因子,可作为癌细胞的生长因子发挥作用。IL-6、VEGF、MIP-3a都是由LMP1诱导的,它们都能促进上皮细胞的生长、迁移和侵袭。IL-8被发现是一种白细胞趋化剂,随后被发现在癌症进展中发挥作用。肿瘤来源的IL-8可诱导癌细胞增殖、上皮向间充质转化(EMT)和细胞迁移。IL-8、MIP-3a和IP-10可将中性粒细胞、其他免疫细胞和免疫抑制剂如MDSC和TGFAP募集至肿瘤部位。此外,LIF和MIP-3a可通过激活和扩增T细胞发挥免疫抑制作用。已经显示VEGF将单核细胞募集到NPC肿瘤部位,其中单核细胞可以通过GM-CSF的作用被诱导分化成TAM。活化的TAM分泌CCL 18可促进EMT和NPC转移。已经发现肿瘤内巨噬细胞浸润增加与NPC患者的存活率差相关。总的来说,这些发现表明LMP 1可以通过刺激许多免疫调节分子的表达来驱动NPC的进展,从而产生具有慢性炎症浸润的TME。
11.LMP 1诱导IL-18和IP-10募集并抑制CXCR 3+NK细胞和T细胞的活性
Hu等的研究表明,NPC组织中的肿瘤细胞和CD 68+巨噬细胞均表达IL-18;而且,他们在发现TME中的CD 3+T细胞和CD 94+NK细胞表达IFN-g。Teichmann等人的另一项研究表明,在NPC组织的肿瘤细胞中,IP-10/CXCL 10(一种IFN-g诱导蛋白)的表达增加,其中存在大量表达CXCR 3的淋巴细胞。
IL-18是LMP1的下游靶点。IL-18最初被认为是一种促炎细胞因子,通过促进NK细胞和T细胞分泌干扰素-g来增强Th1反应。IP-10/CXCL10对CXCR3+T细胞和巨噬细胞具有趋化作用。IP-10/CXCL10的表达可由干扰素-g和肿瘤坏死因子-a诱导,也可由LMP1通过激活核因子-kB信号通路来诱导。相应地,表达LMP1的NPC细胞分泌的IL18刺激浸润性T细胞和NK细胞产生干扰素-γ,从而激活CD68+巨噬细胞分泌IL-18,从而启动白细胞募集的正反馈循环。另一方面,表达LMP1的NPC细胞和干扰素-g激活的NPC细胞分泌CXCL-10促进额外的CXCR3+T细胞和巨噬细胞募集到TME,进一步增加淋巴细胞的渗透。
基于该机制,认为IL-18和IP-10/CXCL 10不发挥肿瘤抑制作用,而是促进IFN-γ分泌和CXCR 3+细胞向NPC TME的化学吸引。通过IL-18和IP-10/CXCL 10募集到TME的CXCR 3+T细胞和NK细胞不太可能具有抗肿瘤功能,尽管它们在IFNg产生中具有活性。事实上,已经发现肿瘤来源的IL-18促进肿瘤进展,尽管其具有促炎功能。在各种癌症中检测到IL-18的高表达,并且肿瘤衍生的IL-18与不良预后相关。在NPC中,癌细胞中IL-18水平升高与肿瘤浸润NK细胞密度高和总体生存率低相关。已显示IL-18通过增加活化的成熟NK细胞上的程序性细胞死亡-1(PD-1)的表达而在癌症中发挥潜在的免疫抑制作用。因此,IL-18和IP-10/CXCL 10在NPC中可能在募集和抑制CXCR 3+肿瘤浸润性NK细胞和T细胞中发挥双重作用(图2)。
12.LMP 1介导的PD-1/PD-L1通路抑制CXCR 3+NK细胞和T细胞的抗肿瘤活性
PD-1是一种在活化的TIL上表达的抑制性受体(也称为功能耗竭标记物)。PD-1通过结合其配体程序性细胞死亡配体1(PD-L1)发挥作用,PD-L1通常在肿瘤细胞和免疫细胞上表达。PD-1和PD-L1属于免疫检查点蛋白家族,可抑制免疫细胞增殖并诱导其凋亡,导致免疫抑制。几项基于免疫组化的研究已经确定了NPC组织中肿瘤细胞上的PD-L1表达和TIL上的PD-1表达。PD-L1在NPC组织中的高表达与较差的总生存率显著相关,PD-1和PD-L1在NPC组织中的共表达显示最差的总生存率。有趣的是,LMP 1已被证明通过MAPK/AP-1,JAK 3/STAT 3和NF-kB途径上调NPC细胞中的PD-L1。同样,NPC细胞中PD-L1的表达可以通过IFN-g激活JAK-STAT途径来诱导。在IFN-g处理后,LMP 1阳性NPC肿瘤细胞可以被诱导表达比LMP 1阴性NPC细胞更高水平的PD-L1,表明LMP 1和IFNg在PD-L1的调节中具有协同效应。总的来说,这些发现表明由表达LMP 1的NPC细胞诱导的IL-18促进CXCR 3+T和NK细胞上的IFN-g分泌和PD-1表达。另一方面,LMP 1和IFN-g上调癌细胞上的PD-L1表达。因此,PD-1和PD-L1在TME中的共表达抑制了局部效应T细胞抗肿瘤功能(图2)。因此,靶向PD-L1/PD 1通路以中断免疫抑制可能是一种有希望的抗肿瘤策略,并将在本综述的后面进一步讨论。
13.LMP1介导的糖酵解促进癌症发展和肿瘤逃逸
我们和其他人已经表明,LMP 1能够促进有氧糖酵解,以增强恶性转化、肿瘤进展和对放疗的抵抗。LMP 1通过上调c-Myc、HIF-1 a和FGF 2/FGFR 1信号传导促进有氧糖酵解,这些信号传导共同诱导丙酮酸激酶M2(PKM 2)、乳酸脱氢酶A(LDHA)、己糖酶2(HK 2)和葡萄糖转运蛋白1(GLUT-1)的表达。LMP 1介导的有氧糖酵解增加了细胞对葡萄糖和谷氨酰胺的摄取,增强了LDHA活性和乳酸盐的产生,通过为大分子的合成代谢生物合成提供能量以及代谢中间体来促进细胞快速增殖。乳酸产生增加所产生的酸性TME也促进肿瘤细胞迁移和侵袭。
在最近的一项研究中,Cai等证明肿瘤细胞中LMP 1的表达与GLUT-1的表达以及NPC组织中CD 33+髓源性抑制细胞(MDSC)的丰度相关。NPC中高水平的LMP 1与低无病生存率(DFS)相关。此外,大量的CD 33+MDSC被发现是预后不良的可靠指标。MDSC是未成熟的骨髓细胞,在许多趋化因子和细胞因子的影响下被募集到炎症和缺氧的肿瘤部位。在TME中,浸润的MDSC快速分化成肿瘤相关巨噬细胞(TAM)并产生大量免疫抑制细胞因子如TGF-β和IL-10以将调节性T细胞吸引至TME。MDSC还抑制DC细胞的抗原呈递功能和细胞毒性TIL的抗肿瘤功能。Cai等人表明,NPC细胞中由LMP 1诱导的有氧糖酵解上调了COX-2表达和NF κ B途径的激活(p65磷酸化),这增加了IL-6和GM-CSF的分泌。LMP 1介导的糖酵解还激活了Nod样受体家族3(NLRP 3)炎性体通路,从而增加了IL-1b和IL-18的产生。在TME中诱导IL-6、IL-1b、IL-18和GM-CSF,随后促进MDSC的分化和扩增以及MDSC的增殖和抗凋亡EBV感染的NPC细胞。此外,已发现NLRP 3炎性体和HIF-1a上调PD-L1表达,进而阻断效应免疫细胞增殖。因此,LMP 1介导的糖酵解活性通过多种途径抑制NPC的抗肿瘤免疫应答。
14.LMP 1通过诱导IL-10增强调节性T细胞的免疫抑制功能
IL-10是一种免疫抑制细胞因子,通常在NPC肿瘤细胞中表达。NPC患者IL-10水平升高与CTL数量减少呈正相关。IL-10通过抑制抗原提呈细胞(APC)的活性和1型辅助性T细胞(Th 1)和CTL的抑制功能来调节免疫应答。因此,NPC组织中IL-10的存在促进了TME内的局部免疫抑制。已显示LMP 1通过p38/SAPK 2信号级联上调IL-10。发现约60-68%的LMP 1阳性NPC肿瘤表达IL-10。有趣的是,NPC衍生的LMP 1可通过增加IL-10的产生来增强CD 4+CD 25+Foxp 3+调节性T细胞的功能。IL-10通过IL-10 R作用于调节性T细胞,维持FOXP 3的表达和抑制活性,增强调节性T细胞的分化和免疫抑制功能。在NPC患者和EBV阳性NPC组织的循环中始终检测到调节性T细胞。调节性T细胞是一种抑制性T细胞群,其在抑制CD 4+T细胞和CD 8+T细胞的活化、增殖和细胞因子产生中起重要作用。调节性T细胞还可抑制B细胞和树突细胞。调节性T细胞通过分泌免疫抑制细胞因子(包括TGF β和IL-10)介导其作用。因此,通过LMP 1上调IL-10激活NPC TME中的调节性T细胞,进一步保护EBV感染的NPC细胞免受免疫攻击(图2)。
15.NPC来源的含有LMP1的外泌体可以促进癌症进展和免疫逃逸
已显示EBV感染的淋巴细胞和上皮细胞释放含有LMP1的外泌体。此外,已在NPC患者和移植有NPC组织的小鼠的血清中鉴定出含有LMP 1的外泌体。有趣的是,在NPC组织中观察到LMP1水平与外泌体标志物CD63之间存在强正相关性。通过纳米颗粒跟踪分析和梯度纯化,Hurwitz等人表明,LMP 1不仅增加了外泌体蛋白标志物的表达,而且还刺激了外泌体分泌。外泌体是直接从质膜出芽的分泌性微泡,其通过将蛋白质、DNA、mRNA和miRNA转移至靶细胞以调节其信号传导途径和细胞活性而在细胞间通讯中起作用。外泌体在TME内局部传递信息以及全身传递到远处组织部位。
先前的研究表明,从表达LMP 1的C666-1 NPC细胞和C33 A宫颈癌细胞释放的外泌体可以有效地转移到HUVEC细胞和Rat-1成纤维细胞。在这项研究中,外泌体衍生的LMP 1显示出生物活性,因为它能够激活受体细胞中的PI 3 K/Akt和Erk/MAPK信号通路。含有来源于NPC细胞的外泌体的LMP 1也显示出直接诱导由强刺激或促分裂原介导的TCR活化触发的T细胞无反应性。总的来说,这些发现表明,外泌体衍生的LMP 1可以在TME内的非EBV感染的宿主细胞中发挥其致癌和免疫抑制作用,以促进癌症进展。
FGF-2、EGFR、HIF 1a和半乳糖凝集素9(Gal-9)也在NPC衍生的外泌体中发现,它们直接或间接与LMP 1相互作用。外泌体HIF 1-a被发现被LMP 1上调,并显示在DNA结合和转录活性中具有功能。发现外泌体HIF 1-a可调节E-和N-钙粘蛋白(与EMT相关的两种连接蛋白)的表达,并促进受体细胞迁移和侵入的能力。还发现LMP 1促进外泌体分泌FGF 2和EGFR。我们以前的研究表明,LMP 1上调FGF 2/FGFR 1信号通路以及HIF 1a表达,以促进有氧糖酵解。FGF-2被认为是一种有效的血管生成因子,参与肿瘤侵袭。EGFR是LMP 1的下游靶点,通过激活多个酪氨酸激酶相关信号级联促进细胞增殖。外泌体EGFR已被证明可激活受体细胞中的促生长途径:MAPK/ERK和PI 3 K/Akt。因此,外泌体中LMP 1与FGF-2、EGFR和HIF 1-a的相互作用促进受体细胞中的细胞增殖、EMT、血管生成和转移。
有趣的是,发现LMP 1与NPC衍生的外泌体中的Gal-9相互作用,即使Gal-9不被LMP 1募集到脂筏,其表达也不被LMP 1诱导。Gal-9是一种β-半乳糖苷结合凝集素,在控制免疫细胞方面具有双重作用。Gal-9作为促炎因子诱导树突状细胞成熟,从而促进Th 1免疫应答。Gal-9是Tim-3的配体,Tim-3是一种死亡诱导受体,其功能是自我限制免疫反应。Gal-9通过与Tim-3结合诱导成熟Th 1细胞凋亡,从而终止Th 1免疫应答,从而产生负反馈回路。Gal-9还促进CD 25+Foxp 3+调节性T细胞分化和扩增。EBV感染和细胞因子,特别是IFN-γ和IL-1b诱导Gal-9表达。NPC肿瘤细胞和异种移植肿瘤显示表达高水平的Gal-9,尽管其表达并不总是与LMP 1的表达相关。含有Gal-9的外泌体通常在来自NPC患者和移植有NPC组织的小鼠的血清中检测到。已显示Gal-9的外泌体递送通过Gal-9/Tim-3相互作用诱导EBV特异性CD 4+T细胞的凋亡。此外,NPC细胞分泌的细胞外Gal-9刺激CD 33+髓样细胞产生IL-1β和IL-6,这反过来又促进MDSC从CD 33+髓样细胞分化和扩增。因此,NPC细胞分泌的含有LMP 1的外泌体通过改变基质细胞在增殖、血管生成、侵袭、迁移以及免疫监视中的反应在调节TME中发挥重要作用。发现重组LMP 1或Gal-9抑制T细胞增殖,当它们组合时没有协同作用。鉴于LMP 1和Gal-9具有相似的免疫抑制特性,因此LMP 1和Gal-9在NPC衍生的外泌体中对肿瘤免疫逃避的影响值得进一步研究。
16.ISG 15在具有上皮-免疫双重特征的NPC细胞中的表达上调
在最近的一项研究中,单细胞转录组分析确定了表达高水平免疫相关基因的肿瘤细胞亚群。有趣的是,NPC组织中具有这种“上皮-免疫”双重表型的细胞的存在与较差的预后相关。它们的存在还与CD 8 TIL上的共抑制受体(PD-1、LAG-3、TIM-3、TIM-4和CD 276)的表达强烈相关,反映了在含有这种独特的癌细胞亚群的肿瘤中TIL的更深刻的功能障碍。功能研究还表明,“上皮-免疫”肿瘤亚群显示出更大的肿瘤发生能力,更大的免疫细胞募集和调节潜力,并且能够抑制T细胞产生IFN-γ。鉴于LMP 1在NPC细胞中的表达上调了许多促进免疫抑制的细胞因子和免疫调节分子,LMP 1表达与这些“上皮-免疫”NPC细胞的存在之间的可能相关性显然是值得进一步研究的领域。
上皮-免疫肿瘤细胞表达高水平的免疫相关基因,包括干扰素(IFN)应答基因[例如IFN刺激基因5(ISG 15)]、主要组织相容性复合体II(MHC II)编码基因(例如HLA-DR)和补体基因(例如C3)。在这些基因中,ISG 15是特别值得注意的。ISG 15最初与抗病毒和抗菌活性相关,并且其表达被IFNα和IFNβ以及IFN调节因子(IRF)如IRF 7上调。有趣的是,ISG 15和IRF-7均由LMP 1通过激活NF-κ B信号传导途径诱导。反过来,IRF 7可以与LMP 1启动子结合以诱导LMP 1表达,与LMP 1形成调节回路。IRF 7-LMP 1正反馈环与ISG 15在NPC细胞中上调之间的可能相关性也是值得进一步研究的领域。
ISG15是一种泛素样蛋白,其以游离ISG15或结合形式存在于细胞中。通过ISG化途径,ISG15与许多参与IFN诱导的免疫应答或细胞蛋白质周转调节的细胞蛋白质结合。ISG15具有免疫调节促肿瘤和抗肿瘤功能。细胞内ISG15已显示促进乳腺癌细胞中MHC I类复合物的表达,而分泌的ISG15已显示通过抑制乳腺癌细胞中的MHC I类复合物的表达而表现出抗肿瘤活性诱导NK细胞增殖和向肿瘤细胞迁移以及从淋巴细胞释放IFN-γ。然而,已显示ISG15在癌细胞中诱导增殖、凋亡抗性、侵袭和迁移。ISG15的高表达已在广泛的人类肿瘤中得到证实,其过表达与分化、转移和不良预后相关。在NPC患者中,高水平的ISG15表达与局部复发、较差的总生存期(OS)和无病生存期(DFS)相关。ISG15在NPC细胞中的异位表达伴随着体外集落和肿瘤球形成以及体内致瘤性的增加。还发现ISG15增加NPC细胞对放射和顺铂治疗的抗性。与ISG15类似,IRF7也具有双重功能。它是响应病毒感染的IFN基因的关键激活剂。然而,IRF7本身是致癌的,因为它可以促进无胸腺小鼠中NIH 3T3的锚定非依赖性生长和恶性转化。IRF7通常在原发性NPC组织中表达,其表达与LMP1表达以及颈淋巴结转移相关。IRF7参与EBV潜伏期的维持,并与LMP 1在细胞转化中具有协同作用。研究IRF7和ISG15在NPC中是否具有双重功能以及它们是否参与LMP1的致癌活性将是有趣的。IRF7和ISG15参与调节NPC中的炎性TME显然是值得进一步研究的领域。
胰腺癌细胞中ISG 15的过度表达已被证明会对吉西他滨产生耐药性,而NPC细胞中的异位表达会降低细胞对放射和顺铂治疗的敏感性。然而,在食管癌细胞中观察到完全相反的效果,其中siRNA介导的ISG 15耗竭或细胞毒性药物(5-Fu和雷帕霉素)治疗导致内源性自噬增加和耐药癌细胞的增强。与这些发现一致,在耐药癌细胞系中观察到ISG 15水平降低,并且ISG 15过表达乳腺肿瘤细胞显示对抗癌药物喜树碱(拓扑替康)的敏感性增加。这些相互矛盾的发现表明,肿瘤中的ISG 15表达可能是影响癌症化疗治疗的因素,并且ISG 15在肿瘤化疗敏感性中的贡献可能是组织特异性的。因此,在考虑将ISG 15作为NPC的新治疗靶点之前,有必要进行进一步的研究。
17.LMP1通过调节TME内的基质细胞促进癌细胞生长、存活、EMT、血管生成和转移
当在上皮细胞中表达时,LMP 1通过刺激称为钙粘蛋白-整合素“转换”的过程诱导上皮间质转化(EMT)。这导致E-钙粘蛋白,γ-连环蛋白和粘蛋白1的下调,以及伴随的间充质标志物波形蛋白、N-钙粘蛋白、纤连蛋白、Twist、Snail和基质金属蛋白酶(MMPs)所有这些共同促进EMT。总的来说,这种转变促进上皮细胞迁移和侵袭,这可以促进癌症转移。LMP 1还可以通过诱导促血管生成因子如VEGF、FGF和IL-8来促进血管生成。LMP 1诱导细胞生长是通过上调许多生长因子如EGFR和细胞因子如IL-6介导的。LMP 1还可以通过上调抗凋亡蛋白(包括Bcl-2和A20)来促进细胞存活,以保护受感染的癌细胞免受由细胞毒性T细胞介导的潜在细胞毒性信号如Fas配体(FasL)、TNF相关的凋亡诱导配体(TRAIL)的影响。
虽然上述现象涉及LMP 1在EBV感染的上皮肿瘤细胞中的作用,但LMP 1诱导的生长因子、细胞因子和外泌体可能用于调节TME内其他细胞类型的表型。这些不同的肿瘤衍生因子不仅影响白细胞,而且影响其他细胞类型如成纤维细胞、间充质细胞和内皮细胞的行为。近年来,研究集中在称为癌症相关成纤维细胞(CAF)的成纤维细胞亚群上,这些成纤维细胞在伤口愈合或慢性炎症时被激活。CAF是TME中活化的成纤维细胞,与静止的成纤维细胞相比具有不同的免疫表型。成纤维细胞作为细胞外基质(ECM)的来源起作用,并且在伤口愈合、炎症和组织修复过程中起重要作用。响应于激活SMAD、JAK-STAT和NF-kB途径的肿瘤衍生因子(TGF-β、LPA、IL-1、IL-6)或肿瘤衍生外泌体,成纤维细胞被激活。然后,这些通过生长因子(TGF-β,HGF,VEGF)、细胞因子(IL-6,CCL 2,CXCL 12)和ECM的部分参与组织重塑,其影响周围的上皮细胞和免疫细胞。事实上,大量证据支持CAF通过调节CD 8 +ve T细胞、调节性T细胞和TAM的活性和功能来维持免疫抑制性TME。
许多研究证实了癌症相关成纤维细胞(CAF)在上皮恶性肿瘤病理学中的作用。CAF通过分泌生长因子、细胞因子和蛋白酶促进肿瘤进展,这些生长因子、细胞因子和蛋白酶不仅刺激细胞增殖,而且降解细胞外基质,使肿瘤细胞迁移并侵入周围基质。虽然对CAFs和NPC的研究有限,但最近的几项研究已经确定了NPC组织活检中CAFs的存在。使用α-平滑肌肌动蛋白(α-SMA)作为已建立的CAF标志物,几项基于化学药物的研究已经确定了EBV阳性NPC中存在CAF。在他们的研究中,Wang等人描述了CAF阳性程度与NPC肿瘤细胞上CXCR 4配体SDF-1(CXCL 12)表达之间的相关性。此外,在a-SMA水平和内皮细胞标志物CD 34(内皮细胞和微血管密度的标志物)之间观察到显著的相关性,支持CAF在NPC进展中的作用。Chen等人确定CAF密度与不良预后相关。Cox多变量分析显示CAF密度可作为预测患者生存率的独立预后因素。
到目前为止,这些研究还没有检查NPC的LMP 1阳性病例之间的差异。然而,体外研究表明,负载LMP 1的细胞外囊泡(EV)能够通过涉及NF-κ B信号传导的过程诱导正常成纤维细胞形成CAF。这一初步发现提出了LMP 1阳性肿瘤可能更有效地诱导CAF形成的可能性。
18.EBV阳性NPC肿瘤中基于LMP 1的治疗策略
NPC是一种高放射敏感性肿瘤,调强放射治疗(IM-RT)是原发肿瘤和区域淋巴结转移的标准治疗。对于与颈淋巴结转移相关的晚期疾病或肿瘤应用同步化疗-放疗。虽然早期疾病患者的总体生存率是有利的,但仍有相当数量的患者发生治疗失败和远处转移。此外,很大一部分患者患有长期治疗后毒副作用和生活质量差。当前治疗方案的局限性伴随大量晚期患者的出现,促使我们开发更有效的治疗方法,以改善转移性NPC患者的缓解持续时间和生存期。
LMP 1具有多种致癌功能,可以影响癌症的发展。EBV与NPC的强相关性,加上相当大比例的肿瘤表达LMP 1癌蛋白的事实,已经导致了许多靶向LMP 1的方法的开发,作为EBV驱动的恶性肿瘤的潜在治疗(表1)。
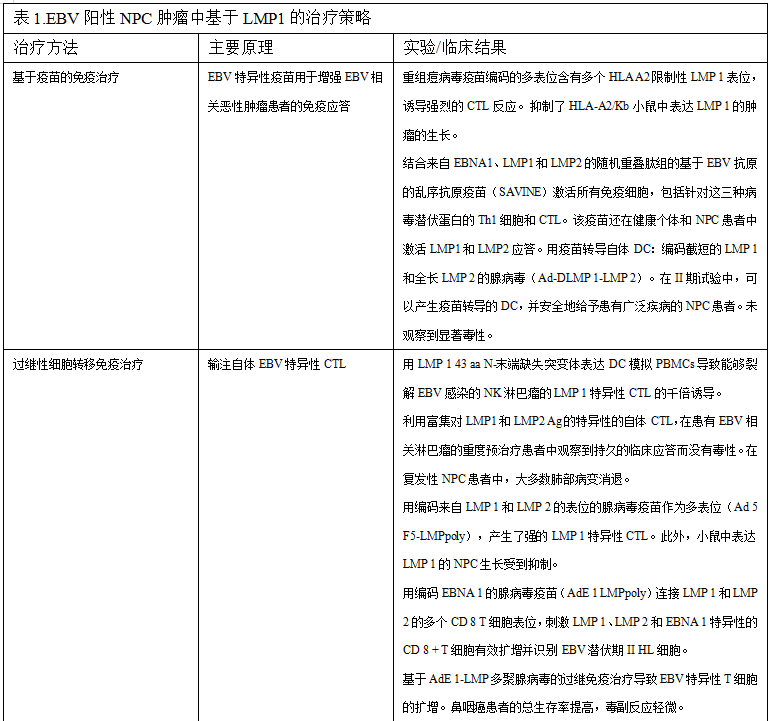
 19.基于T细胞的免疫疗法:基于疫苗的免疫疗法
19.基于T细胞的免疫疗法:基于疫苗的免疫疗法
一种旨在增强EBV相关恶性肿瘤患者免疫应答的EBV特异性疫苗已被评估。一项临床前研究报告称,编码含有多个HLA-A2限制性LMP 1 CTL表位的多表位蛋白的重组痘病毒疫苗不仅诱导了强烈的CTL应答,而且还抑制了HLA-A2/Kb小鼠中表达LMP 1的肿瘤的生长。然而,由于LMP 1表位是HLA-A2限制性的,因此该疫苗并不适合所有种族。因此,一系列HLA等位基因限制性表位对于该方法的普遍适用是必要的。在另一项研究中,Lutzky等人产生了一种基于EBV抗原的混乱抗原疫苗(SAVINE),其掺入了来自EBNA 1、LMP 1、LMP 2的随机重叠肽组。然后将这些肽组插入复制缺陷的腺病毒构建成Ad-SAVINE。这种Ad-SAVINE提供了一个平台来激活所有可能的免疫细胞,包括针对三种病毒潜伏蛋白的辅助细胞和CTL。这种Ad-SAVINE制剂也能够激活健康个体以及NPC患者的LMP应答。
在一项II期临床研究中,Chia等人评估了靶向LMP 1和LMP 2的树突状细胞(DC)疫苗。用编码截短的LMP 1和全长LMP 2的腺病毒(Ad-DLMP 1-LMP 2)转导自体DC。Ad-DLMP 1 LMP 2转导的DC可以成功地产生并安全地施用到16名具有广泛疾病的NPC患者;幸运的是,在任何患者中均未观察到显著的毒性。然而,12名患者中有9名出现迟发型超敏反应,12名患者中只有3名出现临床反应。尽管这些DC在体外激活了LMP 1/2特异性T细胞,但外周LMP 1/2特异性T细胞的数量没有显著增加。进一步探索DC疫苗的修饰或与其他治疗干预的组合可能是必要的,以增加疫苗的治疗效果。
20.基于T细胞的免疫疗法:过继性细胞转移免疫疗法
越来越多的临床证据表明过继性细胞转移免疫治疗(ACT)是治疗EBV相关恶性疾病的一种安全有效的方法。ACT是一种向患者输注通过用EBV转化的LCL重复刺激而离体扩增的自体EBV特异性CTL的方法。ACT对表现出EBV潜伏期III程序的恶性肿瘤特别有效,如移植后淋巴组织增生性疾病(PTLD),其中表达了EBV潜伏期相关蛋白的全部库。然而,在EBV潜伏期II相关的恶性肿瘤(包括NPC和HL)中,只有一部分接受ACT治疗的患者出现临床缓解。这种临床反应性的缺乏可能是由于癌细胞中病毒潜伏抗原表达的受限模式、NPC细胞中表达的EBV蛋白(LMP 1、LMP 2和EBNA 1)的免疫原性差以及局部免疫抑制性TME。由于LCL产生的CTL中只有一小部分识别NPC中表达的EBV蛋白,因此需要设计特异性刺激LMP1、LMP2和EBNA1 CTL的方案。
由于与高水平LMP1表达相关的毒性,LMP1特异性CTL克隆的产生证明是困难的。这种毒性限制了DC作为用于CTL刺激的APC的使用。因此,LMP1特异性CTL通常使用LMP1衍生肽或用过表达LMP1的重组牛痘病毒感染的APC产生。在这些方法中,T细胞克隆的步骤是必要的。然而,T细胞克隆的产生是劳动密集型的,限制了LMP1特异性CTL用于ACT的使用。在这方面,Gottschalk等人开发了一种新的方案,其通过用表达功能上无活性且无毒的LMP1特异性CTL的DC刺激PBMC来产生多克隆LMP1特异性CTL系LMP 1突变体,其中43 aaN-末端缺失。用表达该LMP 1突变体的DC模拟PBMC导致LMP 1特异性CTL的千倍诱导。此外,这些多克隆群体显示出功能性,因为它们能够分别杀死EBV感染的NK细胞系和NK淋巴瘤。在评价富集LMP 1和LMP 2抗原的多克隆CTL的疗效的临床试验中获得了令人鼓舞的结果,在接受过大量预治疗的EBV相关淋巴瘤患者中观察到了持久的临床应答,且无显著毒性。此外,在一项NPC临床研究中,在复发性NPC患者中过继转移LMP 1和LMP 2表位特异性自体CTL,导致大多数肺部病变消退,尽管原发性肿瘤并未完全消退。这些发现表明,特异性靶向LMP 1和LMP 2抗原的CTL可能有助于靶向EBV潜伏期II相关恶性肿瘤患者的肿瘤相关病毒抗原。
为了增强CTL的特异性及其对EBV潜伏期II相关恶性肿瘤的抗肿瘤应答,Duraiswamy等人开发了一种复制缺陷型腺病毒疫苗,其编码来自LMP 1和LMP 2的13个不同的HLA I类限制性CTL表位作为多表位。该重组腺病毒LMP多表位(Ad 5 F5-LMPpoly)载体刺激了针对多种LMP 1和LMP 2抗原的稳健的CTL应答。扩增的T细胞能够在体外杀伤用LMP 1或LMP 2 CTL抗原致敏的自体靶细胞。在体内小鼠模型中,该多表位疫苗始终产生强烈的LMP 1特异性CTL应答,并能够抑制表达LMP 1的NPC肿瘤的生长。此外,Smith等人开发了另外的复制缺陷型腺病毒疫苗,其编码与来自LMP 1和LMP 2的多个CD 8 T细胞表位连接的EBNA 1。这种重组腺病毒EBNA 1-LMP多表位(AdE 1 LMPpoly)技术在扩增对LMP 1、LMP 2A和EBNA 1特异性的CD 8 + T细胞中表现出有效性。扩增的T细胞也能有效识别表达有限EBV潜伏期II抗原的HL细胞。这种基于腺病毒的过继免疫疗法已在涉及复发和转移性疾病的NPC患者的I期研究中进行了评估。在这项研究中,22名患者中有16名成功扩增了EBV特异性T细胞,在14名患者中仅观察到轻度毒性,如1级流感样症状。此外,与未接受ACT治疗的对照组患者相比,治疗组患者的总生存期从220天延长至523天。这些研究表明,复制缺陷型腺病毒疫苗技术是扩增CTL的成功方案,特异性靶向多个LMP 1、LMP 2和EBNA 1表位。临床研究也证明,这种方法在改善复发或转移性疾病患者的预后方面是安全有效的。进一步确定这种方法的疗效的临床研究正在开发中。
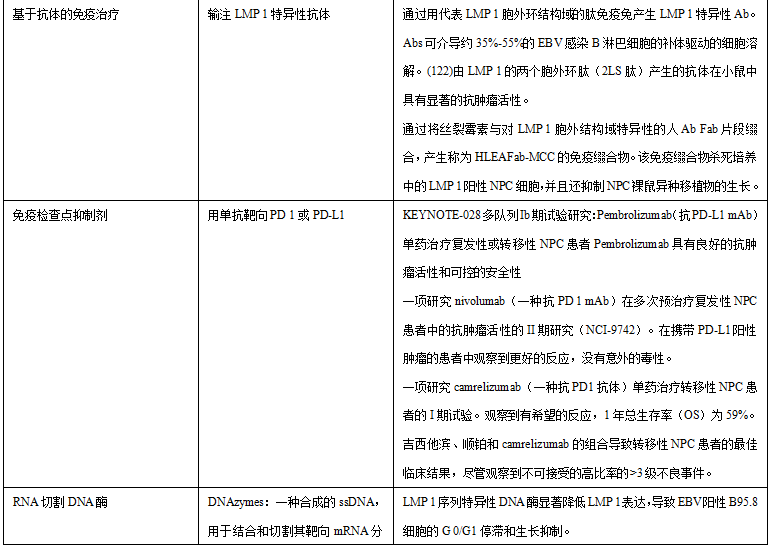
21.基于抗体的免疫治疗
LMP1的细胞外环通常免疫原性差。Paramita等人生成了LMP1特异性通过用包含LMP 1细胞外环结构域的肽免疫兔来制备抗体。这些抗体可以介导约35%- 55%的EBV感染的B淋巴细胞中补体驱动的细胞溶解。虽然只有轻微的免疫原性,但LMP 1肽特异性免疫可能对携带LMP 1表达的肿瘤患者具有治疗潜力。在另一项研究中,Delbende等人报道了模拟LMP1的两个细胞外环的构象肽(2LS肽)可以诱导高亲和力抗体。这些抗体在小鼠中显示出显著的抗肿瘤活性。有趣的是,这些2LS肽构建体不能被来自EBV血清阳性的人或NCP患者的血清识别,这些特异性的抗体反应并不是EBV感染个体的生理免疫反应的结果。因此,这种疫苗接种策略可能有助于在NPC患者中引发对靶向表达LMP 1的肿瘤细胞的免疫应答。这种抗体方法与放疗或化疗的组合可以改善总体临床结果。事实上,Chen等人开发了一种新的对LMP 1胞外结构域特异的人抗体Fab片段,随后将其与化疗剂丝裂霉素C结合,以产生免疫结合物(HLEAFab-MCC)。该免疫偶联物可杀死培养中的LMP 1阳性NPC细胞,并抑制裸鼠中NPC异种移植物的生长,表明其在NPC治疗中的治疗潜力。
22.免疫检查点抑制剂
PD-L1是LMP 1的假定靶点,通常在NPC肿瘤细胞上表达。PD-L1与其T细胞上的反向受体PD-1结合,产生强烈的免疫抑制作用,阻断EBV特异性CTL的活性。在这方面,免疫检查点抑制剂疗法旨在阻断抑制性PD-L1/PD-1信号传导,以重新激活浸润性细胞毒性T细胞的抗肿瘤功能。使用针对检查点蛋白的单克隆抗体的几项I-II期试验表明,使用单克隆抗体靶向PD 1或PD-L1是复发性或转移性NPC患者的可行性治疗发明。在KEYNOTE-028多队列1b期试验研究中,在PD-L1阳性、复发或转移性NPC患者(n=27)队列中评价了pembrolizumab单药治疗(一种PD-L1特异性单克隆抗体)。中位随访时间为20个月,客观缓解率(ORR)为25.9%。此外,15%的患者发生了药物相关不良事件,29.6%的患者报告了≥ 3级药物相关不良事件。这些结果表明,pembrolizumab具有良好的抗肿瘤活性和可控的安全性。此外,在一项多国II期研究(NCI-9742)中,评价了nivolumab单抗(一种人源化抗PD 1单克隆抗体)在多次预治疗的复发性或转移性NPC患者(n=44)中的抗肿瘤活性。在这项研究中获得了有希望的结果,抗体治疗的患者达到了20.5%的总体ORR和59%的1年总体生存率(OS)。在诊断为PD-L1阳性肿瘤的患者中观察到显著更好的缓解。另一个积极的结果是,研究中没有报告nivolumab的意外毒性。
一项研究camrelizumab(一种人源化抗PD 1抗体)在转移性NPC患者中的疗效的I期试验,9/ 45例患者(ORR 20.5%)获得了良好的缓解,1年总生存期(OS)为59%。此外,camrelizumab单药治疗的有效性通过联合化疗进一步增强。在同一项试验研究中,吉西他滨和顺铂与camrelizumab联合治疗转移性NPC患者的临床结局最佳,ORR为91%,1年PFS为68%。然而,观察到>3级不良事件(87%)的发生率高得令人无法接受。总体而言,临床试验结果表明,抗PD 1/PD-L1治疗是复发或转移性NPC患者的潜在治疗方法。正在进行进一步的I-III期试验,以评估临床结果、优化药物组合和确定安全性。
23.RNA切割DNA酶
DNA酶是合成的单链催化DNA,其被工程化以结合和切割其mRNA靶分子。DNA酶已被开发为一种潜在的治疗工具,以抑制恶性EBV感染的肿瘤细胞中LMP 1基因的表达。Lu等首先报道了在EBV阳性B95.8 LCL中用DNA酶成功敲低LMP 1,其中LMP 1是组成型表达的。这些LMP 1序列特异性DNA酶显著下调LMP 1表达,诱导G 0/G1停滞,并抑制B95.8细胞的增殖。此外,Ke等报道,DZ 509是一种特异性LMP 1靶向DNA酶,能够抑制C666-1细胞增殖并诱导细胞凋亡,C666-1是一种组成型表达弱水平LMP 1的EBV阳性NPC细胞系。DZ 509还显著抑制裸鼠中C666-1异种移植物的生长。在另一项临床研究中,在NPC患者中评估了靶向LMP 1的DNA酶DZ 1的抗肿瘤和放射增敏作用。40例鼻咽癌患者接受肿瘤内注射DZ 1沿着放射治疗。3个月随访后,与对照组相比,DZ 1治疗组患者的平均肿瘤消退率和微血管通透性显著改善。这项研究的另一个积极结果是,当DZ 1治疗与放疗联合使用时,没有报告不良事件。本研究的结果表明DZ 1有可能作为放射增敏剂治疗NPC。然而,在改进药物递送方法方面仍有障碍需要克服,例如探索使用纳米颗粒进行局部和全身给药。然而,这些早期研究中观察到的ORR与其他肿瘤一致,并表明通过将免疫检查点抑制剂治疗与ACT等其他方法联合使用可能会获得更有效的缓解。
24.肽治疗
使用基于肽的抑制剂来重新激活EBV裂解性复制或抑制EBV潜伏蛋白的致癌功能的策略正在被探索作为癌症管理的新治疗方法。已经开发了几种直接靶向EBNA 1的肽,并证明其可有效阻断EBNA 1同源二聚化或抑制EBNA 1与EBV基因组OriP序列的相互作用,从而阻止EBNA 1介导的复制和转录。其中一种抑制剂VK-2019目前正在进行针对EBV阳性NPC患者的I/IIa期临床试验。除了EBNA 1之外,已经尝试通过肽抑制剂靶向LMP 1蛋白。在最近的一项研究中,Ammous-Bou等人从噬菌体展示肽库中鉴定出一种名为B1.12(ACPLDLRSPCG)的新肽。该B1.12肽被证明选择性地结合LMP 1的N-末端结构域处的第一胞外环。在C666-1 NPC细胞中,B1.12显示出下调A20表达、抑制NF κ B和Akt信号传导、诱导G 0/G1细胞周期停滞和降低细胞活力。鉴于LMP 1介导其细胞质C-末端CTAR结构域激活各种信号通路以实现其致癌活性,目前还不清楚靶向LMP1 N端胞外环的B1.12肽如何干扰LMP1介导的信号传导和致癌活性,这需要进一步研究。
最近,本课题组建立了EBNA 1-LMP 1双靶向药物UCNP-P5。EBNA 1-LMP 1结合肽与镧系上转换纳米颗粒NaGdF 4:Yb 3+,Er 3 +@NaGdF4(UCNP)偶联,以增强稳定性,延长荧光寿命,并使生物自发荧光的干扰最小化。纳米颗粒和肽用pH敏感且可切割的接头连接; EBNA 1-LMP 1结合肽可以在酸性pH下从UCNP释放,重现肿瘤微环境。静脉注射给药,动物实验结果显示UCNP-P5可显著减小肿瘤的平均大小。LMP 1的靶向作用有助于体内药物的释放和体外细胞的摄取,有助于肿瘤的特异性;抗EBNA 1的功能仍然保持。
25.总结
NPC的特征是存在大量淋巴间质浸润。CTL在NPC中的抗肿瘤功能受到TME中存在的细胞因子、免疫检查点蛋白和癌症来源的外泌体的抑制。EBV编码的LMP 1作为组成型活性TNF受体发挥作用。通过其C-末端CTAR 1和CTAR 2结构域,LMP 1激活多种信号通路。它调节与细胞生长、存活、EMT、迁移、侵袭、有氧糖酵解以及免疫逃逸相关的各种下游靶标的表达。LMP 1具有免疫调节特性,因为它调节许多细胞因子、趋化因子、粘附分子、抗原加工和呈递蛋白的表达,所有这些都调节TME中TIL的免疫应答。例如,LMP 1诱导IL-18和IP-10募集和抑制NK和T细胞。LMP 1诱导PD-1可抑制TIL的抗肿瘤活性。LMP 1诱导的有氧糖酵解导致IL-1b、IL-6、IL-18和GM-CSF分泌增加,进而促进MDSC分化和扩增以及癌细胞增殖和抗凋亡(图2)。此外,NPC细胞释放的含LMP 1的外泌体诱导活化T细胞的无反应性,而含LMP 1的外泌体中的FGF-2、EGFR、HIF-a和Gal-9促进受体细胞的增殖和转移以及免疫耗竭。LMP 1具有多种致癌功能,因此是关键的治疗靶点。
许多研究小组尝试了不同的方法来靶向LMP 1用于治疗用途(表1)。已经建立了几种重组腺病毒或痘病毒疫苗,其编码来自LMP 1、LMP 2和EBNA 1的不同CTL表位作为多表位。临床研究证明了这些疫苗的安全性和有效性。此外,特异性靶向细胞外基质的抗体已经产生了用于治疗用途的LMP 1环。与丝裂霉素C偶联的LMP 1特异性抗体(HLFAFab-MCC)已显示在体外和体内杀死NPC细胞。鉴于LMP 1诱导的PD-L1免疫检查点蛋白在NPC肿瘤细胞上高度表达,已经进行了几项I-III期临床研究,旨在靶向晚期NPC患者的PD-1/PD-L1通路。正在进行进一步的临床试验,以评价临床结局、药物组合、安全性测定。使用DNA酶敲低LMP 1也具有治疗潜力。DZ 509是一种特异性靶向LMP 1的DNA酶,在体外培养和裸鼠体内均能显著抑制鼻咽癌细胞的生长。
此外,一种特异性靶向LMP 1 N末端胞外环结构域的肽已显示抑制LMP 1介导的NF κ B和Akt信号传导。这种肽探针还降低了NPC细胞的活力和增殖。我们的研究小组已经开发了EBNA 1特异性荧光肽探针(L2 P4和UCNP-P4),其靶向EBNA 1二聚化位点。这些探针已被证明在体内肿瘤异种移植物的成像中以及在体外和体内抑制EBV阳性肿瘤细胞的生长中是成功的。类似的方法也可以应用于LMP 1蛋白。与适当荧光团偶联的LMP 1特异性肽可用于体内追踪含有LMP 1的外泌体和表达LMP 1的肿瘤以及抑制LMP 1功能。EBNA 1的功能是维持EBV潜伏期,增强EBV基因组的复制和转录。研究EBNA 1和LMP 1特异性肽探针的组合是否能抑制EBV潜伏期和LMP 1介导的肿瘤发生,可能对治疗EBV相关的恶性肿瘤有用。我们新研制的EBNA 1-LMP 1双靶点药物为这方面提供了一些线索,因此,LMP 1代表了我们追求的另一个有吸引力的EBV靶点。
在过去的50年里,我们已经了解到化疗药物的组合是治疗癌症的最有效方法。这也是当代生物疗法的情况,其中各种抗癌疫苗和药剂只有在与靶向TME的干预措施相结合时才有效。在这篇论文中,NPC提供了一个有用的范例来探索靶向肿瘤特异性蛋白如LMP1的组合疗法的影响,同时也阻断了TME的免疫抑制和肿瘤促进作用。
本站欢迎原创文章投稿,来稿一经采用稿酬从优,投稿邮箱tougao@ipathology.com.cn
相关阅读
 数据加载中
数据加载中
我要评论

热点导读
-

淋巴瘤诊断中CD30检测那些事(五)
强子 华夏病理2022-06-02 -

【以例学病】肺结节状淋巴组织增生
华夏病理 华夏病理2022-05-31 -

这不是演习-一例穿刺活检的艰难诊断路
强子 华夏病理2022-05-26 -

黏液性血性胸水一例技术处理及诊断经验分享
华夏病理 华夏病理2022-05-25 -

中老年女性,怎么突发喘气困难?低度恶性纤维/肌纤维母细胞性肉瘤一例
华夏病理 华夏病理2022-05-07







共0条评论