[导读] 译者:张波
摘要 鼻咽癌(Nasopharyngeal carcinoma,NPC)是头颈部肿瘤中的一种特殊类型,它与EB病毒(EpsteinBarr virus,EBV)密切相关,并伴有高水平的免疫浸润。因此,用于治疗NPC的免疫疗法是追求改善患者结果的有前途的研究领域。了解NPC的肿瘤免疫微环境(TIME)是开发靶向免疫治疗和分层患者以确定最佳治疗方案的关键。最近的研究揭示了NPC中TIME的独特特征以及不同疾病亚型之间的重要差异;然而,回顾该领域的现状,揭示了进一步需要应用新技术,如多路复用高光谱成像和质谱仪。这些技术可用于鉴定NPC中TIME的空间、组成和功能方面,如免疫细胞社会学、新型免疫群体和NPC中免疫相关信号通路的差异,以鉴定临床相关特征,用于靶向免疫治疗开发和生物标志物发现。
1.前言
鼻咽癌(NPC)是一种头颈部癌症,起源于鼻咽部的鳞状上皮细胞。其独特的病因学被认为是由遗传易感性、环境因素以及在大多数情况下与EB病毒(EBV)的关联的组合驱动的。NPC的特征在于非常高的基质和免疫浸润,这可能是由于接近鼻咽中的淋巴结构以及与EBV感染的密切相关。NPC的一个关键特征是对发病机制的免疫贡献,其中免疫抑制微环境为肿瘤细胞提供了有利的环境。放化疗目前是NPC的标准治疗,但约20%的患者复发,此时5年总生存率从70%降至41%。因此,已经将显著的焦点放在在NPC中使用新的策略,特别是免疫疗法以改善患者结局上。已经表明,由肿瘤微环境的免疫特征描绘的NPC亚型可以预测存活和对免疫疗法的反应。最近,适用于以单细胞分辨率研究NPC肿瘤微环境的高通量技术有助于进一步了解免疫对发病机制的贡献,为通过识别可能对特定免疫疗法有反应的患者来优化治疗铺平了道路。
2.肿瘤免疫微环境(The tumour immune microenvironment,TIME)
肿瘤微环境(TME)是围绕实体瘤的直接区域,并且除了非细胞成分如细胞外基质之外,还包括基质细胞如成纤维细胞、内皮细胞和免疫细胞。一旦被肿瘤吸收,TME在支持肿瘤生长和进展方面起着重要作用。相比之下,肿瘤免疫微环境(TIME)由TME的免疫组分减去其他基质和细胞外组分组成(图1)。TIME中的三种主要细胞谱系是T淋巴细胞、B淋巴细胞和骨髓细胞,其包括骨髓来源的抑制细胞(MDSC)、巨噬细胞和树突细胞。在TIME里,具有两个功能亚型细胞:促进抗癌免疫应答的免疫刺激细胞和抑制抗癌免疫应答以促进肿瘤进展的免疫抑制细胞。免疫刺激细胞包括肿瘤浸润淋巴细胞(TIL)、淋巴样细胞(ILC)(包括自然杀伤(NK)细胞)、树突细胞和嗜酸性粒细胞。免疫抑制细胞包括MDSC、肥大细胞、调节性T细胞(TCFs)和巨噬细胞(特别是M2极化的肿瘤相关巨噬细胞)。TIME中免疫刺激和免疫抑制细胞的平衡通常对肿瘤类型具有特异性,并且可以影响肿瘤进展,例如通过抑制免疫应答以促进癌细胞的不受阻碍的生长。
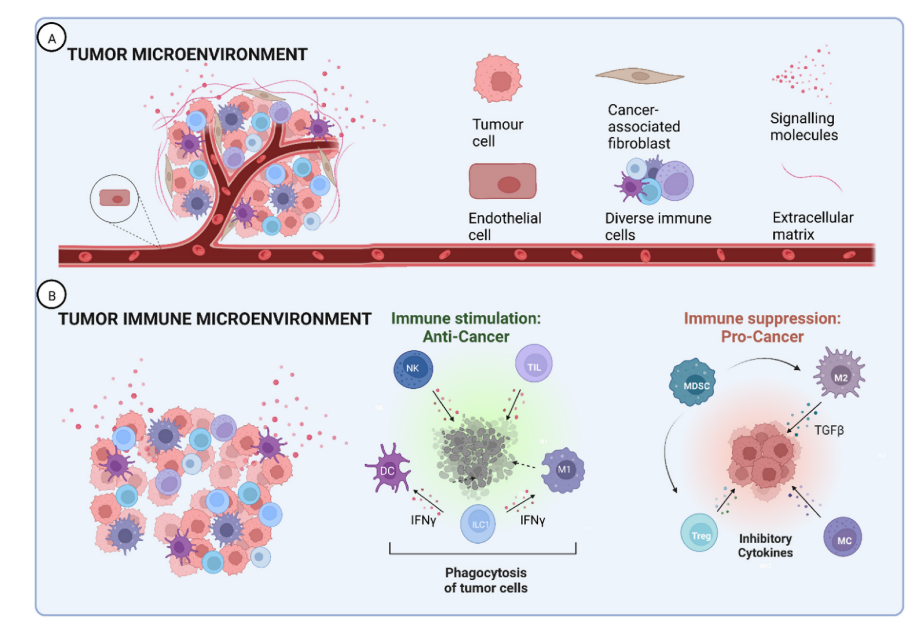 图1.肿瘤微环境与肿瘤免疫微环境。肿瘤免疫微环境是更大的肿瘤微环境的重要组成部分,可以预防或促进肿瘤的进展。A:肿瘤微环境(TME)由肿瘤细胞、肿瘤相关成纤维细胞(CAF)、内皮细胞和多种免疫细胞等间质细胞以及包括信号分子和细胞外基质在内的非细胞成分组成。B:肿瘤免疫微环境(TIME)是TME的免疫亚群,可细分为两个功能群。免疫刺激细胞促进免疫监视,从而杀灭癌细胞,包括自然杀伤(NK)细胞、肿瘤浸润性淋巴细胞(TIL)、M1极化的巨噬细胞、树突状细胞(DC)和1型固有淋巴样细胞(ILC1)。相反,免疫抑制细胞为癌症进展提供了一个允许的环境。这些细胞包括髓系来源的抑制细胞(MDSCs)、M2极化的巨噬细胞、调节性T细胞(Tregs)和肥大细胞(MCs)。
图1.肿瘤微环境与肿瘤免疫微环境。肿瘤免疫微环境是更大的肿瘤微环境的重要组成部分,可以预防或促进肿瘤的进展。A:肿瘤微环境(TME)由肿瘤细胞、肿瘤相关成纤维细胞(CAF)、内皮细胞和多种免疫细胞等间质细胞以及包括信号分子和细胞外基质在内的非细胞成分组成。B:肿瘤免疫微环境(TIME)是TME的免疫亚群,可细分为两个功能群。免疫刺激细胞促进免疫监视,从而杀灭癌细胞,包括自然杀伤(NK)细胞、肿瘤浸润性淋巴细胞(TIL)、M1极化的巨噬细胞、树突状细胞(DC)和1型固有淋巴样细胞(ILC1)。相反,免疫抑制细胞为癌症进展提供了一个允许的环境。这些细胞包括髓系来源的抑制细胞(MDSCs)、M2极化的巨噬细胞、调节性T细胞(Tregs)和肥大细胞(MCs)。
3.NPC中的TIME特征
最近,随着新型高通量方法的使用,由于抗癌免疫应答的抑制,NPC中的TIME显示出在致耐受性环境中增加的免疫浸润(图2)。免疫细胞(免疫刺激性和免疫抑制性)的募集部分由肿瘤细胞、巨噬细胞和树突细胞增加的趋化因子表达介导。免疫逃逸可以通过肿瘤和免疫细胞之间的直接通信介导,例如通过抑制性配体/受体和/或抗原呈递机制的突变,和/或通过趋化因子/细胞因子的间接通信。
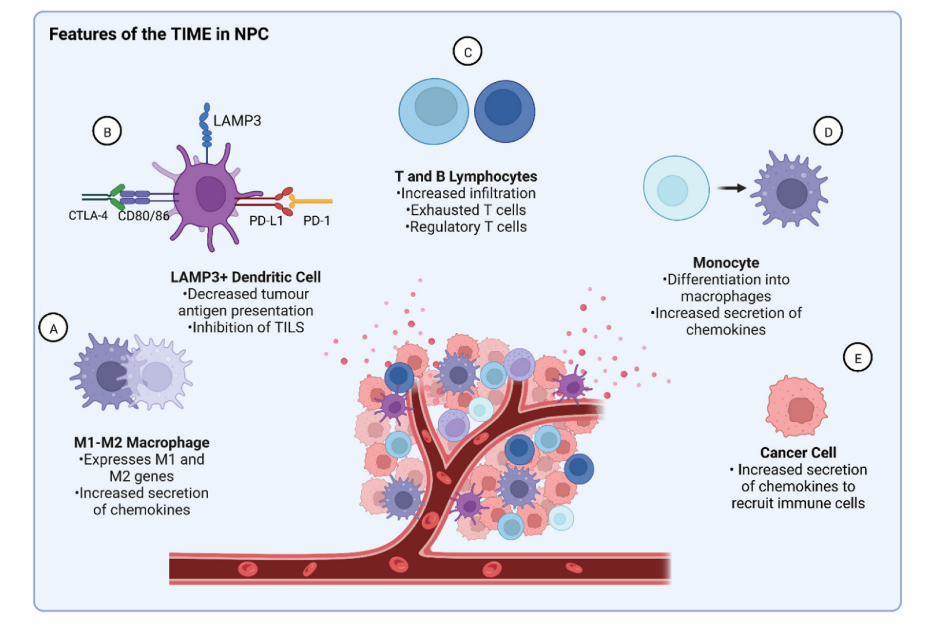
图2.鼻咽癌肿瘤免疫微环境的特点。NPC中的TIME的特征在于免疫细胞的募集增加和致耐受性环境的形成。A:巨噬细胞共表达抗炎M1和促炎M2基因特征,形成已知分泌升高量的趋化因子以将免疫细胞募集到TIME的中间表型。B:LAMP 3+树突状细胞是NPC中独特的表达PD-L1和CTLA 4配体的细胞群,导致树突状细胞中抗原加工的下调和肿瘤浸润淋巴细胞的效应功能的抑制。C:B和T细胞募集的增加部分由TIME的其他组分分泌的趋化因子的增加介导,调节性T细胞的富集有助于观察到大量耗尽的T细胞。D:单核细胞分化成巨噬细胞,巨噬细胞然后分泌趋化因子以募集免疫细胞。E:癌细胞趋化因子分泌的增加促进了免疫细胞的募集。
在NPC的TIME中表现出独特特征的一种免疫细胞类型是巨噬细胞。这些巨噬细胞可以被分泌的趋化因子直接募集,或者可以与被募集的单核细胞分化,如这些巨噬细胞和单核细胞之间转录因子的相似模式所证明的。与组织或循环中的巨噬细胞相比,TIME中的巨噬细胞改变了性质,并且在NPC中已显示出M1和M2相关基因的独特共表达,这可能表明传统肿瘤抑制M1和肿瘤促进M2亚型之间的中间表型。一个独特的树突状细胞亚型标记的溶酶体相关膜糖蛋白3(LAMP 3)也已被描述在NPC。这些LAMP 3+树突细胞通过细胞毒性T淋巴细胞相关蛋白4(CTLA 4)与T细胞相互作用,导致LAMP 3+树突细胞中抗原加工和呈递的下调以及T细胞的增殖,此外还表达程序性死亡配体1(PD-L1),其与细胞毒性T细胞上的PD-1相互作用以引起细胞凋亡。
NPC的TIME的特征还在于比大多数其他实体瘤更高的TIL富集,尽管这些淋巴细胞表达效应标志物(包括白细胞介素-2和干扰素γ(IFN-γ))和耗竭标志物(包括CTLA 4和PD-1),这可能表明它们的效应功能受到抑制。TIL数量增加的证据表明TIL的抗癌效应子功能因此受到抑制,部分由抑制分子介导,如程序性细胞死亡蛋白1(PD-1)和甲型肝炎病毒细胞受体2(HAVCR 2)。
最后,复发性NPC的TIME最近进行了分析,并显示出与原发性NPC相似的特征,尽管在更大程度上。也就是说,已经观察到免疫抑制细胞,特别是T细胞、LAMP 3+树突细胞和M2极化巨噬细胞的富集增加,以及TIL的甚至更强的效应子耗尽信号。结合起来,原发性和复发性NPC的这些特征表明强烈的免疫抑制微环境。
4.EBV+与EBV-NPC感染TIME的差异
在NPC中TIME的一般特征的框架内,在EBV阳性(EBV+)和EBV阴性(EBV-)肿瘤之间观察到某些特征的差异(图3)。这些差异还没有被合成到一个亚型特异性的TIME,但仍然可以提供洞察免疫相关的发病机制的NPC在存在或不存在EBV。
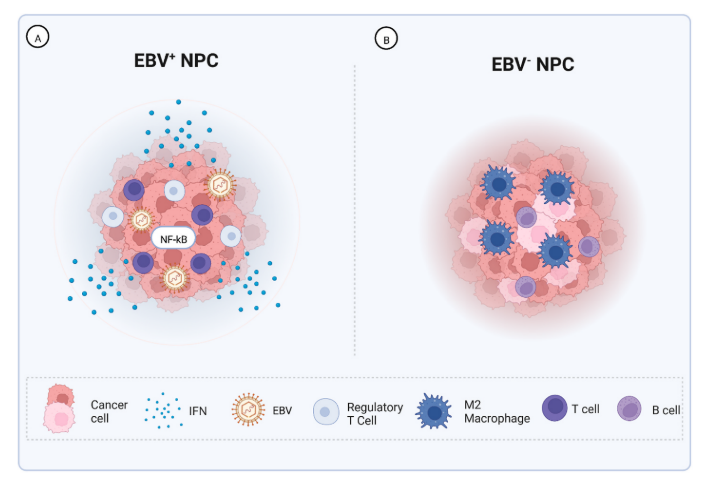
图3.EBV阳性(EBV+)和EBV阴性(EBV-)NPC之间的TIME差异。A:EBV+ NPC表现出效应和调节性T细胞的相对富集,并且由NF-κB的组成性活化和经典的抗癌干扰素介导的信号传导主导。B:EBV-NPC在B细胞和M2极化巨噬细胞中相对富集,癌细胞显示出增加的异质性。
在EBV + NPC中,最近的全基因组测序显示,由潜伏膜蛋白1(LMP 1)的病毒表达或体细胞突变驱动的组成型核因子κ B(NF-κB)活化。下游信号传导导致免疫调节分子如白细胞介素-6(IL-6)、白细胞介素-8(IL-8)和白血病抑制因子(LIF)的分泌增加,其促进免疫细胞的募集以建立慢性炎性环境。此外,EBV + TIME的特征在于高水平的促炎细胞因子IFN-γ,其反应于病毒感染而产生。传统上,IFN-γ被认为是抗肿瘤细胞因子,部分地增加NK细胞和TIL的功效,但是如在EBV + NPC中所见的持续上调可以通过多种机制促进免疫抑制性TIME,包括抑制性分子如PDL-1/CTLA-4的表达。总的来说,EBV + TIME是一种免疫抑制环境,其特征在于大量的TlR、耗尽的TIL和MDSC。
相反,EBV-TIME组成的机制尚未得到很好的研究。然而,已经显示EBV-TIME显示B细胞相对于T细胞的相对富集,其中存在较少的T细胞和髓源性细胞,并且更常见地观察到M2巨噬细胞。EBV-肿瘤还表现出增加的肿瘤内异质性,如通过当使用来自scRNA-seq数据的基因表达状态分类时增加的细胞群体数量和通过肿瘤细胞本身增加的多样性所看到的。需要进行亚型特异性研究,以揭示NPC中独立于EBV感染的免疫发病特征。
5.表征TIME的新方法
研究肿瘤之间和肿瘤内TIME组分的组成、定位和功能是由新型高通量技术驱动的新兴领域(图4)。这些特征与高度免疫浸润的肿瘤如NPC高度相关,它们可用于对肿瘤的亚型进行分层、阐明免疫驱动的发病机制并潜在地指导免疫治疗。
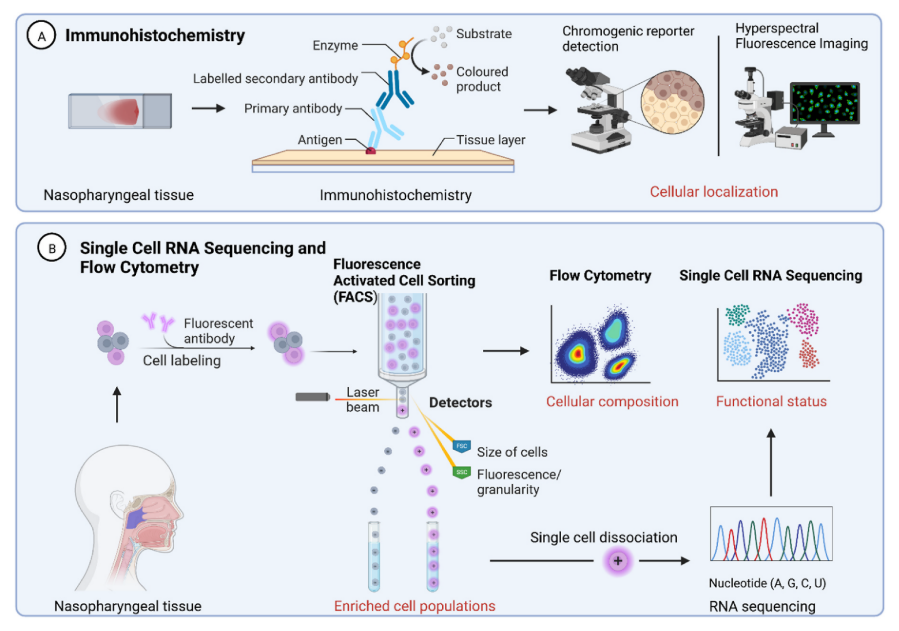
图4.用于表征TIME的技术。可以使用多种技术来表征TIME的不同方面。A:免疫组织化学是使用针对特定细胞类型的抗原或标记物的标记抗体来研究组织切片上的细胞定位的经典技术。然后可以通过颜色变化或荧光显微镜检测与其抗原结合的抗体。B:流式细胞术需要用针对特定标记物的荧光标记抗体标记细胞,此时悬浮液可以通过流式细胞仪或专门的荧光激活细胞分选仪(FACS),当激光照射在通过的单个细胞上时,通过荧光的存在分离细胞。这有助于分析和分离样品中存在的不同细胞群体。单细胞RNA测序发生在FACs的下游,使用单细胞解离,然后进行RNA测序,以通过细胞的转录组给予关于细胞的功能状态的洞察。
细胞定位通常使用组织切片上的免疫组织化学(IHC)来检查,当组织病理学不确定时,其通常用于临床病理学设置以用于鉴别诊断。在NPC中,针对细胞角蛋白的IHC和针对EBV编码RNA的原位杂交(EBER)可分别支持鼻咽源性鳞状细胞癌的诊断。多重IHC其能够在同一组织切片上用标记物组进行顺序染色以提供空间背景,已经与分析宽光谱的高光谱成像结合以促进单细胞表征,允许细胞分析以确定肿瘤-免疫细胞相互作用和单细胞网络分析以描绘克隆扩增。这些细胞社会学特征已被证明指示其他实体瘤中的疾病行为,并可能为开发用于NPC分类的新标记物提供机会。
识别和定量TIME内存在的不同免疫细胞群体的频率传统上使用流式细胞术进行研究,流式细胞术基于是否存在针对特定特征的一组荧光标签来分析悬浮液中的单细胞。最近,已经开发了质谱细胞术来克服可以用流式细胞术测量的参数数量的限制,这是由于荧光标签的色谱之间的重叠而产生的,通过用可以基于原子量分离的独特金属同位素标记抗体。这允许分析每个细胞多达50个参数,以从单个样品以高通量有效地分析免疫群体。
单个细胞的功能状态可以使用单细胞RNA测序(scRNA-seq)来检查。除了TIME的细胞组成外,单细胞RNA测序(scRNA-seq)还可以根据RNA转录组深入了解单细胞的功能状态。结合分析生成的数千个RNA读数所需的降维技术,scRNA-seq是一种强大的工具,可以在TIME内鉴定细胞的功能亚群。总之,从这些技术中获得的信息允许以高分辨率对TIME进行分类,为进一步研究临床应用提供基础,例如潜在的生物标志物或基于免疫亚型的治疗分层。
6.结论
鼻咽癌是一种实体瘤,其特征是高水平的免疫渗透和形成促进肿瘤进展的耐受性免疫微环境。近年来,鼻咽癌中TIME的研究受到了极大的关注,特别是利用新的技术如scRNA-seq在单细胞分辨率方面。因此,鼻咽癌独特的TIME特征目前正被转化为临床领域,以改进现有的免疫疗法并指导治疗。例如,抑制分子PD-1和HAVCR2在NPC时间的流行促使了目前正在进行的针对这两个分子的第二阶段临床试验,以克服仅对PD-1阻断的耐药性。另一个例子是Liu等人生成的免疫标记使用多重IHC,并由免疫标记物PD-L1+、CD163+、CXCR5和CD117组成,被证明可以预测鼻咽癌患者远处转移的风险,潜在地提供了一种工具来确定不同治疗策略的队列。最近的一篇论文还表明,通过数字病理学和深度学习算法确定的鼻咽癌TIL的空间异质性具有预后价值,因为所谓的“免疫热点”与改善患者预后显著相关。虽然我们目前对NPC独特免疫特征的理解正在刺激潜在的临床应用,但仍需要使用新型高通量技术进行进一步研究,如质谱细胞术和高光谱成像耦合多重IHC,以揭示NPC中的新型免疫细胞群,细胞社会学和信号通路,特别关注于区分EBV+和EBV-微环境之间的不同特征。阐明NPC中TIME的这些特征将为生物标志物发现,靶向免疫疗法的开发和个性化治疗策略提供基础,以改善患者的预后。
点此下载原文献

















共0条评论