[导读] 作者:卫惠杰,重庆大学附属涪陵医院病理科
1.概述
淋巴母细胞性淋巴瘤(lymphoblastic lymphoma,LBL)是一类来源于不成熟前体T或B淋巴细胞的临床少见的高度侵袭性淋巴瘤,约占所有非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL)的2%,占儿童非霍奇金淋巴瘤的40%。其中T-LBL占所有LBL的85%-90%,多见于儿童和青年,男女比例约为2:1。最常侵犯纵隔及淋巴结,90%的患者出现胸腺或纵隔肿大。其他可见肿瘤部位包括外周淋巴结、肝、脾、中枢神经系统和性腺器官,而原发于扁桃体的T-LBL很少见。该病发病急、进展快、预后差,大多死于白血病及累及中枢神经系统。我科近期诊断1例发生于扁桃体的T-LBL,现汇报如下。
2.病例汇报
患者,男,6岁。入院前6月无明显诱因出现睡觉时张口呼吸、打鼾,感冒受凉后症状加重。期间于我院予以口服药物治疗(具体不详),患儿症状无明显缓解。现为进一步治疗再次于我院门诊就诊,鼻咽镜检查提示“腺样体肥大”,门诊拟“鼾症、扁桃体伴腺样体肥大”收治入院。专科查体发现,鼻腔内未见新生物,双侧扁桃体III°肿大,无明显充血,悬雍垂居中,咽后壁可见淋巴滤泡增生。手术切除双侧扁桃体及腺样体送检。
病理大体检查:“双侧扁桃体”:扁桃体样组织两块,体积均约3.8cm×3.5cm×2cm,切面灰白、灰红色,实性质软。
镜下形态学扁桃体隐窝周围可见大小不等的淋巴滤泡和一些深染的弥漫的淋巴组织。淋巴滤泡比较稀疏,滤泡间区扩大。扩大的滤泡间区,可见一些深染的细胞,弥漫性的生长(图1、2)。高倍镜可见细胞成分单一,大小形态一致,细胞中等大小,核圆形、卵圆形,染色稀疏,核仁小或不明显,胞质稀少,核质比高。可看到一些“星空”现象。几乎看不到其他炎症细胞。
免疫组化显示肿瘤细胞CD3、CD5、CD7(图3)、TdT(图4)、CD34(图5)、bcl-2、LCA弥漫阳性表达;肿瘤细胞CD20、CD21、pax-5、CD4、CD8、CD1a均为阴性。CD10局灶阳性;肿瘤细胞增殖指数Ki-67约40%(图6)。最终诊断:(扁桃体)T淋巴母细胞性淋巴瘤。患者转院后接受进一步治疗,治疗效果较好。
3.讨论
3.1临床特点
淋巴母细胞淋巴瘤/白血病(lymphoblastic lymphoma/leukemia,LBL/ALL)是一类来源于不成熟前体T或B淋巴细胞的临床少见的高度侵袭性淋巴瘤,约占所有NHL的2%,占儿童NHL的40%。如果骨髓中的肿瘤细胞超过25%,即诊断淋巴母细胞白血病(ALL)。按免疫表型分为T细胞型(约占70%-80%)和B细胞型(约占20%-30%)。
LBL占所有LBL的85%-90%,多见于年长儿童和青年,中位年龄9-12岁,男女比例约为(2.5-3):1。最常侵犯纵隔及淋巴结。其他可见肿瘤部位包括肝、脾、中枢神经系统和性腺器官。目前病因尚不明确,但有研究认为病毒、细菌、放射线、某些化学物质等是可能的诱因,而基因异常、免疫缺陷性疾病使淋巴瘤发病危险性大大增加。
3.2病理形态学特征
镜下形态学:T-LBL肿瘤细胞呈弥漫性生长,细胞中等大小,核圆形、卵圆形或不规则形,核染色质细腻如粉尘,核仁小或不明显,胞质少,核分裂象多见。瘤细胞间很少有其他反应性细胞,部分病例可见“星空”现象。
T-LBL免疫组化:淋巴母细胞标记TdT、CD1a、CD34和CD99阳性,不同程度表达T细胞抗原:CD3、CD2、CD5、CD7等,以胞质型CD3和CD7最常见、最特异。常表达bcl-2,部分病例表达CD79α。CD10也可阳性。约1/3病例可表达髓系抗原CD13、CD33。
TdT阳性常作为诊断的主要依据,但阴性也不能排除T-LBL。在具有典型淋巴母细胞形态的TdT阴性淋巴瘤中,CD1a或CD34的表达、CD79a和CD3的共表达或CD4和CD8的共表达可用于确定淋巴瘤的前体细胞性质。
3.3细胞遗传学
95%以上T-LBL/ALL有TCR基因克隆性重排。约20%T-LBL/ALL同时有IgH基因重排。50%-70%的T-LBL/ALL有染色体核型异常,包括插入突变、缺失以及染色体易位。现已知与T-LBL/ALL有关的原癌基因有CALM-AF10、HOX11、HOX11L2、C-MYC、LMO2等。某些基因异常与预后有关:如t(9;22)、t(4;11)、t(8;14)预后不良;而t(12;21)预后较好。
3.4鉴别诊断
1、慢性扁桃体炎:TdT亦可表达于正常扁桃体组织,但这些阳性表达细胞只是小灶性或散在分布,且形态上缺乏单一性和异型性。
2、惰性T淋巴母细胞增生( iT-LBP) :是一种非克隆性良性疾病,免疫组化染色显示CD3、CD4、CD8和TdT阳性的T淋巴母细胞增生。但无破坏性证据,在未治疗的情况下,6个月以上的随访无明显进展。
3、Burkitt淋巴瘤:其好发于儿童,病理见细胞单一,中等大小,常呈铺路石样镶嵌排列,形态上与 T-LBL有相似之处。但Burkitt淋巴瘤常出现“星空”现象,肿瘤细胞核分裂多见。免疫表型可区分二者,Burkitt淋巴瘤表达B细胞相关抗原,如CD19、CD20、CD10和bcl-6阳性,而TdT、CD3和CD5阴性,Ki-67增殖指数近100%阳性。细胞遗传学显示有特征性t(8;14)(q23;q21)或c-myc基因重排。
4、急性髓系白血病和髓系肉瘤:这两者病理形态上与T-LBL较难区别,前二者细胞形态较不一致,细胞质较多,胞质内可见红染棒状Auer氏小体。免疫表型表达髓系相关抗原,如MPO、CD13、CD14、CD15等,部分髓肉瘤还可表达CD43,但CD3、CD5和TdT阴性。
5、母细胞型套细胞淋巴瘤:其多见于中老年人,它常失去套区样生长方式,肿瘤细胞核变大,染色质细,核分裂象增多,具有向母细胞分化的特征,形态似淋巴母细胞,需与前驱T-LBL相鉴别。前驱T-LBL多见于年轻人,细胞核形较母细胞型套细胞 淋巴瘤更圆润,核分裂象较多,且套细胞淋巴瘤表达CD20、Pax-5和cyclinD1,而CD3、CD5和TdT阴性。细胞遗传学显示有特征性t(11;14)基因重排。
6、胸腺瘤: 胸腺瘤虽好发于50-60岁的中老年人,但也可发生于儿童、青少年。B1型和B2型胸腺瘤中经常有大量淋巴细胞浸润,散在分布的透明上皮细胞或凋亡的淋巴细胞可呈现“星空”现象。胸腺瘤与LBL/ALL均可表达TdT、CD2、CD3、CD99和Bcl-2。当穿刺纵隔肿物活检时两者的鉴别诊断尤其困难。但胸腺瘤中出现CK和p63阳性的肿瘤细胞可与LBL/ALL相鉴别。目前研究显示LMO2是前驱T细胞的特异性标志物(血管内皮细胞LMO2染色阳性可作为内对照),LMO2蛋白表达在T淋巴母细胞淋巴瘤(LMO2表达阳性率约85%),对与胸腺瘤(LMO2表达缺失)鉴别诊断有价值。
7、非淋巴造血小细胞恶性肿瘤:主要包括尤文氏肉瘤、原始神经外胚叶肿瘤(PNET)、神经母细胞瘤、小细胞未分化癌等。可选用多种抗原,包括NSE、Syn、CgA等可资鉴别。
3.5临床治疗及预后
LBL/ALL是青少年高度恶性的淋巴造血系统肿瘤,病情发展迅速,预后差。目前,T-LBL的首选治疗应以化疗为主,造血干细胞移植主要推荐用于高风险、化疗耐药或复发的患者。



图1.低倍镜下见扁桃体肿瘤组织呈弥漫性生长;
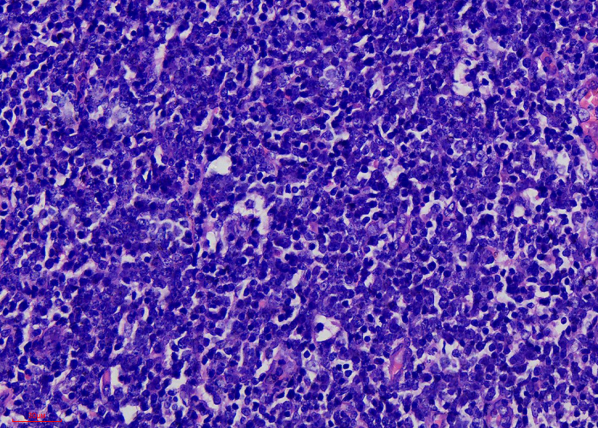
图2.肿瘤细胞细胞中等大小,核圆形、卵圆形,核染色质细腻如粉尘,核仁小或不明显,胞质少;
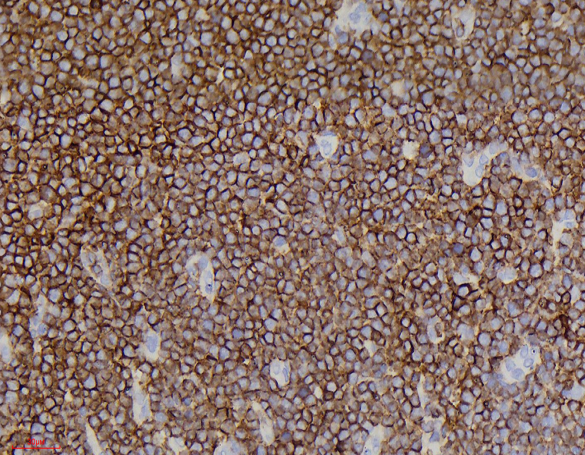
图3.肿瘤细胞CD7弥漫强阳性;
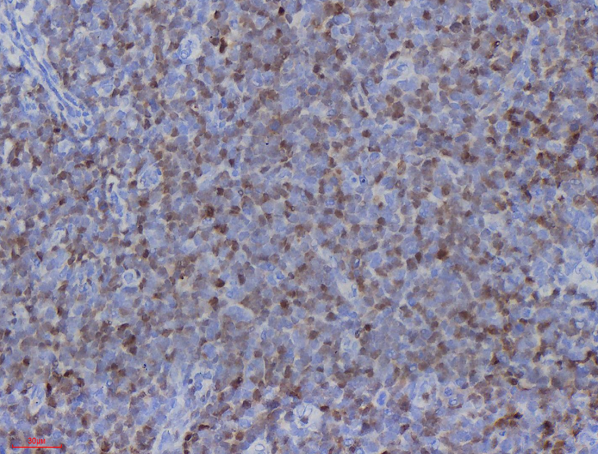
图4.肿瘤细胞TdT大片状阳性;
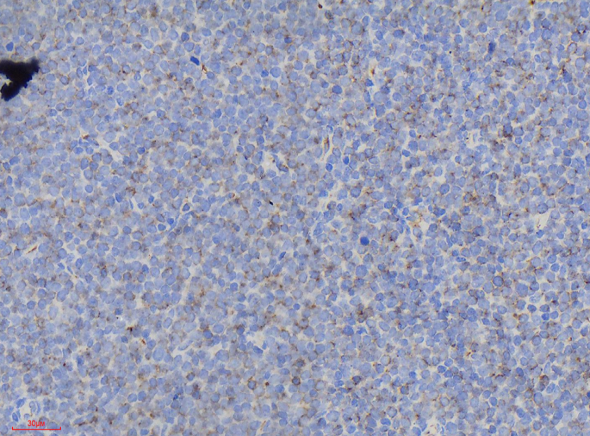
图5.肿瘤细胞CD34阳性;
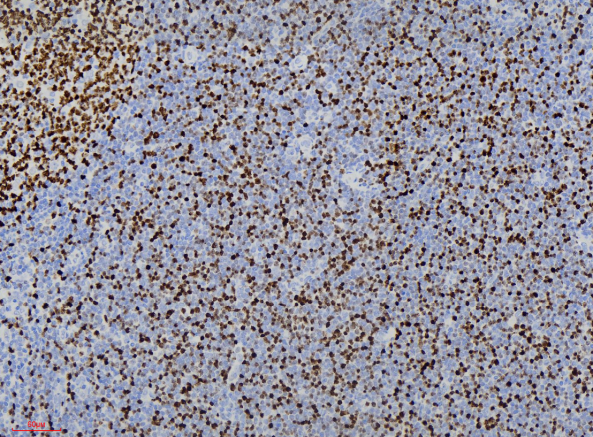
图6.肿瘤细胞Ki-67约40%阳性。
参考文献:
[1]Liu G,Liu F.Diagnosis and treatment of T-lymphoblastic lymphoma in head and neck[J].J Clin Otorhinolaryngol Head Neck Surg,2021,35(6):551-554.
[2]Xiao PT,Wei JH,Hui QH,et al.Prognostic and predictive value of a microRNA signature in adults with T-cell lymphoblastic lymphoma. Leukemia,2019,33(10):2454-2465.
[3]Cortelazzo S,Ferreri A,Hoelzer D,et al.Lymphoblastic lymphoma[J].Crit Rev Oncol Hematol,2017,113: 304-317.
[4]谭月,韩双,于丹,等.原发扁桃体T淋巴母细胞性淋巴瘤/白血病一例及文献回顾[J/CD]中华临床医师杂志:2015,9(24):4722-4724.
[5]Jevremovic D,Roden AC,Ketterling RP,et al.LMO2 is a specific marker of T-lymphoblastic leukemia/lymphoma[J].Am J Clin Pathol,2016,145(2):180-190.
[6]张婷婷,朱培培,毕珂,等.LMO2蛋白表达在T淋巴母细胞淋巴瘤/急性淋巴细胞白血病与胸腺瘤鉴别诊断中的应用[J].临床与病理杂志,2022,42(5):1047-1054.
[7]刘果,刘锋.头颈部T淋巴母细胞淋巴瘤临床诊治分析[J].临床耳鼻咽喉头颈外科杂志,2021,35(6):551-554.
[8]Burkhardt B,Hermiston ML.Lymphoblastic lymphoma in children and adolescents:review of current challenges and future opportunities.Br J Haematol,2019,185: 1158-1170.
[9]Cairo MS,Beishuizen A.Childhood,adolescent and young adult non-Hodgkin lymphoma:current perspectives. Br J Haematol, 2019,185: 1021-1042.
[10]Pizzi M,Brignola S,Righi S,et al.Benign TDT positive cells in pediatric and adult lymph nodes:a potential diagnostic pitfall[J].Hum Pathol,2018:131-137.



















共0条评论