[导读] 编译整理:强子
乳腺导管原位癌(ductal carcinoma in situ,DCIS)和浸润性癌的形态学谱系,意味着乳腺癌病理诊断中存在着诸多陷阱,在标本数量有限的粗针穿刺活检(core needle biopsy,CNB)标本中更是如此。针对这方面的问题,美国哈佛大学附属贝斯以色列女执事医疗中心(Beth Israel Deaconess MedicalCenter)病理专家Quintana和Collins在美国病理学家协会(College of American Pathologists,CAP)官方期刊《Archives of Pathology & Laboratory Medicine》发表文章,详尽介绍了这种情况下较为常见的诊断困难,并重点介绍了相关鉴别诊断、如何预判及避免相关诊断陷阱。为帮助大家更好的了解相关知识点并应用于临床实践,我们将该文要点编译介绍如下。
导管原位癌
导管原位癌(ductal carcinoma in situ,DCIS)是上皮细胞恶性的导管内增生,细胞核级别可以分为低、中、高,且有多种结构形式,如实性、筛状、微乳头状、乳头状、贴壁样,且可以伴或不伴坏死。鉴于这些特征以及导管内增生性病变可以大致分为良性、非典型、恶性的不同情况,因此类似DCIS的病变也有很多。
(一)筛状病变
类似筛状结构DCIS的病种有胶原小体病(尤其小叶原位癌【lobular carcinoma in situ,LCIS】累及的时候)、浸润性筛状癌、腺样囊性癌。关于腺样囊性癌,本文不做讨论,因为该杂志同时发表了乳腺涎腺样肿瘤的相关文献(我们公众号已做编译,详见《病理腺中腺-乳腺涎腺样肿瘤》)。需要注意的是,属于上皮-肌上皮病变的筛状结构腺样囊性癌也会类似胶原小体病和DCIS。胶原小体病为良性,不会有浸润性生长,而腺样囊性癌会有浸润性生长。免疫组化方面,腺样囊性癌还会表达MYB,FISH中也可以检出MYB。
胶原小体病表现为具有圆形管腔的筛状特征,导管内增生的上皮周围有肌上皮围绕、后者产生基底膜。因此,管腔周围细胞的细胞核更为梭形,且与管腔相平行,这与筛状结构DCIS是相反的,后者管腔周围的上皮细胞是朝向管腔内的。
不过,经典型LCIS累及胶原小体病的时候可能诊断困难更大。此时,导管内增生的形态极为均一,筛状结构受到挤压而形态学类似低级别DCIS。胶原小体病与DCIS鉴别的关键,在于前者有受压肌上皮细胞的管腔周围存在基底膜。这种无定型物质可能看上去类似嗜酸性小球,均质性更显著的时候可能为嗜酸性或嗜碱性。肌上皮细胞免疫组化也可用于鉴别:不表达E-cadherin证实病变是被小叶肿瘤累及的;但需要注意的是,肌上皮细胞也可能会表达E-cadherin。
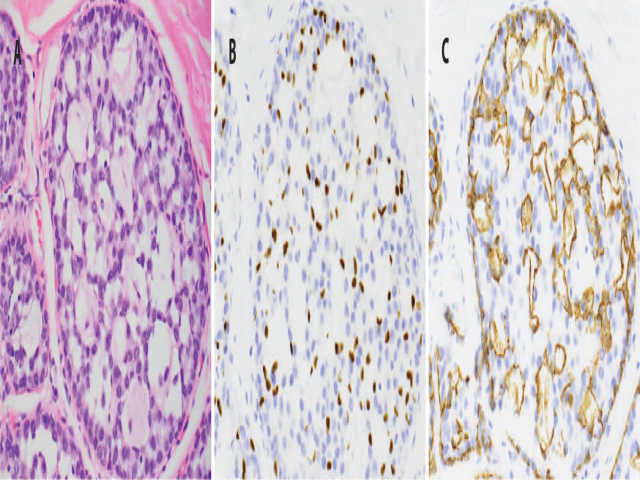
图1.小叶肿瘤累及的胶原小体病。(A)呈筛状结构的管腔周边有扁平的肌上皮细胞衬覆,且有无定型的嗜酸性物质;(B)免疫组化p63,显示增生病变周边和增生病变内有肌上皮细胞;(C)免疫组化E-cadherin在增生的上皮为阴性,支持这些非典型细胞为小叶表型;不过,相关肌上皮有着色。
(二)实性导管内上皮增生
DCIS、尤其细胞核级别为中等的病例评估中,主要难点之一就是与普通型导管增生(usual ductal hyperplasia,UDH)的鉴别,且这一鉴别对于临床处理具有重要影响。其他诊断陷阱还有:细胞核为高级别的DCIS会类似多形性LCIS,且反之也是如此;实性亚型的低级别DCIS会类似经典型LCIS。
UDH VS细胞核中等级别的DCIS
对导管内增生性病变进行CNB检查已经成为乳腺病理的常规操作,但结果却并非总是那么简单直接。仔细评估细胞学特征和不明显的结构特征,有助于明确诊断,尤其是呈实性生长的病例,因为此时旺炽性UDH和细胞核中等级别DCIS的鉴别难度最大。
UDH是多形性的上皮细胞构成。低倍镜下,由于细胞的核浆比低而形成相对淡染的表现,而非典型增生则因为细胞核大而蓝染更为明显。结构上,UDH一般周围有裂隙样腔隙。如果有搭桥或拱形结构,则细胞呈流水样、重叠,但并不会导致结构僵硬的表现。由于UDH为多形性上皮细胞构成,因此相邻细胞之间的细胞核和染色质表现是不同的。
如前所述,这种情况下的主要诊断陷阱是实性表现、细胞核中等级别的DCIS。这两种增生都是不同类型的上皮细胞构成,不过其结构线索有助于做出明确诊断:DCIS病例中,会有少许区域呈有极性的表现或菊型团形成,而UDH中所有裂隙样周围的细胞可能会有平行排列。
细胞核的特点和染色质的特点可能也有助于鉴别。UDH中除了前述细胞核的异质性外,还可能会有核沟、和/或嗜酸性的核内假包涵体。与此不同,DCIS中的上皮细胞为克隆性,因此所有细胞核的染色质数量和性质都相似。
出现坏死、凋亡、核分裂,都要考虑DCIS可能;但UDH中偶尔也会出现这些表现。实际上,伴坏死的UDH可能是诊断陷阱之一。存在坏死时,不管是局灶还是粉刺状,大部分病例都是DCIS。但一定要知道,罕见情况下局灶坏死可以存在于UDH中。评估伴坏死的实性导管内增生时,减除坏死区而仅针对上皮增生灶进行前述特征的评估,可能会有助于鉴别。
对于鉴别困难的病例,ER和CK5/6免疫组化可能是鉴别UDH和有非典型病变的必需项目。DCIS的ER着色为弥漫、强阳性,而不表达CK5/6;相反,UDH是异质性增生,其ER、CK5/6的着色表现不一、或呈镶嵌样。不过,需要注意的是,有些高级别核的DCIS会是ER阴性、且可能会表达基底型CK,如CK5/6,但其细胞核的多形性程度基本可以作出诊断而无需免疫组化才能鉴别。
最后,ER结果作为患者后续处理预测标记时,也总是会借此机会来证实这一增生性病变就是DCIS。低级别、中等级别、以及大部分高级别的DCIS都会表现为弥漫、强阳性的ER表达。如果着色强度在不同细胞之间并不一致,则要注意复阅HE切片确定DCIS的诊断是正确的。
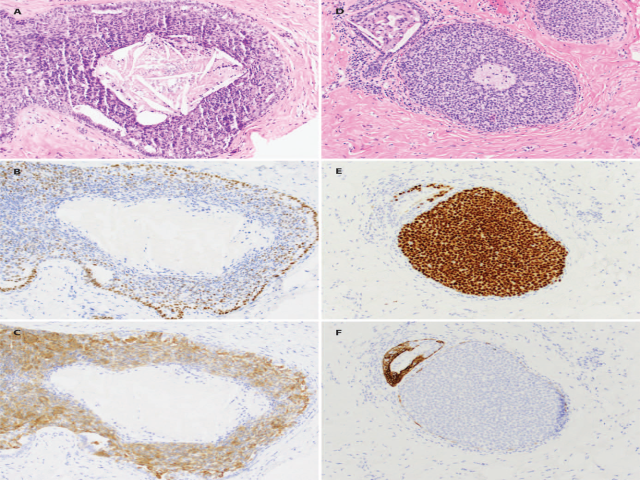
图2.实性导管内增生性病变,左侧为UDH、伴坏死,右侧为DCIS;形态学上,UDH的周边有轻微裂隙样表现,且增生的细胞排列杂乱;右侧的DCIS细胞核为中等级别,排列有序。免疫组化ER(第二行)和CK5/6(第三行)在UDH呈镶嵌样表达,在DCIS则ER为弥漫强阳性、CK5/6为阴性。
正如贯穿本文全程所强调的一样,确诊后的相关处理可能才是最重要的,这在CNB诊断中更是体现的淋漓尽致:误判为DCIS或浸润性癌的情况下,患者则需要手术及放疗、加或不加化疗;诊断UDH则无需进一步处理。因此,仔细判读相关形态学特征、如果必要的话加做免疫组化并判读。
——未完待续——
点此下载原文献
参考文献
[1]Quintana LM, Collins LC. Diagnostic Pitfalls in Breast Cancer Pathology With an Emphasis on Core Needle Biopsy Specimens. Arch Pathol Lab Med. 2023;147(9):1025-1038.
doi:10.5858/arpa.2023-0007-RA















共0条评论