[导读] 作者:游乐园
病史
患者女性,20岁。一年多前无明显诱因出现腹泻,无腹痛、恶心、呕吐、腹胀、胸闷气短等不适症状,虽反复发生腹泻,但可自行缓解,未予重视。一周前因体检行腹部CT平扫发现横结肠扩张,提示先天性巨结肠可能,遂行结肠次全切除+肠管减压+肠粘连松解术。术后病理大体上可见远端狭窄,近端明显扩张,部分区域因为梗阻而肥厚。组织学上以病变处肠管黏膜下及肌间神经丛中神经节细胞缺如及神经纤维增生为主要特征,移行区神经节细胞逐渐增多,神经节细胞区域与无神经节细胞区域相互交替,黏膜下及肌间神经纤维增粗。免疫组化:Calretinin在巨结肠扩张段神经节细胞区域呈阳性表达,而在狭窄段的神经节细胞缺失区域呈阴性表达,S100在巨结肠扩张段神经节细胞区域呈空泡状表现,在狭窄段神经节细胞缺失区域可见强阳性表达的增粗神经纤维。病理诊断:(结肠)先天性巨结肠。
讨论
先天性巨结肠又称肠管无神经节细胞症,是临床较常见的消化道先天性畸形,1886年由丹麦儿科医生HirschsPrung首先将该病描述,故又称HirschsPrung病,简称HD。1920年Valla首先指出该病的基本病理改变是痉挛肠管的肌间及粘膜下神经丛内缺乏神经节细胞,由于病变结肠缺乏神经节细胞(ganglioneeures,IGCs)导致所分布肠段括约肌而引起狭窄,近端肠管继发性扩张形成“巨结肠”。在新生儿中的发病率约为l:5000,男女比例为 3-4:1。一般认为,成人HD的诊断针对的是10岁以上的患者。通常情况下,成人HD患者的年龄从10岁到73岁不等,其中30岁以下患者所占比例较高。关于HD的病因,被广泛接受的遗传基础理论是迷走神经嵴衍生的肠神经系统(ENS)主要由迷走神经嵴衍生的前体形成,这些前体从人类妊娠的第3-8周以口端到尾端方向在肠道中迁移。HD发生在ENS前体细胞未能定植于胎儿远端肠道时。ENS前体的肠道定植是由细胞增殖驱动的,细胞增殖导致对空间和营养因子的竞争,从而推动迁移。ENS前体在胎儿肠道定植需要许多营养因子、细胞表面受体、转录因子和信号分子。因此,许多基因缺陷导致HD的发生。多种基因异常与HD的发病相关,已研究的最重要的基因和通路包括:胶质细胞来源的通路基因 [转染重排原癌基因(RET)、源性神经营养因子(GDNF)、轴突导向因子(NTN)、基因10(SOX10)、配对同源异型盒蛋白2B(PHOX2b)],内皮素通路基因[内皮素3(EDN3)、内皮素受体B(EDNRB)、SOX10]和TGFβ信号通路基因(ZFHX1B)。这些基因似乎通过受体酪氨酸激酶(RTK)和G蛋白偶联受体(GPCR)信号转导途径与RET和EDNRB表现明显。另外缺血缺氧、免疫因素、巨细胞病毒和寄生虫感染、炎症等因素也可毁坏肠壁内神经嵴细胞。
体内肠道功能受迷走神经节和盆腔副交感神经节、椎前和椎旁交感神经节、脊神经节和激素信号(如促肾上腺皮质激素释放激素)的传入和传出神经支配的调节。感觉和运动信号沿着肠脑轴双向传播,使得中枢神经系统和肠道影响彼此的活动。来自ENS的信号影响肠道起搏器细胞(Cajal间质细胞)和平滑肌的活性,以产生因肠道区域和腔内内容物而相反的收缩和松弛模式。远端病变结肠黏膜下神经丛和肌间神经丛内完全或部分缺乏肠神经节细胞,致使神经纤维排列紊乱,呈波浪状,造成结肠持续痉挛,失去正常的推进蠕动功能。胚胎5-12周时,肠自主神经系统的外胚层神经嵴细胞(nerual crest cell,NCC)沿肠壁迁移异常终止,导致部分肠壁肌间神经丛和黏膜下神经丛神经节细胞缺如、不能产生有效肠蠕动。由于粪便通过困难,长期淤积于痉挛肠段,近端结肠代偿性扩张、增厚,形成巨结肠。可简单解释如下:远端肠段神经节细胞缺失,导致肠管痉挛性收缩、变窄,粪便淤滞于近端结肠,近端结肠继发性代偿肥厚、扩张。HD的临床表现因年龄不同而异。在新生儿中,胆汁性呕吐、腹胀和胎粪排出延迟是其主要症状。在成人中,症状延迟出现的原因可能是神经节段短或超短,这导致成人HD常难以诊断。病史是诊断HD的重要工具,可反映腹痛和慢性便秘等症状,其中的一个重要部分是确定便秘的性质和持续时间。
临床上对HD进行分类十分困难,因为神经系统定植失败是易变的或不连续的。国际上通常识别3种表型,包括:1、全结肠神经节垂死症,累及整个结肠,无神经节细胞长度可能近端延伸至不同长度的小肠(通常不超过回盲瓣近端小肠50cm);2、全结肠和小肠神经节垂死症,可能累及一定长度的小肠的神经节;3、更常见的直肠或直肠/乙状结肠神经节垂死症(RA或RSCA)。目前国内将HD分为5个亚型:1、短段型,指狭窄段位于直肠中远段;2、常见型,又称普通型,指狭窄段位于肛门至直肠近端或直肠乙状结肠交界处,甚至达乙状结肠远端;3、长段型,指狭窄段自肛门延伸至降结肠甚至横结肠;4、全结肠型:指狭窄段波及升结肠及距回盲部 30cm以内的回肠;5、全肠型,指狭窄段波及全部结肠及距回盲部30cm以上小肠,甚至累及十二指肠。
无创性检查有助于指导HD的诊断。钡剂灌肠和CT扫描可显示结肠扩张,而乙状结肠或直肠处狭窄有助于排除慢性便秘的其他原因。内镜检查可通过肛门直肠测压显示HD患者有无肛门直肠抑制性反射。与儿童一样,在成人HD患者中,临床常首先进行造影剂灌肠和肛门直肠测压检查,而不是以抽吸活检作为初始诊断方案。如果测压结果提示HD,且在钡剂灌肠中显示出清晰的过渡区,则需要通过抽吸活检来确认诊断。如果上述检查结果均为阴性,则应通过手术切除标本的组织病理学检查结果进行诊断。HD的组织学改变以无节细胞肠段的黏膜下及肌间神经丛中神经节细胞缺如及神经纤维增生为主要特征。移行肠段的基本病理特征有两点:一是神经丛的密度和节细胞数量显著低于正常,二是含节细胞的神经丛和无节细胞的“肥大神经丛”交替出现。免疫组化SMMHC、Smoothelin、CR、S-100 、CD117、NSE、AchE染色诊断HD有着较为准确的诊断率,可有效减少误诊率。鉴别诊断:主要是与非神经节细胞缺如的便秘性疾病鉴别,其临床症状可以与HD相似,表现为便秘、腹胀甚至结肠扩张形成巨结肠。如所谓的“先天性节细胞减少症”、“肠神经元发育不良”等,这些疾病的概念、命名和诊断标准均存在较大的争议。HD最重要的特征是存在无神经节细胞肠段,而其他疾病均没有这一特点,因此诊断工作中一旦发现存在无节细胞区即可确定HD的诊断。
目前针对HD的治疗方法分为保守治疗、结肠造瘘和手术根治等三类。HD保守治疗适应于临床表现尚轻、诊断未完全明确及手术前准备等,可以用等渗温生理盐水灌肠使患儿排便。结肠造瘘适用于保守治疗失败或患者病情严重、不具备接受根治手术条件患儿。肠造口术一般用于并发小肠结肠炎、肠穿孔或全身营养状况较差无法耐受大手术的患者,经治疗一般情况好转后再行根治性手术。根治手术目前包括三种:Swenson手术、Soave手术和Duhamel手术,彻底切除病变肠管,解除梗阻状态,重新恢复肠道连续性。手术原则为尽可能一次性手术达到根治目的,通过提高手术技术和监护水平实现,避免小肠结肠炎、营养不良等并发症的发生。手术过程通过含有神经节细胞的狭窄神经节和扩张的近端肠之间的过渡区指导活检,但解剖时无法向含有肠神经元的肠组织进行过渡。重要的是,解剖过渡区是下神经节性的,如连续切片和定量分析所示,神经元密度在神经节带近端1-4cm处增加。这个发现表明,外科医生应进行造口术或进行拉通手术,距离活检样本上观察到的最远端神经节细胞至少近端4cm,以避免下神经节过渡区。一旦造口术开始,肠道内的空气和粪便可以通过造口术轻松离开肠道。消除功能性梗阻通常可以显著改善食欲,促进生长并预防小肠结肠炎。手术的最终目标是重建肠道,将正常支配的肠道连接到肛门开口。最初的 Swenson拉通手术要切除所有无神经节性肠组织,并将含有神经元的肠连接到肛门边缘的正上方,保护肛门括约肌。Soave拉通手术的开发是为了使支配的肠道通过剥离黏膜的直肠袖带来降低盆腔神经和血管受伤的风险,手术在肛门括约肌上方进行。Duhamal巨结肠根治术由于并发症及后遗症较多,常有粪污,自主排便稍差,目前已弃用。Soave手术可经肛门或腹腔镜进行,切除病变肠段同时适当切除近端严重扩张、肥厚的结肠,将结肠断端与齿状线上肛管切缘缝合固定以恢复肠道的通畅性。腹腔镜辅助下改良的Soave根治术手术创伤更小、恢复快、术中出血少、手术视野清晰,术后患儿恢复较快。但仍存在一定缺点,如高压气腹对小儿生理功能的远期影响不明确等。亦有研究者认为,存在广泛黏连和小肠炎症的患儿不宜采用腹腔镜治疗。目前治疗先天性巨结肠的主要手段仍是外科手术,不同的手术方式均伴有较多的并发症,临床医师应根据疾病特点选择合适的治疗方式,在具体手术操作过程中应强调规范化操作以减少手术并发症,以获得更好的治疗效果。
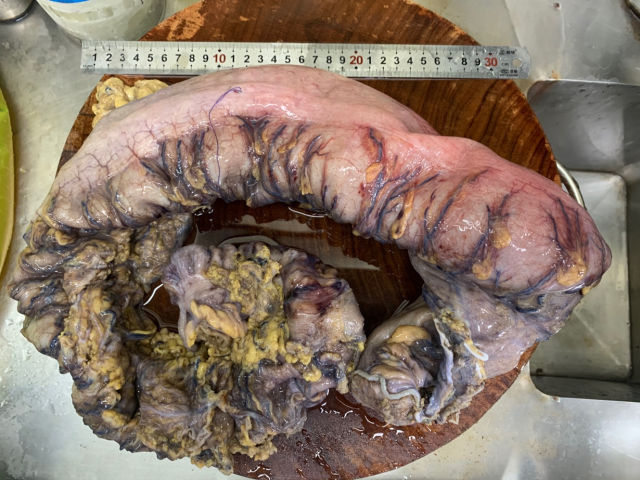
图1.大体上可见远端狭窄,近端明显扩张
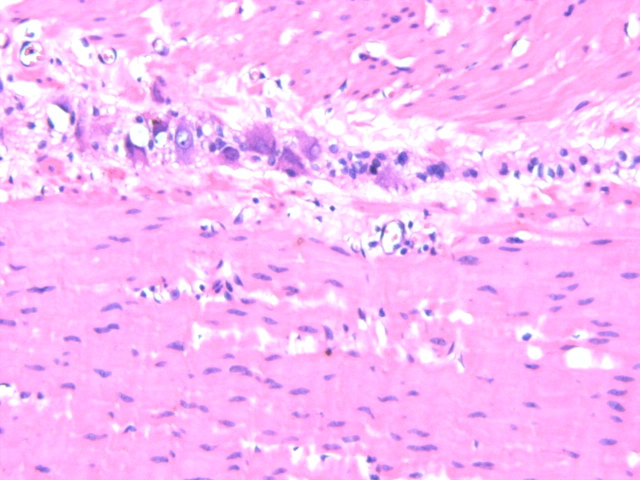
图2.肠管扩张处神经节细胞区域
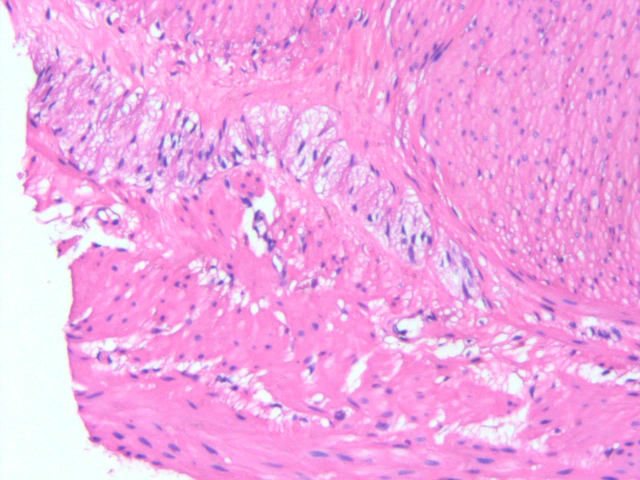
图3.肠管狭窄处神经节细胞缺失区域
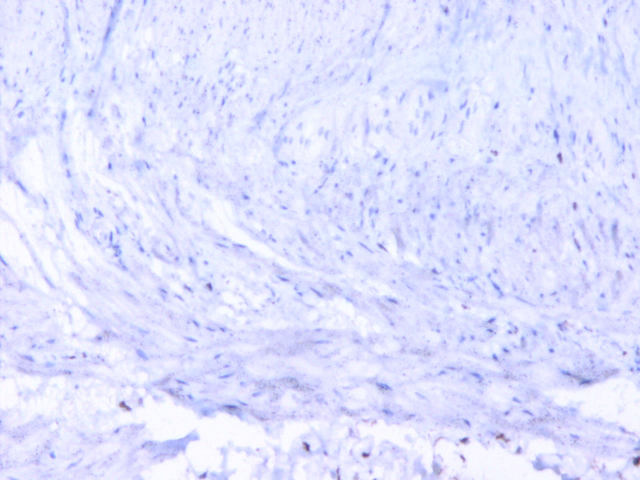
图4.CR在神经节细胞缺失区域呈阴性表达
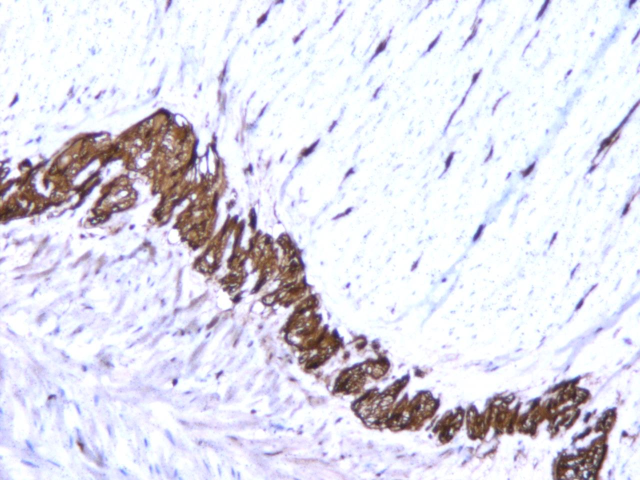
图5.S-100在神经节细胞缺失区域呈阳性表达


















共0条评论