[导读] 作者:张波
摘要:子宫内膜间质肿瘤(ESTs)包括子宫内膜间质结节(ESN)、低级别子宫内膜间质肉瘤(LG-ESS)、高级别子宫内膜间质肉瘤(HG-ESS)和未分化子宫肉瘤(UUS)。由于这些是罕见的肿瘤类型,对于晚期LG-ESS或HG-ESS的系统治疗的临床需求尚未得到满足。ESTs的细胞遗传学和分子生物学研究表明,LG-ESS中存在多种重复基因融合,而HG-ESS是由具有序列相似性22(FAM22)的酪氨酸3-单加氧酶/色氨酸5-单加氧酶激活蛋白(YWHAE)家族鉴定的。最近,一组同时具有锌指CCCH结构域蛋白7B(ZC3H7B)-B细胞淋巴瘤6辅阻遏子(BCOR)融合和BCOR基因内部串联复制(ITD)的ESS被暂时归类为HG-ESS。本综述,首先描述了关于复发性异常蛋白的分子特征及其在LG-ESS和HG-ESS肿瘤发生中的作用。进而,总结了LG-ESS和HG-ESS在肿瘤发生中可能共有的信号通路,并列出了潜在的可操作靶点。最后,在上述讨论的基础上,提出了一些治疗复发性基因改变的LG-ESS和HG-ESS的有效治疗策略。
1引言
子宫内膜间质肿瘤(ESTs)是一种罕见的间质肿瘤。2014年,世界卫生组织(WHO)确认了四类EST,包括子宫内膜间质结节(ESN)、低级别子宫内膜间质肉瘤(LG-ESS)、高级别子宫内膜间质肉瘤(HG-ESS)和未分化子宫肉瘤(UUS)。其中,LG-ESS是以多次或晚期复发为特征的相对惰性肿瘤。携带酪氨酸3-单加氧酶/色氨酸5-单加氧酶激活蛋白酪氨酸激酶(YWHAE)-NUT中线癌家族成员2(NUTM 2)融合蛋白的HG-ESS的预后比LG-ESS差,但好于UUS;后者通常与不良结局相关。手术是LG-ESS、HG-ESS和UUS的主要治疗方法,具有放射性和化疗抵抗性。因此,迫切需要对复发转移性LG-ESS、HG-ESS和UUS进行有效的全身治疗。越来越多的染色体和细胞遗传学研究表明,LG-ESS和HG-ESS中存在一些复发性遗传异常,这些基因改变有利于建立新的有效的全身治疗策略。因此,本文综述了已知的分子改变和治疗LG-ESS和HG-ESS的最新潜在进展。
2 LG-ESS和HG-ESS中的分子改变
2.1 LG-ESSS中的重复融合基因
2.1.1 JAZF1-SUZ12
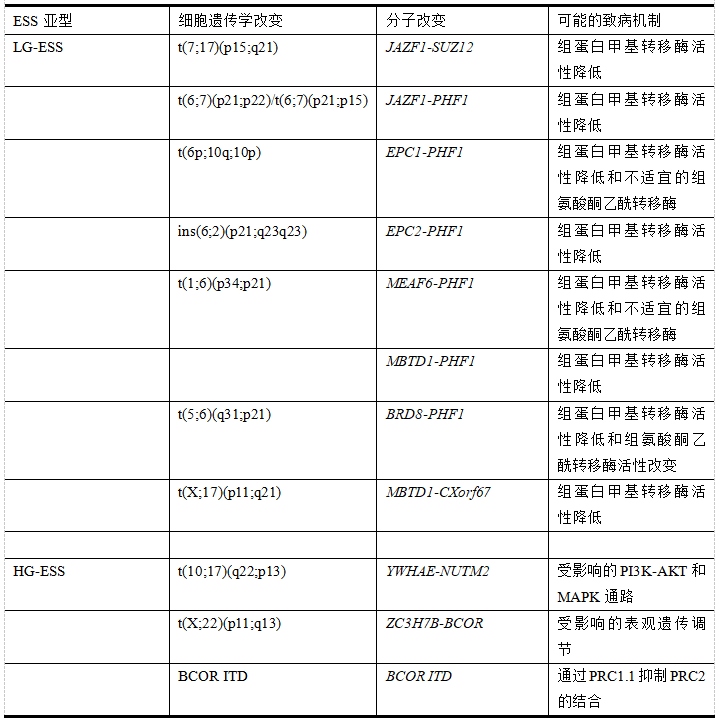
LG-ESS中最常见的遗传畸变是t(7;17)(p15;q21)染色体易位,结果是与另一个锌指基因1(JAZF1)-ZEST 12抑制因子(SUZ12)(以前称为JAZF1-JJAZ1)并列在大约50%的LG-ESS病例中(表1)。可能的JAZF1-SUZ12融合蛋白包含来自JAZF1的N-近端锌指域,来自SUZ12的锌指结构域和C-末端的VEFS-box(VRN2EMF2-FIS2-SUZ12 box)结构域。多项研究表明,JAZF 1表达参与前列腺癌、胃癌和肝细胞癌的肿瘤发生。最近,JAZF 1蛋白被鉴定为H4(NuA 4)复合物的核小体乙酰转移酶的新亚基。SUZ 12是最小组蛋白甲基转移酶(HMT)活性所需的多梳抑制复合物2(PRC 2)的核心组分之一,并且参与PRC 2的中叶和对接叶的形成以稳定活性位点并募集与PRC 2相关的因子。
染色质调节真核细胞中的基因表达,染色质结构不断地被修改以实现其实际作用。用于基因表达的染色质结构的关键调节剂是组蛋白甲基化复合物,其中PRC 2是具有HMT活性的主要类别。PRC2及其成分通过组蛋白3(H3K27me3)上的三甲基化赖氨酸27(H3K27me3)控制着染色质致密化和转录抑制,与癌症的发生和转移有关。组氨酸乙酰转移酶(HAT)复合体也是基因表达的染色质结构的关键调节因子。例如,作为许多关键细胞蛋白的共同激活因子,如核激素受体、β-连环蛋白、核因子-κB(NF-κB)和c-Myc癌蛋白,NuA4HAT复合体进行了很大比例的核乙酰化,对转录调控至关重要。因此,NuA4HAT复合体与肿瘤发生有关。
研究显示,JAZF 1-SUZ 12融合蛋白保留了与NuA 4和PRC 2相互作用的能力,充当两种复合物之间的分子桥梁。它使PRC 2组分,即zeste同源物2(EZH 2)和胚胎外胚层发育(EED)的增强子不稳定,阻止SUZ 12与EZH 2和EED的共定位,消除PRC 2复合物的HMT活性,并降低H3K27me3的水平。同时,同样的研究表明,含有JAZF 1-SUZ 12融合蛋白的PRC 2与靶染色质位点的结合亲和力降低,从而降低了对靶基因的抑制,导致子宫内膜正常分化受到抑制间质细胞和增加细胞增殖。Li等的另一项研究进一步证明,JAZF 1-SUZ 12融合蛋白导致等位基因排斥,进而抑制未重排的SUZ 12等位基因,导致细胞凋亡明显抑制和细胞增殖加速。
所有发现都支持JAZF 1-SUZ 12融合蛋白至少通过改变PRC 2功能参与LG-ESS的发病机制(表1)。据我们所知,尚没有研究探索JAZF 1-SUZ 12融合蛋白是否以及如何在功能上改变NuA 4复合物,其中包括JAZF 1-SUZ 12保留与NuA 4相互作用的能力。
2.1.2 PHF1靶向融合体
LG-ESS中第二个最常见的遗传畸变涉及染色体带6p 21,其中植物同源结构域(PHD)指蛋白1(PHF 1)基因位于其中。PHF 1蛋白是表观遗传调控和基因组维持的必需因子,并且包含两种组蛋白阅读器模块,即一个Tudor结构域和两个PHD锌指结构域,以及延伸的同源结构域。晶体学和功能研究表明,PHF 1作为PRC 2辅助蛋白,通过其翼螺旋(WH)结构域结合DNA,该结构域由位于PHF 1的第二PHD指结构域(PHD 2)C末端的保守区域形成。PHF 1-DNA的这种结合导致PRC 2在染色质上的停留时间延长,并且是PHF 1更有效地促进EZH 2(PRC 2的催化组分)催化H3K27三甲基化的原因,并且PHF 1水平降低导致H3K27me 3的总体水平降低。基于上述关系,PHF 1在H3K27三甲基化中具有重要的功能。
除了PRC 2,一项研究揭示了其他几种PHF 1相互作用的表观遗传因子和复合物,如蛋白质精氨酸甲基转移酶5(PRMT 5)-WD重复结构域77(WDR 77)复合物,Cullin 4 B-环E3连接酶复合物(CRL 4 B),SIN 3转录调节因子家族成员A/组蛋白脱乙酰酶PHF 1在乳腺癌1(AIB 1)中扩增,表明PHF 1参与各种表观遗传转录调控途径。迄今为止,多项研究表明PHF 1与多个融合伴侣重组,包括来自7 q21的JAZF 1基因、来自10 p11的多梳同源物增强子1(EPC 1)基因、来自2 q23的EPC 2基因、来自1 p34的MYST/Esa 1相关因子6(MEAF 6)基因、来自5 q31的含溴结构域蛋白8(BRD 8)基因、和来自17 q21的恶性脑肿瘤(MBT)结构域包含蛋白1(MBTD 1)基因。这些融合基因的蛋白产物是NuA 4复合物的所有组分。这些嵌合蛋白中的所有PHF 1片段,包括JAZF 1-PHF 1、EPC 1-PHF 1、EPC 2-PHF 1、MEAF 6-PHF 1、MBTD 1-PHF 1和BRD 8-PHF 1,都含有对H3K27三甲基化重要的WH结构域。有理由推测,这些嵌合蛋白的构象可能通过WH结构域阻碍PHF 1与DNA之间的结合,导致PRC 2在染色质上的停留时间缩短,HMT活性水平降低,并释放对靶基因的抑制。这可能是所有具有PHF 1相关融合蛋白的LG-ESS的共同致病途径(表1)。
2.1.2.1 JAZF 1-PHF 1
不平衡的t(6p; 7 p)导致融合基因JAZF 1-PHF 1的形成。尽管JAZF 1-PHF 1的嵌合转录物是不同的,但所有研究的JAZF 1-PHF 1蛋白保留来自JAZF 1基因的一个锌指结构域和来自PHF 1基因的所有功能结构域(表1)。考虑到上述编码的PHF 1相关融合蛋白的共同致病机制,目前对JAZF 1-PHF 1融合蛋白如何干扰PRC 2和NuA 4的功能知之甚少;因此,需要额外的研究来鉴定JAZF 1-PHF 1融合如何参与LG-ESS的发病机制。
2.1.2.2 EPC 1-PHF 1和EPC 2-PHF 1
PHF 1基因与EPC 1基因从10 p11通过不平衡的6p; 10 p重排重组和EPC 2基因通过插入(6;2)(p21; q23 q23)(表1)。EPC 1-PHF 1融合蛋白含有来自EPC 1的前581个残基和PHF 1的整个编码区。EPC 2-PHF 1融合蛋白保留了两个基因的全部编码区,编码的蛋白质由来自EPC 2的855个氨基酸残基和来自PHF 1的662个氨基酸。
EPC1-PHF1和EPC2-PHF1可能具有上述编码的PHF1相关融合蛋白的共同致病机制,即通过阻碍PHF1与DNA的结合来干扰PRC2的HMT功能。此外,一些研究人员提出,EPC1-PHF1融合蛋白通过对PHF1‘S正常靶点的不适当HAT活性参与LG-ESS的肿瘤发生(表1)。这一机制的细节将在下面讨论。
从酵母到人类,NuA 4复合物的亚基被组织成不同的功能模块。Piccolo模块,包括达特相互作用蛋白60(TIP 60;酵母中的Esa 1)、EPC 1(酵母中的Epl 1)、生长家族成员3的抑制剂(ING 3;酵母中的YNG 2)和MEAF 6(酵母中的Eaf 6),是NuA 4复合物的功能模块之一,并且能够乙酰化染色质底物。在NuA 4内,EPC 1的N末端结合TIP 60、ING 3和MEAF 6,而C末端-通过MBTD 1桥接EPC 1和NuA 4复合物的其余部分。然而,该研究表明,与EPC 1与MBTD 1的结合相关的EPC 1残基644 - 672不包括在EPC 1-PHF 1融合蛋白中。因此,EPC 1-PHF 1融合蛋白不能桥接Piccolo-NuA 4和NuA 4复合物的其余部分,导致缺乏形成的完整NuA 4复合物。Boudreault等人表明,仅表达Epl 1 N-末端一半的细胞缺乏完整的NuA 4 HAT活性,但具有Piccolo-NuA 4复合物和后续活性。有人进一步提出,PiccoloNuA 4代表了一种非靶向的HAT活性,负责全局乙酰化,而完整的NuA 4复合物被募集到特定的基因组位点,以局部干扰动态乙酰化/脱乙酰化平衡。基于上述发现,Avvakumov和Litté提出了一个非常有趣的可能性,即EPC 1-PHF 1嵌合蛋白将Piccolo-NuA 4的HAT活性转移到PHF 1的正常靶点通常保持在抑制状态的基因组区域。Piccolo-NuA4错误地对组蛋白H4进行乙酰化会导致异染色质的解体,导致基因表达异常,这很容易解释恶性肿瘤的出现。
2.1.2.3 MEAF6-PHF1融合基因
MEAF6-PHF1融合基因来源于t(1;6)(p34;p21)(表1)。该转录本是MEAF6的第5外显子和PHF1的第2外显子之间的框内融合,预测的融合蛋白包含PHF1的Tudor结构域和串联的PhD锌指结构域以及NuA4亚单位MEAF6。在Piccolo-NuA4中,MEAF6是在正常情况下与EPC1和Tip60物理上相互作用的一个附件因子。到目前为止,MEAF6的具体作用还不清楚,但作为一个非催化亚基,它对NuA4复合体的组装、稳定性、基因组靶向、底物特异性和调控至关重要。此外,MEAF6-PHF1融合在LG-ESS肿瘤发生中的作用也不清楚。Panagopoulos等人假设了与EPC1-PHF1类似的机制,即MEAF6-PHF1嵌合蛋白连接PiccolNuA4和PrC2,并将Piccolo-NuA4的活性转移到PHF1的S正常基因组靶点。同样,上述推测的PHF1相关融合蛋白的共同致病机制,即PRC2复合体的HMT功能紊乱,也适用于MEAF6-PHF1。
2.1.2.4 MBTD1-PHF1
Han等报道了一例LG-ESS的MBTD1-PHF1融合,该融合包括MBTD1外显子16和PHF1外显子2的47bp插入,预计编码一个包含MBTD1和PHF1所有功能结构域的嵌合蛋白(表1)。
MBTD1蛋白是一个组蛋白H4赖氨酸20甲基化(H4K20Me)阅读器,它包含四个MBT重复序列和一个Phe-Cys-Ser(FCS)锌指域。结构分析表明,MBTD1通过MBT重复与NuA4非催化亚基EPC1结合,与H4K20Me结合位点不同。MBTD1和EPC1之间的结合促进了完整NuA4复合体的形成,并通过将完整的NuA4复合体招募到特定的基因组座位来调节某些基因的表达。然而,嵌合蛋白MBTD 1-PHF 1可能直接桥接Piccolo-NuA 4和PRC 2复合物,导致Piccolo-NuA 4的HAT活性转向PHF 1的正常基因组靶点,这是一种与EPC 1-PHF 1类似的机制。推测MBTD 1-PHF 1的构象可能干扰了PHF 1与DNA的结合,从而影响了PRC 2的HMT活性。
2.1.2.5 BRD 8-PHF 1
LG-ESS中的BRD 8-PHF 1融合基因在来自5 q31的BRD 8的外显子16和来自6p 21的PHF 1的外显子2之间形成(表1)。嵌合转录物保留了PHF 1的整个编码区,但失去了来自BRD 8的保守布罗莫结构域序列。
BRD 8是人NuA 4 HAT复合物的特异性辅助亚基,赋予该复合物额外的作用。除了将NuA 4与甲状腺激素受体的配体依赖性转录调节相联系之外,BRD 8可能涉及NuA 4复合物初始募集后的局部染色质保留。BRD 8的布罗莫结构域是乙酰化的赖氨酸结合结构域,其在BRD 8-PHF 1中的损失可导致NuA 4的HAT活性和/或蛋白乙酰化的改变。由于PHF 1构成BRD 8-PHF 1融合蛋白的3'端,这增加了BRD 8-PHF 1与其他PHF 1相关融合蛋白共享相同致病机制的可能性(表1)。
2.1.3 MBTD1-CXorf67
Dewaele 等描述了LG-ESS中的t(X;17)(p11; q21)易位和MBTD 1外显子16与X染色体开放阅读框67(CXorf 67,也称为EZHIP或CATACOMB)外显子1的MBTD 1-CXorf 67融合(表1)。嵌合MBTD 1-CXorf 67蛋白被预测包含MBTD 1的所有功能结构域和CXorf 67的富含丝氨酸的区域。
CXorf 67基因在正常卵母细胞中高度过表达,而在其他组织(包括正常子宫内膜)中表达较低。CXorf 67基因表现出高度的DNA甲基化,这可能解释了为什么该基因不能更广泛地表达。然而,在ESS中,MBTD 1-CXorf 67染色体重排导致CXorf 67 3'部分的异位过表达。一项研究进一步证实CXorf 67是PRC 2复合物的亚基。CXorf 67和MBTD 1-CXorf 67融合蛋白均与PRC 2复合物相互作用,并显著减少PRC 2的催化产物H3K27me 2/3。相同的研究还证明,高水平的CXorf 67蛋白是PRC 2功能抑制和H3K27me 2/3水平降低的直接原因。Hübner等人证明,位于CXorf 67 C端区域的高度保守肽序列模拟K27 M突变组蛋白的序列,并与侵袭性后颅窝室管膜瘤中EZH 2的SET结构域结合。这种相互作用阻断EZH 2甲基转移酶活性并抑制PRC 2功能,导致PRC 2靶基因的去抑制。
Piunti等人还表明,嵌合蛋白MBTD 1-CXorf 67不仅与PRC 2亚基EZH 2相互作用,还与NuA 4亚基转化/转录结构域相关蛋白(TRRAP)相互作用。因此,与MBTD 1-PHF 1类似,MBTD 1-CXorf 67可能将Piccolo-NuA 4的非靶向HAT活性转移到PRC 2的正常基因组靶标。然而,由于迄今为止缺乏证据,因此需要进行验证性研究来支持这一理论。
总体而言,LG-ESS中所有上述复发融合蛋白的特征在于存在N-末端NuA 4组分和C-末端PRC 2亚基。这些融合蛋白中的大多数保留了伴侣蛋白的大部分功能结构域。已经证明某些融合蛋白,如JAZF 1-SUZ 12和MBTD 1-CXorf 67,保留了将NuA 4结合到PRC 2的功能。理论上,其他融合蛋白也可能保留结合NuA 4和PRC 2的能力。现在认为异常融合蛋白驱动LG-ESS中的肿瘤发生,虽然确切的机制尚不清楚,但特定位点的异常乙酰化过程或甲基化过程或两者都被认为是关键事件。对LG-ESS基因表达谱研究的荟萃分析结果证实,LG-ESS中失调的基因中有一半构成了SUZ 12的直接靶点,多个基因的激活与Wnt信号传导有关,特别是50%至60%的LG-ESS中的β-连环蛋白表达。这些结果表明LG-ESS中不同重排之间共有的发病机制。
2.2 HG-ESS中的复发基因改变
2.2.1 YWHAE-NUTM 2
在目前的WHO分类中,HG-ESS仅代表由那些具有t(10; 17)(q22; p13)重排导致YWHAE-NUTM 2融合蛋白的肿瘤(表1)。新出现的证据表明,YWHAE基因及其产物在癌症发展和进展中起着多方面的作用。
亚细胞定位决定了潜在相互作用蛋白质和翻译后修饰机制的可及性。然而,据报道YWHAE-NUTM 2融合蛋白主要存在于HG-ESS的细胞核中,而内源性野生型14-3-3ε存在于细胞质。同时,YWHAE-NUTM 2融合蛋白中的14-3-3ε保留了二聚化和磷蛋白结合所必需的氨基酸。最近,一项研究表明,表皮生长因子受体(EGFR)、胰岛素样生长因子1受体(IGF1R)、血小板衍生生长因子α(PDGFα)、以及磷脂酰肌醇-3-激酶(PI3K)-丝氨酸/苏氨酸激酶(AKT)和丝裂原活化蛋白激酶(MAPK)内的后续下游信号传导在伴有复发性t(10;17)(q22;p13)重排的肾透明细胞肉瘤(CCSK)中,该通路与迁移增加相关(表1)。抗-EGFR、抗-IGF 1 R或抗-PDGF α治疗可显著减少细胞迁移。还证实了由CCND 1基因编码的细胞周期蛋白D1的表达上调,而弥漫性细胞周期蛋白D1核免疫染色被认为是YWHAE-NUTM 2 HG-ESS的诊断性免疫标志物。
2.2.2 BCOR相关基因改变
最近,一组在B细胞淋巴瘤6(BCL 6)辅阻遏物(BCOR)基因的最后一个外显子中同时具有含锌格尔CCCH结构域的蛋白7 B(ZC 3 H7 B)BCOR融合和内部串联重复(ITD)的ESS被暂时归类为具有侵袭性临床病程的HG-ESS(表1)。
BCOR蛋白是一种转录辅阻遏物,参与通过组蛋白修饰诱导基因沉默,通过BCL-6结合结构域与BCL 6相互作用,或通过PCGF Ub样折叠结构域(PUFD)结合作为PRC1.1的一部分的多梳组环指1(PCGF 1)蛋白。癌基因BCL-6参与肿瘤发生,特别是淋巴瘤发生。PRC1.1是由BCOR或BCOR样1(BCORL 1)与组蛋白脱甲基酶赖氨酸脱甲基酶2B(KDM 2B)结合形成的非典型PRC 1(ncPRC 1)。PRC 1.1具有由多梳组(PcG)蛋白质环指蛋白1(RING 1)/环指蛋白2(RNF 2)和PCGF 1之间的异二聚体介导的额外H2 A泛素化活性。
ZC3H7B(也称为RoXaN)-BCOR融合基因由t(X;22)(p11;q13)易位形成。然而,对ZC3H7B基因及其产物知之甚少,其含有涉及蛋白质/蛋白质和核酸/蛋白质相互作用的几个结构域。Panagopoulos等人报道,ZC3H7B-BCOR融合蛋白最重要的作用可能是通过保留多个功能结构域的推定融合蛋白进行表观遗传调节,尽管需要额外的实验来确定ZC3H7B-BCOR的致癌机制(表1)。
BCOR ITD改变涉及位于PUFD结构域内的外显子15或外显子16。研究指出,规范的PRC1(CPRC1)通过依赖于PRC2的H3K27me3标记被招募到靶点,以稳定压缩的染色质,而Kdm2b介导的ncPRC1的招募驱动Lys119在His-Tone H2 A(H2AK119)中的泛素化,从而反过来促进PRC2的结合,导致染色质紧凑和基因沉默。然而,BCOR ITD阻碍了BCOR与PCGF1的结合,从而在表观遗传修饰中扰乱了PRC1.1的结构和/或功能(表1)。
与使用YWHAE-NUTM2的HG-ESS相似,BCOR相关性HG-ESS中Cyclin D1免疫反应较强,呈弥漫分布。此外,强烈的BCOR表达不仅在具有ZC3H7B-BCOR和BCOR ITD的HG-ESS中观察到,而且在具有YWHAE-NUTM 2的HG-ESS中也观察到。如最近报道的,大多数具有YWHAE、BCOR重排或BCOR ITD的软组织未分化圆细胞肉瘤显示神经营养性酪氨酸受体激酶3(NTRK 3)mRNA上调和细胞质泛Trk免疫反应性。此外,LG-ESS的甲基化谱不同于HG-ESS的甲基化谱,而具有BCOR重排的HG-ESS和具有YWHAENUTM 2基因融合的HG-ESS共享相似的甲基化谱。这些结果表明,具有不同重排的HG-ESS具有共同的致病机制。
2.3 ESS中的其他融合基因没有确凿的证据
在LG-ESS病例中鉴定了没有记录的1; 17重排核型的MEAF 6-SUZ 12融合基因。Dickson 等描述了两种携带EPC 1- SUZ 12和EPC 1-BCOR融合基因的ESS,其具有侵袭性临床病程和主要的高级别形态。艾伦等人报告了1例最初诊断为LG-ESS伴JAZF 1-BCORL 1融合的病例,其特征为1型神经胶质瘤病(NF 1)内的剪接位点突变和细胞周期蛋白依赖性激酶抑制剂2A/B(CDKN 2A/ B)的纯合缺失。然而,根据现有的形态学图片和文献显示的侵袭性临床过程,Ferreira等认为该病例可能是HG-ESS,在一项回顾性研究中,在ESS中发现了多个先前未发现的BCOR相关重排,包括BCOR-L3 MBTL组蛋白甲基赖氨酸结合蛋白2(L3 MBTL 2),E1 A结合蛋白p300(EP 300)BCOR,BCOR-NUT家族成员2G(NUTM 2G),具有PH结构域和SH 3结合基序1的BCOR-Ral GEF(RALGPS 1),含有BCOR-MAP 7结构域2(MAP 7D2),逆转录转座子Gag样9(RTL 9,在文献中也称为RGAG 1)-BCOR、ING 3BCOR、BCOR-核GT3、生发中心相关(NUGGC)、赖氨酸甲基转移酶2D(KMT 2D)-BCOR,环磷酸腺苷(cAMP)反应元件结合蛋白(CREB)-结合蛋白(CREBBP)-BCOR和BCOR内部重排。与这些融合相关的隐含生物潜力仍有待充分描述。显然,参与上述融合基因的大多数伙伴在表观遗传修饰中发挥作用,主要是甲基化和乙酰化。
2.4 ESS中除复发融合基因外的分子改变
尽管认为复发性融合基因是ESS发展的驱动事件,但包含驱动基因的拷贝数改变(CNA)和点突变也可能有助于ESS的发展。
Patel等人报告了2例缺乏任何已知重排但分别具有连环蛋白β1(CTNNB 1)激活突变和双等位基因CDKN 2A(编码p16/INK 4a)失活突变的ESS病例。CTNNB 1中的突变激活Wnt靶向基因,并且一种这样的激活的Wnt靶向基因CCND 1的表达在ESS中经常上调。CCND 1基因编码细胞周期蛋白D1,它是细胞周期蛋白依赖性激酶4(CDK 4)的变构调节因子,是细胞通过G1/S检查点所必需的。作为TCF/β-catenin途径的cyclin D/CDK 4抑制剂,p16/INK 4a也可能通过CDKN 2A的功能缺失突变促进细胞周期失调。最终,CTNNB 1的激活和/或CDKN 2A的抑制导致细胞周期蛋白D/CDK 4抑制的释放,随后通过G1/S检查点和细胞增殖。另一个病例显示CCND 2基因扩增,其编码细胞周期蛋白D2,一种与细胞周期蛋白D1相似的CDK 4激酶的额外激活剂。在最近的研究中,通过致癌HrasG 12 V表达加CDKN 2A敲低建立了细胞周期蛋白D1阳性的HG-ESS小鼠模型。
许多研究表明,在具有JAZF 1重排或BCOR重排的ESS中,小鼠双微同源物2(MDM 2)和CDK 4加CDKN 2A缺失的扩增一起发生并不罕见。MDM 2和CDK 4基因均位于染色体12 q13 - 12 q15处,染色体12 q13 - 12 q15的扩增可能是肿瘤发生中的关键事件。如上所述,在通过G1/S检查点和随后的细胞增殖中CDK 4在细胞内起关键作用。MDM 2是p53和视网膜母细胞瘤(Rb)蛋白的重要负调节剂。此外,MDM 2与PRC 2物理结合并增强不依赖于p53的促进干细胞的染色质修饰。
3 LG-ESS和HG-ESS的潜在治疗策略
3.1靶向Wnt信号通路
如前所述,Wnt信号传导是LG-ESS中最显著激活的途径。β-catenin的存在表明Wnt信号通路被激活,淋巴增强子结合因子1(Lef 1)转录因子是该通路的主要效应因子之一。β-连环蛋白和Lef 1蛋白的核表达与LG-ESS高度相关。Wnt信号传导还涉及具有BCOR ITD、ZC3H7B-BCOR和YWHAE-NUTM 2的HG-ESS。如上所述,HG-ESS的共同特征是由Wnt靶向基因CCND 1编码的细胞周期蛋白D1的强表达。细胞周期蛋白D1是CDK 4激酶的激活剂,促进细胞通过G1/S检查点。因此,所有可用的证据表明,靶向Wnt通路和下游效应子,特别是CDK 4激酶,可能对HG-ESS或LG-ESS患者有益。
此外,已经证明LG-ESS细胞特征性地表达雌激素受体(ER),并且BCOR相关的HG-ESS细胞特征性地表达ER。一些研究进一步证明了激素治疗对ER阳性ESS的疗效。美国国家综合癌症网络(NCCN)指南也推荐芳香化酶抑制剂作为LG-ESS的首选治疗方案。
考虑到CDK 4/6抑制剂和芳香化酶抑制剂都是可用的,无论是单独使用还是联合使用,特别是CDK 4/6抑制剂与芳香化酶抑制剂的联合使用,晚期ER阳性乳腺癌患者的生存率可以显著提高。因此,应考虑单独使用CDK 4/6抑制剂或与芳香化酶抑制剂联合使用,以治疗ER阳性LG-ESS和ER阳性BCOR相关HG-ESS伴远处转移的患者,特别是对单独内分泌治疗耐药的患者。对于ER阴性的YWHAE-NUTM 2的 HG-ESS,CDK 4/6抑制剂单独或与其他药物联合使用的疗效也需要进一步探索。一个相关报道显示,共靶向CDK 4/6和MDM 2是克服对CDK 4/6抑制的内在抗性的有希望的方法,所述内在抗性归因于增加的p53稳定性和随后由MDM 2拮抗剂诱导的p21积累。
3.2靶向蛋白降解
异常融合蛋白是LG-ESS和HG-ESS发展的驱动因素;因此,毫无疑问,致病性融合蛋白的降解和消除应构成有效的治疗策略。靶向蛋白质降解是一种很有前途的治疗方式,降解提供了去除靶向蛋白质并随后消除其所有相关功能的机会,这种策略特别适用于“无成药性”蛋白质。
蛋白水解靶向嵌合体(PROTAC)是双功能分子,每个包含与E3连接酶配体连接的靶向蛋白的配体。通过PROTAC结合靶蛋白导致靶蛋白的泛素化和随后的降解。据了解,尚未对LG-ESS或HG-ESS中针对肿瘤遗传融合蛋白的PROTAC进行研究。然而,已经证明PROTAC有效地降解融合蛋白,例如断点簇区域-Abelson(BCR-ABL)和间变性淋巴瘤激酶(ALK)融合蛋白,并抑制由这些融合蛋白驱动的癌细胞增殖。某些最近的研究表明,EED靶向的PROTAC不仅可以降解EED,还可以降解EZH 2和SUZ 12,从而抑制PRC 2依赖性癌细胞的增殖。PROTAC对EED、EZH 2和SUZ 12的同时降解是EZH 2、EED和SUZ 12之间紧密结合的结果。根据如上结果,探索PROTAC用于治疗具有复发性基因融合的ESS的作用似乎是可行的。
3.3酪氨酸激酶抑制剂
NTRK融合通过下游细胞生长和增殖途径的组成性激活促进肿瘤发生。正如Khotskaya等人所综述的那样,NTRK拷贝数变异和基因过表达可能对多种恶性肿瘤具有临床意义。最近,Kao等报道,通过RNA测序数据分析,大多数具有YWHAE、BCOR重排或BCOR ITD的软组织未分化圆细胞肉瘤显示NTRK3上调,并且在100%的YWHAE重排和80%的BCOR ITD软组织圆细胞肉瘤中观察到细胞质泛Trk免疫反应性。虽然靶向治疗对NTRK过表达但无基因重排的肿瘤的影响尚未明确确定,但可能值得研究。
如上所述,具有YWHAE-NUTM 2融合蛋白的CCSK细胞的迁移优势通过抑制失调的MAPK和PI 3 K-AKT信号传导途径而消除。此外,已经证明野生型YHAWE在不同情况下参与MAPK和PI3K-AKT信号传导途径。因此,阻断MAPK和PI3K-AKT信号通路的激活可能是用YWHAE-NUTM 2治疗HG-ESS的合适方法。在一个病例中,用帕唑帕尼治疗具有序列相似性22(FAM 22)易位和高表达肥大/干细胞生长因子受体(SCFR,也是C-KIT)的YWHAE家族的转移性ESS患者,并显示出良好的部分反应。帕唑帕尼的主要活性是针对血管内皮生长因子受体(VEGFR)、血小板衍生生长因子受体(PDGFR)和C-KIT。此外,两份病例报告的特征在于,一例C-KIT阳性HG-ESS和一例C-KIT局灶性阳性LG-ESS表现出对甲磺酸伊马替尼的客观反应。甲磺酸伊马替尼的主要作用是对抗BCR-ABL酪氨酸激酶、血小板衍生生长因子(PDGF)、干细胞因子(SCF)和C-KIT。甲磺酸伊马替尼和帕唑帕尼的有效性引发了探索ESS中C-KIT和PDGFR表达的研究。显示携带YWHAE-FAM 22融合基因的ESS经常过表达C-KIT。Cossu-Rocca等人报道,分别有68%和36%的ESS过度表达PDGFRA和PDGFRB。已知PDGFR和C-KIT都是MAPK和PI 3 K-AKT信号通路的上游成员。因此,靶向C-KIT、PDGFR和下游MAPK和PI3K-AKT信号通路的酪氨酸激酶抑制剂在ESS中的作用应进一步探索,因为由于这种疾病的罕见性,上述证据来自少数小病例系列。
3.4靶向表观遗传修饰
虽然LG-ESS和HG-ESS的肿瘤发生与复发的基因改变密切相关,但确切的机制仍不清楚。如上所述,最常见的推测是由于pRC2复合体的HMT活性不足和/或pRC2‘S正常基因组靶点的非靶向性HAT活性不足,导致组蛋白甲基化和乙酰化失衡,以及随后的信号通路紊乱,导致LG-ESS的肿瘤发生。然而,据我们所知,没有直接证据表明ESS的表观遗传修饰支持上述推测。关于HG-ESS,人们对YWHAE-NUTM2、ZC3H7B-BCOR或BCOR ITD在HG-ESS的表观遗传修饰和肿瘤发生中的作用知之甚少。
事实上,一些临床研究已经探索了HDAC表达水平与ESS患者存活率之间的关系,并且某些体外研究已经研究了HDAC抑制剂单独或与其他药剂组合对ESS细胞的作用。这些结果表明,不适当的乙酰化确实参与了ESS的发生和发展,靶向组蛋白乙酰化状态可能是有益的。尽管如此,这些结果与上面推测的ESS的发生或发展机制并不密切相关。
关于ESS中组蛋白甲基化状态的改变,Hashizhimi等人指出,K27去甲基化酶Jumonji结构域蛋白3(JMJD 3)的药理学抑制增加K27 M肿瘤细胞中的细胞H3K27甲基化。如前所述,MBTD 1-CXorf 67融合蛋白仅模拟K27 M突变组蛋白序列的作用,而遗憾的是,没有关于该主题的进一步可靠证据。
基于上述考虑,很难得到一个明确的答案,靶向表观遗传修饰是否可以治愈或改善复发性基因改变的ESS的结果。因此,需要更多的研究来探索融合蛋白表观遗传改变和ESS之间的关系。然而,通过单独或与其他药物联合使用表观遗传药物来改变组蛋白甲基化和/或组蛋白乙酰化状态的ESS治疗方法仍然是一个重要且有效的研究方向。
4结论
由于晚期LG-ESS和HG-ESS是罕见类型的肿瘤,因此这些疾病的系统治疗尚未满足临床需求。本文综述了LG-ESS和HG-ESS中这些反复出现的异常蛋白的结构和分子特征,并总结了它们共同的致病信号通路,以及LG-ESS和HG-ESS的潜在作用靶点。根据上述信息提出了一些治疗策略,但需要进行更多的研究来确定这些策略的可行性。同时,进一步确定这些复发性异常蛋白在LG-ESS和HG-ESS分子病理生理学中的作用的额外基础研究将有利于ESS的改进分类和这些肿瘤类型的新治疗策略的开发。
点此下载原文献














共0条评论