[导读] 编译整理:强子
涉及神经营养性原肌球蛋白受体激酶(neurotrophic tropomyosin receptor kinase,NTRK)基因家族(NTRK1、NTRK2、NTRK3)的融合见于多种类型的肿瘤。由于这一融合可通过某些激酶抑制剂(如拉罗替尼、恩曲替尼)来靶向性治疗、甚至在某些国家和地区无需考虑肿瘤的具体组织学类型,因此目前诊断出这类肿瘤具有重要临床意义。
澳大利亚病理专家Nguyen等人曾在《Pathology》杂志发表文章,详尽介绍了NTRK基因及相关肿瘤、相关检测的问题。为帮助大家更好的了解相关知识点并应用于临床实践,我们将该文要点编译介绍如下。
NTRK及相关肿瘤简介
NTRK属于跨膜受体酪氨酸激酶(receptor tyrosine kinase,Trk)家族成员,具体包括了TrKA、TrkB、TrkC,各自的编码基因即NTRK1、NTRK2、NTRK3。这类受体激酶正常情况下表达于外周神经和中枢神经系统,与神经信号有关。Trk的受体信号与特殊配体(神经营养因子)和受体的结合有关,导致激酶结构域活化、进而激活下游信号通路(如MAPK、PI3K、PKC)从而导致细胞增生、分化和存活。
肿瘤中的NTRK基因重排可以是染色体内的易位,也可以是染色体间的易位,总之是包括NTRK中激酶结构域在内的3’端和其他无关基因的5’端融合在一起。产生的融合蛋白并无配体结合结构域,因此导致下游信号通路配体无关的受体激活、且是不受控制的激活,从而导致肿瘤产生。NTRK基因中也有其他分子改变的报道,如活化型剪切亚型、体细胞性突变、扩增等,但并未发现这些是致癌驱动性改变的情况,也对NTRK抑制剂无明显效果。
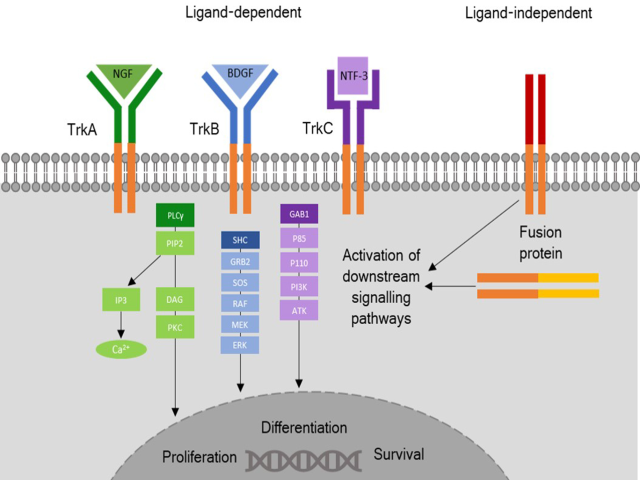
图1.TrK信号通路图示:左侧部分为配体偶联情况下的通路,右侧部分为Trk融合癌蛋白信号通路。二者有所不同:融合蛋白并无和相应结构域结合的配体,因此下游信号通路(PKC、MAPK、PI3K)是配体无关的受体激活、且不受控制的活化,从而导致肿瘤发生。
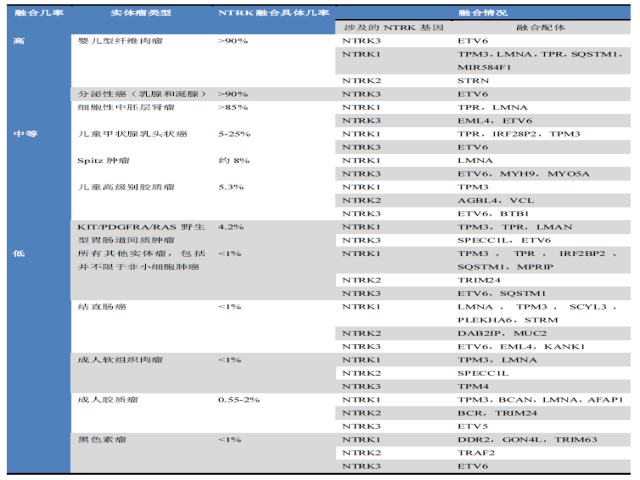
1982年,在一例结直肠癌中首次报道了NTRK的融合;此后逐步发现了80多种不同配体的NTRK基因融合,涉及成人和儿童的诸多瘤种。NTRK基因融合的几率在不同肿瘤有显著差异,大致可分为三种情况,详见表1。
表1.不同类型的实体瘤中NTRK融合的几率及相应融合配体
NTRK融合是有相应靶向治疗药物的,且效果很好、口服耐受较好,具体如拉罗替尼、恩曲替尼,很多国家已临床应用于进展期肿瘤。具体来说,拉罗替尼和恩曲替尼已表现出较高的客观缓解率,具体分别为78%、61.2%;两种药物带来的无进展生存时间中位数已分别达到36.8个月、13.8个月。
总之具有NTRK融合的诸多肿瘤中,相应靶向药物治疗都有了相当客观的效果。不过,具体疗效与患者年龄、肿瘤组织学无关,与涉及的NTRK基因特异性相关。因此,检测NTRK融合对于患者治疗方案的决策有很大帮助,尤其进展期、转移性病变的情况下,因为这时并无其他标准治疗方案,或者相应标准治疗方案存在无效、耐受性差等问题。
目前的NTRK检测方案
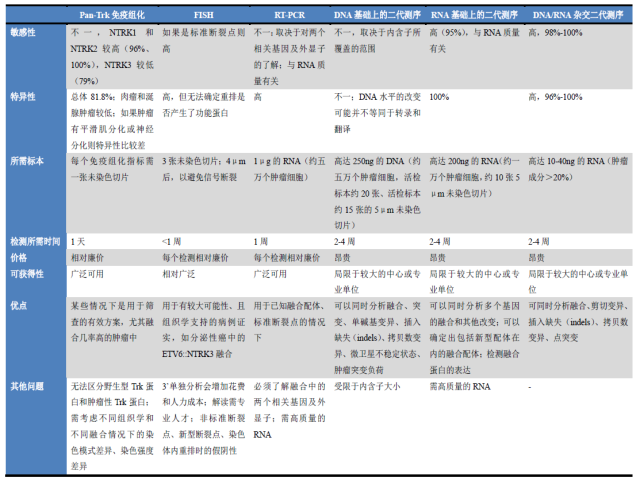
如前所述,准确确定NTRK融合可筛选出TRK靶向抑制治疗获益的患者。由于不同瘤种NTRK融合的几率差别较大,且NTRK融合涉及三种基因、诸多已知或未知融合配体,因此NTRK融合的检测方法应兼顾不同情况下的敏感性和特异性。
临床工作中,NTRK融合检测方法的选择可能难度较大,因为具体涉及蛋白、DNA和RNA水平上的诸多不同方案,且各有自己的优缺点。实际工作中,要注意考虑具体瘤种、可能的融合情况,并注意结合其他因素,如组织的可及性、检测所需的时间、价格、检测方法是否便捷等,详见表2。
表2.NTRK基因融合检测方法及相应因素
——未完待续——
点此下载原文献
参考文献
[1]Nguyen MA, Colebatch AJ, Van Beek D, Tierney G, Gupta R, Cooper WA. NTRK fusions in solid tumours: what every pathologist needs to know. Pathology. 2023;55(5):596-609. doi:10.1016/j.pathol.2023.05.002
















共0条评论