病史
患者男性,59岁,4个月前患者无明显诱因出现左侧胸痛,未予重视,2周前患者发现左侧胸壁疼痛性包块,于外院行CT引导下左侧胸壁包块穿刺活检,病理诊断:(左侧胸壁)穿刺小组织为坏死组织,局部见少量增生、玻变的纤维组织。后行抗炎治疗无好转,遂来我院进行进一步的治疗。胸部CT:左侧胸廓稍塌陷,纵隔无偏移。左侧胸壁可见软组织肿块影,向内侵入胸腔,左侧第3-7肋骨部分骨质密度不均,可见骨质破坏影。右侧第8肋骨骨质密度不均。双侧少量胸腔积液,双侧胸膜增厚,以左侧显著,提示肿瘤性病变,遂行左侧胸壁包块部分切除术以明确诊断。病理检查镜下见弥漫增生的异型上皮样细胞取代胸膜正常结构,细胞圆形或多角形,胞浆丰富,嗜酸性,核浆比增大,核仁明显,排列呈片状。免疫组化:WT-1、CK、EZH2、D2-40、GATA-3阳性,CR、CK5/6弱阳,TTF-1、P40、CK7、CD45、ALK、CD15、EMA、CD3、CD20、CD68均为阴性,Ki-67(约40%+)。病理诊断:(左侧胸壁)恶性上皮样间皮瘤。后追问患者病史,否认石棉接触史及化工厂工作史。
讨论
恶性间皮瘤(malignent mesotIlelioma,MM)是一种高侵袭性、预后不良的恶性肿瘤,发病率约1.5/1000000人,常见于男性,患者多为 50 岁以上的老年男性,我国每年约有2000例新发病例,年增长率约为2.5%。恶性胸膜间皮瘤(Malignant pleural mesothelioma,MPM)是间皮瘤中的主要类型,约占所有间皮瘤的90%。由于MPM发病隐匿、潜伏周期可长达数十年,患者诊断时通常已是疾病晚期,难以手术切除。因此,MPM致死率高,患者5年生存率不足10%,中位总生存(overall survival,OS)仅9个月-12个月,此类疾病给患者及其家庭带来严重的负担和影响。
在大多数情况下,MPM与石棉暴露有关,约80%的患者有石棉接触史。事实上,石棉暴露与MPM之间的关系自1960年以来已被证明,其特点是30至40年的漫长潜伏期,MPM的主要危险因素为石棉暴露,石棉致病机制主要为:石棉纤维根据其长度和宽度渗透到肺部深处。众所周知,纤维越厚越长,它们进入肺部的深度就越深,因此,它们可以在吸入后到达胸膜,并导致反复的胸膜刺激、炎症和修复周期。事实上,石棉纤维与间皮细胞和炎症细胞之间存在相互作用,释放巨噬细胞、细胞因子和生长因子,促进慢性炎症和肿瘤生长,然后,石棉纤维可能会破坏有丝分裂,诱发染色体损伤和链断裂,石棉纤维还可能诱导铁相关活性氧物种的产生,从而导致DNA损伤,最后,石棉纤维诱导间皮细胞中丝裂原活化蛋白激酶(MAPK)和细胞外信号调节激酶(ERK)途径的磷酸化,这与细胞增殖有关。最近关于石棉致癌的证据表明,接触石棉似乎与抗肿瘤免疫力下降有关。事实上,在接触石棉患者的外周CD4+细胞中,CXCR3(即T辅助细胞表面的趋化因子受体)和干扰物γ(IFN-γ)的产生减少。尽管石棉暴露和MPM之间的关系已经长期得到证实,但在一项对5287名以前接触石棉患者的随访研究中,总共只诊断出17例恶性间皮瘤病例,这凸显了个体对石棉的易感性,以及MPM是一种复杂的肿瘤,其他的致病因素还包括电离辐射、毛沸石、猿猴病毒40以及遗传因素等。与其他恶性肿瘤相比,MPM的肿瘤突变负荷为中等程度,主要表现为抑癌基因表达下调,包括乳腺癌易感基因1相关蛋白1(BAP1)、神经纤维蛋白2(NF2)、细胞周期蛋白依赖性激酶抑制剂2A(CDKN2A)、磷酸酶张力蛋白同源物(PTEN)、TP53。黏着斑激酶(FAK)和c-Met是调节肿瘤细胞存活、增殖、迁移和侵袭的酪氨酸激酶,在间皮瘤细胞中表达上调,从而使间皮瘤细胞不受调控的增殖。赖氨酰氧化酶样蛋白2(LOXL2)(一种上皮-间充质转化标志物)和T细胞活化的V型结构域免疫球蛋白抑制因子(VISTA)(一种免疫检查点)出现过表达,提示患者预后不良。血管生成信号对间皮瘤细胞的生长很重要,间皮瘤组织和多种间皮瘤细胞系中高表达促进血管生成的信号分子,如血管内皮生长因子(VEGF)、成纤维细胞生长因子 1(FGF1)、转化生长因子-β(TGF-β)、血小板衍生生长因子(PDGF)和血小板衍生生长因子受体(PDGFR)β,研究显示,肿瘤微血管密度高提示预后较差。为了润滑胸膜腔,间皮细胞需产生大量的细胞表面糖蛋白,这些蛋白质在内质网中折叠,因此功能性内质网很重要,由于对蛋白质分泌需求较高,增加了蛋白质错误折叠率,进而引起了内质网应激,是促进 MPM进展和治疗耐药的关键机制。间皮瘤组织中可检测到肿瘤浸润淋巴细胞(TIL)、巨噬细胞和自然杀伤细胞,调节性T细胞和M2型巨噬细胞导致的免疫抑制微环境可导致间皮瘤。细胞毒性 CD8+T淋巴细胞浸润与更好的预后相关,高水平的“促瘤”M2型巨噬细胞 往往提示更短的生存期。在MPM中,免疫检查点程序性死亡受体配体1表达上调和存在的肉瘤样成分均与间质TIL的增加有关,这些免疫微环境改变的特点,为免疫调节提供了线索。
MPM的常见症状包括呼吸急促、胸痛、咳嗽、失眠、疲劳、食欲不振和体重减轻,MPM的临床症状通常比其他肿瘤更严重,局部病变患者可能会出现明显的呼吸急促和胸痛,MPM很少出现远处转移和相关症状,中枢神经系统转移并不常见,而副肿瘤综合征很少见。对于胸膜增厚的人,建议进行胸部增强CT、MRI或PET-CT检查,MPM主要需要与良性胸膜疾病和其他有胸膜转移的恶性肿瘤(如肺癌、肉瘤和其他实体肿瘤)区分开来,影像学检查具有提示作用,但很难诊断。组织病理学检查是诊断MPM的主要方法。根据世界卫生组织(WHO)2021年胸膜肿瘤分类标准,恶性胸膜间皮瘤(MPM)的组织学亚型主要包括上皮样、肉瘤样和双相类型,要诊断双相MPM,上皮样和肉瘤样成分必须超过10%。其中上皮样类型是最常见的,肿瘤细胞形态基本一致,呈立方状、多边形,胞浆嗜酸性,核分裂象不常见,形态学变型又包括管状乳头状型、实体(片状)型、腺瘤样/微腺样型、小细胞型、透明细胞型、蜕膜样型、多形性型。肉瘤样型,由梭形细胞构成,细胞排列成束状或杂乱分布,细胞形态从温和到明显异型,有时见上皮样分化区域(要求所占比例
MPM的治疗:手术贯穿恶性胸膜间皮瘤的诊断、分期和治疗,现推荐的MPM各个手术的范围如下:(1)扩大的胸膜肺切除术(EPP):完整切除同侧肺、脏层和壁层胸膜以及累及的心包和膈肌;(2)扩展性胸膜切除术(EPD):切除脏层和壁层胸膜以移除全部大体肿瘤,并切除膈肌和/或心包;(3)胸膜切除术(PD):切除脏层和壁层胸膜以移除全部大体肿瘤,保留膈肌和心包;(4)部分胸膜切除术:通常是以诊断或者姑息性治疗为目的,切除部分脏层和/或壁层胸膜,留下大体肿瘤。对于胸腔积液的管理,优先选择滑石粉胸膜固定术或胸腔导管引流,电视辅助胸腔镜下手术-部分胸膜切除术(VATS-PP)昂贵且并发症严重,与滑石粉胸膜固定术相比,其对总生存率无影响,一般不作为局部治疗的首选。顺铂和培美曲塞为MPM患者的一线治疗方案,如条件允许,应加入贝伐单抗,顺铂、培美曲塞和贝伐单抗比顺铂和培美曲塞的生存期更长。抗PDl免疫检查点抑制剂治疗间皮瘤具有潜在的治疗价值,大约40%的肿瘤表达PDLl,帕博丽珠单抗用于PDLl阳性的MPM患者的Ib期临床试验,纳入25例患者,有效率为20%,平均持续12个月,中位总生存期为18个月,纳武单抗对复发性MPM治疗有效,总之,数据表明抗PDl或PDLl免疫治疗对MPM有效,但仍需要进行试验来进一步确认。对于PS评分、肺功能和肾功能良好且腹部、对侧胸部或其他部位没有病变的患者,术后半侧胸腔辅助放疗可以降低局部复发率并延长存活率。手术后需要氧气治疗的患者无法通过辅助放疗提高生存率,不应考虑辅助放疗。对于无法接受根治性切除的患者来说,姑息和支持性治疗的重点是疼痛管理和缓解呼吸窘迫和缺氧症状。恶性胸膜间皮瘤患者表现出两种最难控制的疼痛类型:癌症引起的骨痛和神经性疼痛。由于局部影响神经血管束,MPM患者的疼痛经历具有很强的神经病变成分,除了阿片类药物外,还可以使用针对特定神经性疼痛机制的辅助药物,最常用的是三环类抗抑郁药和抗癫痫药物,如加巴喷丁和普瑞巴林。考虑到MPM的预后不佳,定期随访可以早期发现肿瘤进展,建议患者应在积极治疗后每3-6个月接受一次胸部CT复查。
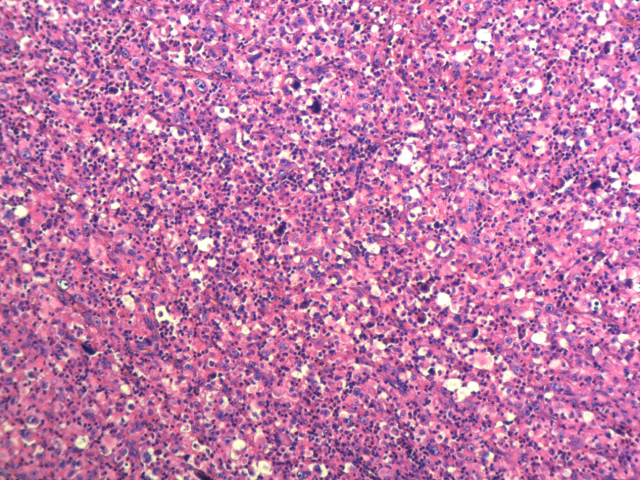
图1.弥漫增生的异型上皮样细胞

图2.细胞圆形或多角形,胞浆丰富,嗜酸性,核浆比增大,核仁明显

图3.肿瘤细胞WT-1(+)免疫组化

图4.肿瘤细胞EZH2(+)免疫组化
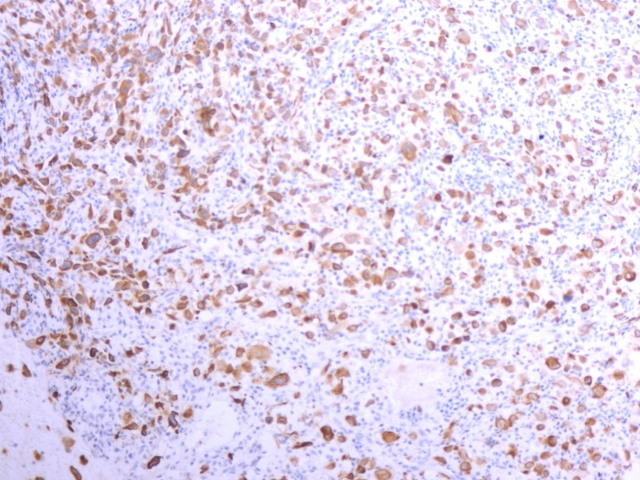
图5.肿瘤细胞CK(+)免疫组化

图6.Ki-67阳性指数约40% 免疫组化



















共0条评论