[导读] 编译整理:强子
众所周知,病理诊断在临床诊疗工作中至关重要,甚至一定情况下被抬上了“金标准”的神坛。不过,病理诊断也不是万能的,比如实际工作中某些肿瘤还有“恶性潜能未定”的诊断分类。
意大利医学专家Tinelli等曾在《Medicina (Kaunas)》杂志发表综述,详尽介绍了恶性潜能未定子宫平滑肌肿瘤(uterine smooth muscle tumors of uncertain malignant potential,STUMP)的相关知识点。为帮助大家更好的了解具体信息并应用于临床实践、促进临床病理沟通,我们将该文要点编译介绍如下。
1.STUMP的解剖病理特征
大体上,STUMP类似子宫平滑肌瘤,也是境界清楚、无包膜的表现。不过,有时候边界可能呈推挤性、甚至有局灶的浸润性。切面一般为灰白色、质实、漩涡状。可能局灶会有显著的梗死、出血、黏液样变。STUMP大小2.5-12.2cm不等,中位数6.7cm。对于该肿瘤,需要广泛取材,尤其是有黏液样区域时。
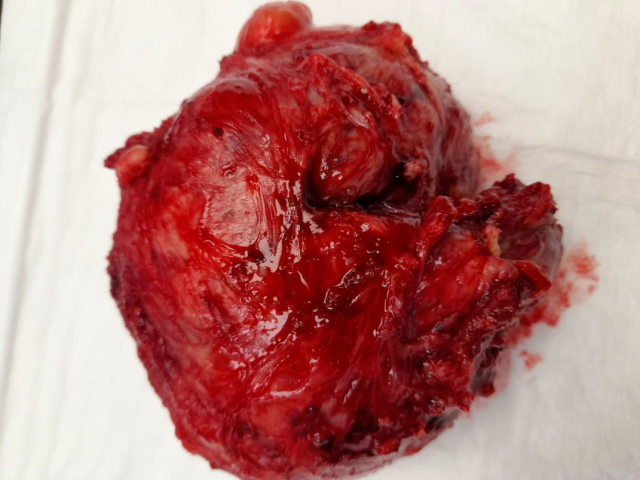
图1.本例为39岁患者开腹手术切除的STUMP,境界清楚,无包膜。
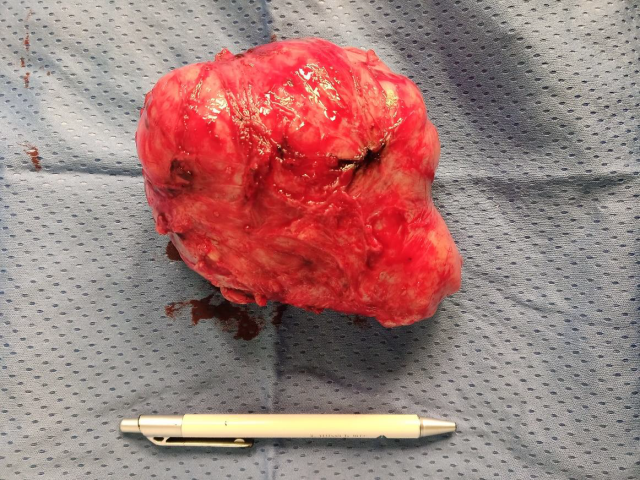
图2.本例为32岁患者开腹手术切除的STUMP,质软,质地均一。
组织学上,STUMP的特点是梭形细胞呈相互交织的束状结构,瘤细胞的细胞核呈雪茄烟样,不过,有时候形态变化较为宽泛。
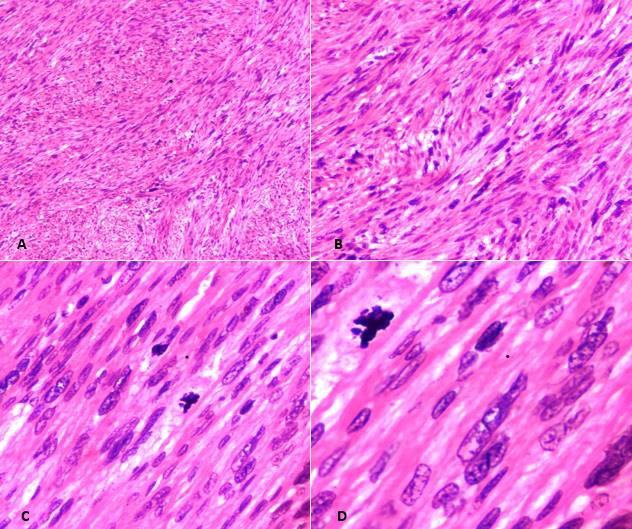
图3.STUMP组织学表现。(A)低倍镜下,可见束状的平滑肌细胞;(B)中倍镜下,瘤细胞具有弥漫性的中至重度非典型;(C)图示具有非典型和多形性的梭形细胞;(D)高倍镜下示瘤细胞的非典型,偶见核分裂。由于并无肿瘤坏死,且核分裂计数<10个/10HPF,因此符合STUMP的诊断。
STUMP基本上是不足以明确诊断为平滑肌肉瘤的肿瘤。因此病理诊断中,该肿瘤应有下述四条特征中的一条:
1.平滑肌肿瘤,伴局灶或多灶、或弥漫的细胞学非典型(中至重度),无凝固性肿瘤坏死,核分裂6-9个/10HPF(对应2-4个/mm2);
2.无细胞学非典型或核分裂计数增加,但有明确的凝固性肿瘤坏死的平滑肌肿瘤;
3.核分裂计数升高(>15个/10HPF或>6个/mm2)、但并无凝固性肿瘤坏死或细胞学非典型的平滑肌肿瘤;
4.核分裂计数不确定,但有弥漫性细胞学非典型(中至重度)的平滑肌肿瘤。
上皮样和黏液样SYUMP的组织学标准与此有相当大差别。上皮样平滑肌肿瘤的特征是细胞圆形或多边形,胞质嗜酸性、颗粒状至透明表现。无凝固性肿瘤坏死及非典型的情况下,核分裂达2-3个/10HPF的上皮样平滑肌肿瘤就归为上皮样STUMP。无凝固性肿瘤坏死和细胞学非典型的情况下,核分裂1个/10HPF就满足黏液样STUMP的诊断标准。黏液样STUMP一般细胞稀疏,且细胞被阿辛兰阳性的黏液样物质分隔。
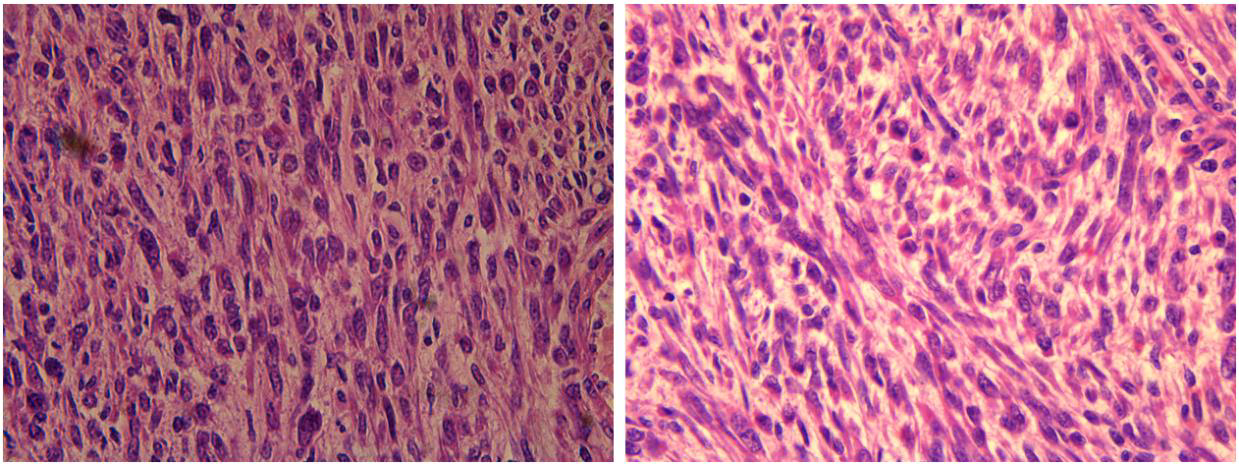 图4.图示显著细胞学非典型(左)和核分裂(5-10个/10HPF)。
图4.图示显著细胞学非典型(左)和核分裂(5-10个/10HPF)。
该肿瘤并无单独的分期方案,基本上是按照平滑肌肉瘤的方案进行分期,具体FIGO分期方案见表1。
表1. 子宫平滑肌肉瘤分期方案

2.STUMP的分子生物学特征
从分子层面来说,STUMP遗传学具有异质性,从罕见染色体改变、到染色体高度不稳定均可出现,具体涉及染色体获得和拷贝数获得。不过,相比平滑肌肉瘤来说,STUMP的染色体改变几率低。
对于诊断疑难病例来说,分子检测可能可以用于STUMP和平滑肌肉瘤的鉴别:根据2019年的意大利肿瘤肿瘤医学会指南,评估PR、p53、Ki-67的表达有助于病理鉴别平滑肌肉瘤、平滑肌瘤、STUMP。文献中还有其他标记物与前述指标相结合用于鉴别的报道,如p16,大部分报道中p16的表达增加都与肿瘤的侵袭性有关。
对于确定临床有侵袭性的平滑肌肿瘤来说,p16、p53、Ki-67似乎是最有用的免疫组化标记,它们的表达在平滑肌肉瘤似乎要高于STUMP。
最近有研究将STUMP的免疫组化中p53分为“异常”或“野生型”、p16分为“弥漫”或“局灶/阴性”、Ki-67增殖指数分为“≥10%”或“<10%”,得出结论认为:p53和p16可能可以用于STUMP的风险评估;且这些指标不能单独作为预后标记。
其他研究则着眼于BCL-2:相比平滑肌瘤和STUMP来说,该标记阳性更多见于平滑肌肉瘤。文献中还有其他标记的相关研究,如MMP2、CRBP1、EGFR、galectin-3,但尚需更多研究来找出用于STUMP和平滑肌瘤及平滑肌肉瘤鉴别的组合。
微阵列比较基因组杂交分析(Array-Comparative Genomic Hybridization Analysis)等新型分子方法也希望能找到STUMP的特异性遗传学特征。相关方案中,遗传学指数(genomic index)
STUMP与炎症性成肌纤维细胞瘤(inflammatory myofibroblastic tumors,IMTs)具有共同之处。后者是一种罕见的恶性肿瘤、具有淋巴浆细胞浸润及成肌纤维细胞,文献中曾有IMT和STUMP之间误判的一例报道。由于二者都是罕见肿瘤,且文献中仅少数报道,因此具体诊断和鉴别标准还并不明确。
3.STUMP的临床检查及诊断
STUMP的术前诊断非常困难,只有组织学检查才能确诊。半数以上的病例都是偶见,一般为术后确诊;很多情况下,MRI及盆腔超声等都难以在术前鉴别子宫平滑肌肿瘤的良恶性。
虽然尚无特异性的超声特征可以区分STUMP和平滑肌瘤及平滑肌肉瘤,但STUMP中也可能会出现某些恶性超声特征,如肿物血管丰富、轮廓不规则、由于坏死而表现不一,且与平滑肌肉瘤无法区分。STUMP由于病变周围和病变内有大量血管,因此超声多普勒回声会增强。
对于平滑肌瘤和STUMP的鉴别来说,增强MRI似乎要比弥漫加权MRI更为特异。血清乳酸脱氢酶结合动态MRI可以辅助用于平滑肌瘤和平滑肌肉瘤的鉴别。PET-CT的鉴别意义有限。也有研究发现,PET-CT中特异性的“空心球”(hollow ball)一般代表的是坏死区,一般见于STUMP和平滑肌肉瘤、而不见于平滑肌瘤。
4.STUMP的处理
目前对于STUMP的处理、治疗和随访,还没有广泛的实用指南。标准治疗是手术,但激素治疗或化疗的作用还不清楚,因为STUMP是否激素敏感的数据还十分有限。
如果宫腔镜或子宫肌瘤切除后组织学诊断为STUMP,则对于已有孩子的女性标准治疗方案为子宫切除术。对于希望妊娠而要保留生育能力的患者来说,需要多学科合作、制定精准的随访方案,可以选择肌瘤切除、完成生育后再进行子宫切除术。总体来说需要考虑患者年龄以及生育意愿;具体手术方案(如经腹、经阴道、微创)则需综合考虑病变类型、患者情况、生育情况、手术医生的技术。
需要注意的是,STUMP的恶性潜能虽然比较低,但也有复发的风险。回顾性综述中提出,不同治疗方式下STUMP随访期间的复发率为7.3%至14.3%不等。有人提出,STUMP子宫切除术后的随访方案为每年影像学检查(胸部、腹部、盆腔CT);也有人建议术后前5年每半年一次随访,5年后每年随访。
文献中还有STUMP转移的报道,但较为罕见。最近的多中心回顾性研究发现,粉碎切除或碎片状切除、核分裂是转移的独立危险因素。
点此下载原文献
参考文献
[1]Tinelli A, D'Oria O, Civino E, et al. Smooth Muscle Tumor of Uncertain Malignant Potential (STUMP): A Comprehensive Multidisciplinary Update. Medicina (Kaunas). 2023;59(8):1371.
doi:10.3390/medicina59081371


















共0条评论