[导读] 译者:张波,郝兴辉
前言
子宫内膜间质肿瘤(endometrial stromal tumor,EST)是仅次于平滑肌肿瘤的第二大常见类型的子宫间叶源性肿瘤,可表现出多种组织形态学模式、遗传变异和临床预后。其特征是复发性遗传事件,最常见的是染色体重排,产生致癌基因融合。这些肿瘤目前被WHO分类为子宫内膜间质结节(endometrial stromal nodular,ESN)、低级别子宫内膜间质肉瘤(low grade endometrial stromal sarcoma,LGESS)、高级别子宫内膜间质肉瘤(high grade endometrial stromal sarcoma,HGESS)和未分化子宫肉瘤(undifferentiated uterine sarcomas,UUS)[1]。根据2020 WHO分子遗传学分类,HGESS有三种常见的基因异常,即YWHAE-NUTM2融合、ZC3H7B-BCOR融合和BCOR内部串联重复(BCOR Internal Tandem Duplication,BCOR ITD),HGESS常表现为YWHAE-NUTM2和ZC3H7B-BCOR融合[2]。HGESS组织学形态以高级别圆形细胞为主,其预后介于LGESS和UUS之间,与含有低级别纤维黏液样成分相关,并携带t(10;17)(q22;p13),导致YWHAE-NUTM2融合[1]。或与黏液样平滑肌肉瘤有形态学和免疫表型重叠,携带t(X;22)(p11.4;q13.2),导致ZC3H7B-BCOR融合,故在黏液样子宫肉瘤的鉴别诊断中,应考虑伴有BCOR融合的HGESS[2]。本文着重学习BCOR免疫表型在不同分子分型HGESS中的表达特征。
不同分子分型的HGESS组织学形态
HGESS组织学形态表现为高级别、中等大小圆形或梭形细胞,核异型显著,染色质颗粒状,核仁可见,核分裂活跃,排列成片状和巢状(图1a-b)[3],具有假乳头状或假腺状结构[2]。ZC3H7B-BCOR融合型HGESS是一种独特的临床病理类型,表现为舌状子宫肌层浸润和淋巴血管浸润,细胞核异型性更显著,呈束状结构可不围绕血管随意分布,并且常有黏液样基质(图2),与黏液样平滑肌肉瘤有显著的组织学重叠,易误诊。在一些ZC3H7B-BCOR HGESS中观察到的其他形态学特征包括胶原斑块、圆形“球状”增生的细胞、分散的良性子宫内膜样腺体、血管周围肿瘤细胞围绕的小动脉、厚壁血管和血管外皮细胞瘤样扩张血管(图3)[4]。YWHAE-NUTM2融合型HGESS中未发现梭形细胞和突出的黏液样基质,这些瘤细胞通常由片状、假乳头状或假腺状圆形细胞组成。伴有BCOR ITD的HGESS表现出相似的形态和黏液样背景,在BCOR ITD中也可以观察到高级别圆形细胞成分,类似于YWHAE-NUTM2相关的HGESS。(为避免HE图片重复,后两种类型组织学图片将与免疫组化图片一同展示。)
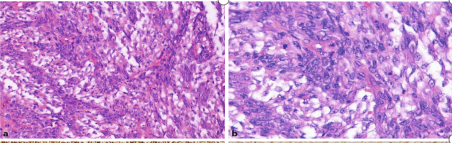
图1.HGESS。瘤细胞为梭形细胞形态(a),具有明显的异型和核分裂(b)。
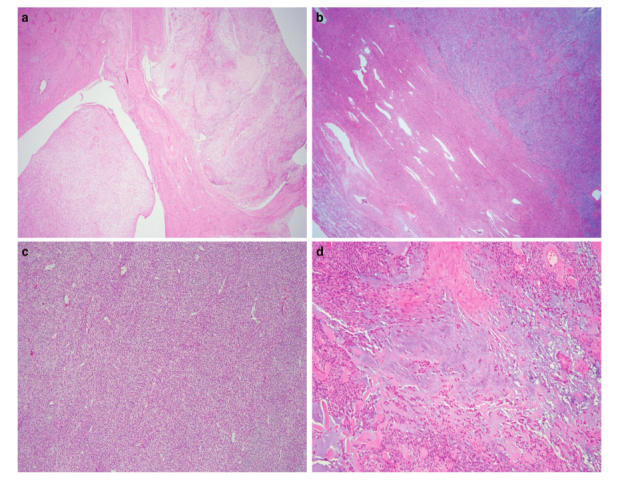
图2.ZC3H7B-BCOR HGESS的组织学特征。典型的子宫内膜间质肉瘤的舌状浸润性生长模式伴有淋巴血管浸润(a),不规则的子宫肌层浸润(b),束状结构(c)和黏液样基质(d)。
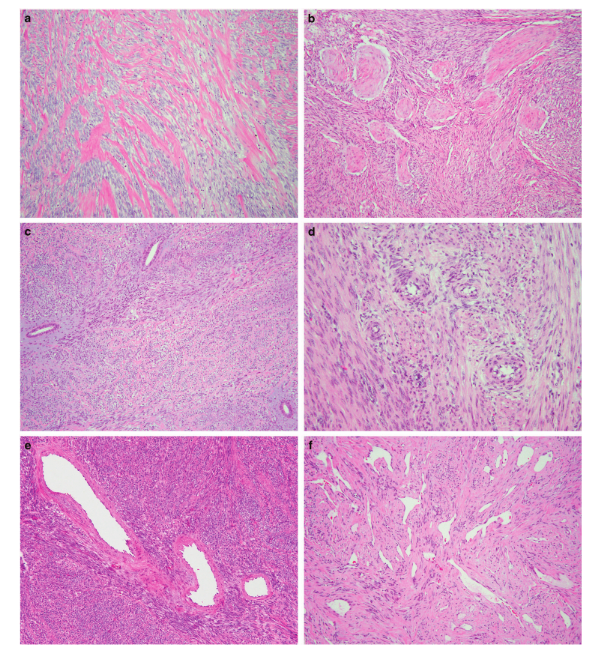
图3.在一些ZC3H7B-BCOR HGESS中观察到的其他形态学特征包括胶原斑块(a)、圆形“球状”增生的细胞(b)、分散的良性子宫内膜样腺体(c)、血管周围肿瘤细胞围绕的小动脉(d)、,厚壁血管(e)和血管外皮细胞瘤样扩张血管(f)。
HGESS分子分型及免疫表型分析
HGESS的免疫谱不完全一致,并且取决于分子亚型和LGESS组分的存在。通常表现出CD10的强表达,并且细胞周期蛋白D1大多呈弥漫强阳性(>70%的细胞核阳性)(图4c-d),以及不同程度的BCOR的阳性表达[3]。BCL-6协同抑制因子(BCOR)基因位于染色体Xp11.4上,编码BCOR,其在一种变体多梳抑制复合物(PRC1)中与PCGF1相互作用,增强转录抑制,BCOR重排在各种肿瘤类型中的存在表明BCOR在驱动肿瘤发生中具有重要作用。BCOR免疫染色现已成为EWSR1阴性的软组织小蓝圆细胞肿瘤的有力标志物,该肿瘤含有YWHAE-NUTM2、BCOR-CCNB3和BCOR-MAML3融合,以及BCOR ITD。弥漫性细胞周期蛋白D1和BCOR表达可存在于ZC3H7B-BCOR和YWHAE-NUTM2这两种类型的HGESS中。YWHAE-NUTM2 HGESS的高级圆形细胞组分中通常不存在CD10、ER和PR的表达,而在ZC3H7B-BCOR融合的肿瘤中可呈阳性[4]。故强而弥漫的细胞周期蛋白D1染色与缺失的CD10、ER和PR表达相结合,是YWHAE-NUTM2 HGESS圆形细胞成分的高度特征[2]。研究[1]显示,在所有20个(100%)YWHAE-NUTM2 HGESS的圆形细胞成分中观察到>95%的肿瘤细胞中的强核BCOR染色。这些肿瘤中有6例还显示出低级别或纤维粘液样成分,其中BCOR染色的强度和程度不同,范围从弱(2例)到强(1例),(图5)。
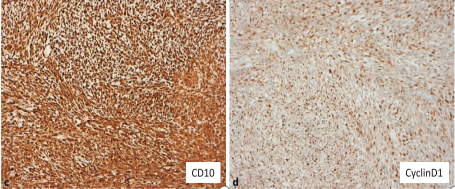
图4.CD10(c)的强表达,CyclinD1(d)的表达。
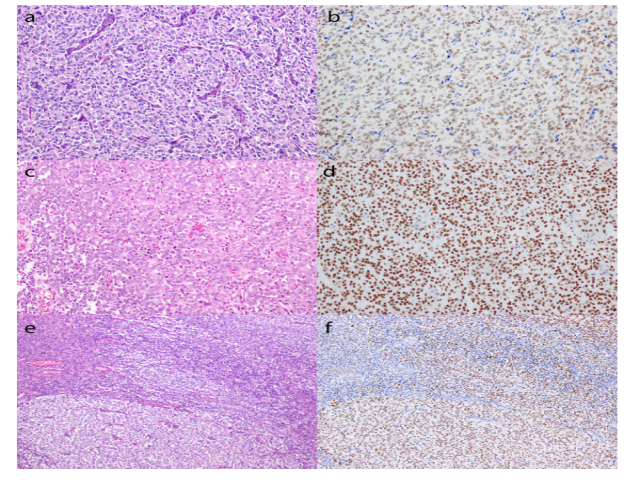
图5.BCOR在YWAHAE-NUTM2HGESS圆细胞成分中的明显表达。代表性H&E(a,c)和免疫组织化学染色(b,d)显示弥漫性核BCOR染色,其强度可能中等(b)或强烈(d)。低级别组分(e,左上)显示出局灶性、弱BCOR免疫染色(f,左上角),而圆形细胞组分(e,右下角)中BCOR表达强烈且弥漫。
YWHAE-NUTM2 HGESS的典型形态学特征在肺转移时有丝分裂活性较低,由纺锤状到星状细胞组成,卵圆形细胞核稍大,核仁突出,包埋在丰富的黏液样间质中(图6 a和b)。在整个转移性肿瘤中可见强烈和弥漫性的核BCOR表达(图6c)。原发性子宫肿瘤,主要由高度非典型的细胞组成,具有明显的细胞核多形性和突出的核仁,排列成片状和巢状,周围是透明到粘液样间质(UUS)(图6 d和f)。有丝分裂指数为56/10高倍视野,包括许多非典型有丝分裂。在多形性成分中,有更小、更均匀的纺锤形细胞,有丝分裂指数为10/10高倍视野(图6 d和e)。虽然多形性肉瘤组分仅表现出弱和局灶性细胞周期蛋白D1阳性(图6g),但BCOR表达是弥漫性和强的(图6h),FISH研究证实了YWHAE重排的存在(图6i)。可见,BCOR免疫组织化学的效用可能超过细胞周期蛋白D1,特别是在表现出异常形态的YWHAE-NUTM2肿瘤中,或在少数未能表现出弥漫性细胞周期蛋白D1表达的经典YWHAE-NUTM2 HGESS中[1]。
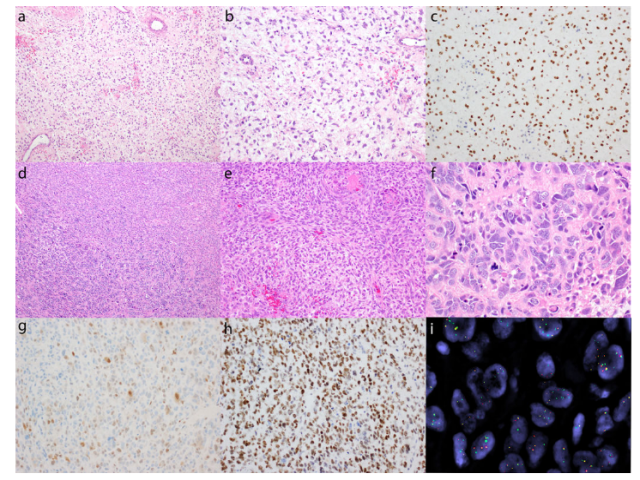
图6.BCOR在2例组织学异常的YWHAE-NUTM2 HGESS中的表达。由具有低有丝分裂指数(a,b)的中级纤维黏液样多刺细胞组成的肺转移瘤表现出强烈和弥漫的BCOR免疫表达(c)。UUS(d,左下,f)由具有明显核多形性、有丝分裂活性活跃和非典型有丝分裂的细胞组成,背景为与HGESS相邻的透明质基质(d,右上,e),显示出具有卵圆形核和突出核仁的细胞,围绕小动脉排列。UUS组分仅显示局灶性弱至中度细胞周期蛋白D1染色(g),但弥漫强BCOR表达(h)。绿色5′和红色3′信号以及单个绿色5′信号的分离(i)通过FISH证实YWHAE重排。
除了鉴定YWHAE-NUTM2 HGESS的圆形细胞成分外,BCOR还表达一种新的框内BCOR ITD HGESS,该肉瘤与前者具有相似的形态学和免疫表型特征,但缺乏YWHAE、BCOR以及BCORL1重排,存在舌状肌层侵犯模式(图7a),具有低级别的纤维黏液样成分,小的纺锤状细胞(图7b)和高级别的圆形细胞成分,具有较大的圆形细胞核(图7c)。圆形细胞成分内的局灶性黏液样间质(图7d),一些区域显示出较大的细胞,具有显著核非典型性(图7e)。免疫表型显示强而弥漫的细胞周期蛋白D1染色,仅局灶性CD10阳性,ER和PR表达缺失。BCOR在整个肿瘤中弥漫强烈表达(图7f)[1]。
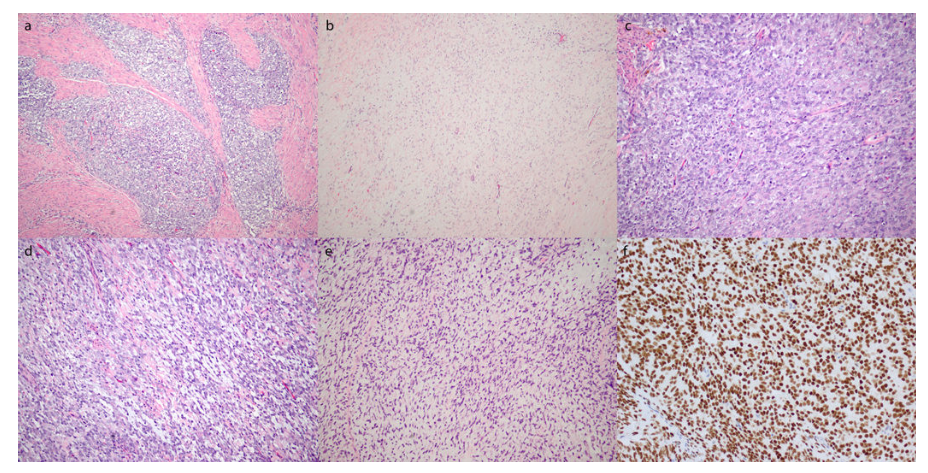 图7.HGESS BCOR ITD的形态学特征和BCOR染色模式。a) 舌状肌层侵犯。低级别纤维黏液样(b)和高级别圆细胞(c)成分,类似于YWAHAE-NUTM2高级别子宫内膜间质肉瘤的特征。d) 圆形细胞内黏液样间质病灶。e) 纤维黏液样成分内更广泛的核异型性。f) 弥漫和强烈的BCOR表达。
图7.HGESS BCOR ITD的形态学特征和BCOR染色模式。a) 舌状肌层侵犯。低级别纤维黏液样(b)和高级别圆细胞(c)成分,类似于YWAHAE-NUTM2高级别子宫内膜间质肉瘤的特征。d) 圆形细胞内黏液样间质病灶。e) 纤维黏液样成分内更广泛的核异型性。f) 弥漫和强烈的BCOR表达。
研究[5]表明,BCOR ITD是HGESS亚群中YWHAE-NUTM2融合的替代遗传事件。BCOR ITD的HGESS通常影响年轻患者,可能具有临床侵袭性。子宫肉瘤中的BCOR ITD既不常见,也与YWHAE-NUTM2重排相互排斥,且在2例诊断为USS的病例中发现BCOR ITD,建议对具有染色质均匀细胞核特征和弥漫性细胞周期蛋白D1表达的USS进行BCOR-ITD检测,如果存在BCOR-ITD,则应将该肿瘤归类为BCOR-ITD阳性的HGESS。
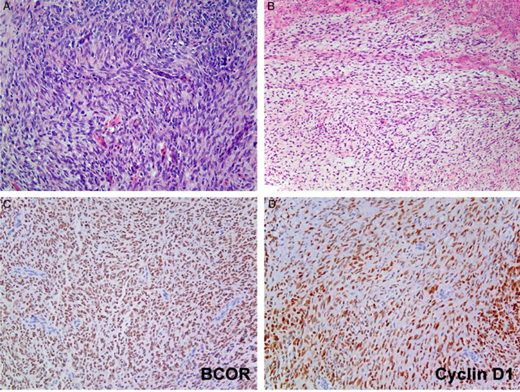
图8.BCOR ITD HGESS形态学和免疫组织化学研究。卵圆形至梭形细胞,细胞质稀少,排列成带黏液样间质的束状并渗透到肌层(A-B)。BCOR(C)和细胞周期蛋白D1(D)的强、弥漫性核表达。
通过基因组PCR和靶向DNA测序鉴定了框内BCOR ITD,其中BCOR外显子16的重复序列跨度为86 bp,重复序列之间插入4 bp(图9)。BCOR ITD在邻近的正常子宫肌层中不存在[1]。
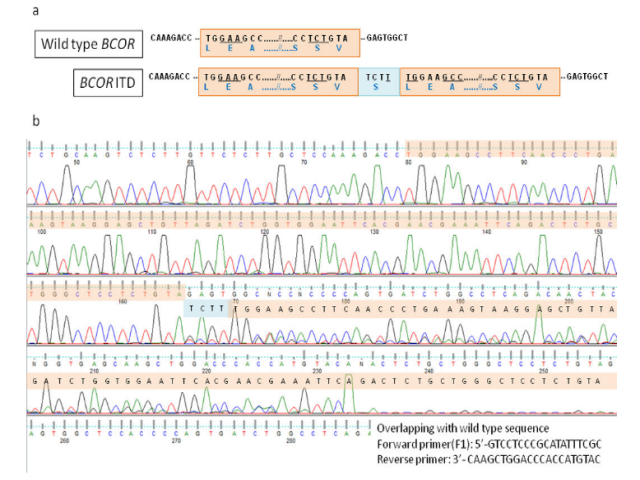
图9.HGESS BCOR外显子16内部串联重复。a) 野生型BCOR(顶部)和BCOR内部串联重复(底部)序列示意图。b) 重复区域(以米色突出显示)与BCOR野生型序列重叠,在重复区域之间插入4-p(以蓝色突出显示)。
该研究还评估了5个ZC3H7B-BCOR和3个BCOR-ZC3H7B HGESS的全组织切片中BCOR的表达,并发现>95%的肿瘤细胞中有核染色,其中3个病例(2个ZC3H7B-BCOR和1个BCOR-ZC3H7B)中有强染色(图10a和b),另一个病例(ZC3H7B-BCOR)中有弱染色(图10c和d)。其余4例肿瘤均无BCOR染色。在具有融合转录组数据的3个ZC3H7B-BCOR HGESS中,仅在一个表现出强烈和弥漫性BCOR表达的肿瘤中检测到相互融合。
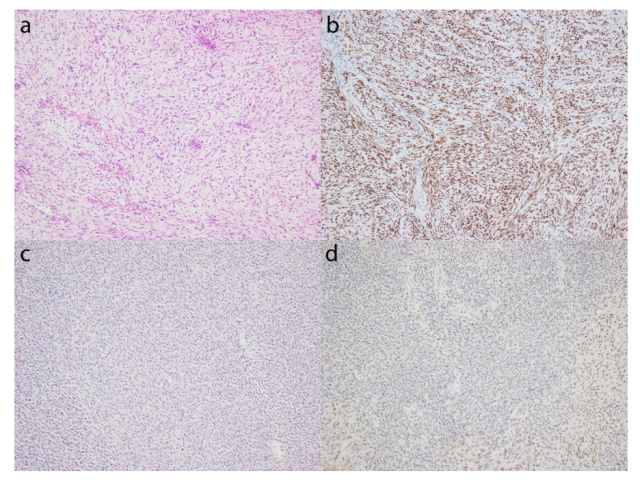
图10.BCOR在ZC3H7B-BCOR HGESS中的表达。a和b)表现出强烈和弥漫性BCOR染色的黏液样细胞肉瘤。c和d)具有不太明显的黏液样特征的梭形细胞肉瘤,仅显示弱BCOR表达。
该研究还总结了BCOR阳性各类肿瘤细胞在HGESS中的百分比,如图11所示。
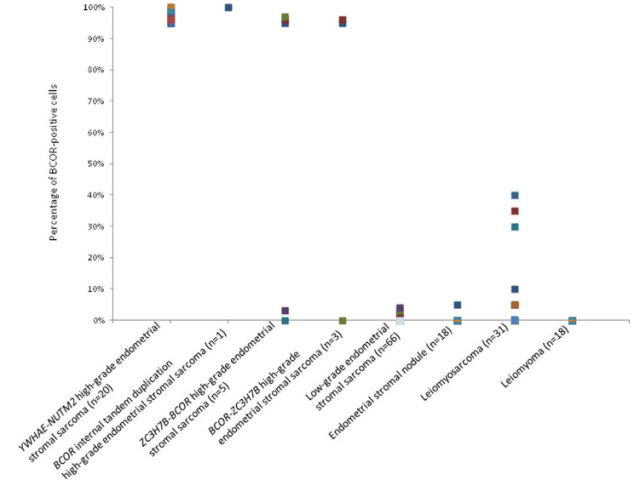
图11.BCOR阳性肿瘤细胞在HGESS中的百分比,该肉瘤含有YWHAE-NUTM2、ZC3H7B-BCOR和BCOR-ZC3H7B融合和BCOR ITD,低级别子宫内膜间质肉瘤、子宫内膜间质结节、平滑肌肉瘤和平滑肌瘤。
鉴别诊断方面,BCOR异常的HGESS最主要易与黏液样平滑肌肉瘤混淆,因为这些肿瘤可能不同程度表达平滑肌标记物,如SMA和结蛋白。同样,黏液样平滑肌肉瘤也可能表现出CD10阳性,类似于BCOR易位的HGESS。Mohammad等人的研究中,包括特异性基因融合和ITD在内的HGESS表现出散在p53(野生型)表达,而子宫平滑肌肉瘤通常表现出较强的弥漫性核p53表达。因此,p53阴性或分散表达也有助于鉴别HGESS和子宫平滑肌肉瘤[2]。
BCOR作用机制
以上研究结果表明,BCOR是一种可靠的标志物,可以将YWHAE-NUTM2、ZC3H7B-BCOR、BCOR-ZC3H7B和BCOR ITD的HGESS与其他子宫间质肿瘤区分开来,BCOR的强弥漫性染色高度提示HGESS。然而,这并不是一个百分之百敏感的发现,诊断最终应该得到FISH等分子研究的支持。多梳抑制复合物1(PRC1)是一类重要的表观遗传调控因子调节表观遗传学沉默,并明显与罕见的恶性肿瘤类型相关。X连接的BCOR基因(BCL-6核心抑制因子)是PRC1复合物的成员,并通过BCL6与PRC1的结合增强转录抑制。BCOR基因或BCL-6辅阻遏物,位于Xp11.4上,被认为通过表观遗传沉默在调节基因转录中发挥作用。作为多梳抑制复合物1(PRC1)的变体,BCOR催化组蛋白修饰,并已被证明在干细胞分化和功能中发挥作用。有证据表明,BCOR ITD突变最常发生在C末端(第15外显子,共17外显子),影响BCOR的PUFD(PCGF-Ub样折叠鉴别器)结构域的功能和PRC1的结合。据推测,这会通过PRC1破坏BCOR的抑制功能,导致基因表达异常。此外,BCOR可能通过I类和II类组蛋白脱乙酰酶相互作用独立影响基因表达。因此,BCOR的改变与间质来源的肿瘤有关,ESS病例中BCOR-ITD的存在与导致融合的染色体重排相互排斥,后者与低级别或高级别ESS的发病机制有关。此外,这些病例也一直缺乏其他已知的致癌基因组驱动突变。携带BCOR ITD的HGESS病例具有低TMB、高级别未分化形态和临床侵袭性行为。这些特征都表明BCOR ITD是高级别HGESS基因组定义亚群中的致癌驱动因素。此外,BCOR也可以通过未知机制在携带YWHAE-NUT2B重排的HGESS中频繁过表达,进一步支持BCOR ITD是HGESS的驱动因素[6]。
不同分子分型的HGESS临床预后
在预后方面,总体而言,HGESS临床结果介于LGESS和USS之间,HGESS比LGESS更易进展为UUS。YWHAE和BCOR相关的HGESS之间似乎存在预后差异,在YWHAE相关的HGESS中,无论肿瘤分期如何,5年生存率约为33%,中位生存期为20个月。BCOR相关HGESS的预测信息由于其罕见性、非典型程度、肿瘤坏死、Ki-67指数和DNA倍性程度的预后意义尚不清楚。ZC3H7B-BCOR HGESS患者往往表现出更高的疾病分期,高复发率及死亡率,类似于YWHAE-NUTM2 HGESS的报道结果[3]。
总结
综上,BCOR是一种可靠的标志物,可以将YWHAE-NUTM2、ZC3H7B-BCOR、BCOR-ZC3H7B和BCOR ITD的HGESS与其他子宫间质肿瘤区分开来。BCOR表达在携带BCOR遗传畸变和YWHAE-NUTM2基因融合的肿瘤中的机制尚不清楚。BCOR由位于Xp11.4上的BCL-6辅阻遏物(BCOR)基因编码,并在通过组蛋白修饰抑制基因表达的变体PRC1中与PCGF1相互作用。BCOR mRNA在各种正常人体组织中普遍表达,在具有BCOR ITD的肿瘤中,复制的BCOR区域位于PUFD结构域内,该结构域促进与变体PRC1的另一个成员PCGF1的结合,并且可能在表观遗传学修饰中破坏PRC1的结构和/或功能。但需要进一步研究更多的BCOR ITD、BCOR和YWHAE重排对PRC1功能的影响以及导致HGESS的未知的致病机制,为HGESS患者找到治疗福音。
点此下载原文献
参考文献
[1]Chiang S,Lee CH,Stewart CJR.BCOR is a Robust Diagnostic Immunohistochemical Marker of Genetically Diverse High-Grade Endometrial Stromal Sarcoma, Including Tumors Exhibiting Variant Morphology[J].Mod Pathol,2017,30(9):1251-1261.
[2]Alkanat NE,Uner A,Usubutun A.High-grade Endometrial Stromal Sarcoma: Morphologic and Clinical Features, the Role of Immunohistochemistry and Fluorescence in Situ Hybridization in Diagnosis[J].Int J Surg Pathol,2023,31(5):521-531.
[3]Mayr D,Horn LC,Hiller GGR.Endometrial and other rare uterine sarcomas : Diagnostic aspects in the context of the 2020 WHO classification[J].Pathologe,2022,43(3):183-195.
[4]Lewis N,Soslow RA,Delair DF.ZC3H7B-BCOR high-grade endometrial stromal sarcomas: a report of 17 cases of a newly defined entity[J].Mod Pathol,2018,31(4):674-684.
[5]Mariño-Enriquez A,Lauria A,Przybyl J,et al. BCOR Internal Tandem Duplication in High-grade Uterine Sarcomas[J].Am J Surg Pathol,2018,42(3):335-341.
[6]Juckett LT,Lin DI,Madison R,et al. A Pan-Cancer Landscape Analysis Reveals a Subset of Endometrial Stromal and Pediatric Tumors Defined by Internal Tandem Duplications of BCOR[J].Oncology,2019,96(2):101-109.
























共0条评论