[导读] 作者:游乐园
患者女性,62岁,上腹部胀痛不适3月余,以夜间隐痛为主,可忍受,无放射痛,偶有恶心、反酸、乏力。自服用胃药(具体名称不详)效果欠佳。入院后查体:生命体征平稳,浅表未扪及肿大淋巴结,腹平软,剑突下轻度压痛,无反跳痛及肌紧张,余无特殊,否认既往慢性肝炎病史。CT提示胃窦处见软组织密度影伴强化,肝脏形态正常,未见异常密度影。胃镜检查:胃窦处见大小约3x2cm的溃疡灶,中央凹陷,底污秽,触之易出血,周围黏膜充血肿胀。镜下见肿瘤由多角形嗜酸性肝细胞样肿瘤细胞组成,呈梁索状、巢片状排列,弥漫浸润于胃壁组织,肿瘤细胞大、多边形,胞浆丰富,透明粉染,核分裂像易见,在肿瘤细胞内或细胞间可见嗜酸性玻璃样PAS阳性小体,免疫组化:CK8/18、EMA、CEA、GS、Hepatocyte、CDX2阳性,AFP、Glypican-3、CK20、SALL4局灶阳性,CK7、MUC2、MUC5AC、Arginase-1阴性,Ki-67(阳性约60%)。病理诊断:(胃)溃疡型肝样腺癌。
讨论
肝样腺癌(hepatoid adenocacinoma,HAC)指发生于肝外,组织学形态类似于肝细胞癌的特殊类型腺癌,可发生于全身多个器官,如食道、胃、十二指肠、小肠、大肠 、胰腺、肺、卵巢和输尿管等,但以胃最为常见,约占63%。胃肝样腺癌(hepatoid adenocaricinoma of stomach,HAS)是原发于胃黏膜腺体的一种低分化癌,同时具有腺癌和肝细胞癌样分化特点,是胃癌的一种特殊亚型,占所有胃癌的0.3%-1%,较少见,好发于中老年男性,临床表现缺乏特异性,症状包括纳差、乏力、消瘦、黑便、呕血、反酸等,部分患者无任何症状,仅在体检中发现,主要以肿瘤组织中出现肝细胞样分化区以及产生甲胎蛋白(α-fetoprotein,AFP)为主要特征,甚至以肝转移灶为首要表现。HAS最早于1970年由Bourreille等首先报道,但当时报道病例为1例伴有血清甲胎蛋白升高和肝转移的胃腺癌病人,并没有病理学证据支持,故仅称为“产生甲胎蛋白的胃癌”。直到1985年,日本学者Ishikura等报道了1例血清AFP升高的胃腺癌病例,其组织形态学和免疫组化呈独特的肝样分化特征,故首次提出HAS的概念,第5版WHO消化系统疾病分类中,取消了HAC原有的单独分类,将其列入少见组织学类型,与伴肠母分化的腺癌、伴卵黄囊瘤样特征的腺癌共同称为产AFP的癌。HAS具体发生机制至今尚未完全明确,较为认同的观点是,胃和肝脏在胚胎时期共同起源内胚层和前肠,这可能是HAS潜在的发病机制,并且在疾病的发展过程中伴随遗传进化和/或变异,与普通胃癌相比,HAS通常伴有更广泛的杂合性缺失以及更高水平的分部等位基因缺失,基因突变以TP53最为常见,此外,体细胞突变和广泛的拷贝数变异也在疾病进展中发挥了重要作用,染色体20q11.2-13.12区域发生的拷贝数增益促进了HAS不良生物学行为的产生,推动了疾病的发生发展。对于患者血清AFP升高的机制,目前的假说主要有:(1)肝样区域为异位肝细胞化生,可产生AFP;(2)由胃的原发病灶转移至肝脏后,AFP由肝内的肿瘤细胞产生;(3)肿瘤来源于非生殖细胞,是产生AFP的内胚层肿瘤的组织学亚型;(4)肝样细胞具有全能细胞的特性,某些癌细胞可能向肝细胞或胎儿胃肠细胞方向分化而产生AFP。已有统计显示HAS患者血清AFP的阳性率可达70%-80%,特别是对于没有病毒性肝炎、结节性肝硬化、肝细胞癌等基础疾病的患者,血清AFP可作为HAS提示指标,并不能成为其诊断标准,尤其是早期胃癌。但血清AFP水平与HAS预后呈相关性,AFP>500ng/ml是HAS患者死亡的危险因素.其死亡风险是AFP≤500ng/ml者的1.987倍。腹部CT检查目前是判断胃癌临床分期的首选手段。胃癌在CT下的典型征象包括胃壁增厚、溃疡、不规则肿物等,与普通胃癌相比,HAS的CT表现并无特异性,同样不能用于确诊,甚至会造成多数的早期HAS漏诊。但近期一项同顾性研究发现,动态增强CT中HAS动脉期强化程度明显高于普通胃癌,静脉期低于普通胃癌,其可能的原因是HAS组织中存在肝样分化区,强化方式类似于肝细胞癌,故动态增强CT有可能成为鉴别HAS的手段。
目前,病理仍是诊断HAS的“金标准”,其典型的组织学表现是镜下可见多角形、嗜酸性肿瘤细胞,肿瘤细胞的形态特征及排列类似于肝癌细胞,细胞较大,不规则,呈梁索状或巢样排列,血窦丰富,核仁大,居中,可见核分裂象,巨核或畸形核,肿瘤细胞周围可见胆汁样物质。但并未量化规定肝细胞样肿瘤细胞构成的区域占肿瘤的百分比,大部分HAS组织中肝样分化区与普通胃癌并存,两者间存在移行区,仅少部分病例全部为肝样分化区。肝样分化区Hepa、AFP、Glypican-3、GS及SALL4等不同程度表达,以上标记在普通腺癌内一般不表达,证实这些细胞具有肝细胞分化。在上皮标志物中,CK8/18、CKl9、AEl/AE3在HAS中阳性率较高,CK7、CKl4、CK20较少在HAS中表达。已有报道认为AFP、Hepa、Glypican-3可作为鉴别肝样分化的常用标记,Glypican-3与AFP特异性较高,而Hepa敏感性更高。产甲胎蛋白只是HAS的一个重要特点,不是必要条件,因为肠化的胃黏膜能像胚胎性肠黏膜一样产生甲胎蛋白,许多胃癌产生甲胎蛋白仅仅表明胃黏膜肠上皮化生,而不是肝样分化。甲胎蛋白阴性的HAS可产生其他正常的肝细胞产物,如白蛋白、α1-抗胰蛋白酶 、凝血素、异常凝血酶原、铁蛋白及转铁蛋白等。HAS需要与其他低分化癌鉴别,如原发于胃的印戒细胞癌、淋巴上皮瘤样癌、神经内分泌癌等。当组织学形态难以区分时,可以借助免疫组化鉴别。由于HAS与肝细胞癌有许多相似性,临床上可能会将HAS肝转移误诊为肝癌胃转移,因而进行鉴别诊断、避免漏诊及误诊至关重要。首先确定肿瘤原发部位,往往原发性胃癌的病人既往无肝炎、肝硬化病史,而原发性肝细胞癌病人大多合并慢性肝炎、肝硬化等情况。其次,对于同时发现胃肿瘤和肝肿瘤的病人,我们通常应采用一元论来解释,而肝癌胃转移实属罕见,但胃癌出现肝转移的发生率很高,尤其是对于一些肝脏多发病灶的病例,更应该考虑HAS合并肝转移。
在治疗方面,目前缺乏针对HAS的治疗方案,HAS患者唯一能取得潜在治愈效果的方法是通过外科手术彻底切除胃癌原发灶,早期治疗仍主张根治性手术治疗,若无肝外转移,胃大部分切除也能提高病人生存期。如存在肝外转移、腹腔种植等情况,胃大部分切除术则不能提高病人生存期,这时只能采用系统化疗、介入治疗、射频消融等综合治疗方法。以顺铂为基础的化疗方案是转移性HAS治疗的一线方案,XELOX方案可作为主要化疗方案,但HAS对于化疗药物敏感性较差,有研究表明FLEP方案(氟尿嘧啶+亚叶酸钙+表阿霉素+顺铂 )对此类病人相对敏感,能有较好的生存获益。HAS的预后一般比普通胃癌差,其血管淋巴管浸润、淋巴结转移率更高,尤其是肝转移率高达75.6%,其他常见转移部位有肺及胰腺,5年生存率仅为 9%,肝转移是HAS病人死亡的主要原因。HAS病人的1、3、5年生存率分别为37.5%、12.5%和8.3%,而普通胃癌病人的肝转移率为11.5%,1、3、5年生存率分别为95%、57%和38%。目前认为,与肝转移最相关的基因是c-Met基因,其表达产生的Met蛋白是肝细胞生长因子的受体,在胃腺癌中的阳性率为18.0%-71.1%。c-Met基因的表达与肿瘤的浸润深度和淋巴结转移有关,而且Met蛋白更倾向在侵袭浆膜或发生转移的晚期病人肿瘤组织中表达。产甲胎蛋白胃癌比甲胎蛋白阴性胃癌有更高的Met蛋白阳性表达率。因此我们认为,很可能是由于Met蛋白高表达后所致的胃癌细胞与肝癌细胞相似,导致其易于在肝细胞组织中存活,故HAS比普通胃癌更易出现肝转移,这也为HAS的精准靶向治疗提供了可选择的靶点。
综上,HAS具有分化低、特异性差、侵袭性强、转移率高、临床预后差等特点,血清AFP值升高具有诊断提示意义。目前尚无特异有效的药物治疗,早发现、早诊断、早手术仍然是获得良好预后的关键,对于已有远处转移者,手术治疗效果亦较差。病理诊断作为“金标准”,准确描述肿瘤特征,尽可能多提供肿瘤信息,利于对该肿瘤的认识及后续相关临床研究。
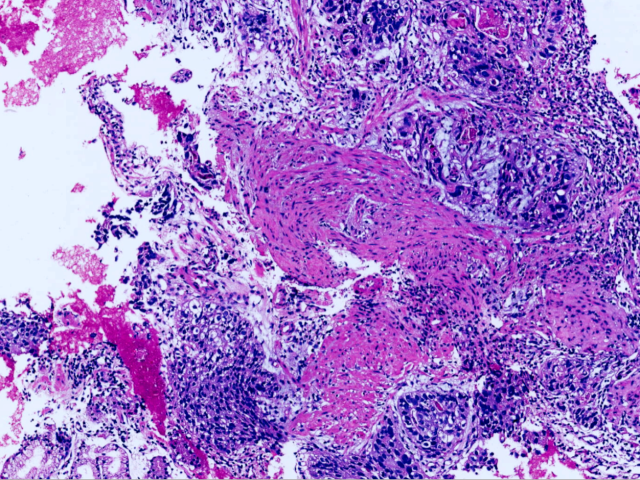
图1.肿瘤呈巢状、梁索状生长
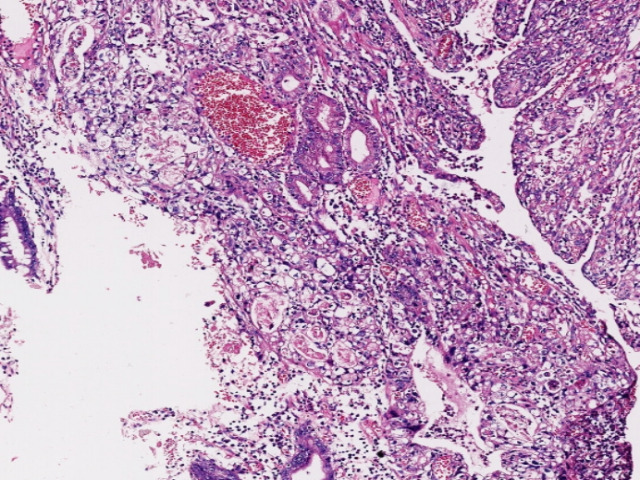
图2.HAS区域
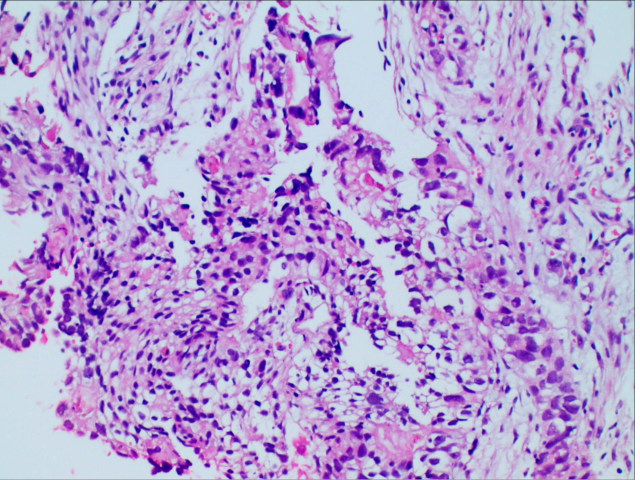
图3.HAS区域高倍
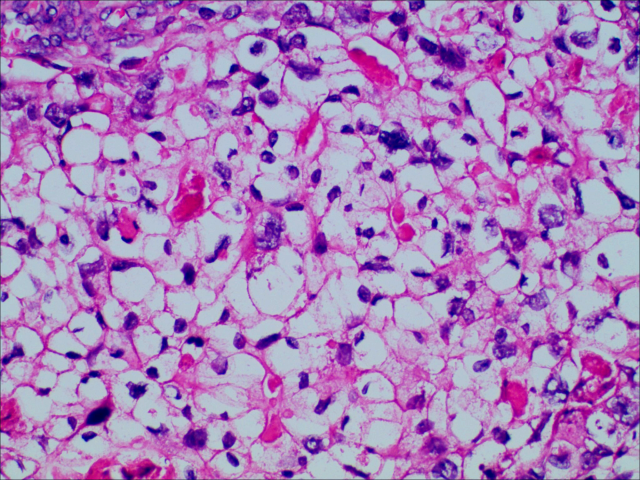
图4.肿瘤细胞呈多角形,嗜酸性,肝细胞样
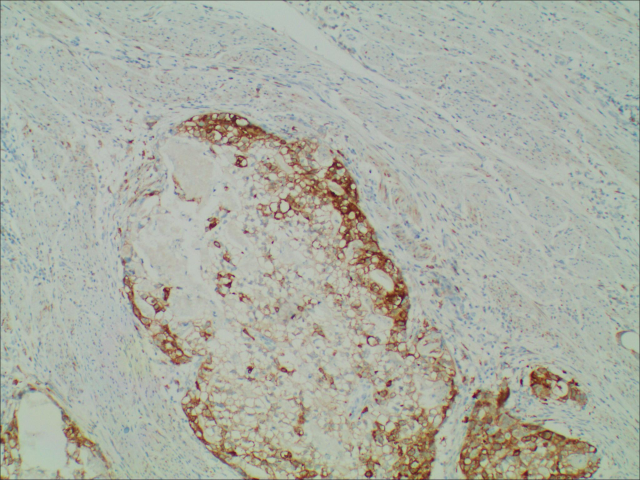
图5.免疫组化GS(+)
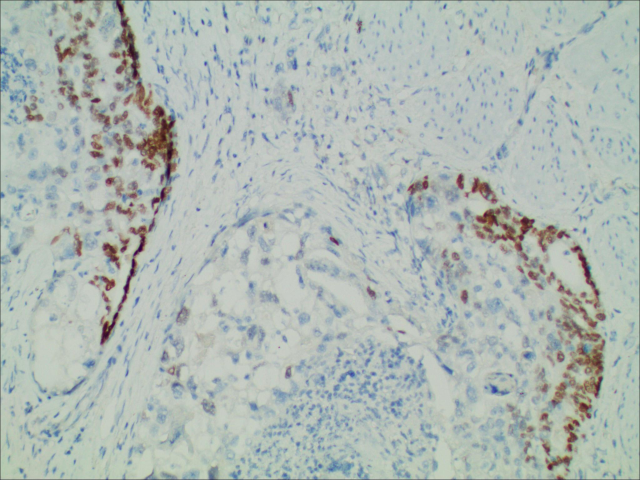
图6.免疫组化SALL4(+)
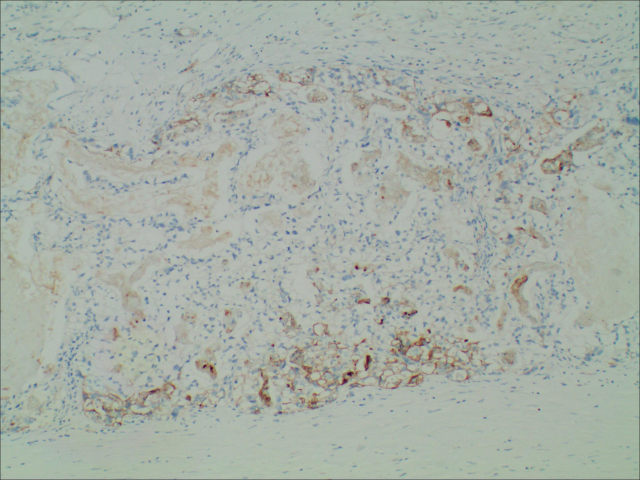
图7.免疫组化GPC3(+)




















共0条评论