[导读] 译者:佛山市顺德区龙江医院 张波
摘要
叉头框C1 (Forkhead box C1, FOXC1)转录因子参与正常胚胎发育,调控许多器官的发育和功能。最近,大量文献表明FOXC1在肿瘤的发展和转移中起着关键作用,FOXC1表达升高与许多癌症亚型的不良预后相关,如基底样乳腺癌( basal-like breast cancer, BLBC)。与其他乳腺癌亚型不同,FOXC1在BLBC中高度特异性表达。本文将对FOXC1在肿瘤发生发展中的功能和调控进行综述,重点介绍其在BLBC中的作用,以及这些新发现对癌症诊断和治疗的意义。
前言
FOXC1是属于Forkhead box (FOX) /Winged helix家族 “C”亚族的一个转录因子,FOX的DNA结合域是由100多个保守氨基酸序列组成的,这是FOX结构上的最大特点。FOX DNA家族蛋白参与许多生物过程,包括细胞增殖、分化、生存和死亡。除了在生理过程中的作用,FOX蛋白的调节也参与肿瘤的进展,故FOX蛋白可被用作癌症诊断标志物和治疗靶点。
FOXC1作为FOX家族的一员,有着自己独特的结构和功能。从结构上看,FOXC1由N端反式激活结构域、叉头DNA结合结构域、转录抑制结构域和C端反式激活结构域组成。叉头结构域具有一致的DNA结合位点序列GTAAATAAA。与FOX家族其他成员相比,FOXC1在生理和病理条件下都具有重要的功能。通常,FOXC1在胚胎发育的不同阶段发挥着重要作用。越来越多的证据表明,它在肿瘤的发展和进展中发挥作用,包括乳腺癌、急性髓细胞白血病(AML)、肝细胞癌和许多其他癌症亚型。FOXC1突变在癌症中很少见,而它的突变与Axenfeld-Rieger (AR)综合征有关,这是一种常染色体显性遗传疾病,主要影响眼睛和骨骼的发育。本文就FOXC1在乳腺癌发展和肿瘤生物学中的作用,特别是在最具侵袭性的BLBC中的作用进行综述。
FOXC1在胚胎、生理及病理过程中的作用
FOXC1信使RNA (mRNA)可在多种胚胎组织中检测到,包括原肠形成早期的近轴中胚层、排卵后8.5天的体前中胚层、眼周间质、角膜、中肾小管和周围的间质、内皮细胞。这些广泛的表达模式表明FOXC1在早期胚胎发育中的必要性。FOXC1参与胚胎发生过程中许多器官的发育,如大脑、眼睛、心脏和骨骼。FOXC1在癌症进展的许多方面发挥作用,包括迁移、侵袭和肿瘤干细胞。FOXC1在干细胞生态位维护、上皮-间充质转化和血管生成等生理过程中也发挥着重要作用。(图1)
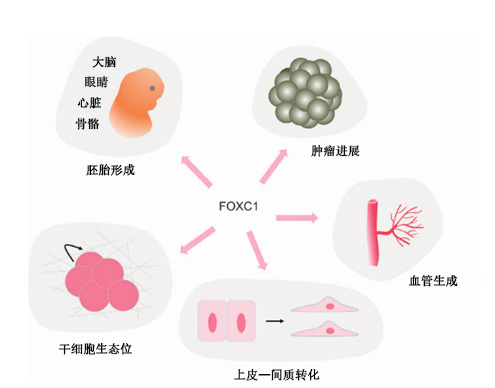
图1.FOXC1在生理病理过程中的作用示意图
FOXC1表达升高与各种癌症类型的不良预后相关,尤其是BLBC。它参与肿瘤进展的多个步骤,包括癌细胞的迁移和侵袭(表1)。

FOXC1在BLBC中的作用
乳腺癌在临床和分子特征方面是一种高度异质性的疾病。根据基因表达谱,乳腺癌被分为4个主要亚型,包括 Luminal A、Luminal B、Her2-enrich亚型和BLBC亚型。人乳腺癌微阵列数据集的基因表达分析表明,与其他分子亚型相比,FOXC1在BLBC中特异性表达。
传统上,BLBC通过三阴性表型 (ER-、PR-和Her2-),加上EGFR和CK5/6免疫组化染色来鉴定。然而,一项回顾性免疫组化研究显示,与单纯三阴性或三阴性+基础CK染色相比,三阴性+ FOXC1染色在BLBC中具有更高的预后相关性。与这一观点一致,基于FOXC1的免疫组化检测(±实时定量聚合酶链反应(qRT-PCR))表明,FOXC1表达是BLBC可靠的诊断性生物标志物,可以作为一种快速、准确和经济的方法用于BLBC的临床诊断和预后。
与BLBC中FOXC1表达升高相关的临床结果
对不同人类乳腺癌互补DNA (cDNA)微阵列数据集的分析显示FOXC1升高表达与较差的总生存期相关,这与一项回顾性的乳腺肿瘤组织免疫组化研究的结果一致。多因素分析进一步表明FOXC1预测乳腺癌临床结局的预后能力与其他常见的临床病理因素如年龄、肿瘤大小、淋巴结状态无关。此外,FOXC1表达与乳腺癌脑转移呈正相关,并显著缩短无脑转移生存期同样。FOXC1表达与乳腺癌肺转移呈正相关。这些数据表明FOXC1可能在乳腺癌脑转移和肺转移中发挥调控作用,进一步建立了FOXC1作为已知的具有向肺和脑转移倾向的BLBC的标记物。值得注意的是,FOXC1的表达也预示着许多其他类型的癌症的不良预后(参见表1)
FOXC1对BLBC细胞功能的影响
FOXC1水平与乳腺癌临床结果的明确关联可以用FOXC1对BLBC细胞功能的影响来解释,至少部分解释(图2),为长期以来认为BLBC具有NF-κB活性的观点提供了一种机制。Wang等人发现FOXC1可以通过上调BLBC细胞中NF-κB表达,从而增加p65/RelA蛋白的稳定性,激活NF-κB信号通路。FOXC1激活的NF-κB信号通路可能介导FOXC1诱导的BLBC细胞增殖、迁移和侵袭。另一项研究表明FOXC1的侵袭促进功能可能也依赖于MMP7表达的上调,这一发现支持了MMP7的下调可削弱FOXC1诱导人乳腺上皮不死细胞株MCF10A的侵袭能力。
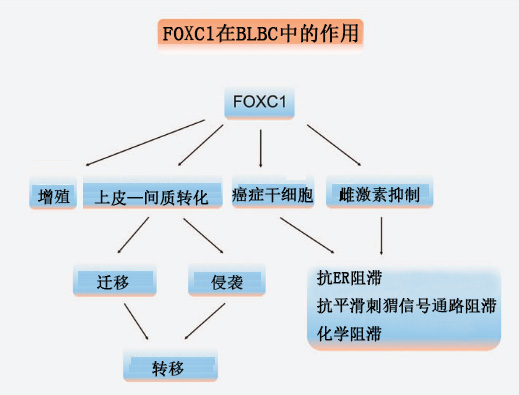
图2.FOXC1在BLBC中的功能示意图。BLBC,基底样乳腺癌;CSC,癌症干细胞;EMT,上皮-间质转化;ER,雌激素受体
上皮-间充质转化(EMT)是胚胎细胞迁移形成组织和器官的过程。已有研究表明,EMT也参与肿瘤转移,且最近的研究表明FOXC1在乳腺癌细胞中诱导EMT。在MCF12A乳腺上皮细胞中过表达FOXC1可诱导EMT,FOXC1是顶级的EMT诱导基因之一。最近研究表明,EMT对转移不是必要的,而是诱导化疗耐药性。与这一观察结果一致的是,FOXC1水平已被证明与乳腺癌细胞模型的化疗耐药和FOXC1启动子的高甲基化有关,这表明FOXC1表达的抑制可能预示着化疗乳腺癌患者生存率的提高。
除上述功能外,FOXC1还参与乳腺癌发展的其他功能。FOXC1在BLBC细胞中过表达增加了乳腺癌症干细胞(CSC)的特性,其特征是CD24-CD44+、ALDH+、CD133+和乳腺球群细胞形成。进一步的研究表明,CSC特性的增加是由FOXC1激活的smoothened (SMO)-independent hedgehog信号通路介导的,进一步暗示FOXC1可能是BLBC治疗的潜在治疗靶点。越来越多的证据表明,CSC与肿瘤进展有关,FOXC1诱导的BLBC中的CSC特性可能至少部分解释了该疾病的侵袭性和短的总生存期。
在乳腺发育和乳腺癌进展过程中,ER发挥着重要作用,其表达被精确调控。BLBC通常缺乏ER的表达,但其潜在的机制尚不清楚。先前的研究表明, GATA3与ESR1启动子的结合对乳腺癌细胞内质网表达的诱导至关重要。我们最近的研究发现FOXC1与GATA3竞争ER基因上游顺式调控元件的相同结合区域,从而下调ER的表达,从而下调其转录活性,提供了BLBC细胞中ER表达缺失的可能机制。临床上,ER表达缺失在复发性乳腺肿瘤中是一种普遍现象。根据我们的研究,大部分患有ER+原发肿瘤的乳腺癌患者在接受他莫西芬辅助治疗后复发为ER -。FOXC1表达与复发肿瘤中ER表达的降低或检测不到相关,进一步表明FOXC1在ER表达抑制中的作用。
值得注意的是,不同亚型的乳腺癌表现出优先的器官特异性远处转移。BLBC易向肺和脑转移,但很少向骨转移。FOXC1过表达与较短的脑无转移生存期和较好的骨无转移生存期相关。然而,其潜在的分子机制尚不清楚。最近发表的一篇论文表明,肿瘤细胞弥散到脑后失去了磷酸酶和张力素同源物(PTEN)的表达,该表达激活NF-κB信号转导,进而诱导C-C基序趋化因子配体2 (CCL2)依赖的髓系细胞聚集,促进脑内肿瘤生长。如上所述,FOXC1在BLBC细胞中激活NF-κB信号通路,因此,FOXC1可能有助于肿瘤细胞播散到脑的良好微环境的建立。FOXC1诱导的EMT和迁移也可以通过促进肿瘤细胞通过血脑屏障的渗透促进脑转移。BMP信号是骨细胞功能和骨形成的重要调控因子。根据最近的一篇报道,FOXC1激活BMP信号通路,使毛囊干细胞(HFSC)细胞周期静止,可以推测骨微环境或骨髓可能诱导FOXC1+的乳腺癌细胞进入细胞周期阻滞。
在EGFR+ BLBC细胞中,FOXC1可被EGF以剂量和时间依赖的方式上调。值得注意的是,EGFR已被用作IHC的替代标记之一来定义BLBC。EGFR诱导的RAS/ ERK和PI3K/AKT信号通路促进FOXC1表达。同样,FOXC1和EGFR的表达在人乳腺肿瘤中被发现呈正相关。EGF还可以通过调控FOXC1的蛋白稳定性来调控其转录活性位于FOXC1蛋白抑制域的丝氨酸-272,可以被EGF激活的ERK信号通路磷酸化,从而稳定FOXC1蛋白。最近的一项研究发现,乳腺癌易感基因1 (BRCA1)和GATA3可以在FOXC1启动子处相互作用,共同抑制FOXC1的转录,从而证明了BLBC细胞中FOXC1表达的另一种调控机制。有趣的是,这项研究为FOXC1在不同乳腺癌亚型中的内在基因表达模式提供了可能的解释。如上所述,FOXC1仅在BLBC中高表达,而在其他亚型中没有表达,鉴于在ER+乳腺肿瘤细胞中经常观察到GATA3的表达,而在BLBC细胞中却没有,而且BRCA1突变在BLBC中非常普遍,我们有理由认为,缺乏GATA3表达以及低或突变BRCA1的存在可能逆转FOXC1的抑制,导致FOXC1在BLBC中特异性表达。
FOXC1在乳腺癌中的表达也可以通过启动子区DNA甲基化来调控。一篇报道显示,FOXC1甲基化状态在经过治疗的局部晚期乳腺肿瘤中有所不同,这表明FOXC1启动子甲基化的增加可能是新辅助阿霉素治疗期间对抗肿瘤侵袭的保护因子。然而,在其他报道中,FOXC1的甲基化状态似乎与FOXC1的肿瘤促进功能相矛盾。例如,与早期浸润性乳腺癌相比,FOXC1甲基化状态在晚期疾病中显著增加。与原发性乳腺肿瘤相比,在匹配的远处转移中FOXC1甲基化水平更高。这一令人困惑的观察可能可以用FOXC1在不同乳腺癌亚型中的内在表达模式来解释,其中FOXC1在ER -而不是ER+乳腺肿瘤中高表达。在上述分析中,ER+乳腺肿瘤中FOXC1的DNA甲基化水平明显高于ER -乳腺肿瘤。在匹配的原发和转移性肿瘤研究中,几乎所有的分析样本都是ER+。在MCF-7管腔乳腺癌细胞中,FOXC1的启动子是高甲基化的,而MCF-7管腔乳腺癌细胞具有无法检测到的FOXC1表达。有趣的是,在电离辐射诱导的生长停滞后恢复的再生细胞中,FOXC1启动子的甲基化水平显著降低,提示FOXC1可能参与了放疗抵抗。甲基化对FOXC1的调控也发生在正常组织中,其中人类乳腺上皮细胞CD44+祖细胞样亚群具有低甲基化的FOXC1启动子和高表达的FOXC1,这些研究揭示了FOXC1表达和活性的一些上游调控因子。然而,更全面的了解其在BLBC中的监管还需要进一步的调查。
FOXC1在其他类型癌症中的作用
FOXC1在其他癌症类型中的关键作用不仅限于乳腺癌,因为它也被发现参与了许多癌症类型。例如,FOXC1表达升高与肝细胞癌、胰管腺癌和胃癌的预后不良相关。与癌旁正常组织相比,肝细胞癌细胞表达较高的FOXC1,这与总体生存率低和高复发率有关。FOXC1促进肝细胞癌细胞侵袭和肺转移,可能是通过诱导神经前体细胞表达的发育下调蛋白9 (NEDD9),增加EMT介导的微血管侵袭。另一项研究也报道了FOXC1介导肝细胞癌转移的另一种机制,FOXC1通过直接与肝癌细胞的启动子结合,上调CCL2和CXCR1的表达水平,上调的CXCR1促进肝癌细胞的侵袭和转移。此外,CCL2可以招募肿瘤相关巨噬细胞(TAM)进一步促进转移。最近发表的一篇论文显示FOXC1至少在20%的AML患者中过表达,FOXC1通过阻断单核细胞谱系分化和增强克隆潜能加速AML的发生。FOXC1在肾细胞癌和胆管癌的调控网络中作为中心转录因子出现。FOXC1表达升高与非小细胞肺癌患者预后不良相关。在雄激素非依赖性前列腺癌异种移植中,FOXC1高表达并参与前列腺癌的进展。此外,已有研究表明FOXC1与黑色素瘤有关。然而,FOXC1在这些癌症中发挥作用的确切机制仍有待阐明。总的来说,FOXC1促进癌细胞增殖、迁移、侵袭和远处转移,与其在乳腺癌中的功能一致。此外,FOXC1表达升高通常与这些癌症类型的不良预后相关。
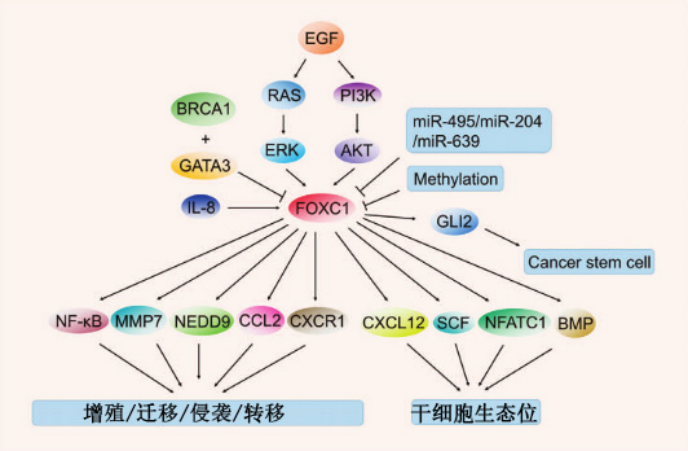
图3.不同生理和病理条件下FOXC1相关信号通路示意图
FOXC1在这些癌症类型中的调控也被广泛研究(图3)。例如,在子宫内膜细胞中,miR-495可以抑制FOXC1的表达,抑制FOXC1诱导的细胞生长和迁移,在子宫内膜细胞中FOXC1的表达也可能受到另一种miRNA的调控。在子宫内膜样子宫内膜癌的发展过程中,miR-204的表达水平被下调,进而释放miR-204抑制的FOXC1表达,促进FOXC1诱导的迁移和侵袭。在舌鳞状细胞癌细胞中,miR-639抑制FOXC1的表达并阻断FOXC1介导的EMT。研究还发现了其他一些在其他癌症中参与调节FOXC1的因素。在肝细胞癌中,FOXC1可通过IL-8上调,IL-8是由缺氧诱导因子1-α (HIF-1α)与FOXC1启动子结合介导的。FOXC1也是弥漫性大B细胞淋巴瘤中JUN信号的一个靶点。
正常细胞相关的FOXC1功能在癌症中的意义
最近的研究表明FOXC1是造血干细胞(HSPC)生态位形成的关键调控因子。CXCL12-abundant reticular cell(CAR)细胞既是成脂祖细胞,也是成骨祖细胞,对HSPC的维持至关重要。与成骨细胞相比,CAR细胞中FOXC1 mRNA的表达水平在发育中和成人骨髓中均显著升高。CAR细胞中FOXC1的表达上调CXCL12和干细胞因子(stem cell factor, SCF)的表达,进而抑制CAR细胞向脂肪细胞的分化,不利于HSPC的维持。同样,FOXC1也需要维持HFSC的静止状态。FOXC1的表达在HFSC被激活时被诱导,当静止的干细胞重新进入细胞周期时。FOXC1诱导激活一组基因,包括激活t细胞核因子1 (NFATC1)和BMP信号,这是控制干细胞静止的两个关键途径,以促进静止的HFSC特性,以响应HFSC的激活。这些观察结果与FOXC1在BLBC中的功能之一一致,即FOXC1通过细胞内在机制增加CSC特性。
许多研究表明FOXC1在促进血管生成中起重要作用。在胚胎血管发育过程中,FOXC1与Ets易位变异2 (ETV2)相互作用,调节内皮特异性基因的表达此外,FOXC1可与血管内皮生长因子和NOTCH信号通路相互作用,调控内皮细胞中动脉特异性基因的表达。在胎儿脑发育期间,FOXC1由脑周细胞表达,它是周细胞调节血管发育所必需的。这些发现提示FOXC1可能在肿瘤血管生成中发挥作用,而血管生成是肿瘤发生和进展的一个标志,因此值得在未来的研究中进一步研究FOXC1在肿瘤血管生成中的作用。
结束语
FOXC1最初被确定为胚胎发育中的一个重要调控因子。到目前为止,它已经被证明与胚胎发育的许多方面有关,包括大脑、眼睛和心脏的形成。此外,FOXC1在多种生理过程中发挥着关键作用,如维持细胞的正常生长干细胞生态位。最近发表的研究表明FOXC1参与了癌症,特别是乳腺癌的多方面调节作用。基于全面的基因芯片表达和免疫组化分析,FOXC1已被提出作为一种简单而准确的BLBC患者诊断的生物标志物。尽管BLBC和三阴性乳腺癌(triple-negative breast cancer, TNBC)有相当多的重叠,但它们在基因表达谱和临床特征方面存在差异。临床上,BLBC通常由TNBC和CK5/6和EGFR免疫染色来定义。作为一种替代方法,BLBC也可以通过基于微阵列的基因表达谱来诊断,如PAM50。从成本效益和便利性方面来说,这些方法可能不是确定BLBC的理想方法。因此,基于FOXC1表达的BLBC鉴定有望显著简化患者的亚型分型和预后预测过程,并可能有助于指导BLBC患者的治疗选择。考虑到FOXC1在基底样肿瘤中激活SMO-independent Hedgehog信号通路,并介导EGFR功能,对FOXC1通路的干预可能为BLBC治疗提供新的有效方式。此外,FOXC1可能作为一种预测性生物标志物,用于识别那些可能或不可能受益于抗EGFR、抗Hedgehog和其他靶向治疗的患者。
尽管一些研究试图阐明FOXC1在癌细胞中的调控作用,但对其在肿瘤细胞中的调控网络的全面了解仍在很大程度上是未知的。FOXC1在BLBC细胞中调控的机制可以为我们了解FOXC1是如何在BLBC中特异性表达,而在其他乳腺癌亚型中被排除提供一些线索。FOXC1基因启动子上BRCA1和GATA3的相互作用可能解释了FOXC1在不同乳腺癌亚型中的特异性表达模式。然而,要完全了解FOXC1调控的信号网络,还需要进一步的研究。考虑到FOXC1参与胚胎发育和乳腺癌进展,FOXC1在乳腺发育中发挥作用是合理的。已有研究表明FOXC1在乳腺腔内祖细胞中表达与这一观察结果一致的是,FOXC1可以在乳腺上皮细胞分化中诱导祖细胞样表型,这些发现暗示FOXC1和乳腺发育之间可能存在联系。一个有趣的概念是,BLBC可能来自乳腺管腔祖细胞。由于FOXC1在腔内祖细胞中表达,因此它在BLBC的细胞起源中表达的可能性是一个值得探讨的推测。
综上所述,FOXC1作为胚胎发育的关键调控因子,已被证明参与肿瘤的发生,特别是在BLBC中。然而,其在癌症进展过程中的功能和调控的详细机制仍有待进一步阐明。阐明FOXC1功能的分子基础将成为FOXC1过表达肿瘤的潜在治疗靶点。

















共0条评论