[导读] 编译整理:强子
鉴别诊断
皮肤非典型血管病变和血管肉瘤的诊断及鉴别诊断中,密切结合临床病史非常关键,尤其非典型血管病变和血管肉瘤的鉴别。如前所述,取材部位的放疗史、长期淋巴水肿,需要考虑的病种从非典型血管病变至继发性血管肉瘤均可。
组织学上,非典型血管病变的鉴别需注意淋巴管瘤、靴钉样血管瘤。局限性淋巴管瘤为淋巴管良性的表浅增生,可非常类似淋巴管型非典型血管病变。虽然这一病种也可见于放疗后的皮肤,但更多见于婴儿、且表现为局灶性小泡状结构的局灶聚集,而非典型血管病变为红斑状。靴钉样血管瘤也可表现为孤立性斑块或结节,但最常见于年轻人至中年人的躯干或四肢,且此前放疗并非该病变的特征。组织学上,非典型血管病变和靴钉状血管瘤都是形态温和的内皮细胞,细胞核突向血管腔内。该组病变的形态学差异非常轻微:靴钉状血管瘤为双相型表现,即表浅为扩张的管腔,内皮细胞靴钉状,管腔内有乳头状凸起;而较深处则为不太明显的挤压、裂隙状、分支毛细血管。
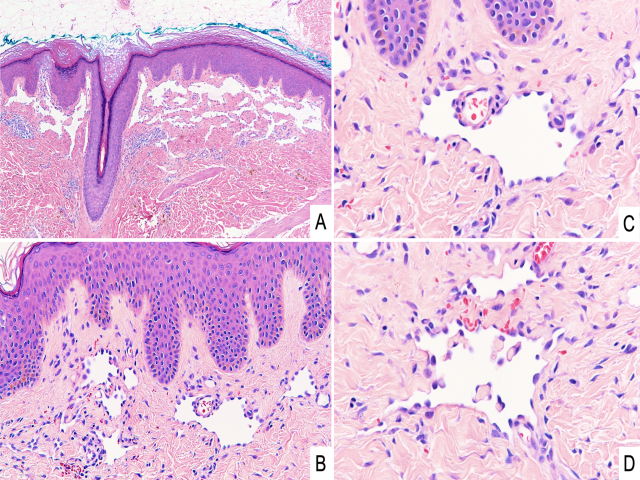
图8.靴钉状血管瘤,(A)HE切片中表现为真皮表浅处、境界清楚的血管增生,(B)具体为薄壁、淋巴管型管腔;(C)管腔衬覆内皮呈靴钉状,即显著突入管腔,腔内偶见乳头状凸起(D)。
除前述病种,乳腺原发和继发血管肉瘤形态学还可能与下述病变重叠:上皮样血管内皮瘤、上皮样血管瘤、Kaposi肉瘤、Kaposi型血管内皮瘤。上皮样血管内皮瘤为血管中心性肿瘤,常伴管腔,细胞为小而温和的上皮样;该肿瘤可表现为单细胞、条索样、片状,间质可从显著黏液样至透明样变表现不等。上皮样血管内皮瘤一般并无血管肉瘤中可见的管腔形成及核分裂,尤其无非典型核分裂。此外,上皮样血管内皮瘤具有独特的WWTR1::CAMTA1融合,这可通过免疫组化中细胞核强阳性表达CAMTA1而证实;不过,其他基因重排所致的上皮样血管内皮瘤无此特征。
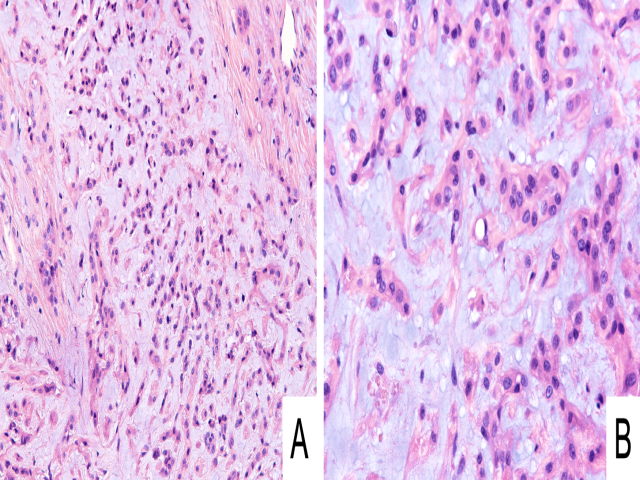
图9.上皮样血管内皮瘤,(A)组织学表现为形态均一的上皮样细胞、呈条索状及小巢状增生,背景为黏液样表现;(B)高倍镜下可见胞质内腔隙。
上皮样血管瘤为真皮或皮下、境界清楚的良性血管性肿瘤,常见于头颈部,但也可见于骨、深部软组织、内脏器官。组织学上,上皮样血管瘤为毛细血管呈模糊的分叶状,衬覆上皮样内皮细胞,胞质丰富、嗜酸性。此外,伴显著炎症成分、尤其嗜酸性粒细胞成分是一个有助于鉴别诊断的线索。存在梭形或上皮样内皮细胞构成的实性区,有时会造成诊断困难,此时会类似上皮样血管内皮瘤、上皮样血管肉瘤。不过,上皮样血管内皮瘤中并无间质改变、也无真正管腔结构形成;上皮样血管瘤中的炎症细胞浸润,血管肉瘤中的细胞学非典型、核分裂都有助于鉴别。此外,上皮样血管瘤中常见FOS/FOSB基因重排,可通过免疫组化检测出来。
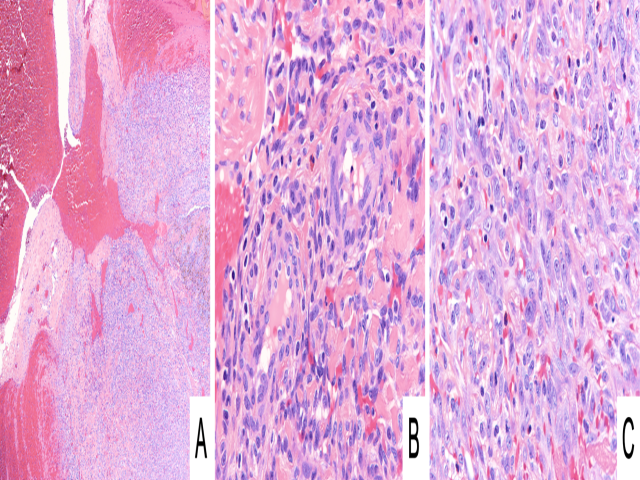
图10.上皮样血管瘤,(A)图中可见管腔较大的血管受到破坏,周围有上皮样内皮细胞的增生,胞质稍嗜酸性,衬覆于小血管内(B)、或呈实性片状生长(C)。背景中有显著炎症成分,尤其嗜酸性粒细胞。
血管肉瘤和Kaposi肉瘤在组织学上可能存在重叠,尤其Kaposi肉瘤的早期,因为它们都可表现为不规则管腔结构的复杂生长。病程较长的Kaposi肉瘤可表现为形态温和的梭形细胞、围绕小管腔生长,或梭形细胞融合、形成特征性的结节状生长。除形态学外,Kaposi肉瘤和血管肉瘤的鉴别可结合临床表现和免疫组化:Kaposi肉瘤见于免疫抑制状态,且有HHV-8感染。
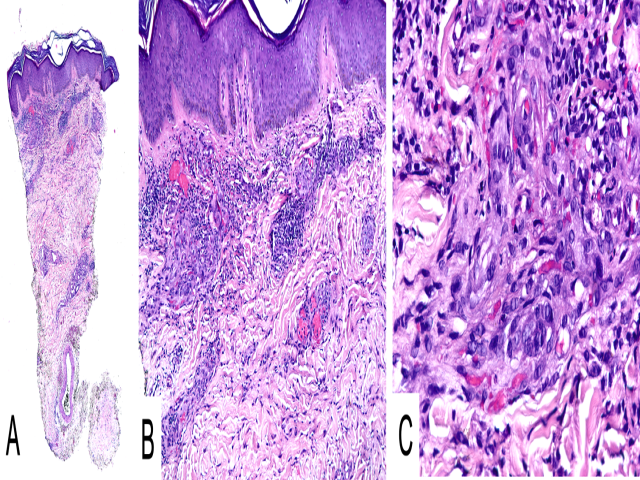
图11.Kaposi肉瘤,(A)低倍镜下表现为真皮浅层似有炎症表现,(B)高倍镜下,可见围绕真皮内小血管的结节状浸润,细胞为特征性的形态温和、梭形细胞,裂隙状管腔内有红细胞(C)。
如病变累及乳腺实质或皮肤,则鉴别诊断又有所不同。伴实性或梭形特征的低分化肿瘤可能需鉴别高级别浸润性导管癌、化生性梭形细胞癌、转移癌、恶性叶状肿瘤伴间质过度生长、恶性黑色素瘤、其他肉瘤。这种情况下,免疫组化有极大帮助,且建议选择一组指标、并注意相关陷阱。高分化血管瘤则可能与良性血管性病变混淆,尤其小活检标本中,具体如血管瘤、血管脂肪瘤、乳头状内皮增生(Masson瘤)。这三种病变都无细胞学非典型,且一般境界清楚、无浸润性生长,血管脂肪瘤也无相互沟通的网状结构。大部分血管瘤都不足2cm,而乳腺原发血管肉瘤一般更大。乳头状内皮增生中复杂的血管结构可类似血管肉瘤中的管腔表现,但确定位于血管内是诊断的关键,弹力纤维染色也有助于鉴别。
血管瘤病也是乳腺内的罕见血管性病变,表现为大而囊性扩张的血管腔隙弥漫分布,形态学可能会类似低级别血管肉瘤。更重要的是,这些血管腔广泛累及小叶外间质。血管性腔隙中有陷入的乳腺导管和小叶,但血管肉瘤中是侵犯及破坏小叶内间质。小活检标本中有时无法做出鉴别,需手术切除才能明确诊断。
乳腺活检标本中更常见的一种情况为假血管瘤样间质增生,这是乳腺间质内肌纤维母细胞的良性增生,可能是对激素、尤其孕激素的过度反应。假血管瘤样间质增生大部分为偶见,也可表现为可触及肿物。形态学为衬覆扁平、温和、梭形细胞的裂隙样管腔,相互沟通。与血管肉瘤的鉴别点在于无细胞学非典型、无核分裂,裂隙样腔隙内无红细胞。尽管CD34阳性,但内皮特异性标记(如ERG、CD31)为阴性。
分子特征
皮肤原发血管肉瘤具有遗传学异质性,最常见的突变基因有TP53、KRAS、PTPRB、PLCG1,且肿瘤突变负荷高,且有紫外线所致突变印迹。
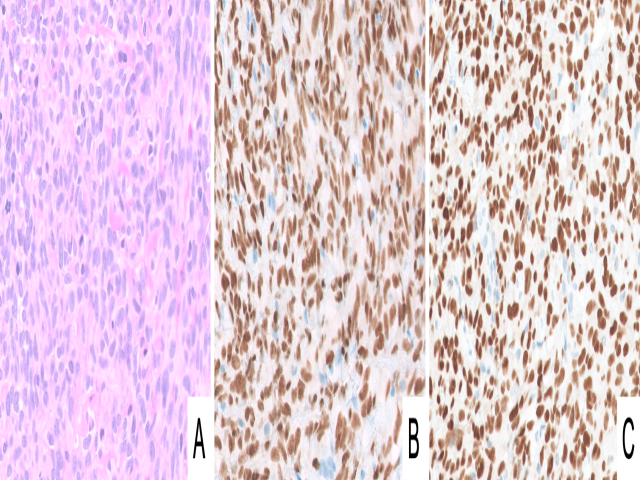
图12.皮肤原发血管肉瘤,(A)本例形态学方面管腔分化特别并不明显,但ERG弥漫阳性(B);同时瘤细胞出现p53的弥漫、强阳性异常表达(C),提示有TP53基因改变。
乳腺原发血管肉瘤的分子特征不同于其他部位血管肉瘤。尽管乳腺血管肉瘤可有类似皮肤血管肉瘤的PTPRB改变,但乳腺血管肉瘤相比其他部位血管肉瘤来说,KDR突变和PIK3CA突变的几率更高。需要注意的是,乳腺原发血管肉瘤中一般并无MYC扩增和TP53改变。
相反,因放疗或长期淋巴水肿所致的继发性血管肉瘤中会有MYC、KIT、RET的改变以及CDKN2C下调,且肿瘤突变负荷较低,无紫外线相关遗传学标签。对于乳腺继发性血管肉瘤来说,MYC扩增是最显著的分子驱动事件,这是由上游的转录因子FOXO1调节所致,并会影响下游PD-L1的表达,即MYC扩增会有PD-L1的表达增加,这在皮肤血管肉瘤中已经观察到、且预后更差。需要注意的是,皮肤原发血管肉瘤相比继发血管肉瘤来说,MYC扩增相对少见,但即使无放疗病史的情况下可能也会有MYC的扩增,这说明原发血管肉瘤中MYC存在非基因扩增、但蛋白过表达的其他机制。
关于非典型血管病变的分子机制了解很少。最近有研究发现有少量的HRAS和TERT启动子突变,且皮肤血管肉瘤中常见的遗传学改变(如前述TP53功能缺失、MYC扩增)并不多见。
——全文完——
往期回顾:
皮肤非典型血管病变和血管肉瘤的临床病理诊断(一)
皮肤非典型血管病变和血管肉瘤的临床病理诊断(二)


















共0条评论