[导读] 作者:张春英
今天向大家介绍宫颈癌系列知识,目的是帮女性朋友选择最适合自己的预防性筛查方法。我们先科普宫颈癌的发病原理,特别是病毒学方面的知识,进而介绍宫颈癌筛查的科学依据、筛查方法比较。病理报告如何解读?也是大家关心的问题。筛查发现异常怎么办?且听在下娓娓道来。
一、宫颈癌的发病原理
宫颈癌的罪魁祸首是一种病毒,人乳头瘤病毒,英文简称HPV。需要强调的是,HPV有很多亚型,其中能致癌的亚型称为高危型HPV,包括:16,18,31,33,35,39,45,51,52,56,58,59,68。
那么,高危型HPV是怎样导致宫颈癌呢?
从病毒学方面讲,HPV病毒感染分为两种阶段。第一阶段,称为潜伏性感染。普通的方法检测不到HPV病毒,宫颈细胞学筛查和病理学筛查都是阴性,只能用特殊的分子学检查方法才能发现。第二阶段是复制性病毒感染。HPV病毒在宫颈细胞内大量复制,导致棘层肥厚、细胞质空泡、挖空细胞、多核细胞和核异型性,普通的筛查方法能检测到,如宫颈细胞学、宫颈活检和HPV检测。(图1)
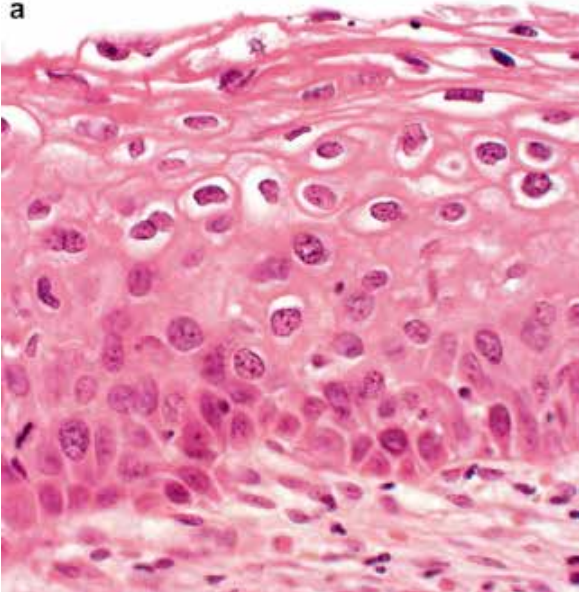
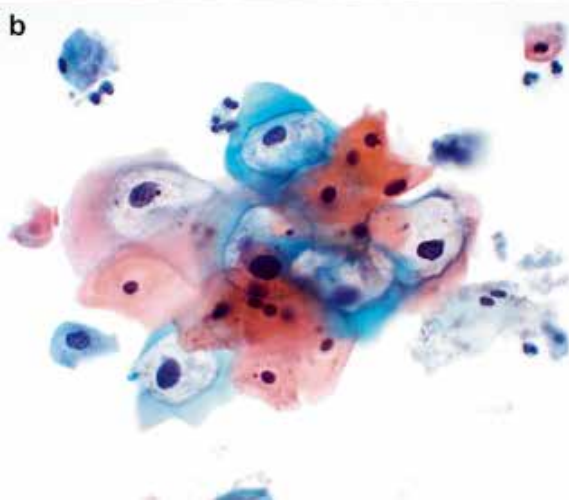
图1.HPV感染导致的细胞病变。HPV感染导致的细胞病变包括核增大、核固缩或核深染、细胞大小不一、多核和核周胞质空泡化。a.典型的低度鳞状上皮内病变(LSIL)的组织学特征;b.典型LSIL的细胞学特征
从流行病学方面讲,HPV病毒感染都是接触性传播。在各种传播方式中,性生活最常见,但并不是必然的感染途径。估计每次性生活具有40%的传播风险使用避孕套可减少但不能消除女性被传染的风险。男性包皮环切术可减少HPV的携带与传播。大多数女性在性生活开始后几年内感染HPV。国外有一项研究,80%的女性大学生在某一段时间感染了HPV。
大多数HPV感染为暂时性的,且病毒会被清除或潜伏1到2年。如果感染持续存在36个月以上,那么病毒在将来被清除的可能性显著降低。而且,感染持续时间越长,进展为高级别病变的可能性越高。在细胞学正常的20岁左右的女性中,高危型HPV的阳性率比较高,并且随着年龄的增长而下降。
二、宫颈癌筛查的科学依据
从感染高危型HPV到发生宫颈癌,是一个漫长的过程,并且这个过程是可以检测的、可以治愈的,这就是宫颈癌筛查的科学依据。
国内外多种学术机构都制定了科学的筛查指南,可以简单地归纳为针对病毒的筛查(HPV检测)、针对细胞的筛查(宫颈细胞学筛查,如TCT)和联合筛查(HPV+TCT)这三大类筛查方法。最新指南强调了HPV检测用于初筛的价值,同时基于“同等风险,同等管理”的理念,在HPV初筛阳性的管理中,HPV16/18型具有最高的风险,需要直接转诊阴道镜,而其他12种亚型阳性,通过细胞学或者醋酸染色目视观察(VIA)进行分流。
三、宫颈癌筛查:方法比较
HPV检测:主要检测高危型HPV。优点:自动化检测,灵敏度高。缺点:存在假阳性;病毒感染并不一定致病,HPV检测用于大规模筛查会导致社会资源的浪费。
TCT检测:检测宫颈细胞。如前所述,复制性病毒感染才会导致细胞学异常,所以避免了HPV检测的假阳性和虽然HPV阳性但不致病的那些人群,节省社会资源,减少不必要的恐慌。这是其优点,但也有缺点,需要经过培训的、有经验的病理医生,人力成本高,工作量有限,存在漏诊的可能性。
联合筛查:同时检测HPV和细胞学。优点是这种筛查方法弥补了各自单独筛查的缺点,具有高度敏感性和高度特异性。缺点是成本高,不适合大规模筛查。
四、阴道镜活检--宫颈鳞状上皮内病变的病理报告解读
筛查发现异常,医生会根据行业规范或指南,可能会建议做阴道镜检查和宫颈活检。“活检”是一种病理检查方法,是疾病诊断的金标准。活检发现异常,后续可能会做宫颈锥形切除手术,并进一步做病理检查,这部分内容已经超出本次科普的范围,容我后续详述。宫颈宫颈锥形切除和/或其他宫颈手术后,仍然需要定期做宫颈癌筛查。
1、定义
宫颈的鳞状上皮内病变(SIL),也称为宫颈上皮内瘤变(CIN),是由HPV感染驱动的鳞状细胞增殖,显示成熟异常和/或病毒性细胞学改变,未突破基底膜。它们分为低度鳞状上皮内病变(LSIL)和高度鳞状上皮内病变(HSIL)。
2、正常鳞状上皮
子宫颈成熟鳞状上皮从基底层向上逐渐成熟,中层细胞空泡化,基底细胞为单层,核垂直于基底膜。在上皮间质连接处,可见指状纤维血管间质乳头突入上皮下部。(图2)
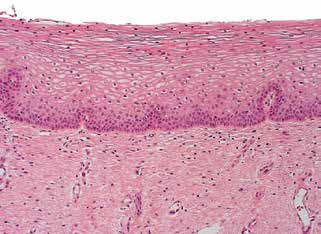
图2.正常鳞状上皮
3、低度鳞状上皮内病变(LSIL)
LSIL的特征是基底层细胞/副基底层细胞在上皮的下1/3层增殖,可显示核分裂活性,但没有非典型核分裂象,并且可有挖空细胞异型性伴成熟/分化的特征。(图3)
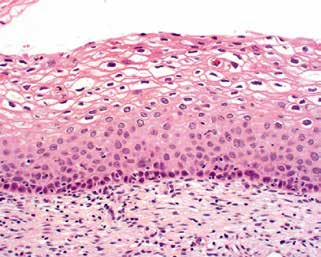
图3.低度鳞状上皮内病变(LSIL)的上皮下1/3层仅有轻微的细胞异型性
4、高度上皮内瘤变
在HSIL中,非典型性应当见于鳞状上皮全层,其范围和程度均超过LSIL。基底层和副基底层具有显著的核非典型性和AMF。不成熟基底型细胞占据上皮的下1/3层以上。
4.1 HSIL(CIN 2)
不成熟基底样细胞占上皮厚度的2/3,但未累及上1/3。同样,核分裂象只出现在上皮的下2/3层,而不出现于上1/3层。(图4)
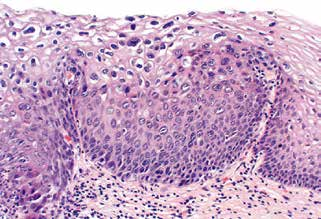
图4.HSIL伴明显的挖空细胞病。除了不成熟基底样细胞延伸至上皮中层之外,该病变还有挖空细胞病的特征。这种病变以前被归类为CIN2
4.2 HSIL(CIN 3)
不成熟基底样细胞累及上皮层的上 1/3,核分裂象可见于上皮全层(图5)。
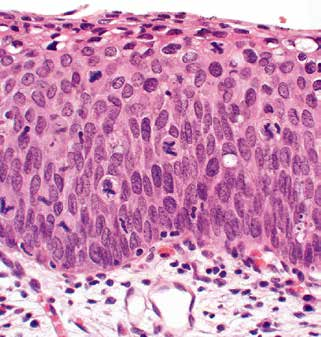
图5.HSIL。这种HSIL的不成熟基底样细胞和核分裂象几乎延伸至上皮表面。该病变以前被归类为CIN3
5、实际病例
如下图,你认为这个病例是LSIL还是HSIL?
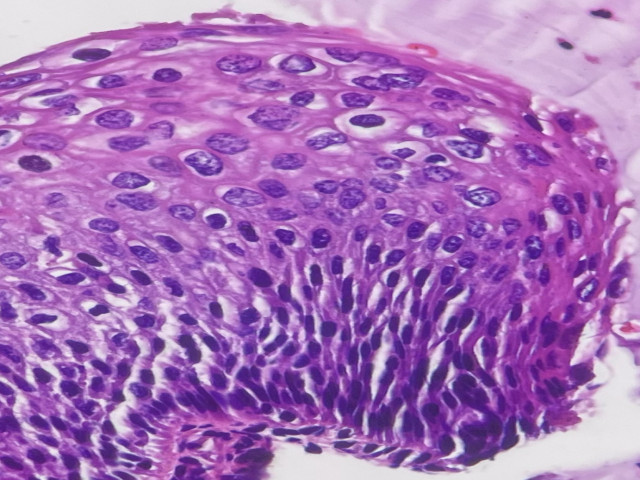
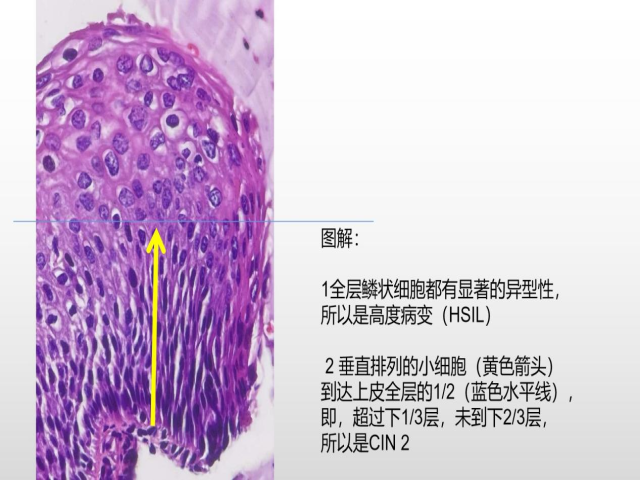
分析:全层鳞状细胞都有显著的异型性,所以是高度病变(HSIL)。
不成熟基底型细胞占据上皮的下1/3层以上,但未到达下2/3层,大概到达1/2层,所以是CIN2。
垂直排列的小细胞都是不成熟基底型细胞。
附临床信息:女,36岁,常规筛查发现异常(HPV16+,TCT HSIL),行阴道镜活检。免疫组化:p16+
进一步图解如下:
五、筛查建议
以下摘录2021年版世界卫生组织(WHO)宫颈癌筛查指南中“对一般女性的具体筛查建议”,供大家参考。国内也有相似的指南,有兴趣者可自行在网上查阅。
一般女性无论选择哪种策略,均建议:从30岁起进行HPV检测,每5-10年定期筛查一次。关于筛查方法、频率及相关处理,具体推荐和管理规范声明如下:
1、建议在筛查和治疗方法中使用HPV检测作为主要筛查方法。
2、无论是否采用分诊策略,HPV检测均是首选初步筛查方法。
3、在“筛查和治疗”策略中,建议对HPV检测呈阳性的女性进行治疗。在“筛查、分诊和治疗”策略中,对HPV检测呈阳性的女性,建议通过基因分型、阴道镜检查、VIA或细胞学检查进行分诊。
4、进行HPV检测时,建议由医疗卫生专业人员采样或由女性自行采样。自行采样可能让患者更自在,但需得到专业指导。
5、一般女性从30岁开始定期进行宫颈癌筛查。
6.50岁以后,如按WHO建议的筛查间隔定期筛查且连续两次均为阴性,则可停止筛查。
7、应优先筛查30-49岁的一般女性。当有适合的诊疗方法时,还应优先考虑50-65岁女性年龄段从未接受过筛查的女性(管理规范声明)。
8、如以HPV检测作为主要筛查方法,每隔5-10年定期筛查。
9、如果HPV检测尚未实施,仍使用VIA或细胞学作为主要筛查方法,则需每3年定期筛查。
10、即使一生只进行两次筛查,也是有益的(管理规范声明)。
11、如初步筛查为HPV检查,呈阳性,但在后续分诊检测中呈阴性,则24个月后重新进行HPV检测,如果阴性,则可转为常规定期筛查间隔。
12、如初步筛查为细胞学呈阳性,但阴道镜检查结果正常,则12个月时重新进行HPV检测,如果阴性,则可转为常规定期筛查间隔。
13、因组织学证实的CIN2/3或原位腺癌(AIS)或因阳性筛查结果而已经接受治疗,在12个月时优先重新进行HPV检测,如果阴性,则可转为常规定期筛查间隔。
14、在引入HPV检测的机构,无论女性既往筛查采用的是什么方法,下一次常规筛查都使用HPV检测。如目前筛查仍以细胞学或VIA检查为主,则继续使用,直至HPV检测可用(管理规范声明)。
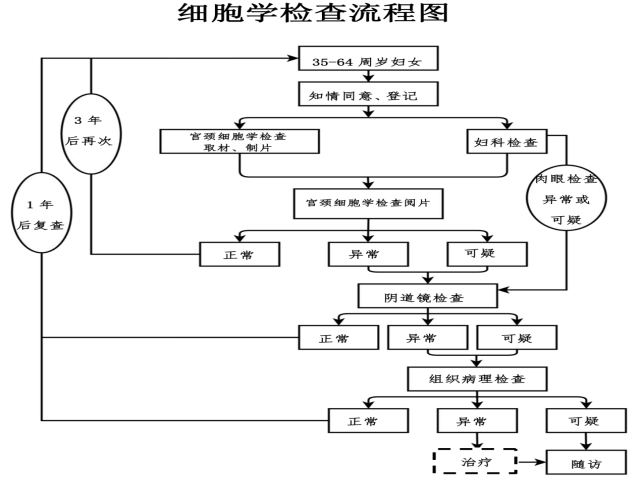
附1:国家卫生健康委印发《宫颈癌筛查工作方案》2021年版细胞学检查流程图
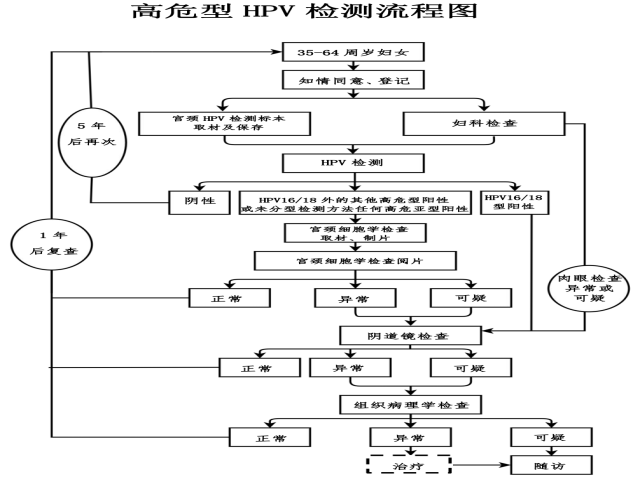
附2:国家卫生健康委印发《宫颈癌筛查工作方案》2021年版HPV检测流程图























共0条评论