[导读] 译者:慧海拾穗
【简介】
肥大细胞增多症是一组异质的骨髓(BM)起源疾病,其特征在于克隆转化的肥大细胞增生,通常与KIT体细胞激活点突变相关,临床和形态学特征谱广泛,从自限性良性疾病(如幼年皮肤肥大细胞增多症(CM)或色素性荨麻疹(UP))到高侵袭性肿瘤,如肥大细胞白血病。
肥大细胞增多症中观察到的症状与肥大细胞介质的自发或触发释放有关,或与肥大细胞在组织中的病理性积聚有关。总的来说,肥大细胞增多症可分为两种主要亚型:CM和系统性肥大细胞增多(SM),后者主要累及BM。世界卫生组织将SM分为几个主要亚型(表33.1):CM、惰性SM(ISM)、伴有相关克隆性造血非肥大细胞疾病(SM-AHN)的SM、侵袭性SM(ASM)、肥大细胞白血病、肥大细胞肉瘤和皮肤外肥大细胞瘤。
CM可分为四种不同的临床变异型:UP、孤立性肥大细胞瘤、弥漫性CM和持久性发疹性斑状毛细血管扩张。皮肤表现通常伴随着肥大细胞释放介质的继发症状。大多数儿童CM预后良好,皮肤病变逐渐消退。
SM患者的表现包括贫血、白细胞增多、嗜酸性粒细胞增多、血小板减少和脾肿大。SM变异型可通过临床病理学标准可进一步分类为“B”表现(骨髓中>30%的肥大细胞和/或血清类胰蛋白酶水平>200ng/mL;骨髓细胞增多/发育不良,而不符合另一种髓系肿瘤的标准;或肝脏、脾脏或淋巴结肿大,而无器官损伤的证据)和“C”标准(器官损害的证据,如肝功能异常和/或腹水、脾功能亢进、血细胞减少、大的溶骨性病变/骨折、吸收不良和体重减轻)。肥大细胞白血病是一种极其罕见的肥大细胞增多症亚型,肥大细胞白血病扩散,疾病进展迅速。
系统性肥大细胞增多症的标准见表33.2。

与SM相关的髓系肿瘤包括骨髓增生异常综合征(MDS)、骨髓增殖性肿瘤(MPNs)、混合MDS/MPN,包括慢性髓单核细胞白血病(CMML)、嗜酸性粒细胞疾病和急性髓系白血病(AML)。淋系肿瘤不常见。
【形态学】
肥大细胞增多症是一种形态学诊断,不应仅根据临床结果来诊断。大多数肥大细胞增多症患者有皮肤受累的证据。骨髓受累见于SM。其他受累部位包括脾脏、淋巴结、肝脏和胃肠道。正常肥大细胞通常是圆形的单核细胞,细胞质中有明显的异染颗粒。很少见到肥大细胞祖细胞(未分化的类胰蛋白酶阳性细胞、异染细胞和前肥大细胞)。
肥大细胞增多症中肥大细胞圆形至多角形,具有明显细胞质颗粒,但可能存在非典型形式,包括梭形细胞、多叶细胞和异色粒状成纤维细胞样细胞(图33.1)。
系统性和更具侵袭性的肥大细胞疾病更常表现出非典型的细胞形态学特征。
骨髓
骨髓活检显示纤维组织细胞基质内多个界限清晰的肥大细胞灶,多位于血管周围和/或小梁旁(图32.2)。
肥大细胞也可弥漫性浸润骨髓,取代了骨髓成分,导致全血细胞减少。
肥大细胞表现出细胞异型性,包括具有圆形、卵圆形或不规则细胞核和丰富的嗜酸性细胞质的大梭形细胞。
一些病例可能显示肥大细胞比正常(良性)肥大细胞小,或显示单核细胞样形态。
肥大细胞常伴有多种细胞浸润,包括淋巴细胞、组织细胞、嗜酸性粒细胞、中性粒细胞、内皮细胞和成纤维细胞。
在ISM BM中,活检显示散在梭形肥大细胞(异常表型和KIT突变有助于确认)。
少见的是以肥大细胞为主,仅伴少量淋巴细胞和嗜酸性粒细胞。
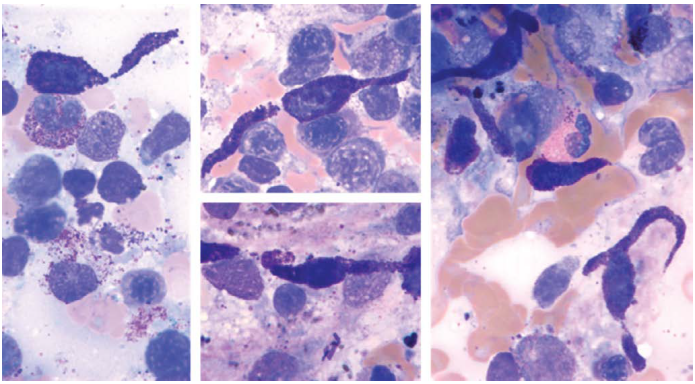
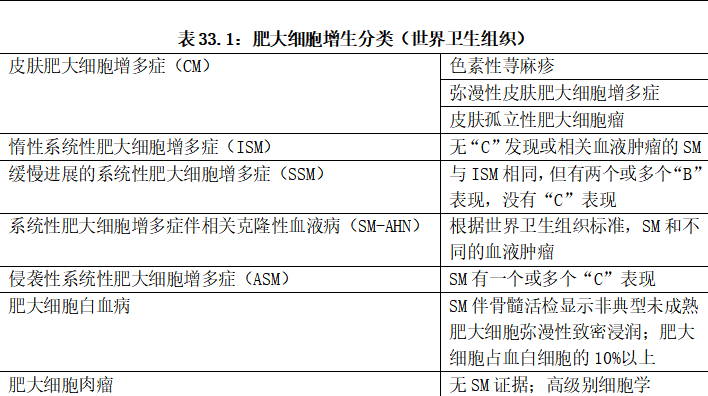
图33.1肥大细胞增多症细胞学检查(系统性肥大细胞增多的骨髓涂片):存在大量梭形肥大细胞,具有深染细胞质颗粒。
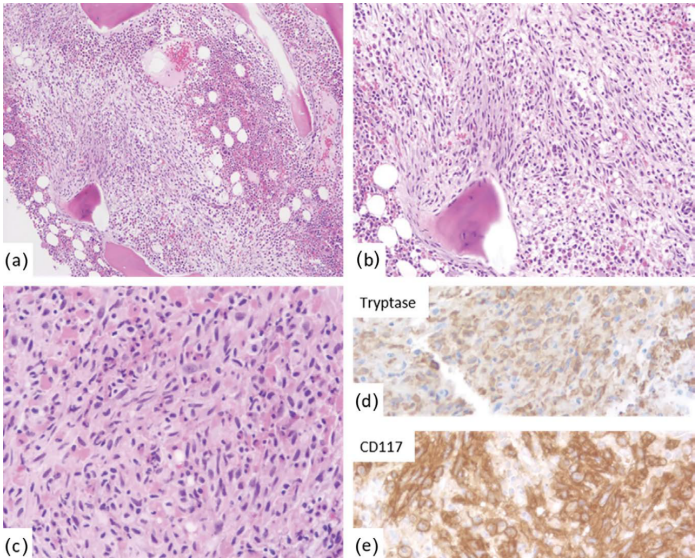
图33.2肥大细胞增多症组织学。(a-c)系统性肥大细胞增多症骨髓活检。大片非典型梭形细胞,胞质淡染透亮。(d-e)免疫组化:肥大细胞类胰蛋白酶(d)和CD117(e)阳性。
系统性肥大细胞增多症伴相关克隆性血液病
SM可能与其他(非肥大细胞)造血肿瘤相关,如AML(图33.3)、MDS(图33.4和33.5)、恶性淋巴瘤、浆细胞肿瘤、MPN、混合MDS/MPN肿瘤,如CMML和MDS/MPN,伴有环形铁粒幼细胞和血小板增多症(MDS/MPNRS-T)。
这两种肿瘤必须符合世界卫生组织规定的诊断标准。
在SM-AHN中,血液肿瘤可在SM之前、之后或同时诊断。
这类病例的报告频率变化很大,占所有SM病例的5%~40%,大多数病例(80~90%)为髓系肿瘤。
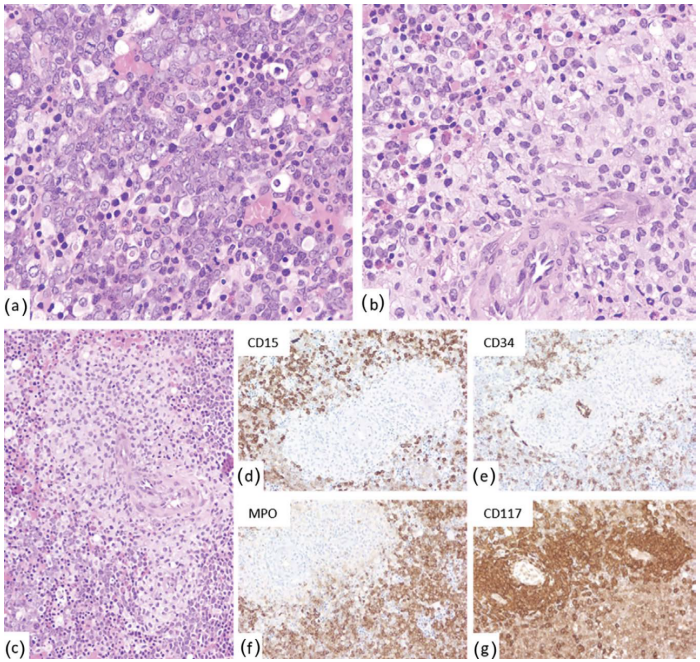
图33.3急性髓系白血病和全身性肥大细胞疾病-骨髓(BM)。(a)以母细胞为主的BM区。(b)另一个有大量肥大细胞的区域。(c)低倍镜显示肥大细胞(血管周围聚集)和母细胞(与免疫组织化学染色比较)。(d-g)免疫组织化学:髓母细胞CD15(d)、CD34(e)、MPO(f)和CD117阳性(弱表达,g)。肥大细胞CD117(g)强阳性。
隐性SM
在罕见的伴有KIT突变的SM病例中,BM活检在H&E染色中不明显,没有非典型肥大细胞聚集,只有通过CD117或肥大细胞类胰蛋白酶的免疫组化染色,才能识别不易察觉的间质肥大细胞浸润,其中大部分是散在单个肥大细胞
由于这种间质模式对SM不是特异性的,并且更常见于反应性肥大细胞增生,因此综合BM形态学分析(包括肥大细胞的细胞学形态)、KIT突变、BCR-ABL1融合、PDGFRA/B、JAK2/CALR/MPL突变、流式细胞术(FC)免疫表型、淋巴结和皮肤情况是最终亚分类所必需的(以区分克隆性肥大细胞过程和反应性变化。
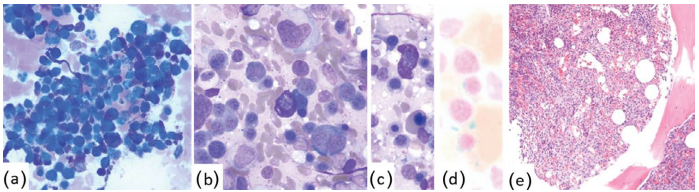
图33.4系统性肥大细胞增多症和骨髓增生异常综合征(MDS伴环状成铁细胞和单系发育不良,MDS-RS-SLD)。
(a)涂片显示肥大细胞簇。(b-c)高倍镜显示具有红细胞生成障碍的红系前体和肥大细胞。(d)环状成铁细胞铁染色。(e)组织学切片显示骨髓细胞过多,有肥大细胞团。
淋巴结
肥大细胞增多症常累及淋巴结和脾脏。在SM累及的淋巴结中(图33.6和33.7),肥大细胞可能形成不明显的簇或明显的浸润,取代正常的淋巴结结构。通常,浸润仅限于类似T细胞淋巴瘤的副皮质区。在由肥大细胞取代滤泡的情况下,模式可能类似于滤泡淋巴瘤(FL)或滤泡增生。细胞质丰富、淡染或透亮,颗粒细小,边界清晰。圆形细胞核通常位于中央。肥大细胞浸润常伴有嗜酸性粒细胞。
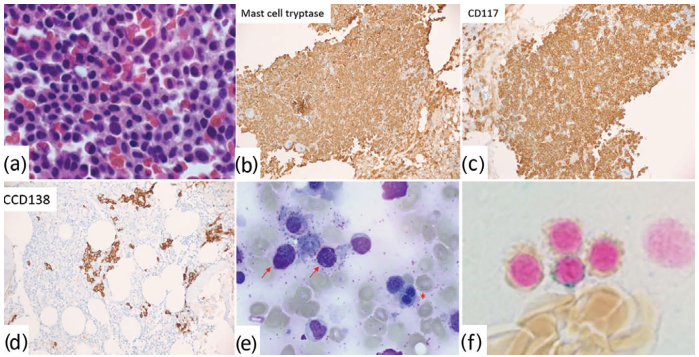
图33.5系统性肥大细胞增多症伴骨髓增生异常综合征(MDS伴环状成铁细胞和单系发育不良;MDS-RS-SLD)和意义不明的单克隆丙种球蛋白病(MGUS)。活检(a)显示骨髓细胞增生,伴有非典型肥大细胞。肥大细胞类胰蛋白酶(b)和CD117(c)阳性。CD138免疫染色显示浆细胞成簇(d),通过流式细胞术分析,其为单一型。涂片(e-f)显示肥大细胞(箭头)和红细胞生成障碍,伴有双核和核间桥接(e,*)和环形铁粒幼细胞(f;铁染色)。
脾脏
SM通常累及脾脏。它通常与局灶或弥漫性纤维化有关。白髓和红髓都可能累及。SM病变可累及脾脏的小梁旁(92%)、滤泡旁(69%)、滤泡(15%)和弥漫性红髓(8%)。
皮肤
大多数SM患者都存在称为UP的特征性皮肤病变,但临床表现可能从瘙痒皮疹到不明原因的昏倒和猝死。斑丘疹CM/UP可进一步细分为多见于成人的单一型和多见于儿童的多形性。大多数SM患者表现为UP。弥漫性CM可累及全身皮肤,最严重的累及躯干、头部和头皮。可在出生时或婴儿早期出现,并可能持续到成年。皮肤肥大细胞瘤通常在出生时出现。皮肤受累表现为圆形或梭形肥大细胞数量增加,个别散在或成簇,并倾向于真皮上部、皮肤附件和血管周围区。
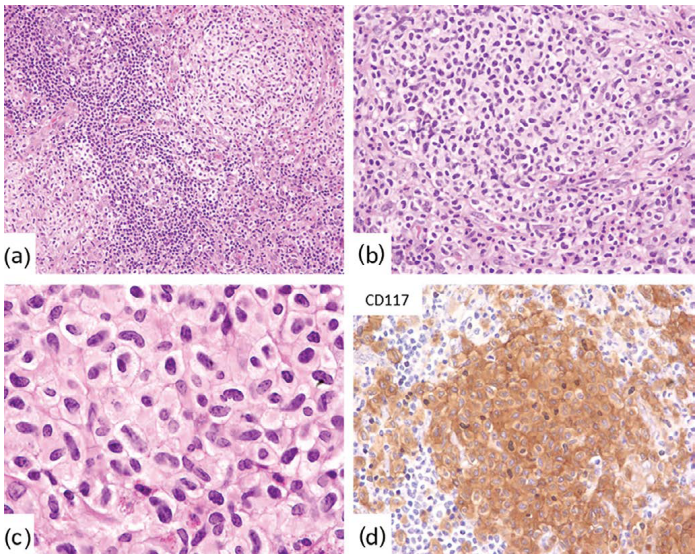
图33.6肥大细胞增多症-淋巴结。(a-c)系统性肥大细胞增多症淋巴结组织切片显示,具有拉长且通常不规则细胞核的透明细胞黏附成簇。肥大细胞CD117(d)强阳性。
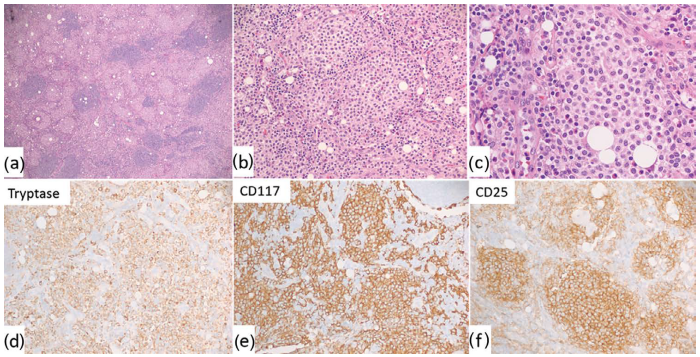
图33.7系统性肥大细胞增多症(淋巴结)。(a-c)组织学(低倍、中倍和高倍)。可见具有透亮细胞质的非典型肥大细胞片状分布。(d-f)免疫组化。肥大细胞类胰蛋白酶(d)、CD117(e)和CD25(f)阳性。
免疫表型
建议在所有疑似病例中使用抗类胰蛋白酶、CD117和CD25的抗体。由于大多数SM病例BM浸润程度非常低,肥大细胞类胰蛋白酶和抗CD117对于肥大细胞筛选和定量非常重要,尤其是对于检测甚至是小的密集浸润,作为肥大细胞增多症的唯一主要诊断标准。肥大细胞表达CD25被定义为次要诊断标准,通常仅在肥大细胞增多症中可见(图33.8),而在反应性肥大细胞增生中不表达。肿瘤性肥大细胞表达CD2、CD25、CD43、CD45、CD68、CD117和肥大细胞类胰蛋白酶。正常(良性)肥大细胞不表达CD2和CD25。肥大细胞表达CD30常与ASM或肥大细胞白血病相关,但在SM的其他变异型可能较少,包括惰性型。通过FC分析,肥大细胞表现为明亮的CD117+和CD45+细胞,侧面散射增加(图33.9)。
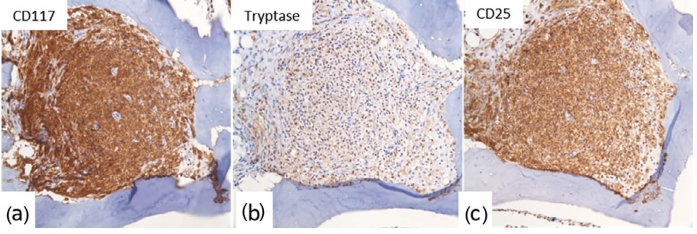
图33.8系统性肥大细胞增多症-免疫组织化学。肥大细胞CD117(a)、肥大细胞类胰蛋白酶(b)和CD25(c)阳性。
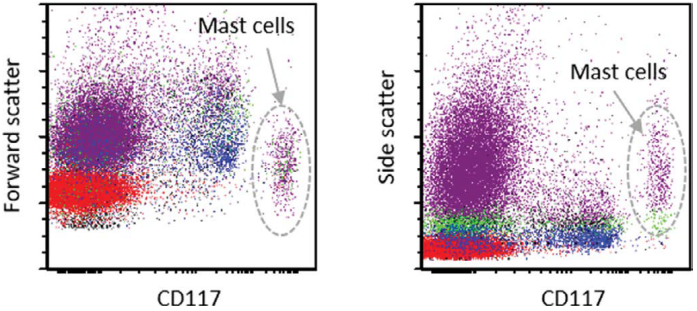
图33.9肥大细胞疾病-流式细胞术分析。肥大细胞通过增加前向和侧向散射以及CD117的明亮表达来鉴定。
遗传学特征
在常规细胞遗传学中,约35-40%的患者骨髓细胞中存在染色体异常克隆,包括与其他血液肿瘤中观察到的相似的克隆。描述了以下染色体异常:del(5q)、del(7q)、del(11q)、del(20q)、−Y、+8、+14。KIT受体酪氨酸激酶基因中的激活密码子816突变(D816V)导致c-KIT受体失活,这在大多数患者中存在。与嗜酸性粒细胞增多症相关的SM病例存在血小板衍生生长因子受体α(PDGFRA)的激活突变。检测密码子816 KIT突变是SM的次要诊断标准。诊断SM需要在存在主要标准(骨髓活检中存在15个或更多细胞的多灶性肥大细胞簇)的情况下证明一个次要标准(KIT D816V突变)。在大多数病例中,SM的诊断可以通过BM活检的形态学评估来确定。需要结合细胞遗传学、FC免疫表型和其他相关临床信息对BM进行分析,以排除伴随的血液系统恶性肿瘤。
【肥大细胞增多症的鉴别诊断】
鉴别诊断包括:
•反应性肥大细胞增多症(肥大细胞增生)
•PDGFRA和PDGFRB重排的MPN
•BCR-ABL1阴性MPN
•MDS
•与肥大细胞增多相关的淋巴瘤(尤其是淋巴浆细胞淋巴瘤)
•外周T细胞淋巴瘤,特别是血管免疫母细胞T细胞淋巴瘤(AITL)
•滤泡性淋巴瘤
•卡波西肉瘤
•毛细胞白血病(HCL)
•伴SM的造血肿瘤(SM-AHN)
•CEL和其他与显著嗜酸性粒细胞增多相关的疾病
•慢性和急性嗜碱性白血病
基于肥大细胞激活综合征临床表现的鉴别诊断
出现一系列症状的患者,包括潮红、腹痛、腹泻、不明原因晕厥和典型UP病变,应怀疑为肥大细胞增多症。鉴别诊断肥大细胞增多症的三个最重要的情况是类癌综合征、VIPoma(产生血管活性肠多肽的肿瘤)和Zollinger-Ellison综合征。与SM(系统性肥大细胞疾病)一样,每一种情况都会导致腹泻、腹痛和某种程度的吸收不良。
BM中基于形态学的鉴别诊断
SM或SM-AHN的诊断基于世界卫生组织现行标准。在无皮肤受累的情况下,SM的诊断可能具有挑战性,尤其是在具有低肥大细胞负荷的ISM患者中,称为孤立性BM肥大细胞增多症。鉴别诊断包括AITL、经典霍奇金淋巴瘤(cHL)、原发性骨髓纤维化和肉芽肿性炎症。伴随淋巴瘤(如LPL/Waldenström巨球蛋白血症[WM])或HCL的肥大细胞散布在淋巴浸润内或周围,不形成明显的聚集。肥大细胞增生代表肥大细胞的反应性增加,肥大细胞不表现出细胞学或免疫表型异常。肥大细胞呈圆形,具有丰富的异染颗粒。它们单独散在,而非呈簇分布。与肥大细胞增生相反,ISM和孤立的BM肥大细胞增多,梭形肥大细胞数量增加,表现出CD25表达的非典型免疫表型,其倾向于形成(至少局部)小的致密聚集。KIT突变的存在证实了肥大细胞浸润的肿瘤性质。
淋巴结中基于形态学的鉴别诊断
所累及的淋巴结散在的肥大细胞常见于其他恶性肿瘤(如cHL、LPL和反应性改变(淋巴结炎)。根据浸润的肥大细胞呈透亮或单核细胞样外观,鉴别诊断包括转移性肿瘤或淋巴结边缘区淋巴瘤。透亮细胞与嗜酸性粒细胞、血管和组织细胞混合存在可能类似于AITL。偶尔有肥大细胞浸润滤泡形成结节状的病例,需要与滤泡性淋巴瘤(FL)进行鉴别诊断。扩大免疫组化套餐标记物有助于正确的诊断,包括B细胞和T细胞标记物、CD30、CD117和肥大细胞类胰蛋白酶。
皮肤中基于形态学的鉴别诊断
SM累及皮肤的肥大细胞数量高于正常皮肤。肥大细胞通常表现出细胞异型性或异常表型(CD2和/或CD25表达)。在皮肤中,鉴别诊断包括肥大细胞增生和肥大细胞增多的淋巴瘤。由于肿瘤性嗜碱性粒细胞免疫组化可检测到表达类胰蛋白酶,因此区分嗜碱性粒细胞与肥大细胞可能具有挑战性。
脾脏中基于形态学的鉴别诊断
脾脏中的肥大通常模仿(或伴随)其他疾病,如T细胞淋巴瘤,特别是AITL、FL、cHL、卡波西肉瘤、肉芽肿、HCL和其他MPN。与扩大的免疫表型标志物、临床和实验室数据、骨髓形态学发现、先前诊断和/或基因检测的相关性有助于确认(或排除)脾脏中的肥大细胞疾病及其亚类。
基于免疫表型的鉴别诊断
肿瘤性肥大细胞类胰蛋白酶和CD117呈阳性,通常表现出CD2、CD25和CD30的异常表达。SM中转化的肥大细胞对各种其他造血抗原的异常表达对于正确诊断来说并不重要,但可能导致除肥大细胞增多症以外的血液肿瘤的误诊。它们包括骨髓单核细胞标志物(CD14、CD33、CD61、CD63和CD68)、淋巴标志物(CD2、CD9、CD25、CD26、CD30、CD52和CD79a)、NK细胞相关抗原CD57和树突状细胞相关抗原(CD35、CD123)。
CD117表达
除肥大细胞外,CD117在AML和部分浆细胞骨髓瘤(PCM)中的母细胞中表达。类胰蛋白酶表达胰蛋白酶的表达对肥大细胞不是特异的。它可能见于肿瘤性嗜碱性粒细胞(慢性粒细胞白血病[CML]、慢性嗜碱性白血病、急性嗜碱性粒白血病)和一些AML中的母细胞。慢性嗜碱性白血病是一种非常罕见的MPN,通常表现为先前存在的慢性髓性白血病的继发性“嗜碱性危象”。慢性和急性嗜碱性白血病是罕见的,后者主要发展为慢性粒细胞白血病的爆发危机。由于肿瘤性嗜碱性细胞表达类胰蛋白酶,嗜碱性细胞与肥大细胞的区分依赖于细胞形态学和CD117表达(嗜碱性细胞总是CD117-)。
CD30表达
CD30在不同类型肥大细胞疾病中可能是阳性的,但在ASM和肥大细胞白血病中常是强阳性表达。CD30在cHL、间变性大细胞淋巴瘤(ALCL)、淋巴瘤样丘疹病(LyP)以及其他部分B细胞和T细胞淋巴瘤的肿瘤细胞中表达。
【肥大细胞白血病】
肥大细胞白血病(图33.10)是一种罕见的ASM,占所有肥大细胞增多症的<1%。它可能是新发或继发于以前的肥大细胞增多症。诊断基于骨髓中存在≥20%的非典型肥大细胞或血液中存在≥10%的非典型肥大;然而,经常会遇到一种白细胞缺乏型,其中循环肥大细胞的数量<10%[3]。肥大细胞通常分化较差,有核仁、染色质细腻和双裂核,形态上类似于其他未成熟的单核细胞。
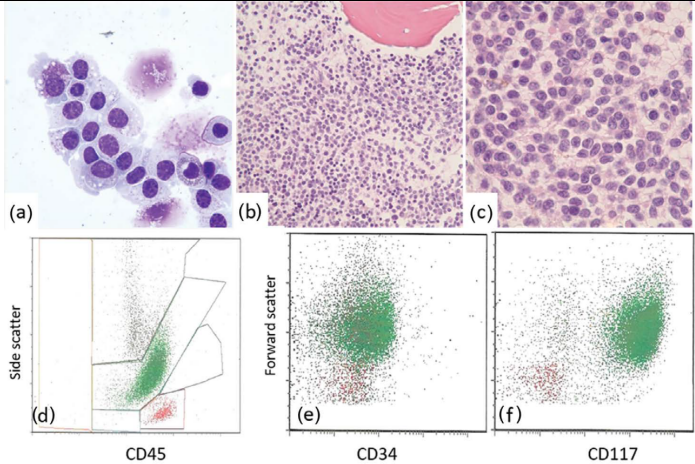
图33.10肥大细胞白血病(患者,女,42岁)。骨髓几乎完全被未成熟的肥大细胞取代(a,骨髓涂片;b-c,骨髓活检)。流式细胞仪分析显示,侧散和明亮的CD45略有增加(d;在淋巴细胞上方的“单核细胞”门中放置以绿色圆点表示的肿瘤细胞,显示为红色圆点)。CD34阴性(e),CD117强阳性(f)。
CD45和CD117阳性,尽管CD117的表达可能比SM中的表达更弱。一些病例还可能表达CD30。此外,与肥大细胞增多症相比,肥大细胞白血病中CD2和CD25的表达频率较低。在Georgin Lavialle等人报道的一系列研究中,分别有25%和48%的病例未发现CD25和CD2的表达[3]。约1/3的病例为CD2/CD25双阴性。与SM一样,在KIT D816V阳性(66%)的肥大细胞白血病患者中CD2和CD25阳性频率高于KIT D816V阴性(25%)患者。由于治疗反应差导致预后不佳;中位生存时间<6个月。

























共0条评论