[导读] 译者:慧海拾穗
往期回顾:
分子时代儿童肾肿瘤的最新研究进展(1)
【易位肾细胞癌】
①简介
儿童肾细胞癌(RCC)不常见,占肾肿瘤的不到5%。
大多数病例属于世界卫生组织定义的小眼相关转录因子(MiT)易位RCC(tRCC)家族,涉及MiT转录因子家族基因的融合谱不断增加(框4)。

②大体和镜下特征
最早描述和最常见的易位涉及染色体Xp11位点的TFE3基因,包括与17号染色体上的ASPSCR1(以前称为ASPL)和1号染色体上PRCC的融合。
ASPSCR1融合与腺泡状软组织肉瘤(ASPS)中的融合相同,但在tRCC中通常为平衡易位,在ASPS中为不平衡易位。
ASPSCR1-TFE3融合病例以假乳头状至器官样结构为特征,伴有纤细的纤维血管分隔和沙砾体样钙化。细胞可能是非黏性的,导致腺泡型。肿瘤细胞有丰富的透明至细颗粒胞质,可能是嗜酸性细胞。细胞核不规则,核染色质空泡状、核仁明显。核分裂象少见,但血管侵犯常见。
PRCC-TFE3病例更可能具有巢状至腺泡型,细胞质透明至嗜酸性。细胞核形态与ASPSCR1融合肿瘤相似,血管浸润不太常见。
这两种基因变异都是无包膜肿瘤。这两种融合亚型的形态广泛重叠,也可能与RCC的其他亚型重叠,因此仅形态不能预测易位伴侣(图5)。
一组不太常见但特征明确的tRCC包含11号染色体上的MALAT1(以前称alpha)与6号染色体上TFEB的融合。
TFEB-MALAT1病例具有更实性的巢状生长模式,典型病例被描述为双相,上皮样肿瘤细胞具有丰富的嗜酸性颗粒或透明胞质和细胞核,与TFE3重排肿瘤相似,较小的细胞染色质致密,聚集在透明变基底膜物周围。
同样,这些肿瘤的特征可能与其他类型的RCC显著重叠。
TFE3阳性肿瘤通常表达PAX8、RCC和CD10,并且对细胞角蛋白和组织蛋白酶K呈不同的阳性。
部分病例表达黑素细胞标志物,包括HMB45和melan-A。
相比之下,TFEB阳性肿瘤角蛋白通常为阴性,HMB45、melan-A和组织蛋白酶K通常为阳性。CD10和RCC局灶阳性或阴性。
已经开发了免疫组织化学染色,其利用了各自肿瘤中TFE3和TFEB的过度表达。阳性染色为核染色(见图5),抗体的早期研究显示出非常高的敏感性和特异性。
然而,根据额外的经验,很明显,根据所用的抗体、手动与自动处理、固定时间和其他技术特征,性能可能会有很大差异。

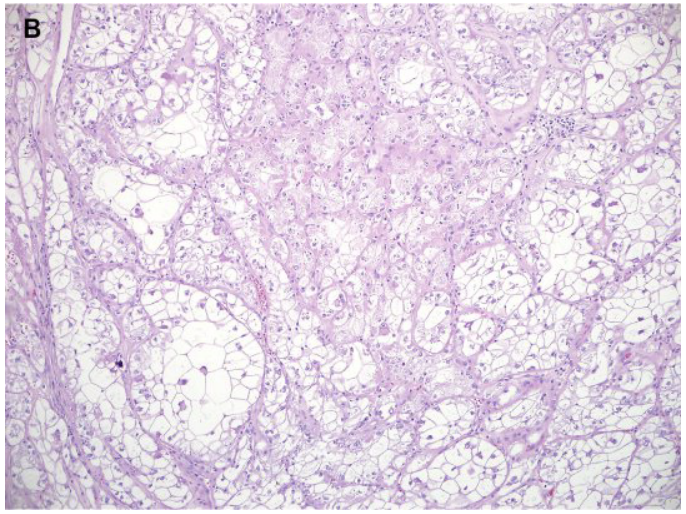
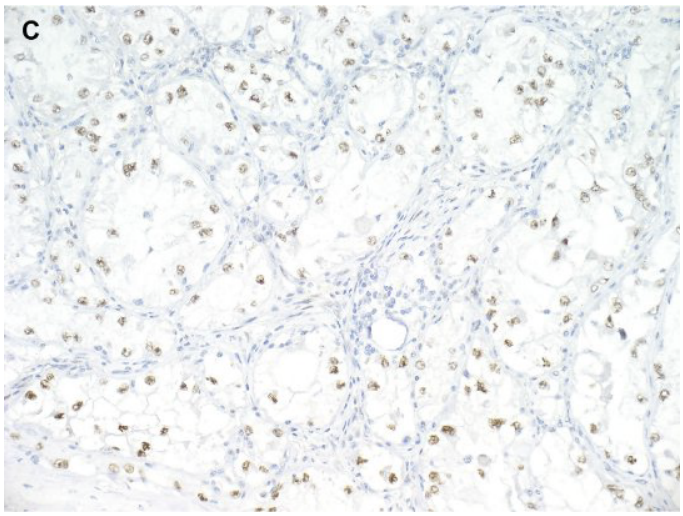
图5.tRCC:(A)TFE3重排RCC,显示乳头状至巢状结构和沙砾体。(B)肿瘤细胞具有大量透明颗粒细胞质。(C)免疫组化显示TFE3肿瘤细胞核阳性染色。
③分子病理学特征与诊断
与许多融合驱动肿瘤一样,NGS的广泛应用扩大了tRCC中已知的融合谱。迄今为止,TFE3至少有19个伙伴,ASPSCR1和PRCC仍然是最常见的基因。
现在甚至包括EWSR1融合病例。
SPFQ(以前的SPF)是第二个最常被描述的伴侣,它可能与间质分化的黑色素性肾和软组织肿瘤的演变类别有关。
TFE3免疫染色、FISH和/或核型分析仍然是最常用的诊断方法;然而,如前所述,免疫染色具有局限性。
此外,ALK融合RCC中报告了核TFE3强阳性,这代表了一类形态非常不同的不相关RCC,TFEB阳性可见于TFEB扩增的RCC,这是一种在成人中可见的侵袭性肿瘤。
最近描述的一些融合是X染色体的反转,包括TFE3与NONO、RBM10和GRIPAP1融合。
由于参与反转的2个基因之间非常接近,TFE3的标准FISH分离探针可能无法产生足够的分裂信号以进行准确解释。
特别是在具有tRCC形态学但TFE3和TFEB免疫染色和FISH阴性的情况下,基于NGS的融合分析可被认为是检测融合的罕见和技术挑战。
④临床特征
从儿童早期到成年后期,RCC的MiT家族分布在各个年龄段。尽管它们在儿童和年轻成人人群中占RCC病例的40%以上,但在成人中占RCC的比例要低得多,接近1%~4%。然而,由于RCC在成人中更为常见,因此在成人中tRCC的数量要高得多。
在30岁以下的患者中,TFE3重排病例约占93%,其余为TFEB重排病例。
大多数病例出现在III或IV期,但即使是淋巴结转移的病例,存活率也超过70%。据报道,在确定性治疗多年后,晚期复发的病例。既往化疗已被确定为环境风险因素,高达15%的患者有相关病史。
【肾透明细胞肉瘤】
①简介
肾透明细胞肉瘤(CCSK)是一种少见的儿童肿瘤,但通常在诊断上具有挑战性。尽管诊断仍然主要基于组织学特征,但在过去5年中,对该肿瘤分子基础的理解迅速发展(框5)。

②临床特征
CCSK约占儿童肾肿瘤的5%,是侵袭性更强的儿童肾肿瘤之一,总生存率约为70%。
在诊断时,肝门淋巴结是最常见的转移部位,而在复发时可以看到骨、肺和腹部转移。也有可能在最初诊断后10年内复发。诊断的中位年龄为3岁,但CCSK可见于婴儿至青少年。
③大体和镜下特征
大体上,CCSK起源于髓质,在诊断时通常很大(图6)。
显微镜下形态多样,经典型为有片状、巢状或索状的肿瘤细胞排列在纤细的所谓的鸡爪样毛细血管周围(见图6)。
瘤细胞核卵圆形至纺锤形,染色质细腻和透亮。核仁不明显。
已经描述了多种模式,包括富于细胞型、微囊型和细胞外基质,从而有可能进行广泛的鉴别诊断。
免疫组化染色显示cyclin D1(见图6)和BCOR阳性,最初是因为基因表达数据而确定的。
Cyclin D1是非特异性的,可见于多种肿瘤,包括尤因肉瘤、神经母细胞瘤和其他圆细胞肉瘤。
BCOR染色也很强且弥散,但在滑膜肉瘤中也可能呈阳性,这可能是要和CCSK鉴别。
最近描述的一种标记物NGFR也非常敏感,但并不完全特异。
BCL2、CD56和TLE1也呈阳性,而PAX8、desmin、CD34和细胞角蛋白通常呈阴性。
④分子病理学特征
20多年前,在CCSK中首次发现了10号染色体长臂和17号染色体短臂之间的重现性易位,后来发现该易位代表了YWHAE和NUTM2B之间的融合。然而,这种融合仅存在于约12%病例中。
最近,大多数融合阴性病例发现存在BCOR基因重现性内部串联重复。
这种内部串联重复发生在基因的最后一个外显子的末端,并且总是在框架内。
这种改变似乎在其他儿童肾肿瘤的大量样本中对CCSK具有特异性,并且与YWHAE-NUTM2B融合相互排斥。
融合阳性和内部串联重复(ITD)阳性病例的组织学和临床特征相似。
有趣的是,BCOR-ITD病例中的基因表达谱显示出与BCOR-CCNB3融合未分化肉瘤的显著重叠。
在未分化圆细胞肉瘤中也报道了罕见的YWAE-NUTM2B融合,这需要进一步阐明未分化的圆形细胞肉瘤和CCSK之间的关系。
在临床病理相似的CCSK肿瘤、未分化圆细胞肉瘤和婴儿原始黏液样间叶性肿瘤患者中发现了类似的BCOR ITD突变。
根据这些关系,可以预期的是,还报告了具有BCOR-CCNB3融合的CCSK病例,并且可能在稍微年长的患者群体中看到。
其他具有这些分子特征的肿瘤现在包括一部分高级别脑肿瘤和子宫肉瘤。
⑤分子病理诊断
CCSK的病理学检查可能因机构资源而异,通常取决于组织学特征。
一些用于免疫组织化学评估的更有用的抗体,如NGFR、细胞周期蛋白D1和BCOR,可能没有广泛的可用性。由于分子改变的可变性,分子后处理可能需要通过多种方式进行测试。
FISH可检测YWHAE重排和BCOR-CCNB3融合,但BCOR-ITD不能通过细胞遗传学或FISH检测。
BCOR ITD是外显子的,可以通过基于DNA和基于RNA的NGS方法检测,但由于其位于最后一个外显子末端,生物信息学分析可能需要额外的步骤。
如果肿瘤需要进行测序,实验室检测这些变化的能力应该得到验证。基于RNA的测序可以检测融合和BCOR ITD,是诊断CCSK的最有效的分子检测。这种重复也可以通过毛细管凝胶电泳等分析区域大小的技术来检测。
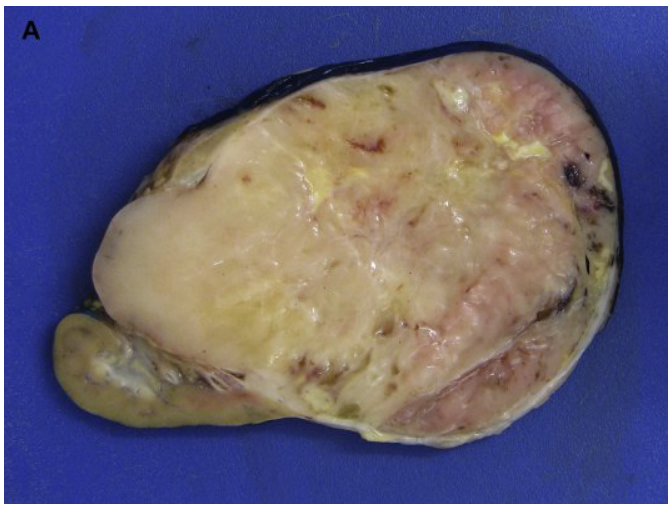
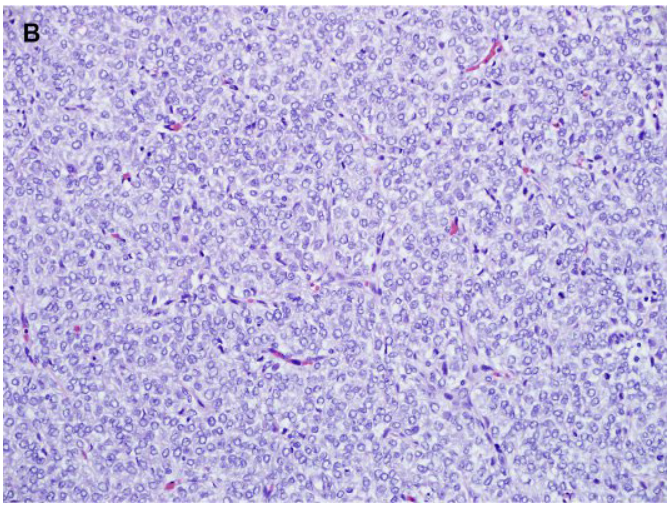
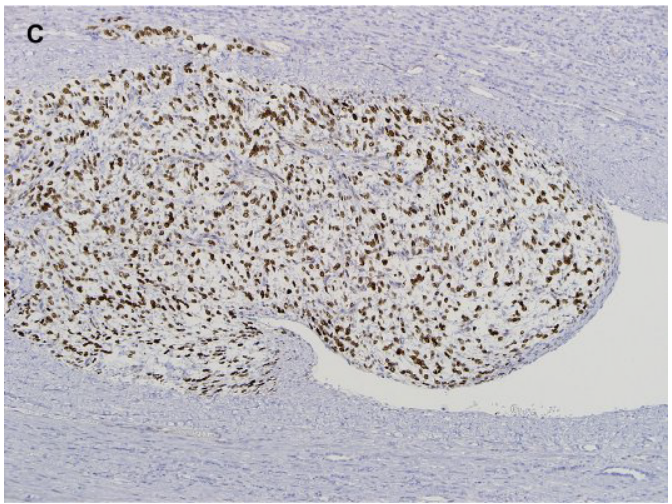
图6.CCSK:(A)伴有坏死和出血区域的大肿瘤。(B)片状小肿瘤细胞,核空泡状,细胞质稀少,背景中有纤细的分支血管。(C)免疫组化显示肾窦血管内的肿瘤细胞核CyclinD1强阳性。
【肾横纹肌样瘤】
①简介
肾横纹肌样瘤是儿童肾肿瘤中最具侵袭性的。尽管SMARCB1突变在横纹肌样瘤中作为致癌驱动因素的作用在文献中得到了很好的描述,但INI1蛋白的功能和下游相互作用现在正在引导研究新的治疗方案(框6)。
框6:肾横纹肌样瘤的分子特征及其临床意义
·分子改变:体细胞或胚系SMARCB1突变;总体上非常低的肿瘤突变负担;
·临床病理特征:与其他部位的横纹肌样瘤的形态学和分子重叠;胚系突变与横纹肌样瘤易感性综合征相关;SMARCB1/INI1-免疫组化核染色缺失是横纹肌样瘤的特征;SMARCB1/INI1在其他基因表观遗传调控中的潜在作用是新治疗策略的目标。
·诊断性分子检测:肿瘤诊断通常由免疫组化确认,无需进行分子检测;胚系突变的鉴定可能涉及肿瘤和胚系样本的测序;较大的缺失事件或LOH可能需要特定的缺失/复制技术,如微阵列或MLPA。
②临床特征
横纹肌瘤最常见于出生至3岁之间,且通常处于晚期。
在过去的30年中,生存率一直很低,并继续徘徊在20%至25%左右。
年龄增加和在没有转移性疾病的病例完全切除是有利的预后指标,但即使在该人群中生存率仍然很低。
③大体和镜下特征
大体上,横纹肌样瘤通常表现为取代肾脏的巨大肿块(图7)。
镜下,它们的特征是形态单一肿瘤细胞片状分布,瘤细胞核仁明显和核染色质空泡状(图7)。
丰富的嗜酸性细胞质包含由中间丝组成的内含物。
核分裂象较多,轻度到中度多形性。
总体细胞模式可能在上皮样、纺锤状、微囊型或假腺型之间有所不同。
肿瘤表现出对周围肾脏及其他部位的侵袭性。
横纹肌样瘤的标志性免疫组化特征是核SMARCB1/INI1表达缺失,这在正常组织是普遍存在(见图7)。
胞质包涵体波形蛋白强阳性。
上皮标志物,包括广谱角蛋白、EMA和CAM 5.2,在略多于一半的病例中呈阳性。
还报道了肌肉特异性肌动蛋白、CD99、NSE和S100表达不一。
Desmin和CD34通常阴性,MyoD1和myogenin也是阴性。
值得注意的是,少数WT1可能阳性,这可能为这些肿瘤的部分病例的潜在起源细胞提供了线索。
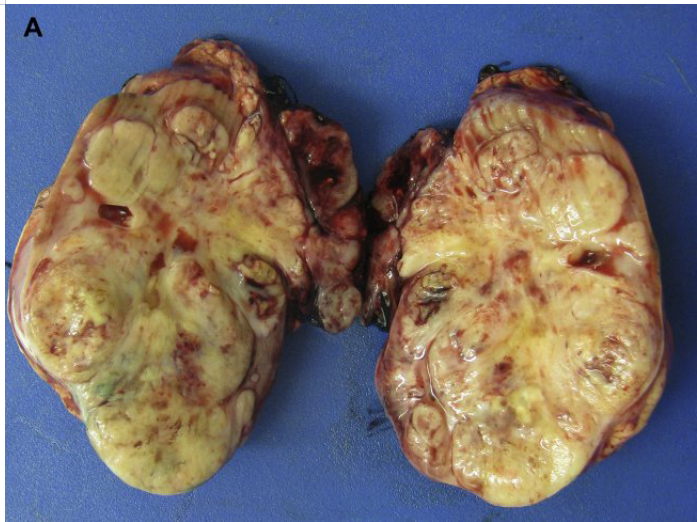
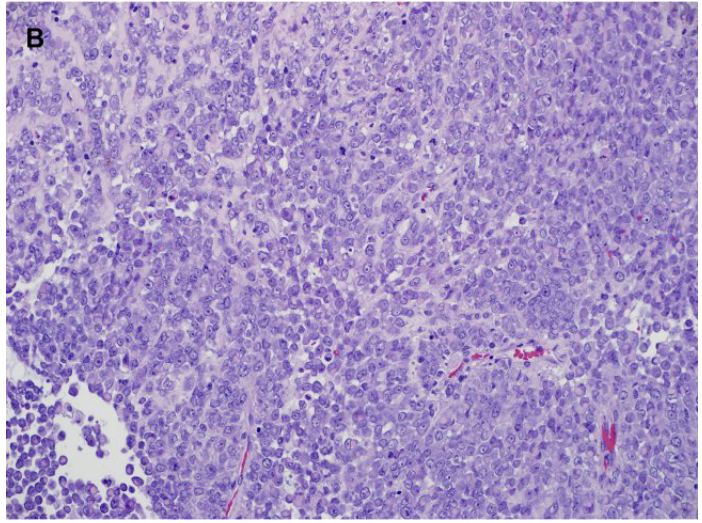
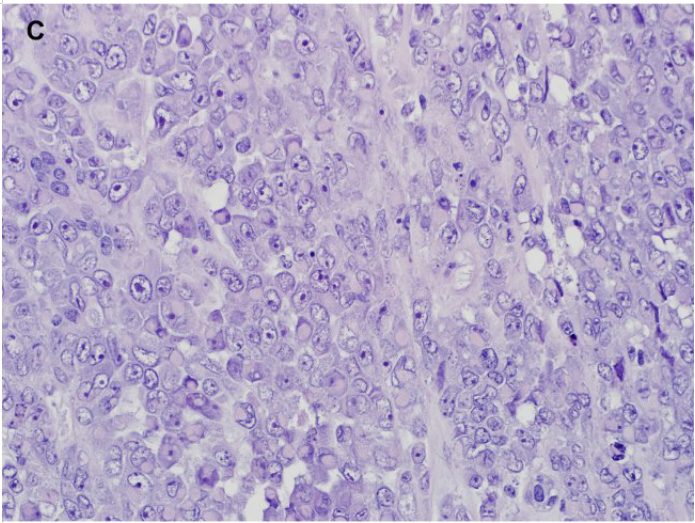
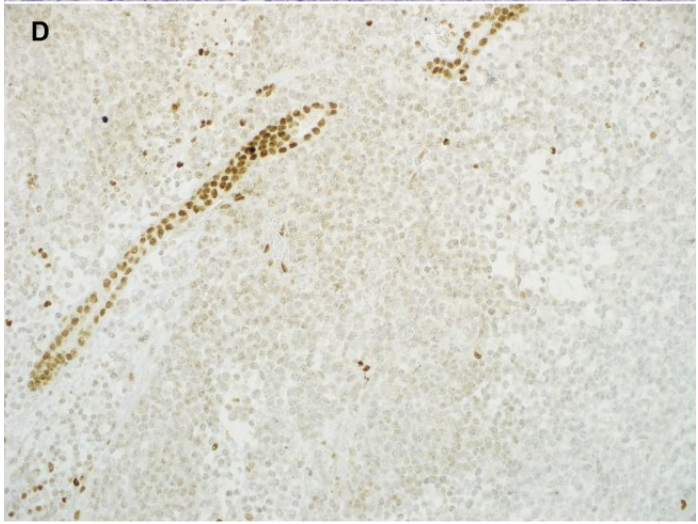
图7.肾横纹肌样瘤:(A)大肿瘤取代肾脏并向肾外延伸。(B)片状不规则的肿瘤细胞,核仁明显。(C)肿瘤细胞具有与中间丝相对应的浅嗜酸性细胞质内包含物。(D)整合酶相互作用因子1(INI1)免疫染色,肿瘤细胞核表达缺失和血管/小管表达保留。
④分子病理学特征与诊断
在多次报道22号染色体长臂缺失后,将常见的重叠区域映射到SMARCB1基因,之前称为BAF47、hSNFS、SNF5和INI1。还发现了其他功能缺失突变,导致肾和肾外横纹肌样瘤中该基因的双等位基因缺失或失活,并认识到SMARCB1作为肿瘤抑制基因的作用。
在一组病例中发现了胚系突变,被描述为1型横纹肌样瘤易感综合征。该综合征与早期表现、双侧原发性肾肿瘤和其他部位的横纹肌样瘤有关。大约1/3患者有潜在的胚系突变,二次打击是22号染色体的大缺失、单体或拷贝中性杂合性缺失。2型横纹肌样瘤易感综合征与SMARCA4基因突变有关,但迄今为止尚未报道有SMARCA4突变的肾横纹肌样瘤病例。
已发表的建议包括对肿瘤组织进行突变和缺失的分子分析,然后对血液中检测到的突变进行筛查,尽管根据使用的测序方法,有些突变可能无法检测到。由于遗传的复杂性,家庭咨询变得更加复杂,一些突变显示出低外显率或可变表达,一些突变表现出受限的性腺嵌合体。受影响家族中的一些患者也可能出现神经鞘瘤病,通常没有横纹肌样瘤,这取决于特定的家族突变。建议对受影响的患者定期进行MRI肿瘤监测。从分子角度来看,横纹肌样瘤是少见有趣的,因为它们常缺乏SMARCB1以外的其他突变事件。
对肿瘤突变负荷的研究表明,横纹肌样瘤是所有癌症类型中肿瘤突变负荷最低的肿瘤之一,这表明SMARCB1及其蛋白几乎是致癌和肿瘤行为的唯一驱动因素。
SMARCB1蛋白是SWI/SNF染色质重塑复合物的一部分,在转录激活和抑制中起着积极作用。
SMARCB1失活通过其在该复合物中的作用以及对其他基因表观遗传调控的后续影响,影响许多关键细胞途径。包括cyclinD1调节的细胞周期进展、SHH、WNT/β-catenin、RB和MYC。INI1和SWI/SNF复合物在组蛋白乙酰化和转录激活中起作用。
该复合物的功能与多梳抑制复合物2(PRC2)相反,后者包括EZH2作为其催化亚基,并参与组蛋白甲基化和转录抑制。SMARCB1失活导致EZH2过表达和组蛋白H3K27三甲基化,导致肿瘤抑制基因的转录沉默。如此多的细胞途径参与了肾和其他部位横纹肌样瘤的发生,导致了对多种靶向治疗的研究,包括EZH2抑制剂和免疫检查点抑制剂。
这些调查仍在进行中,希望能提高这种毁灭性诊断患者的生存率。
参考文献:
[1] Pediatric Renal Tumors Updates in the Molecular Era. Surgical Pathology (2020) 695-718. https://doi.org/10.1016/j.path.2020.08.003.

























共0条评论