[导读] 译者:慧海拾穗
前言
未分化肉瘤—细胞起源和/或分化方向不清楚的肿瘤—通常根据其主要细胞形态(例如,圆形细胞、梭形细胞、多形性)进行细分;虽然方便,但这是公认的不精确的分类,因为许多肿瘤都有重叠的形态。小圆细胞肉瘤是这些未分化肿瘤的一个巨大而异质的亚群。本章重点介绍尤文肉瘤和以前被认为是“尤文样”肉瘤的实体(图14.1A)。尤文肉瘤在分子上被定义为具有RNA结合蛋白FET家族成员(由EWSR1或FUS编码)与转录因子ETS家族成员(E26转化序列[E-26特异性序列])(由FLI1、ERG编码)融合的肿瘤(图14.1B)。另一方面,尤因样肉瘤代表了一组形态上极为异质的重叠肿瘤,缺乏FET-ETS融合。这些肿瘤因其独特的基因驱动因素而越来越受到人们的认可,这些基因驱动因素可能包括,也可能不包括FET成员。重要的是,除了遗传上的差异外,现在已经知道这些差异与临床—也许最终是与治疗有关。因此,诊断性分子亚分类变得越来越必要。
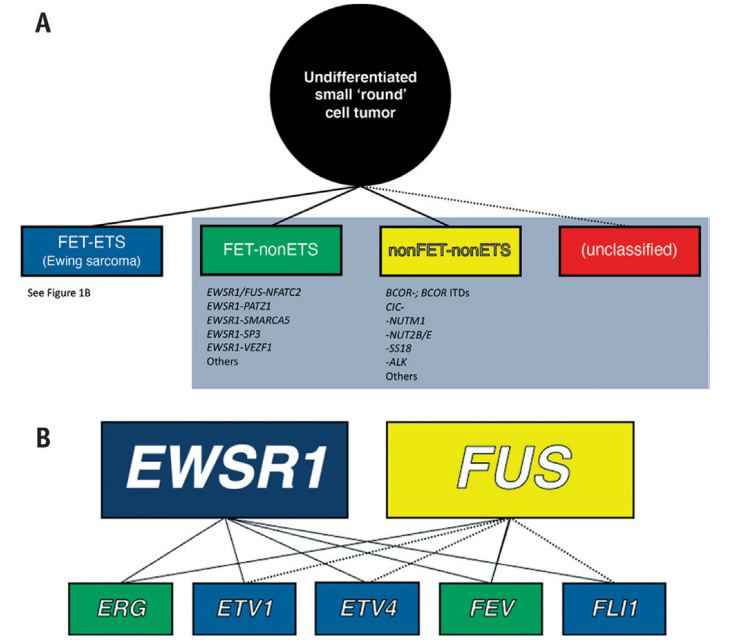
图14.1(A)图示未分化的小“圆形”细胞肉瘤的各种遗传学类型。尤文家族肿瘤被定义为包含RNA结合蛋白FET家族成员(例如,由EWSR1和FUS编码)与转录因子ETS家族成员(如,由ERG、ETV1、ETV4、FEV、FLI1编码)的融合。以前被归类为所谓尤文样肉瘤(灰框)的肿瘤缺乏ETS和/或FET家族成员。(B)图示尤文家族肿瘤中的各种潜在融合基因组合。实线表示已建立的融合基因组合,虚线目前是理论上的。
EWING家族肿瘤
1921年,James Ewing报道了一系列发生在年轻患者的圆细胞肉瘤。他将这些肿瘤描述为片状分布的具有单一形态细胞核的小多面体细胞,并根据他起初对内皮衍生的印象,最初将其称为“弥漫性骨内皮细胞瘤”。随后独立报告了在其他解剖部位出现的相关实体(如Askin瘤、原始神经外胚层肿瘤/周围神经上皮瘤)。然而,直到鉴定出一个共同的t(11;22)(q24;q12)事件(随后显示该事件导致EWSR1-FLI1融合基因),这些肿瘤才有可能合并为“Ewing家族肿瘤”(EFT)。随后在EFT中发现了其他EWSR1融合伙伴;在形态学上相似的病例中,缺乏ETS伴侣或FET伴侣的病例被初步归类为“Ewing样肉瘤”。
【临床特征】
尤因家族肿瘤是一种罕见的侵袭性肉瘤,主要发生在儿童和年轻人身上。包括老年人在内的年龄较大患者偶尔会发生该肿瘤。这些肿瘤几乎发生在任何解剖部位,可能累及骨骼、软组织或内脏。据报道,他们男性稍微多见,一些种族群体似乎比其他种族群体受影响更大(例如,欧洲血统)。自然,临床表现因疾病的解剖部位而异,而症状往往是非特异性的,如疼痛性肿块或部分骨肿瘤伴病理性骨折。
【放射学特征】
在骨骼中,常规X线片可能显示渗透性生长。由于肿瘤细胞容易浸润Haversian和Volkmann管,因此在皮质破坏的放射学证据之前,可能存在广泛的软组织受累。骨膜的反复扩张会导致多层骨膜反应-所谓的“洋葱皮”外观。影像学模式通常是互补的;例如,CT和MRI有助于评估骨和软组织受累的程度,而前者在突出皮质破坏方面也很有用。在软组织中,影像学发现往往是非特异性的。
【病理学特征】
(1)大体表现
未经治疗的标本通常柔软易碎,呈白灰色;多少不等的出血和坏死。大多数切除标本都是经过了新辅助治疗的。据报道,肿瘤的范围从<1cm到>20cm。
(2)镜下表现
肿瘤通常呈浸润性,由具有分叶状模式的小圆细胞片状组成(图14.2)。
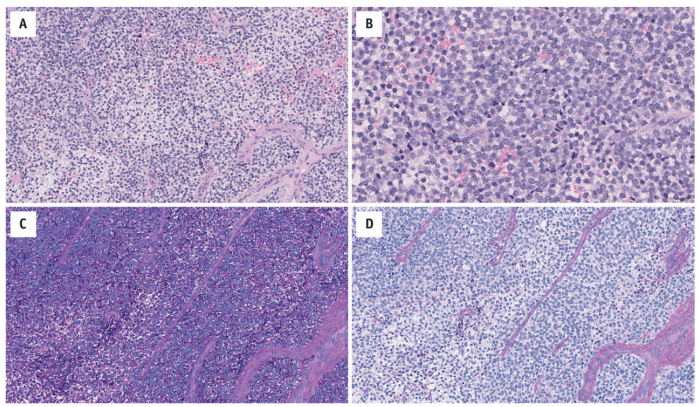
图14.2显示传统形态的Ewing家族肿瘤(通过RNA-seq鉴定的EWSR1-FLI1融合基因)。(A) 片状小圆细胞,胞质透明至淡嗜酸性,具有模糊的小叶结构。核圆形、单一形态。肿瘤由一个纤细的薄壁脉管系统支撑。(B)细胞质稀少,细胞边界模糊。细胞核有精细的斑点染色质和小核仁。使用PAS染色突出显示胞质内糖原的存在:(C)有淀粉酶,(D)无淀粉酶。
细胞质稀少,细胞边界模糊。它通常是淡染,嗜酸性-双色透明的;胞质内糖原通常可以通过PAS染色来显示。细胞核为圆形-卵圆形,形态单一,染色质均匀分散;核分裂象多少不等。细胞间通常有一个纤细的薄壁脉管系统。坏死常见;它可以是地图状的和/或局限于散在的退化细胞。已经报道了一系列的形态,例如:在结构上,肿瘤可能包含菊形团和/或假菊形团(“PNET”),或玻璃样变基质;可能是梭形或大(“非典型”)细胞;并且,特别是在头颈部,可存在上皮分化(“釉质瘤样/造釉细胞瘤样?”)(图14.3)。
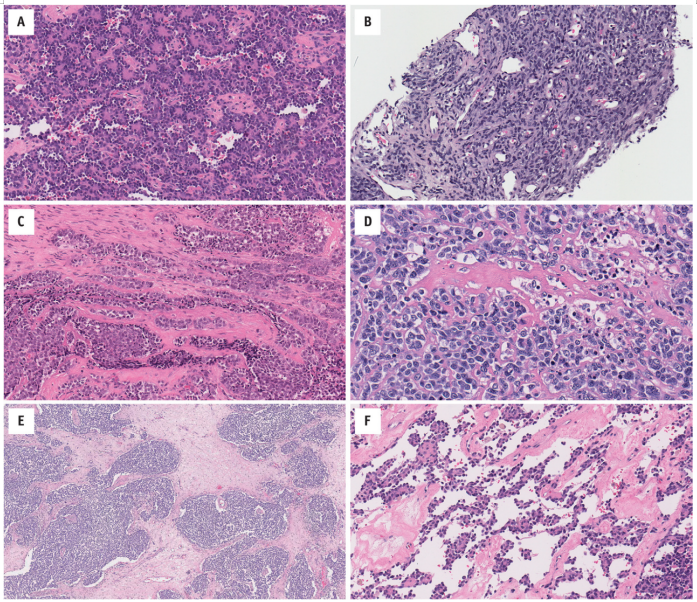
图14.3 Ewing家族肿瘤偶尔包含其他形态:(A)菊形团和假菊形团(外周神经外胚层肿瘤;EWSR1-FLI1融合基因);(B)大细胞(非典型Ewing肉瘤;EWSR1-ERG融合基因);和(C)上皮分化(“釉质瘤样/造釉细胞瘤样?”;EWSR1-FLI1融合基因)。它们可能很少有:(D)骨样基质类似小细胞骨肉瘤(EWSR1-FLI1融合基因);(E)类似促结缔组织增生性小圆细胞肿瘤的促结缔组织细胞间质(EWSR1-FLI1融合基因);和(F)模仿血管肉瘤的假血管腔隙(EWSR1-FLI1融合基因)。
【辅助检查】
(1)免疫组化
EFT没有特异的免疫组织化学标记。大多数病例CD99(MIC2)弥漫性膜表达和NKX2.2核染色。大多数肿瘤也显示FLI1强核染色,而ERG融合的病例具有弥漫性核ERG表达。约20%~30%的病例显示局灶/斑片状角蛋白表达。Syn、S100和desmin染色不太常见(图14.4)。
(2)分子病理学
90%以上的EFT含有源自t(11;22)(q24;q12)的EWSR1-FLI1融合基因。约5%的病例具有源自t(21;22)(q22;q12)的EWSR1-ERG融合基因。少数含有罕见的EWSR1融合伴侣,包括ETV1、ETV4和FEV(图14.1)。FUS可替代EWSR1;有关于FUS-ERG和FUS-FEV融合产物以及其他组合的报道。这些融合基因目前被认为是EFT的疾病定义,因为它们在其他肿瘤类型中没有发现。尽管许多这些融合可以使用常规细胞遗传学来鉴定,但大多数实验室目前使用荧光原位杂交(FISH)或逆转录酶聚合酶链反应(RT-PCR)。鉴于潜在融合基因和潜在断点的广泛性,更不用说鉴别诊断中的其他融合相关肿瘤,许多诊断实验室已经开始向诊断性RNA测序(RNA-seq)迈进。
【鉴别诊断】
EFT的鉴别诊断范围很广,包括其他未分化圆细胞肉瘤(如CIC相关、BCOR相关)、差分化滑膜肉瘤、间叶性软骨肉瘤和促结缔组织增生性小圆细胞肿瘤等。CIC和BCOR相关肉瘤可能表现为膜CD99染色;然而,CIC相关肿瘤一般具有核WT1表达,而BCOR相关肿瘤通常具有核SATB2表达。差分化滑膜肉瘤虽然CD99也呈阳性,但TLE1通常呈阳性,这在EFT中很少见;此外,通过充分取材,通常可以识别出更多的原型梭形细胞区域。尽管间叶性软骨肉瘤可以表达CD99,同样通过充分取材,通常可以根据软骨样基质的存在来区分。许多淋巴瘤-特别是急性淋巴细胞性、急性髓细胞性和间变性大细胞-可能表达CD99,但通常可以使用广泛的造血淋巴免疫组化套餐进行适当区分。
CIC相关肉瘤
1996年,Richkind等人描述了一种具有t(4;19)(q35;q13.1)事件的原始小细胞肿瘤。
Kawamura Saito等人报道了两个与t(4;19)(q35;q13)形态学相似的病例,进一步表明这导致了CIC-DUX4融合基因产物。这些肿瘤被初步分类为Ewing样肉瘤,随着下一代测序的出现,许多其他疾病定义的易位已在未分化的圆细胞肉瘤中被发现,其中包括具有BCOR-CCNB3融合基因的肿瘤。这些肿瘤的遗传特征不同于EFT,从而证明了它们的临床区别。
【临床特征】
CIC相关肉瘤是一种罕见且高度侵袭性的肿瘤。他们以年轻人为主,但从儿童到老年人均可发生。这些肿瘤主要发生在深部软组织;然而,它们可能发生浅表部位,或者发生于骨骼或内脏。尽管最初的研究相互矛盾,但总体而言,似乎男性稍微多见。
【放射学特征】
影像学表现往往是非特异性的。MRI T1加权图像产生中间信号,T2加权图像具有高信号强度,具有异质性对比增强。
【病理学特征】
(1)大体表现
未治疗标本多为分叶状、肉质和灰白色;他们有不同程度的出血和坏死。据报道,它们的大小从0.7厘米到20厘米以上。
(2)镜下表现
肿瘤通常浸润性生长,由片状分布的小到中等大小圆形-卵圆形细胞组成(图14.5)。细胞质淡染,嗜酸性-嗜双色,细胞边界模糊;偶尔也会出现透明富含糖原的液泡。细胞核呈圆形卵圆形,具有轻微的多形性,染色质粗,小核仁明显;核分裂象常见。可能存在少量黏液样间质和/或纤细的纤维间隔。地图样坏死常见。细胞呈索状或网状排列不常见。少数细胞可能是上皮样-横纹肌样-纺锤形。
【辅助检查】
(1)免疫组化
CIC相关肉瘤没有特异性免疫组织化学标记。肿瘤通常具有WT1和FLI-1的弥漫性核染色。CD99可能表现为弥漫或斑片状膜表达;S100、结蛋白、ERG、角蛋白和EMA可能局灶表达。据报道,这些肿瘤不表达TLE1。
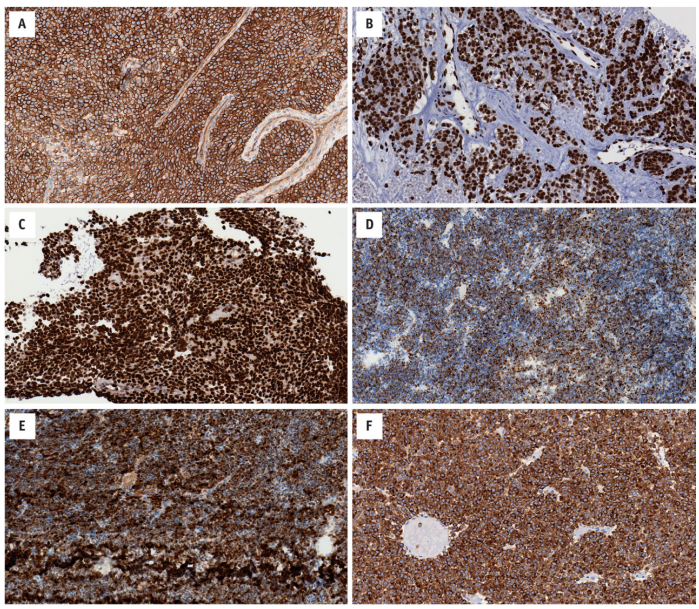
图14.4免疫组化在Ewing家族肿瘤中的作用通常有限且非特异性。(A)这些肿瘤通常细胞膜表达CD99。(B)具有FLI1融合伴侣的肿瘤表达FLI1(EWSR1-FLI1基因)。(C)ERG融合伴侣的肿瘤表达ERG(FUS-ERG融合基因)。有时肿瘤可能包含其他标志物的弥漫表达,例如(D)角蛋白(EWSR1-FLI1融合基因)、(E)S100(与“D”相同的病例)和(F)Syn(EWSR1-FEV融合基因)。
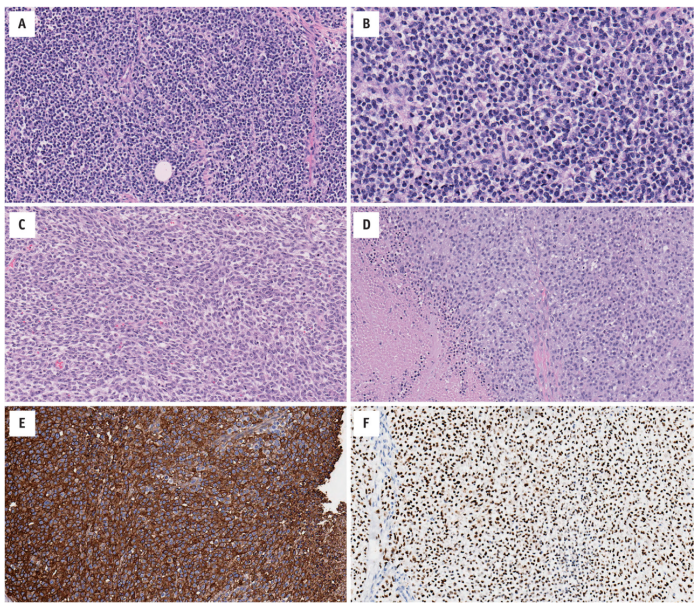
图14.5 CIC相关肉瘤显示相对传统的形态(CIC-DUX4融合基因)。(A)小圆细胞片状分布,胞质淡嗜酸性,模糊小叶状被纤细的纤维分隔。(B)细胞核为圆形-卵圆形,具有轻微的多形性、染色质粗、小核仁明显。(C)束状梭形细胞伴局灶黏液样变。细胞核呈卵圆形,具有活跃的核分裂象(CIC-DUX4L2融合基因)。(D)胖上皮样多边形细胞片状分布,细胞边界模糊。散在多形性和明显的坏死(CIC-DUX4L2融合基因)。与(D)相同病例的免疫组织化学显示(E)CD99膜表达,(F)WT1核表达。
(2)分子病理学
大多数肿瘤的特征是t(4;19)(q35;q13)或t(10;19),分别对应于CIC-DUX4或CIC-DUX4L融合基因。最近还报道了其他CIC伙伴,包括-FOXO4和-NUTM1。其中一些事件可以使用常规细胞遗传学来识别,但大多数实验室目前使用FISH、RT-PCR或RNA-seq。需要注意的是,在使用FISH和RNA-seq的部分病例中报告了假阴性结果;可以通过修改数据分析管道来避免假阴性,以防止对这些事件的意外过滤,或者如果怀疑诊断,使用“grep”命令。
【鉴别诊断】
CIC相关肉瘤的鉴别诊断与EFT相似(见上文)。这些肿瘤与EFT(非典型)和BCOR相关肉瘤有明显的形态学重叠。然而,在大多数病例,弥漫核WT1表达的存在可以鉴别。含有EWSR1-WT1融合基因的促结缔组织增生性小圆细胞肿瘤也需要鉴别;而且,虽然这些肿瘤很少表达WT1,但大多数只能使用靶向该蛋白羧基端的抗体检测。CIC重排的分子确认代表了CIC相关肉瘤的当前诊断金标准;事实上,鉴别诊断中的大多数实体可以使用RNA-seq或相关技术来解决。
【预后和治疗】
许多患者接受常规EFT化疗方案,但组织学反应往往较差,关于最佳治疗仍存在相当大的不确定性。尽管进行了多种形式的治疗,但这些患者的情况明显比EFT患者差。5年总生存率为43%;对于表现为局限性疾病的患者,这一比例略高,为49%。
BCOR相关肉瘤
【临床特征】
这是一种罕见的肉瘤,主要发生于儿童,但年龄范围很广。它们似乎更常见于骨骼,出现在许多解剖部位,但也可能发生于软组织,很少发生于内脏。有一种明显的男性偏好。患者通常表现为疼痛或肿胀,很少发热。骨受累可能与病理性骨折有关。
【放射学特征】
涉及骨的肿瘤通常界限不清、溶解和/或硬化,并与皮质破坏相关。除了突出的骨膜反应外,通常还有明显的软组织延伸。
【病理学特征】
(1)大体表现
关于这些肿瘤的大体特征,报道的信息有限。它们可能呈分叶状,呈灰白色。据报道,直径从6.3厘米到>20厘米。
(2)镜下表现
虽然最初报道为小圆形细胞形态,但BCOR相关肉瘤因其一系列形态学发现而逐渐被认可(图14.6)。
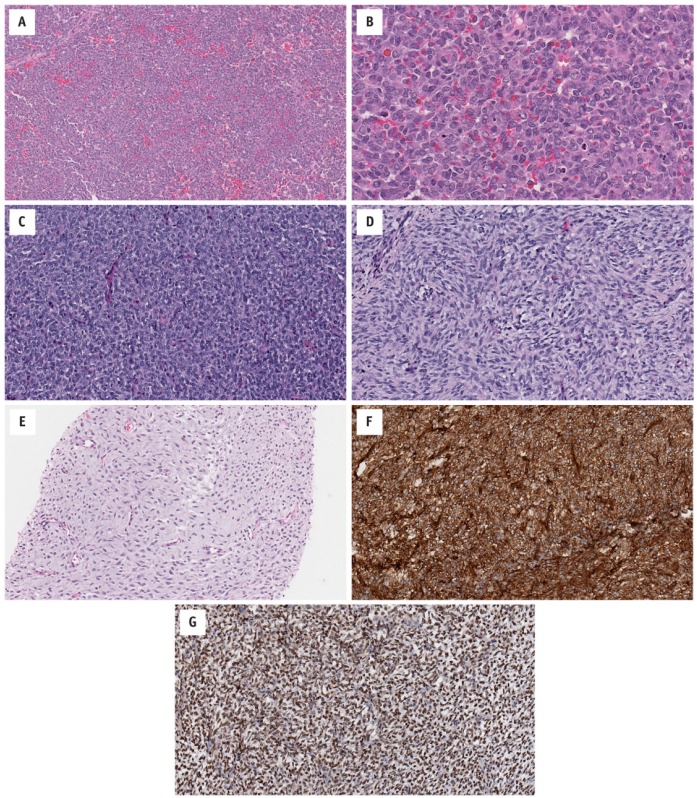
图14.6 BCOR相关肉瘤显示相对传统的形态(BCOR-CCNB3融合基因)。(A)小到中等大小圆形细胞片状分布,胞质淡嗜酸性。(B)细胞核圆形-卵圆形,具有轻度多形性、粗染色质和突出的小核仁。一例同时具有(C)小圆细胞区和(D)梭形细胞区(BCOR-CCNB3融合基因)。(E) 一例梭形-星状细胞位于丰富的黏液样间质(BCOR-CCNB3融合基因)内。与(D)相同病例的免疫组织化学显示(F)CD99和(G)SATB2的表达。
肿瘤往往呈浸润性。它们可能由小圆细胞组成,提示EFT,也可能含有较大的卵圆形细胞。此外,它们可能含有梭形细胞,呈束状-漩涡状,令人联想到滑膜肉瘤。总的来说,细胞质趋向于缺乏-中度嗜酸性和嗜双色。细胞核呈圆形-卵圆形-成角,形态单一;核分裂象活跃。
间质偶尔为黏液样水肿,有稀疏的小成角血管。细胞凋亡和坏死经常出现。
【辅助检查】
(1)免疫组化
大约一半的病例表达CD99,尽管分布可能是可变的。大多数病例SATB2和TLE1呈阳性,有报道称局灶性上皮膜抗原表达。大多数病例表达BCOR,大多数与CCNB3融合的病例表达CCNB3。由于这些肿瘤上调NTRK3,许多肿瘤伴有pan-Trk过度表达。它们通常阴性表达结蛋白、S100、角蛋白和WT1。
(2)分子病理学
大多数BCOR相关肉瘤携带BCOR-CCNB3融合基因,该基因来源于X染色体同臂内反转。最近,已经确定了BCOR其他融合伙伴,包括-MAML3、-ZC3H7B和-CHD9;其他伙伴可能会在未来被确定。BCOR内部串联复制的未分化圆细胞肉瘤可能具有类似的发病机制。这些遗传事件无法使用常规细胞遗传学进行鉴定,需要FISH、RT-PCR和/或RNA-seq。需要强调的是,这些基因驱动因素中的一些并不局限于BCOR相关肉瘤。也就是说,存在分子多效性,其中一些遗传驱动因素在其他肿瘤(如子宫内膜间质肉瘤和骨化性纤维黏液样肿瘤)中共享;在诊断这些和相关实体时,临床-形态学相关性至关重要。
【鉴别诊断】
BCOR相关肿瘤的鉴别诊断与EFT相似(见上文)。尽管存在形态学重叠,BCOR相关肿瘤可能会表达CD99、TLE1和上皮膜抗原,这可能会使滑膜肉瘤的鉴别在有限的样本上特别具有挑战性。BCOR重排或ITD的分子图解是当前诊断的金标准。
【预后和治疗】
这些肿瘤的结果信息目前有限。部分患者存在转移。大多数患者接受多模式治疗,类似于EFT;尽管如此,这种情况仍有很高的局部复发率和偶尔的死亡率。5年生存率估计为75%~80%。
FET非ETS相关肉瘤
这类肿瘤在世界卫生组织分类的2020年迭代中被新采用。用于表示FET与非ETS融合的圆形细胞肉瘤。分类中特别提到了具有EWSR1/FUS-NFATC2和EWSR1- PATZ1的肿瘤;然而,许多其他实体可能属于这一范畴(例如,EWSR1/FUS-CREM、EWSR1-E1AF2、EWSR1/FUS-POU5F1、EWSR1- SMARCA5、EWSR1-SP3、EWSR1/FUS- TFCP2和EWSR1-VEZF1等)。附带地,其他已确定的实体,如促结缔组织增生性小圆细胞肿瘤(EWSR1-WT1),是否最终属于本题,仍有待观察。
【临床特征】
具有EWSR1/FUS-NFATC2融合基因的肉瘤是罕见的。他们主要发生于年轻人到中年人,但从儿童到老年人均可见。这些肿瘤在骨骼中发生频率较高,但也可能发生在软组织中。男性多见。除了疼痛和/或触及肿块,关于临床表现的信息有限。
【放射学特征】
涉及骨骼的肿瘤通常界限不清、溶解性的,并且与皮质破坏和软组织延伸相关。
【病理学特征】
(1)大体表现
肿瘤呈分叶状、灰白色和肉质。坏死通常很明显。据报道,它们的大小从4.0到18厘米不等。
(2)镜下表现
具有EWSR1/FUS-NFATC2融合基因的肿瘤表现出一系列形态(图14.7)。
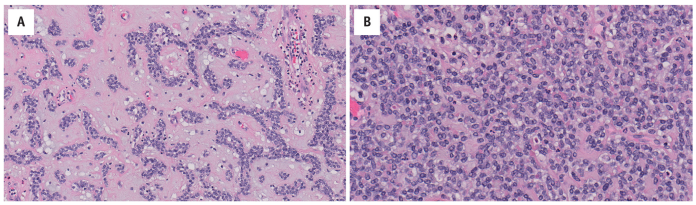
图14.7 EWSR1-NFATC2-相关肉瘤显示(A)多角形细胞呈网状条索分布,具有丰富的黏液样间质,和(B)具有圆形-卵圆形细胞核的小圆细胞片状分布,间质稀少。
这些细胞通常是浸润性的,由小-中圆形细胞组成,嗜酸性细胞质稀少-中等量。细胞核为圆形-卵圆形,有轻-中度异型性,核分裂象多少不等。肿瘤可以排列成网状索和小梁,或巢状和片状。间质通常很明显,范围从黏液样到胶原。偶尔会出现骨样基质和软骨样分化。
【辅助检查】
(1)免疫组化
大多数肿瘤表达CD99,呈膜状、胞质或核旁点状。
这些肿瘤对角蛋白、上皮膜抗原、NKX2.2和WT1表达不一。它们通常不表达结蛋白、平滑肌肌动蛋白、S100和SATB2。
(2)分子病理学
EWSR1作为NFATC2伴侣在这一特定肿瘤亚群中比FUS更常见。(如前所述,任何具有FET非ETS基因融合的未分化小圆细胞肉瘤目前在技术上都属于这一类。)
【鉴别诊断】
EWSR1/FUS-NFATC2相关肿瘤的鉴别诊断与EFT相似(见上文),此外还包括肌上皮性肿瘤、硬化性上皮样纤维肉瘤和小细胞骨肉瘤。
硬化性上皮样纤维肉瘤可基于MUC4免疫表达的存在而区分。
部分肌上皮性肿瘤在形态学和免疫组织化学上高度相似,并依赖于分子检测来确定分类。
【预后和治疗】
关于EWSR1/FUS-NFATC2相关肉瘤的预后仍有相互矛盾的报道。约50%的肿瘤与局部复发和/或远处转移有关。这些肿瘤似乎对常规EFT化疗耐药。
新出现的非FET非ETS相关肉瘤
这类未分化的小圆细胞肉瘤不涉及FET或ETS伴侣;尽管与CIC和BCOR相关的肉瘤,但这些实体极其罕见,基因异质性强,最近才被人们所认识。
例如,这些包括:ALK相关(例如EML4-ALK)、GLI1相关、NCOA2/ CITED相关(例如VGLL2-NCOA2)、NTRK相关(例如TPM3-NTRK)、NUTM1相关(例如BCORL1-、BRD3/4-、CIC-、MXD1/ MXD4和ZNF532)、-SS18相关(例如CRTC1- SS18)(图14.8)和TFE3相关(例如SFPQ-TFE3)。
其他也存在,更多基因的身份即将确定。这些肿瘤的诊断可能是一个挑战,通常依赖于RNA测序等先进的诊断测试方法。
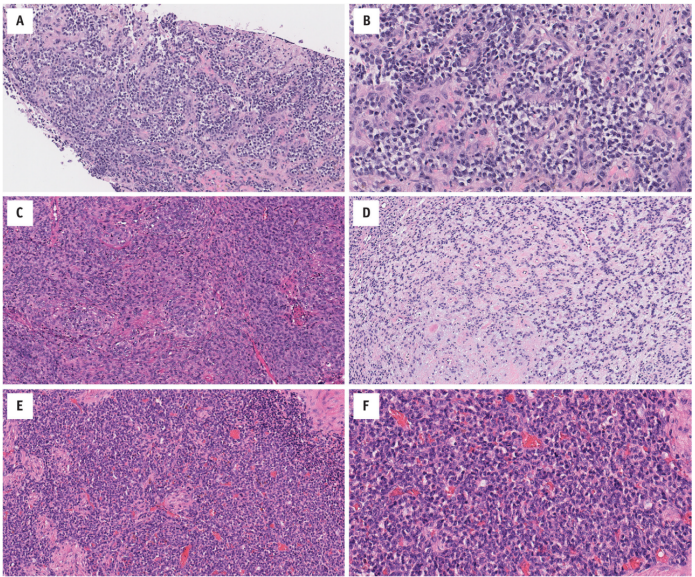
图14.8 NUTM1相关肉瘤(BRD4-NUTM1融合基因):(A)具有少量嗜酸性细胞质的小圆细胞巢状分布。(B)细胞核为圆形-卵圆形,具有轻度多形性和小核仁。ALK相关的软组织肿瘤(EML4-ALK融合基因):(C)圆形-卵圆形细胞巢状分布,稀少-中等量嗜酸性细胞质,细胞边界不清楚,呈漩涡状。细胞核为圆形-卵圆形和单一形态。(D)在其他地方,肿瘤具有网状结构,其间有大量的黏液玻璃样变间质(免疫组化显示ALK、S100和CD34染色[未显示])。GLI1相关软组织肿瘤(ACTB-GLI1融合基因):(E)小圆细胞分叶状,胞质稀少嗜酸性。背景包含一个突出的薄壁脉管系统。(F)细胞核为圆形-卵圆形,偶有核假包涵体。
结束语
“小圆细胞肉瘤”是一种人为概念,但目前仍有助于为这些肿瘤的分类提供一个初步框架。
未分化的小圆细胞肉瘤是一种多样而迷人的肿瘤混合物,通常通过组织病理学上的相似性结合在一起。这些肿瘤表现出多种形态和免疫表型,因此如果没有先进的分子技术,它们的诊断可能很困难。在其他未分化软组织肉瘤(例如未分化梭形细胞肉瘤)有时重叠的形态学细分分类中也存在类似的挑战。随着RNA-seq等技术的常规应用变得越来越普遍,病理学家可以期待更定期地识别未分化肉瘤中不常见的基因驱动因素,并分享新的发现。在融合这些罕见的分子蓝图后,最好是与它们的临床属性相结合,未来间叶肿瘤的分子分类将更加严格和全面。
参考文献:
[1] BONE AND SOFT TISSUE PATHOLOGY:The Foundations in Diagnostic Pathology[M], SECOND EDITION.2023.





















共0条评论