[导读] 作者:游乐园
患者男性,63岁,一年前体检发现右肺上叶结节,大小约为1.0x0.6cm,后定期随访。今年5月份外院胸部CT提示:右肺上叶后段见一结节,大小约4.3x4.7cm,形态不规则,分叶状改变,无咳嗽咳痰、胸闷气促,无午后低热夜间盗汗等不适,为求进一步治疗来我院就诊,门诊以“肺结节”收入院。入院后胸部CT:双侧胸廓对称,肺纹理清晰,双肺见多个囊状透光影,提示肺气肿;左肺上叶见单发实性结节,大小约4x5mm,结节清晰,定期随访。右肺上叶后段见单发实性结节,大小约44x49mm,边界欠清,分叶状,胸膜凹陷征象,增强扫描呈轻度不均匀强化,提示占位、恶性肿瘤可能。气管及主支气管通畅,纵隔居中,纵隔淋巴结肿大,肺门未见明显肿大淋巴结影,胸腔未见明显积液征象,双侧胸膜未见明显增厚。遂行右上肺叶切除手术。
病理检查 巨检:右上肺叶切除标本一个,大小约18.5x10.5x3cm,切开距支气管断端1cm、紧邻胸膜下见一肿块,大小约5x3x3cm,切面灰白色、实性、质脆,与周围组织分界不清。于支气管旁扪及淋巴结2枚,直径约0.2-0.3cm。镜检:肿瘤细胞弥漫片状、巢团状、条索状,可见多灶的大片坏死,肿瘤组织主要由中等至大的上皮样细胞组成,部分区域见失黏附性的横纹肌样细胞,细胞质丰富,淡嗜伊红色或空泡状,核仁明显,核分裂象易见。支气管旁淋巴结未见癌转移,切缘阴性。免疫组化:SMARCA4、CK7、TTF-1 、NapsinA、P40、VIM、NUT、CgA、ALK阴性,CAM5.2、CD56、Syn弱阳,p53(90%,突变型),Ki67(80%+)。ALK、ROS1、EGFR检测均为发现突变,为野生型。
病理诊断:(右上肺叶)SMARCA4缺失的未分化肿瘤,病理分期:pT3N1M0。
患者术后未进行任何治疗,随访至今已近7个月,状态良好,未见疾病复发。
讨论 肺SMARCA4缺失的未分化肿瘤(SMARCA4 deficient undifferentiated tumors,SMARCA4-udt)罕见,2015年首次报道了发生于胸部的SMARCA4缺失性肿瘤[1],当时认为是一种肉瘤性病变,遂用SMARCA4缺失性肉瘤进行命名,鉴于该肿瘤独特的病理特征,2021版WHO胸部肿瘤分类重新将其命名为SMARCA4-udt,以更好的反映其可能的上皮组织来源。胸腔SMARCA4-udt是一种高度侵袭性和罕见的恶性肿瘤,涉及肺部、纵隔和胸膜,好发于有吸烟史的中年男性,男女比例9:1,中位年龄48岁,非吸烟人群也可能成为受害者。临床表现包括呼吸窘迫、胸痛、血痰、吞咽困难、体重减轻等,影像学表现为边界不清的侵入性肿块,压迫周围正常组织,肿瘤中位大小为10cm,常见肺气肿、胸膜增厚、胸腔积液、上腔静脉受压。临床分期常为晚期,患者肿瘤负荷高,常见的转移部位包括骨骼、淋巴结、肾上腺、腹腔和大脑[2]。
目前,SMARCA4-udt发病机制尚不明确。SWI/SNF复合物是一种多亚基的染色质重塑复合物,该复合物和转录因子相互作用,在DNA复制、修复、转录激活,调节细胞的生长、分裂和分化、器官发育中发挥着重要作用,通过这些过程,SMARCA4起到肿瘤抑制的作用。这些亚基包括SMARCA4 (BRG1)、SMARCA2 (BRM)、SMARCB1 (INI1)、SMARCC1、SMARCC2、SMARCD1、SMARCD2、SMARCD3等[3]。SMARCA4是癌症中最常见的异常染色质重构ATP酶之一,其编码的转录激活蛋白,称为BRG1,具有溴化结构域和解旋酶/ ATP酶活性。溴化结构域是一个约110个氨基酸的蛋白质结构域,可识别乙酰化赖氨酸残基,解旋酶是结合并改造核酸或核酸蛋白复合物的酶,ATP酶是一种催化三磷酸腺苷中的磷酸键水解形成二磷酸腺苷的酶,利用磷酸键破裂释放的能量执行其他细胞反应,这些结构域在调控基因转录中起着关键作用[4]。SMARCA4还可以结合BRCA1,调节致瘤蛋白CD44(一种跨膜糖蛋白,与众多肿瘤的生长和转移有关)的表达。SMARCA4突变包括两类:第一类突变包括截断突变、融合和纯合子缺失,第二类突变包括错义突变。SMARCA4失活突变可见于食管、胃肠、子宫、胸腔、鼻窦等部位[5]。
显微镜下,肿瘤组织常呈实性片状、巢团状、条索状生长,浸润周围组织,坏死明显,核分裂象易见,部分卵圆形或多角形肿瘤细胞呈横纹肌样,核偏位,胞质丰富嗜酸性,失黏附,部分肿瘤细胞呈上皮样,染色质空泡状,核仁明显,多核肿瘤细胞可见,少数病例可见梭形细胞[2]。免疫组化:BRG1、BRM表达缺失,INI1表达无丢失,常表达SOX2、SALL4、CD34,局灶表达CK、EMA,P53过表达,Ki67指数高,神经内分泌标记呈不同程度的表达,多为局灶性,余TTF-1、P40、NUT、Claudin-4、VIM等标记不表达。分子检测SMARCA4 (BRG1)基因缺失,可伴有TP53、KRAS、STK11、KEAP1共突变[6]。
鉴别诊断:①SMARCA4缺失性非小细胞肺癌:以男性吸烟者多见,病理组织学形态多样,可表现为分化较好的鳞癌或腺癌、低分化(实性)腺癌、大细胞癌、多形性癌,但大多数病例表现为低分化癌。免疫组化:SMARCA4缺失,P40、TTF-1均阴性,CK、CK7、CAM5.2等上皮标记阳性。②上皮样肉瘤:具有间充质和上皮的双重分化,免疫组化INI-1失表达,CK、EMA、VIM阳性。③NUT癌:形态单一小至中等大小的圆形或卵圆形细胞,片状或巢团状分布,部分肿瘤细胞含较多透明胞质,形似煎蛋样,局部可出现鳞状细胞分化,与周围组织无移行。免疫组化NUT呈细胞核斑点状着色,大于50%的肿瘤细胞NUT核阳性可诊断为NUT癌。NUT癌还可表达多种免疫标记,包括神经内分泌标志物、鳞状细胞标志物、腺上皮标志物等。④胸腺癌:发生在前上纵隔的恶性肿瘤,较罕见,最常见的组织学类型为鳞状细胞癌,明显异型的上皮细胞呈巢状或条索状排列,纤维间隔广泛透明变,缺乏T淋巴细胞围绕。免疫组化表达CD5、CD117、CR 。⑤黑色素瘤:肿瘤组织生长方式呈假腺样、栅栏状、梁状等多种方式,细胞形态包括气球样、上皮样、短梭形、胖梭形、怪异形等多种形态,免疫组化特异性表达S100、HMB45、MelanA、SOX10[2]。上述鉴别诊断2-5中均不存在BRG1及BRM的失表达,可作为有力的鉴别诊断证据。
SMARCA4-udt侵袭性高,临床进展快,多数患者临床分期常为晚期,肿瘤负荷高,且部分患者在最初的诊断时就伴发了转移,常见的转移部位包括骨骼、淋巴结、肾上腺、腹腔和大脑,预后很差,中位总生存期在4-7个月之间,2年存活率12.5%[1]。目前该疾病尚无标准的治疗方法,常见的治疗方式仍以手术为主,对放射治疗不敏感,以基于蒽环类药物的化疗为主,与软组织肉瘤的化疗相同。对于晚期非小细胞肺癌,抗PD‐1/PD‐L1抗体和细胞毒性药物的联合治疗已被证明是有效的,无论PD‐L1在肿瘤细胞中的表达如何。此外,抗PD‐1/PD‐L1抗体和抗血管生成药物的协同作用也已被证实[7]。在胸部SMARCA4缺陷的未分化肿瘤中,无论PD‐L1的表达程度如何,使用抗PD‐L1抗体均可获得治疗效果,但观察到的客观有效率总是低于20%,显示出了有限的疗效。陆续有报道称pembrolizumab单抗联合ipilimumab单抗治疗可出现部分应答,atezolizumab单抗、Bevacizumab单抗、卡铂联合紫杉醇可在短期内迅速稳定病情[8],这些案例报道说明了潜在的治疗方法,可能有助于改善预后,但仍需要积累更多病例来评估上述治疗是否有效。
参考文献:
[1]Francois L L,Sarah W,Gaelle P,et al.SMARCA4 inactivation defines a group of undifferentiated thoracic malignancies transcriptionally related to BAF-deficient sarcomas[J].Nat Genet,2015,47(10):1200-5.
[2]Yoshida A,Boland J M,Loarer F L,et al.WHO classification of tumours of the lung,pleura,thymus and heart[M].5thed.Lyon:IARC Press,2021.
[3]Mittal P,Roberts CWM.The SWI/SNF complex in cancer-biology, biomarkers and therapy[J].Nat Rev Clin Oncol ,2020,17(7):435–48.
[4]Agaimy A, Daum O, Markl B,et al.SWI/SNF Complex-deficient Undifferentiated/Rhabdoid Carcinomas of the Gastrointestinal Tract: A Series of 13 Cases Highlighting Mutually Exclusive Loss of SMARCA4 and SMARCA2 and Frequent Co-inactivation of SMARCB1 and SMARCA2[J].Am J Surg Pathol,2016,40(4):544–53.
[5]Schoenfeld AJ,Bandlamudi C,Lavery JA,et al.The Genomic Landscape of SMARCA4 Alterations and Associations with Outcomes in Patients with Lung Cancer[J].Clin Cancer Res,2020,26(21):5701–8.
[6]Brian D S,Frederic K,Tiago M,et al.SMARCA4-Deficient Thoracic Sarcoma: A Case Report and Review of Literature[J].Int J Surg Pathol ,2020 ,8(1):102-108.
[7]Finn RS,Qin S,Ikeda M,et al.Atezolizumab plus bevacizumab in unresectable hepatocellular carcinoma[J]. N Engl J Med,2020,382(20):1894–1905.
[8]Kei K,Jiro O,Satoshi T,et al.Conversion Surgery for Advanced Thoracic SMARCA4-Deficient Undifferentiated Tumor With Atezolizumab in Combination With Bevacizumab, Paclitaxel, and Carboplatin Treatment: A Case Report[J].JTO Clin Res Rep,2021,2(11):100235.
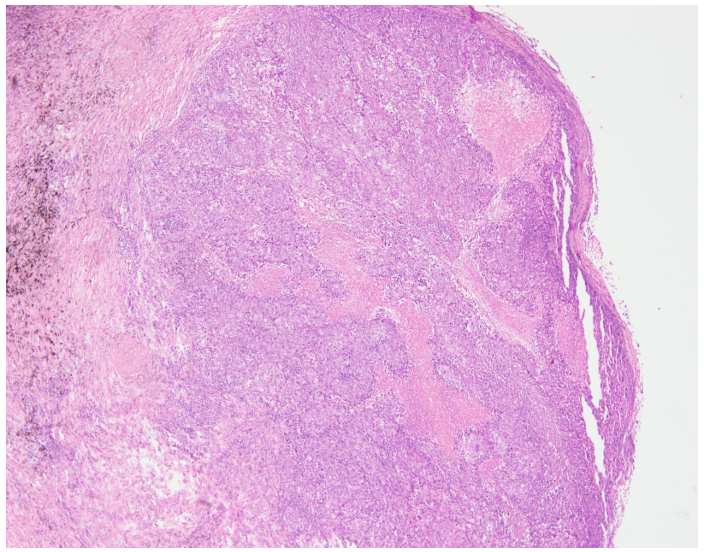
图片1.肿瘤组织呈实性、巢团状生长,坏死明显
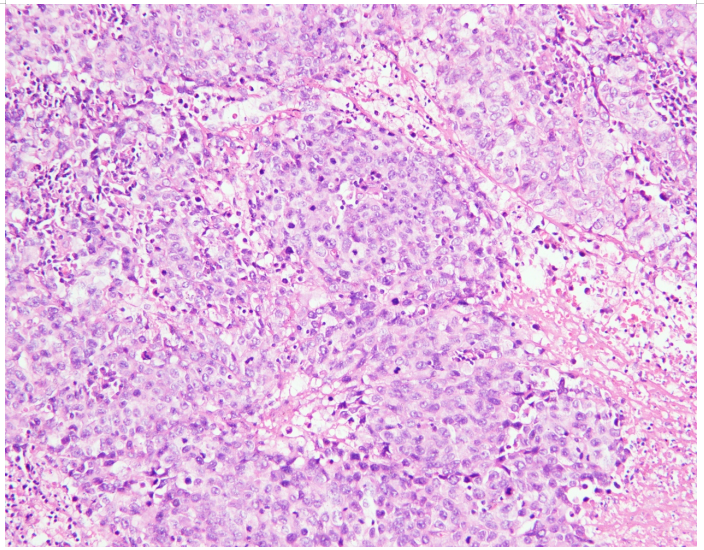
图片2.核分裂象易见
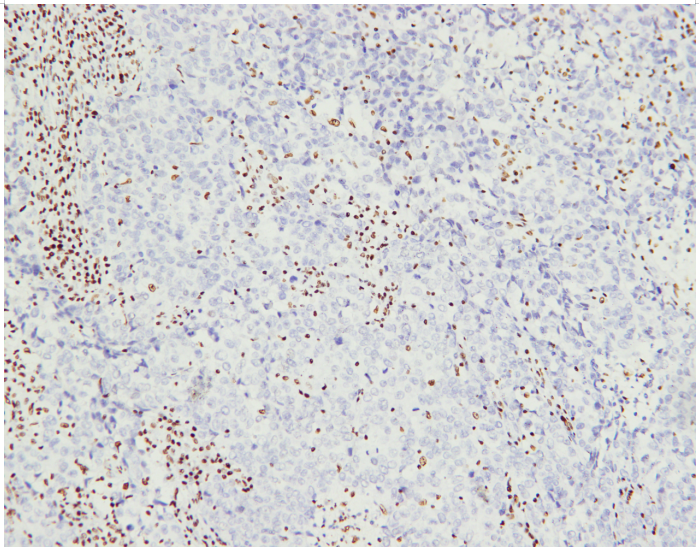
图片3.SMARCA4表达缺失 EnVision法
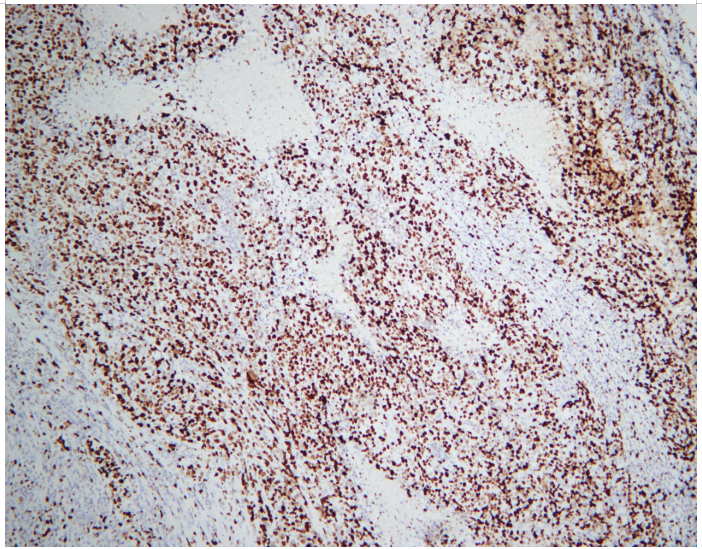
图片4.Ki67高表达 EnVision法

















共0条评论