[导读] 译者:陈旭
纺锤形细胞原位癌
具有梭形细胞形态的DCIS,是一种罕见的疾病,可能被误认为是UDH。这种形式的DCIS,完全或主要由排列成束状、螺旋状和实心片状的梭形细胞组成。梭形细胞的束状排列,可以模拟UDH的“流”模式(图16)。正确诊断的线索,包括缺乏细胞间隙和周围开窗的实体生长模式。细胞看起来均一,具有低度至中度核异型。至于其他形式的DCIS,细胞对HMWCK5/6和14呈阴性。大多数病例呈ER阳性,也显示出神经内分泌分化。
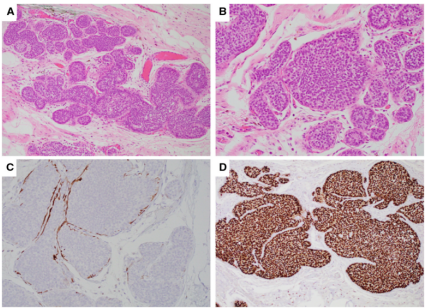
图16.(A,B)纺锤形细胞DCIS可能模仿UDH形态。(C)梭形细胞DCIS中没有CK5/6染色。(D)梭形细胞DCIS显示ER弥漫性强核表达。
低级别实性DCIS
由于目前不同的治疗方法,低级别实性DCIS与经典LCIS的区别,在临床上很重要。经典LCIS通常通过乳房X光检查进行管理,同时指南推荐内分泌治疗。相比之下,DCIS通常作为乳腺癌癌前病变进行管理,通过完全手术切除,随后进行放射治疗。两者的鉴别诊断可能很困难,尤其是在CNB上。两者均由具有单形核的小而均匀的细胞组成。提示导管分化的特征,包括细胞凝聚、明确的细胞边界和肿瘤细胞的局灶性柱状形状。腔周围细胞极化的微腺细胞的鉴定,有利于DCIS的诊断。支持小叶表型的特征,包括缺乏细胞内聚力,以及存在胞浆内空泡。当出现这种鉴别诊断时,E-钙粘蛋白IHC很有帮助。
有包膜的乳头状癌
尽管导管内乳头状瘤很少被误诊为恶性,但由于其轮廓分明、扩张性生长模式和突出的乳头状结构,有包膜的乳头状癌,乍一看可能呈现“良性”外观。低倍镜下的一个有用线索是,与导管内乳头状瘤的保存完整的特征相比,病变相当零散,且具有破坏的性质(图17 )。仔细检查发现,有包膜的乳头状癌,通常缺乏外周MEC层,病变内的纤维血管核心,仅被上皮细胞覆盖,这些细胞学上具有有丝分裂活性,在细胞学上是非典型的。重要的是要,纤维血管核心,由一种细胞类型排列,通常具有多个细胞层,这与由两种细胞类型排列的导管内乳头状瘤的核心,形成对比。在一些病变中,与纤维血管核心直接接触的上皮细胞,呈现球形外观,可能模仿MEC,产生所谓的“双态模式”。IHC可用于在可疑情况下,阐明细胞的性质。在没有明确IC的情况下,包膜乳头状癌目前被分类,并分期为原位病变。
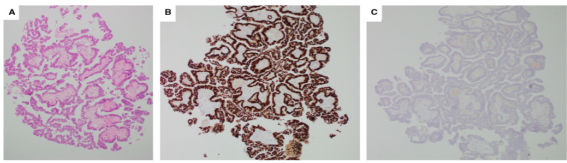
图17.(A)来自CNB(H&E)的包膜乳头状癌碎片。增殖显示ER(B)的弥漫性强核表达并且CK5/6(C)呈阴性,证实了该乳头状病变的克隆性质。
实性乳头状癌
实性乳头状癌,由均匀的上皮细胞增生组成,中间点缀着脆弱的纤维血管核。具有圆形轮廓和推动边界的肿瘤,被归类为具有或不具有外周MEC层的原位肿瘤。如果轮廓呈锯齿状、间质结缔组织增生或上皮细胞的细胞学为高核级别,则肿瘤被归类为浸润性肿瘤。这些肿瘤可能表现出神经内分泌分化,有时与粘液癌有关。边界清楚的肿瘤,其中上皮细胞显示低到中等核级别,并具有纺锤形效应,可能在H&E上呈现平淡的外观,并且病变可能被误认为是伴有丰富UDH的导管内乳头状瘤。识别上皮细胞的均匀性质、脆弱的纤维血管网络以及结节内部和通常周围无MEC,有助于正确诊断。在困难的情况下,IHC有助于证明MEC的缺失,以及上皮细胞增殖的克隆性质,即弥漫性ER阳性和HMWCK阴性。
纤维瘤样化生性癌(FLMBC)
纤维瘤样化生性癌(FLMBC) ,很容易被误诊为纤维瘤病或其他良性病变,尤其是CNB,并且是外观平淡的乳腺SCL最重要的鉴别诊断(图18)。它通常由梭形细胞组成,具有最小的核多形性、稀少的有丝分裂活性,并且没有原位成分。间质可能硬化或胶原化。在一些肿瘤中,可见外周炎性细胞浸润淋巴滤泡。FLMBC与良性硬化病变的关联,进一步增加了漏诊的可能性,尤其是在早期病变中。FLMBC与其他MBC相比,预后良好,但可能局部复发,偶有转移的报道。识别显然很重要,因为FLMBC目前根据低级别IBC,进行管理。大多数肿瘤表达CK和p63。由于CK阳性可能是局灶性的,并且没有一种抗体能染色所有MBC,建议使用一组针对上皮标记物的抗体。β-catenin核染色,是纤维瘤病的特征,在FLMBC中不常见。然而,偶尔可以看到局灶性弱核染色,并且不应阻止病理学家做出FLMBC的诊断。CD34为阴性。CNB可能无法做出明确诊断,在这种情况下,建议进行诊断性切除。
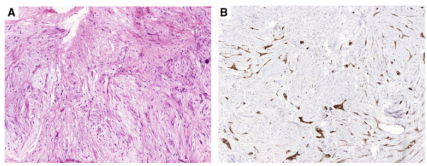
图18.(A)纤维瘤样化生性乳腺癌,在H&E上具有细胞学上温和的梭形细胞增殖的外观。(B)细胞角蛋白MNF116,揭示了病变的上皮性质,并支持FLMBC的诊断。
低级别血管肉瘤
血管肉瘤是一种罕见,但通常具有侵袭性的乳腺肿瘤,约占原发性乳腺肉瘤的25%。乳腺血管肉瘤可能是原发性的,也可能继发于放射治疗,并表现出不同的形态,从以血管形成为主的病变,到以实体生长模式为主的肿瘤。与继发性血管肉瘤相比,原发性血管肉瘤通常由吻合、结构良好、中小型血管通道组成,这些血管通道穿过脂肪组织(图19)。低级别血管肉瘤,由结构良好的血管通道组成,内衬内皮细胞,异型性极小,有可能被误诊为良性血管瘤。与血管瘤不同,血管肉瘤的血管增生,不呈分叶状,血管相互连通,并穿过正常的小叶和脂肪组织。
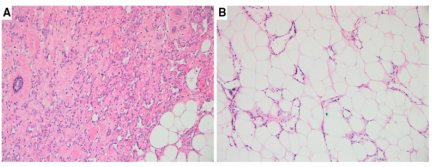
图19.(A)具有血管形成生长模式(H&E)的血管肉瘤。(B)病变的外围有更细微的外观,有细小的薄壁血管浸润脂肪(H&E)。
可能被错误诊断为原发性乳腺癌的恶性疾病
转移到乳房的肿瘤
据报道,从乳腺外原发性恶性肿瘤,转移到乳房,占乳腺恶性肿瘤的0.2%至1.1%,并且是高达三分之一病例的恶性肿瘤的第一个征兆。发病率似乎在增加,可能是由于更详细的放射学调查和组织学分析。乳腺转移最常见的来源,是黑色素瘤、肺癌、胃癌和结直肠腺癌、肾细胞癌、肉瘤和男性前列腺癌。恶性间皮瘤、神经内分泌肿瘤和子宫颈鳞状细胞癌也可能累及乳房。临床表现可能与原发性BC非常相似,可能是有症状的或通过筛查发现的。识别和准确诊断对于指导适当的管理至关重要,包括避免不必要的手术。
由于临床或放射学发现或患者既往病史,可能会提醒病理医师注意转移的可能性。多灶性、双侧病变的存在,虽然在原发性BC中并不少见,但应促使病理医师考虑转移。没有DCIS,可能是指示病变是转移的线索,但并非所有原发性BC,在诊断时都显示原位成分。乳房外转移的其他微观线索,包括不寻常的形态,例如黑色素瘤的黑色素色素、结直肠癌的经典“花环样”坏死或肾细胞癌的透明细胞质,或与组织学特征不一致的生物标志物特征,例如三阴性低级别癌。
与之前的组织学和IHC检查进行比较,包括乳腺标志物ER、GATA3、GCDFP-15、SOX10和其他由形态学和临床病史指导的抗体,对于明确诊断非常有用。虽然乳腺转移通常为三阴性,但ER表达并非乳腺特异性,在妇科恶性肿瘤中很常见。同样GATA3在其他肿瘤中表达,包括尿路上皮癌、皮肤鳞状细胞癌和恶性间皮瘤。尽管进行了彻底的检查,但一些高度恶性肿瘤(例如肺和卵巢),在形态学上可能无法与高度原发性BC区分,并且可能难以区分同步原发肿瘤和转移性疾病。
淋巴瘤
累及乳腺的淋巴瘤,占结外淋巴瘤的2%,占所有乳腺恶性肿瘤的0.5%。患者通常有症状,但乳腺淋巴瘤也可能通过乳腺X光筛查被诊断出来。弥漫性大B细胞淋巴瘤,是局部疾病患者中最常见的亚型,其次是粘膜相关淋巴组织的结外边缘区淋巴瘤(MALT淋巴瘤),这些通常表现为孤立性乳腺肿块。滤泡性淋巴瘤、套细胞淋巴瘤和小淋巴细胞淋巴瘤,常见于有播散性疾病的患者,可能表现为多灶性乳腺病变。在临床和放射学上,乳腺淋巴瘤与原发性BC的表现非常相似,尽管最近的一项研究表明,由于病变较大、形状规则、淋巴结受累以及没有钙化,淋巴瘤可以在影像学上加以区分。
在组织学上,低级别乳腺淋巴瘤,可能与ILC相似,因为细胞群的均匀性、粘附性差和致密胶原蛋白的存在,特别是在滤泡性淋巴瘤中,可能会产生单细胞浸润模式(图20)。在考虑CNB诊断ILC时,需意识到这种潜在的陷阱,注意不存在非典型小叶增生/LCIS和意外的激素受体阴性,应该避免误诊和不必要的手术。高级别淋巴瘤可能被误认为三阴性IBC,无特殊类型(NST),3级。仔细评估细胞学和结构细节,没有DCIS,以及在IHC辅助下,进一步研究三阴性BC的低门槛准确识别。在评估多灶性或双侧乳腺病变时,始终要考虑淋巴瘤或转移性疾病的可能性。
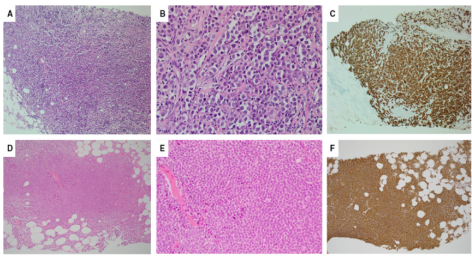
图20.(A,B)实体小叶癌,低倍和高倍图像(H&E)。(C)细胞角蛋白AE1/AE3IHC证实了肿瘤细胞的上皮性质。(D,E)低级别淋巴瘤,低倍和高倍图像(H&E)。(F)CD20染色低级别淋巴瘤。
高级别血管肉瘤
与上文讨论的低级别血管肉瘤相反,高级血管肉瘤由实心梭形细胞和上皮样细胞组成,具有不同程度的血管形成。常见有丝分裂活动、坏死和血湖。具有主要上皮样形态的血管肉瘤,可能被误认为是IBC NST,在H&E上为3级。血管肉瘤表达内皮标志物,包括CD31和ERG。这些肿瘤显示不同程度的CD34、D2-40 和FLi1抗体阳性。考虑任何先前的临床病史和对临床表现的了解,这可能是特征性的,可以帮助诊断。虽然在乳腺中相对罕见,但大多数乳腺病理医师,在其职业生涯中会遇到许多此类肿瘤,因此应将血管肉瘤纳入高级别三阴性乳腺肿瘤的鉴别诊断中。
其他
一些罕见的BC,可能会模仿良性病变,或者可能不会被识别为原发性侵袭性疾病。分化良好的腺样囊性癌,可能被误分类为乳腺圆柱瘤,而外观温和的粘液表皮样癌,可能被误分类为伴有化生的导管内乳头状病变。由于浸润性乳头状簇的管状轮廓,一些浸润性乳头状癌,可能被误解为乳头状DCIS。一些高级IC ,可能具有边界清楚的推动边界和乳头状核,模仿包膜乳头状癌。我们在临床实践中遇到的另一个陷阱,是未能识别为检测转移癌而切除的淋巴结中的低级别淋巴瘤。
免疫组织化学陷阱
E-钙粘蛋白
ILC的准确诊断具有临床意义。ILC的活检诊断,可能需要进行乳腺磁共振成像(MRI) ,以估计疾病范围,排除多灶性和双侧肿瘤的可能性,并确定患者是否适合进行保乳手术。ILC对新辅助化疗的反应,往往比IBCNST差,这可能会影响治疗决策和未来的临床指南。
ILC和LCIS的诊断,通常基于形态学特征。由于E-钙粘蛋白介导的细胞粘附丧失,可见小叶病变的粘性异常外观特征发生。这导致E-钙粘蛋白没有膜表达,这可以使用IHC证明,并且经常用于辅助诊断形态学不明确的病例(图21A 、B)。大多数ILC和LCIS(包括华丽和多形性变体)缺乏E-钙粘蛋白的膜表达,而 IBC NST、DCIS和正常乳腺上皮,显示出强烈的环状膜染色。然而,E-cadherin表达,并不排除小叶病变的诊断。它可能存在于高达16%的ILC病例中,以及LCIS中。在一些高级IBCNST中,缺乏E-钙粘蛋白表达。
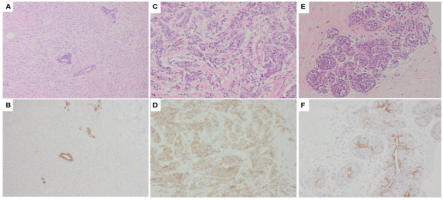
图21.(A,B)ILC显示E-钙粘蛋白表达缺失。(C,D)ILC显示异常的E-钙粘蛋白表达,具有碎片化的膜染色模式,相对于背景正常导管上皮减少。(E,F)具有阴性E-钙粘蛋白的经典LCIS。还要注意肌上皮细胞的颗粒染色。
病理医师意识到,可能存在难以解释的“异常”E-钙粘蛋白染色模式。 ILC和LCIS并非完全呈E-钙粘蛋白阴性,而是经常表现出微弱或减少和碎片化的膜表达(图 21C,D)。与邻近正常乳腺组织中强烈的弥漫性膜染色进行比较,有助于确认该模式是“异常的”,并支持小叶表型。一些具有典型经典ILC或LCIS形态的病例,E-钙粘蛋白显示弥漫性强膜染色,这可能是由于E-钙粘蛋白失活,但作为功能失调的蛋白质保留在细胞表面。如果可用,使用p120和β-catenin,可能会提供这些情况下小叶分化的证据。重新评估形态学,结合E-钙粘蛋白的发现,也很有帮助。
混合了E-钙粘蛋白阳性良性上皮细胞的LCIS,可能会导致解释困难。LCIS可能部分累及导管或腺泡,或破坏现有的良性上皮细胞,呈pagetoid模式。残留的良性天然上皮,显示E-cadherin的强烈表达,这可能导致无法识别LCIS,极易误诊为DCIS。MEC包裹LCIS涉及的腺泡和导管空间,但可能与LCIS细胞混合。MEC的颗粒染色及其细胞质染色(图 21E,F),可能被误认为是LCIS细胞的染色。
LCIS细胞与UDH混合,可能模仿DCIS或非典型导管增生。与H&E比较,有助于病理学家确定E-cadherin 阳性存在于增生性导管上皮中,通常见于增生的中央部分,呈流线状或合胞状。小的、圆形的、不粘附的LCIS细胞,这些细胞主要出现在导管的外围。在疑难病例中,CK5/6和ER也有助于诊断。
当形态学诊断很确定时,不推荐使用E-cadherinIHC。如果组织学特征是典型的,意外或异常的染色模式,不应阻止病理医师将病变分类为小叶性。
乳腺标记物
除了形态学评估外,包括“乳腺谱系”标记(下文讨论)和生物标记ER、PR、HER2的IHC组合,可与器官/部位特异性标记结合使用,例如CDX2(消化系统)、TTF1(肺)和PAX8(妇科),以确定肿瘤的起源。临床情况和肿瘤位置,将影响病理医师在尝试确定肿瘤是否为原发性乳腺转移时,对IHC标记物的选择。
GCDFP-15和mammaglobin
大囊性病液蛋白15(GCDFP-15)和乳房珠蛋白(mammaglobin)是细胞质染色。这些标志物在大多数ER+ 和HER2+BC中呈阳性,但表达可变且通常是局灶性的。mammaglobin是一种比GCDFP-15更敏感的染色剂。这些染色剂在TNBC中的作用不大,据报道,在TNBC中,GCDFP-15的灵敏度范围为12%至16%,而mammaglobin的灵敏度范围为16%至32%。皮肤附件癌也可以表达这些标志物,因此,病理医师在评估可能的皮肤复发时,应注意这一点。
GATA3
GATA3是一种核转录因子,参与乳腺腔上皮细胞的分化,并与BC中的ER信号通路相关。GATA3的敏感性与ER状态密切相关。它在超过90%的ER+BC中表达,并且通常表现出强烈的弥散染色。它是一种比GCDFP-15或mammaglobin更敏感的ER+BC标志物,而且GATA3的核染色模式也更容易解释。淋巴细胞也表达GATA3,在许多情况下代表有用的内部阳性对照。GATA3在TNBC中的敏感性较低,文献报道的表达率为66%、67%和82%。GATA3是一种有助于调查疑似转移性BC的标志物。原发性乳腺肿瘤和转移瘤之间的GATA3表达,高度一致。即使ER表达缺失,原发性乳腺肿瘤和转移瘤之间的GATA3表达的一致性,仍然很高。
虽然 GATA3是乳腺癌和尿路上皮癌的敏感标志物,它可以染色其他上皮肿瘤,包括皮肤基底细胞癌和鳞状细胞癌、皮肤附件肿瘤、绒毛膜癌、嫌色细胞肾细胞癌、唾液腺癌腺癌和胰腺导管腺癌。一些研究发现,它在多种癌症中以较低频率(<10%)表达,例如肺、胃肠道和妇科来源的腺癌。
SOX10
SOX10是一种转录因子,在神经嵴细胞、黑素细胞和雪旺细胞的发育中发挥作用,最初用于黑素细胞和神经肿瘤的IHC研究。SOX10也在乳腺和唾液腺MEC中表达。SOX10是一种有价值的IHC标记物,因为它在不表达GCDFP-15、mammaglobin或GATA3的BC中表达。与GATA3相比,SOX10表达在ER+BC中很少见,但它在31%至69%的TNBC中可见,特别是在GATA3阴性的那些病例中,据报道该亚组的表达率为30-74%。
GATA3和SOX10的组合,可能有助于阐明疑似TNBC转移瘤的原发性乳腺起源,并且它们是互补的,因为它们似乎优先染色不同的亚群;GATA3染色可见于非TNBC原发性肿瘤的转移性BC,且生物标志物表达缺失;而SOX10标记原发性TNBC的转移。与GATA3类似,据报道SOX10表达在原发性和转移性肿瘤之间,保持稳定。
SOX10还会染色原发性和转移性黑色素瘤,这是一个潜在的陷阱。S100也存在类似的缺点,S100是在某些BC中表达的另一种神经和黑素细胞分化标志物。为避免诊断错误,SOX10和S100应结合其他标志物,如 CK进行解读,在怀疑转移性TNBC时,可用于确认肿瘤的上皮性质。
除了非乳腺来源的肿瘤表达乳腺标志物外,还值得注意的是,BC可能表达由其他肿瘤表达的标志物,例如CDX2和PAX8。这提醒我们,结合H&E形态学以及临床和放射学背景,来评估IHC结果。
肌上皮细胞免疫组织化学
在H&E和IHC上,是鉴定MEC是良性和恶性腺体、乳头状和导管内增生性病变的诊断检查和分类的重要因素。病变周围无MEC,可能支持侵袭性恶性肿瘤的诊断,但必须结合具体情况,并谨慎解读。如前所述,尽管没有外周MEC层,但有包膜和实性乳头状癌,可归类为原位病变。如果分类需要证明MEC,建议至少使用两种MEC标记,通常是核染色和细胞质染色的组合。
p63是一种核染色剂,对MEC具有高敏感性和特异性,在血管或肌成纤维细胞中不表达。常用的细胞质 MEC标记,包括SMA钙调蛋白、平滑肌肌球蛋白重链(SMMHC)和CD10,它们显示出不同程度的敏感性和特异性。细胞质MEC标记物的主要缺点,是它们倾向于染色肌成纤维细胞和血管,这会妨碍解释。这在区分DCIS涉及的扭曲导管与IC病灶时,尤其成问题,其中肌成纤维细胞排列在侵袭性病灶的外围,模仿细胞质MECIHC上的MEC层(图22 )。
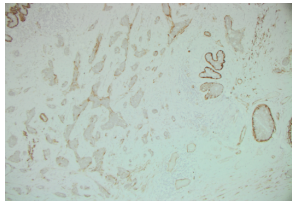
图22.肌成纤维细胞与非特异性钙调蛋白染色(钙调蛋白IHC)的IC细胞巢对齐。这种非特异性染色,与正常导管上皮和DCIS周围的MEC的强细胞质染色,形成对比。
HMWCK抗体,也可用于MEC染色,但可能会显示染色强度的变化和假阴性结果。除了染色肌成纤维细胞外,CD10可能对上皮细胞,表现出非特异性反应。据报道,与高级别DCIS相比,它是识别LCIS和低级别DCIS中MEC的更具特异性的标记。
据报道,硬化性腺病、DCIS和大汗腺病变的p63核染色强度降低,这可能导致诊断困难。这可以解释为 MEC肥大,伴随细胞伸长和核间距离增加,使得核染色难以可视化。然而,在良性和非浸润性乳腺病变中,也有细胞质MEC标记物表达减少的报道,特别是在大汗腺病变中,可见缺失的MEC。大汗腺病变的评估,尤其应考虑所有细胞学和结构特征,并且不应仅根据是否存在MEC进行分类。
其他潜在的缺陷,包括p63在鳞状或基底分化细胞中的表达。这可能会给一些低级别TNBC的诊断带来挑战,例如低级别腺鳞癌,其中小腺体结构的上皮细胞,显示p63染色,可能被误认为是MEC(图23 )。
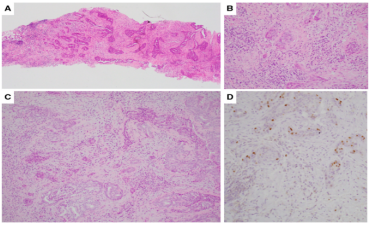
图23.(A-C)低级别腺鳞癌(H&E)。(D)低级别腺鳞癌内小巢的上皮细胞,显示局灶性p63染色。
MEC还可以表达淋巴血管标志物,例如D2-40。使用特定的MEC标记,将有助于区分淋巴血管浸润(p63阴性和D2-40阳性)和DCIS伴回缩,其中外周MEC表达这两种标记。
总结
了解H&E染色切片和IHC制备评估中的潜在缺陷,以及在手术和非手术乳房标本的诊断检查中,保持综合判断的能力,对于乳腺病理医师避免误诊,并确保安全和正确的患者管理,至关重要。
点此下载原文献:
[1]Cecily Quinn,Aoife Maguire,Emad Rakha.Pitfalls in breast pathology.Histopathology.2023 Jan;82(1):140-161.doi: 10.1111/his.14799.
往期回顾:乳腺病理诊断的陷阱(一)





















共0条评论