[导读] 译者:慧海拾穗
【摘要】
根据分子特征有助于对儿童肾肿瘤的理解,包括儿童囊性肾瘤与DICER1肿瘤综合征的关系、具有体细胞BRAF突变的后肾肿瘤家族、ETV6-NTRK3阴性先天性中胚层肾瘤的特征、易位肾细胞癌中基因融合谱的扩大、肾透明细胞肉瘤与其他BCOR改变的肿瘤的关系,以及肾横纹肌样瘤中SMARCB1改变影响的途径。这些进展对儿童肾肿瘤的诊断、分类和治疗具有重要意义。
【概述】
非肾母细胞性儿童肾肿瘤少见且多样,影响不同年龄组,具有不同的生物学起源和临床行为。
分子技术的广泛应用,包括细胞遗传学和测序,为深入了解这些肿瘤的诊断、分类和治疗打开了大门。这些进展大多数是最近才取得的,仅在过去几年内,可能为取得更多进展奠定基础,特别是在侵袭性肿瘤的治疗方面。
【囊性肾瘤】
① 简介
发生于儿童的儿童型囊性肾瘤(CN)是一种良性肿瘤,不同于成人型囊性肾肿瘤。最初认为是肾母细胞瘤和囊性部分分化型肾母细胞瘤(CPDN)谱中最良性病变,在过去十年,它们被确定为主要由DICER1突变驱动的肿瘤,具有胚系或体细胞DICER1基因突变(框1)。
② 大体和镜下特征
儿童CN大体上是一种多囊性肿瘤,外观与CPDN相同,具有薄分隔和缺乏实性区域(图1)。
囊肿内壁光滑,囊内可能含有透明液体。显微镜下,囊肿被覆扁平到立方或鞋钉样上皮。
分隔由纤维组织组成,可能有一层梭形细胞(见图1)。与CPDN相比,分隔中可能存在成熟的管状结构,但未见胚芽或原始上皮成分。
③ 鉴别诊断
在分子鉴定之前,在胸膜肺母细胞瘤(PPB)患者或其家庭成员中报告了CN。首次发现PPB与DICER1胚系突变相关,在一项大宗报道中,12%的PPB有或有CN家族成员。高比例的组织学定义的儿童CN具有DICER1突变,而CPDN患者没有突变,从而将CN与CPDN谱区分开来。儿童CN也不同于成人CN,成人CN被包括在混合性上皮和间质肿瘤谱系中。在组织学上,儿童肿瘤缺乏典型的卵巢型间质和成人肿瘤的黏稠胶原蛋白。成人型间质抑制素阳性,但两者均可显示雌激素受体阳性。几乎所有成年患者DICER1突变均为阴性,罕见的例外可能是儿童期未被识别的CN病例。
④ 分子病理学特征与诊断
DICER1相关肿瘤在DICER1中具有双等位基因突变。它们可能携带一个常染色体显性胚系加上一个体细胞突变,也可能完全是体细胞突变。随着越来越多的肿瘤被研究,一种突变模式已经出现,大多数体细胞突变聚集在核糖核酸酶(RNase)IIIB结构域的热点,胚系突变更常见地在整个基因中传播,并导致功能丧失。在没有家族史的情况下出现DICER1相关肿瘤的患者中,通过测序和缺失/重复检测对肿瘤和胚系标本进行检测有助于确定肿瘤是否为散发性肿瘤或是否存在DICER1肿瘤易感综合征家族的风险。在已发表的建议中,儿童CN被认为是胚系检测的主要适应症。注意,在肿瘤组织中不总是识别出2个突变,这可能是因为内含子突变或缺失/重复事件,根据所用的测序方法,这些突变可能无法检测到。由于胚系中存在低水平嵌合体的可能性,测序结果的解释可能会更加复杂。与PPB类似,多个DICER1相关的肿瘤目前已被证明具有从良性到高度侵袭性谱的组织学和临床特征。
具有更具侵袭性特征的肿瘤以未分化的梭形和小圆蓝细胞为特征,具有明显的多形性或间变性和异源分化,包括横纹肌母细胞、软骨母细胞和骨或骨样形成。肾间变性肉瘤(ASK)具有这些相同的特征:内衬鞋钉样上皮并由薄纤维隔膜分隔的囊腔。ASK也缺乏与CN类似的原始肾源性成分。ASK具有与CN相同的DICER1突变模式,既有散发性突变,也有家族性/胚系突变。
尽管大多数儿童CN是温和的良性病变,但它们似乎与ASK有关,可能会从CN发展到更具侵袭性的病变。在小病例报告中,ASK与较高的转移率和局部复发率相关。
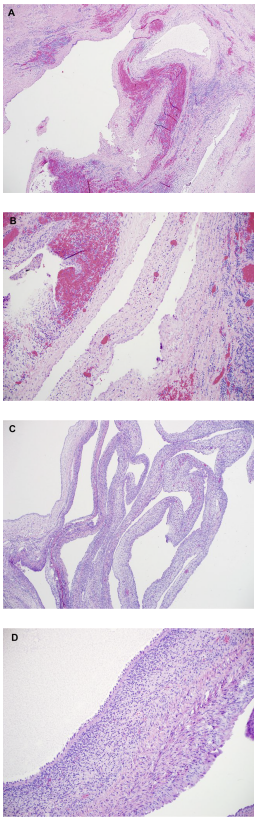
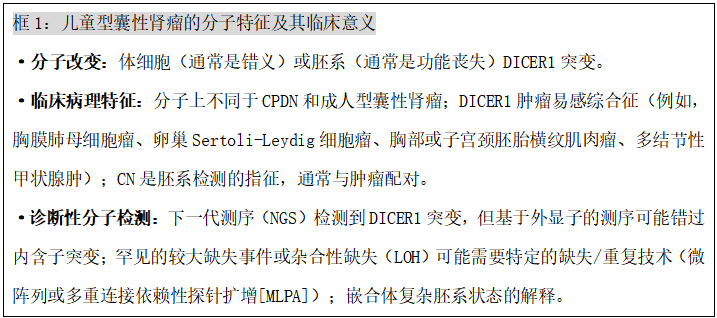
图1.儿童型CN。(A,B)伴胸膜肺母细胞瘤和胚系DICER1突变的CN病例,显示了由鞋钉样上皮排列的囊性间隙由纤维组织分隔。囊壁含有出血、慢性炎症和稀疏的间质细胞。
(C,D)DICER1胚系检测阴性散发性CN病例,分隔被覆相同的鞋钉样上皮,分隔中的间充质梭形细胞数量增加。这些样本之间的组织学差异并不特定于是否存在种系DICER1突变。
【后肾肿瘤】
① 简介
后肾肿瘤家族包括后肾腺瘤(MA)、后肾腺纤维瘤(MAF;以前称为肾源性腺纤维瘤)和后肾间质肿瘤(MST)。这些肿瘤通过其重叠的组织病理学特征谱以及在大多数情况下在整个组织学谱中存在BRAF突变而相关。尽管MA在成人中更常见,但MAF发生于儿童和年轻成人,MST主要发生于年轻儿童(框2)。

② 大体和镜下特征
MST是一种良性肾肿瘤,起源于肾髓质。大体上,它们看起来边界清晰、分叶状,可能有囊性变区域。壁内可见钙化或骨化。显微镜下,它们无包膜,可以显示生长到周围的实质中,包裹正常结构并破坏肾盂的尿路上皮。肿瘤由梭形、星芒状至上皮样间质组成,细胞密度不等和核分裂象多少不等。其他特征包括基质细胞围绕内陷的发育不良血管和内陷小管可能表现为囊性扩张。球旁细胞增生和异源分化,特别是胶质或软骨样细胞也可能存在,局灶增生胚胎性增殖也可能存在。基质成分通常CD34阳性,结蛋白和细胞角蛋白阴性。MAF也是良性的,见于儿童和年轻人,偶尔表现为红细胞增多症。与MST相似,MAF发生于髓质,但更可能是囊性的。生长模式和基质与MST相同,并伴有与MA相同的上皮成分。上皮成分以密集的管状和乳头状结构为特征,有时伴有沙砾体。缺乏球旁细胞增生。基质的免疫组织化学特征与MST相同,CD34阳性,上皮成分显示出可变的细胞角蛋白表达和WT1阳性,与MA中的一致。
MA是后肾肿瘤中最常见的一种,代表后肾肿瘤的上皮末端,通常无未包膜但界限清楚的肿瘤,与周围的实质有清晰的界面。它们由温和的肿瘤细胞组成,在非细胞间质中形成密度不等的腺泡。也可以看到管状或乳头状。肿瘤细胞为圆形至卵圆形,无明显核仁,细胞质稀少(图2)。大多数MA完全缺乏核分裂象和纤维性包膜;然而,最近的研究表明,这些可能存在,尽管程度非常有限。营养不良骨化可见于长期带瘤病例。MA可能显示细胞角蛋白的可变染色,但WT1(见图2)和CD57始终呈阳性。
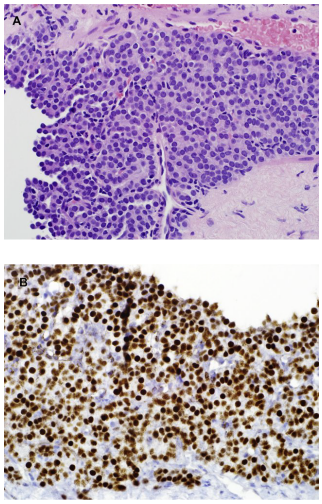
图2. MA:(A)肿瘤呈腺泡和管状模式,瘤细胞形态单一,卵圆形,核仁不明显。(B)细胞核WT1呈强阳性。
③ 分子病理学特征
在对这些肿瘤进行分子鉴定之前,后肾肿瘤被认为与肾母细胞瘤和叶内型肾源性残余有关。
早期主要对MA分子研究,因为可供研究病例数较多,许多研究通过测序显示大多数病例存在BRAF V600E突变,很少有其他BRAF密码子V600突变的报告。这些研究之后,对MST和MAF进行了分子评估,再次显示出BRAF突变的肿瘤比例很高。免疫组织化学现在可用于评估BRAF V600E突变,并且与这些肿瘤的突变状态高度相关,尽管抗体未检测到除V600E以外的BRAF密码子V600突变,如V600D。MA的其他分子研究已经显示染色体异常,包括17号染色体长臂的复杂获得和19号染色体短臂的扩增,尽管许多病例没有显示出获得或缺失。更广泛的MA测序分析显示,其他肿瘤相关基因(包括NF1、NOTCH1和SPEN)存在可变突变。
也发现BRAF和其他基因之间的罕见融合。这些改变的临床意义及其对其他后肾肿瘤的适用性尚未确定。
④ 分子病理诊断
后肾肿瘤中BRAF突变的鉴定对于确定这些肿瘤之间的相关性以及它们与其他肿瘤类型的不同起源是最有用的。通过测序或免疫组化检测BRAF突变可能有助于区分这些肿瘤与其他组织学重叠的肿瘤,或者在切除前进行活检的情况下。
【先天性中胚层肾瘤】
① 简介
先天性中胚层肾瘤(CMN)是一种发生于婴儿的低级别肿瘤,分为经典型、细胞型和混合型。尽管20多年前就发现细胞型具有ETV6-NTRK3易位,但缺乏这种融合的病例包括经典型、部分混合型和罕见的细胞型,直到最近都不清楚(框3)。

② 大体和镜下特征
经典型CMN占35%至50%,细胞型占35%至45%,混合型占15%至20%。所有亚型的CMN都无包膜,可能表现为侵入肾实质或肾周软组织,通常位于肾门。在经典型型中,切面显示出漩涡状外观,而细胞型更均匀,可有出血、坏死或囊性变(图3)。混合型可能具有两者任一特征。
镜下,经典型CMN由具有细长卵圆形细胞核的弯曲和交织束状排列的肿瘤细胞组成(见图3)。核仁不明显,通常很少有核分裂,少数病例可能会增加。这些肿瘤与实质呈不规则的指状界面,并包裹正常结构。脉管系统是开放的、薄壁的,可能具有分支、血管外皮细胞瘤样模式。软骨结节也可能存在。细胞型由较短束状排列的较密集的肿瘤细胞组成,但也可能具有随机结构。细胞核比经典型更肥胖,核分裂像更多(见图3)。可有坏死或出血。混合型细胞密度不等,可有或无明显的经典或细胞型区域。经典型无特异性免疫组化指标。
图3.CMN:(A)经典型CMN大体外观呈漩涡状,与周围实质边界模糊。(B)经典型CMN,具有弯曲束状和温和的梭形细胞。右上角可见一个软骨结节。
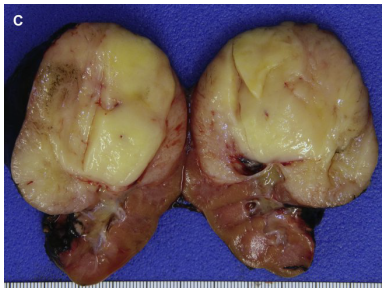
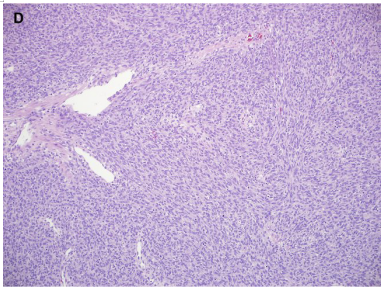
图3(续):(C)细胞型CMN的切面均质。(D)细胞型CMN具有较短、更密集的束状结构,由胖梭形细胞组成,具有散在薄壁扩张血管。
③ 临床特征
CMN是最常见的先天性肾肿瘤,产前诊断率高达16%。大多数病例在出生后的第一年被诊断出来,经典型在几天到几周内出现,细胞型在出生后3到5个月内出现。CMN的总生存率约为95%至96%。局部复发率小于5%;转移是罕见的。肿瘤进展在第一年内最常见,在细胞型和缺乏ETV6-NTRK3融合的细胞型CMN中最常见。总的来说,大约一半的复发或转移患者死于疾病。手术切除是首选的治疗方法,尽管对于不可切除的肿瘤可能需要新辅助化疗,术后化疗可能用于晚期表现和肿瘤。值得注意的是,鉴于靶向治疗选择的出现,特别是含有NTRK基因融合的肿瘤靶向治疗的高成功率,治疗策略目前正在变化,可能会发生变化。
④ 分子病理学特征
CMN分子特征的早期研究集中于细胞遗传学,特别是t(12;15)(p13;q25)易位导致ETV6和NTRK3融合,在细胞型和混合型中进行了描述(图4)。这一发现在许多研究中得到了证实,大多数细胞型和不同比例的混合型病例出现基因融合。融合阳性病例显示混合组织学,似乎所有组织学成分均融合阳性。针对TRK蛋白家族(panTRK)的免疫组化抗体小宗病例显示,3例融合阳性CMN病例中有2例阳性,这表明这可能是一种识别融合阳性病例的有用的低成本方法。CMN的标准分子后处理长期依赖于荧光原位杂交,最常用的是ETV6分离探针,而不常用的是NTRK3基因重排的FISH。直到最近,对这些重新排列呈阴性的病例通常没有进一步调查。在过去的两年,随着广泛的下一代测序(NGS)在DNA和RNA改变中的应用迅速增长,对融合阴性CMN的认识越来越多。CMN中融合谱已扩展到包括NTRK融合(如EML4-NTRK3融合、NTRK1基因融合)、RET融合和BRAF融合。细胞型和混合型是这些选择性融合的病例之一。其他融合阴性肿瘤,包括经典型、细胞型和混合型,已被鉴定为基因内BRAF复合物缺失和重复,更常见的是EGFR内部串联重复。尽管这些研究有限,但这种不断增加的额外分子改变似乎解释了大多数ETV6-NTRK3阴性病例。这些新发现的分子改变是否与临床行为相关,仍有待观察。
⑤ 分子病理诊断
用于鉴定ETV6-NTRK3融合的FISH或靶向逆转录酶聚合酶链反应通常用于诊断检查。如阴性可考虑扩大基于NGS的检测。这种扩展的检测可能对可能受益于TRK或其他靶向抑制剂治疗的晚期患者特别有用。尽管文献中报道了极少数用TRK抑制剂治疗的CMN病例,但这些肿瘤和其他肿瘤表现出相当大的反应,与化疗相关的发病率较低,这突出了病理医生在识别这些病例中的重要性。
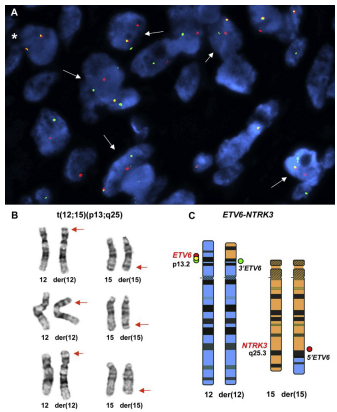
图4.细胞型CMN显示ETV6阳性重排和肿瘤染色体培养的t(12;15)(p13;q25)与ETV6-NTRK3融合一致:(A)间期荧光原位杂交分析ETV6(12p13)双色分离探针。箭头指示ETV6重排细胞模式:1个正常融合信号(黄色)和1个分离的红色和1个绿色断裂信号表示ETV6阳性重排。“星号”表示正常细胞的正常信号模式:2个融合信号。(B)细胞遗传学培养细胞,箭头指向异常染色体重排的断裂点。(C)t(12;15)/ETV6-NTRK3彩色示意图。
——未完待续——






















共0条评论