[导读] 译者:菜菜喵
主要的肝细胞癌亚型
目前多种肝细胞癌的结构生长模式和组织学亚型已经被确认。鉴别肝细胞癌的形态学谱不仅有助于准确诊断,而且对预后也很重要。组织学亚型不应与结构生长模式相混淆。虽然有4种主要的结构生长模式,但可有多种组织学亚型(表2)。4种主要的结构生长模式包括:细小梁、实体/致密、假腺泡/腺泡和粗小梁(图1)。相反,不同的组织学亚型具有不同的组织学形态特征,由特异性的免疫组化图谱或分子改变支持,并具有特定的临床相关性。例如,富脂型肝细胞癌亚型经常与代谢综合征和NASH相关,而纤维板层型肝细胞癌与涉及DNAJB1和PRKACA基因的特异性易位相关。大约35%的肝细胞癌可被划分为不同的组织学亚型。因为许多组织学亚型具有预后意义,所以尽可能了解并报告这些是很重要的。此外,同样重要的是,HCC可能表现出显著的瘤内异质性,对小活检标本的过度诊断可能导致肿瘤的错误分类。值得注意的是,尽管有些肝细胞癌,如拟肝癌型肝细胞癌或纤维结节型肝细胞癌没有明确的组织学,但有时根据其特殊的外观和临床特征,它们仍被归类为肝细胞癌亚型。
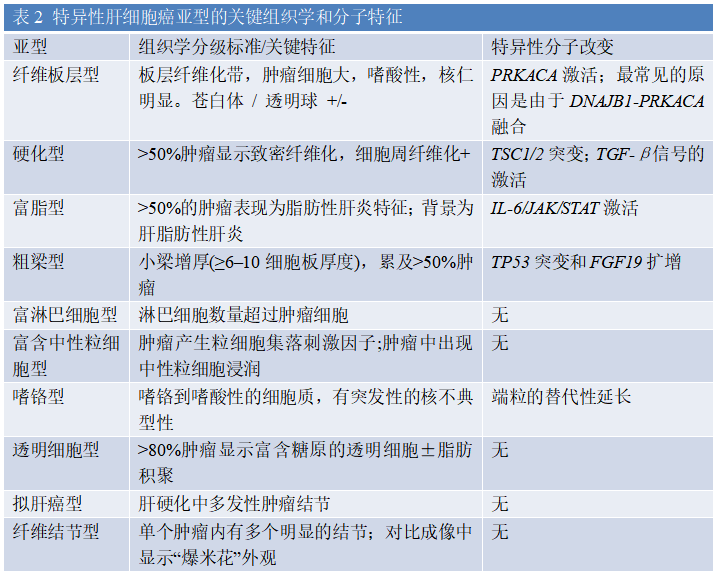
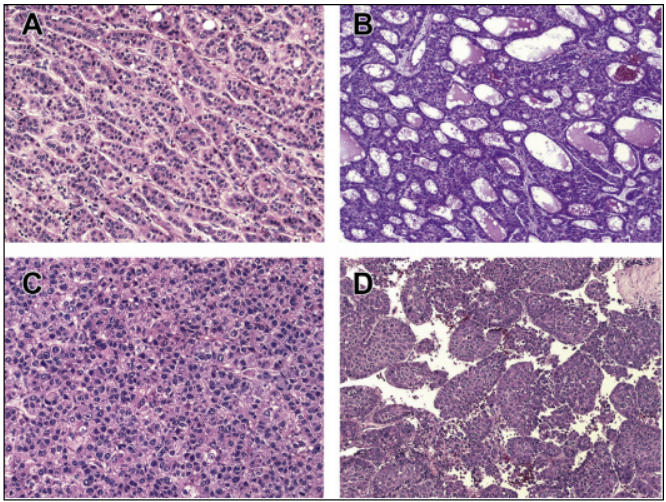
图1. HCC结构生长模式: (A)肿瘤细胞以不同厚度的小梁模式生长,小梁内衬有明显的窦状内皮细胞。(B)肿瘤细胞呈假腺状/腺泡模式生长,具有腺体或腺泡结构。(C)肿瘤细胞以实性/致密的模式生长,无小梁或假腺体的生长。(D)肿瘤细胞呈粗梁状生长,小梁厚超过10个细胞层(HE染色,100倍)。
1、纤维板层型肝细胞癌
纤维板层(FL)-HCC是典型的HCC亚型,通常发生在没有任何肝硬化背景的年轻患者中。近年来,由于鉴定出与该肿瘤相关的特异性分子改变,引起了广泛的关注。总的来说,这些肿瘤比常规肝细胞癌大,常显示中央瘢痕伴钙化。肿瘤细胞呈多边形,有大量嗜酸性颗粒胞浆,明显嗜酸性大核仁,并沉积在丰富的胶原基质中,呈板层状(图2A)。这些特征虽然可诊断FL-HCC,但未必见于每个病例。常出现苍白体,但无特异性。HepPar-1、pCEA(管状型)和arginase阳性。CD68的颗粒细胞质染色敏感,但不具有特异性,细胞经常表达CK7和CK19。新的DNAJB1-PRKACA融合被认为是FL-HCC的关键特征;然而,最近这种融合基因在一组具有独特的嗜酸细胞形态的胰胆管肿瘤中也被鉴定出来,并且不是FL-HCC所特有的。当有争议时,这种基因融合的证明仍然被认为是诊断的金标准。用特异性激酶抑制剂靶向治疗这种融合到目前为止还未见成效。
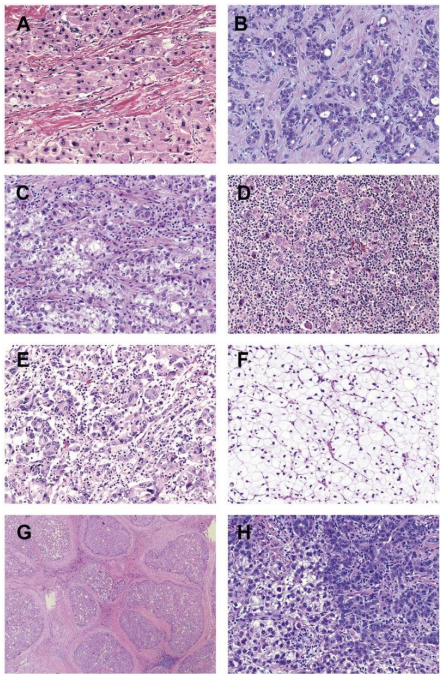
图2.肝细胞癌的主要亚型:(A) FL-HCC:肿瘤细胞显示丰富的嗜酸性胞浆,明显的大核仁,偶尔可见苍白体和层状纤维化带(HE染色,200倍)。(B)SC-HCC:肿瘤巢和单个肿瘤细胞存在于致密的结缔组织增生背景下(HE染色,200倍)。(C)SH-HCC:肿瘤显示巨泡脂肪变性,气球样变,马洛里-登克小体,炎症和细胞周围纤维化(HE染色,200倍)。(D) LR-HCC:肿瘤显示肿瘤细胞在密集淋巴细胞浸润的背景下(HE染色,200倍)。(E) NR-HCC:肿瘤显示大量中性粒细胞浸润(HE染色,200倍)。(F) CC-HCC:肿瘤细胞具有富含糖原的透明胞浆(HE染色,200倍)。(G)FN-HCC:肿瘤呈纤维结节状外观,其特征为广泛的纤维化,在单一肿瘤病变中将肿瘤细胞分裂为多个边界清楚的肿瘤结节(HE染色,40倍)。(H)合并肝细胞-胆管癌:肿瘤同时显示HCC和胆管癌成分(HE染色,200倍)。
2、硬化型肝细胞癌
硬化型(SC)-HCC的特征是巢状或单个肿瘤细胞被明显的纤维化间质包围(图2B),在肿瘤中比例大于50%。SC-HCC的发病率估计约为4.0%。致密纤维化的存在可能导致在影像学和大体检查误诊为胆管上皮癌。形态学特征与中高度分化肝细胞癌相似。透明细胞改变和透明小体也有报道。常用的肝细胞标记物如HepPar-1和pCEA在50%以上的SC-HCC中是阴性的,而通常用于识别腺癌的标记物,如CK7, CK19和EPCAM在2/3的病例中是阳性的。由于其致密的纤维化和重叠的形态学和免疫组织化学特征,SC-HCC是模拟纤维板层的肝细胞癌。尽管两组患者的人口统计学可能不同,DNAJB1-PRKACA融合的分子检测可用于以形态学和免疫组织化学特征为基础难以分类的病例。虽然一些研究显示SC-HCC的预后较差,但大多数研究表明,与常规肝细胞癌相比,在人口统计学、慢性肝病、肝硬化、血清AFP水平或预后方面没有差异。
3、富脂型肝细胞癌
有些肝细胞癌有广泛的气球样变、炎症、马洛里-登克小体和细胞周纤维化(图2C),而另一些主要表现为脂肪变性。为了诊断富脂型(SH)-HCC亚型,需要有炎症和气球样变伴细胞周纤维化的损伤的证据。仅有脂肪变性是不够的。虽然许多患者有代谢综合征相关的危险因素,背景非肿瘤性肝脏可能表现为脂肪性肝炎,但一些患者可能没有。它可能在NASH中比酒精性肝病更常见。尽管关于这种组织学亚型的数据仍然有限,但研究表明,与常规肝细胞癌相比,在总生存期、无病生存期、转移性疾病的发展或局部复发方面没有差异。一项研究显示,SH-HCC患者似乎有更好的无病生存期。该亚型的免疫组化特征与常规的肝细胞癌相似;然而,由于IL6/JAK/STAT通路的激活,炎症标志物如C反应蛋白(CRP)的染色增加。与常规肝细胞癌相比,这些肿瘤较少出现β-catenin突变。鉴别诊断包括脂肪性肝炎,需要注意组织学和细胞学异型性(IHC可用于确认);脂肪性肝炎样改变的FNH,需要注意FNH特征,包括厚壁血管、管状反应和厚纤维带,有助于鉴别FNH和HCC。
4、粗梁型肝细胞癌
粗梁型(MT)-HCC由于其独特的分子特征和预后意义而受到关注。WHO定义MT-HCC为肝小梁≥6个细胞板厚度,占HCC的50%以上(见图2D)。然而,与MT成分大于50%的肝细胞癌相比,具有≥30% MT成分的肝细胞癌显示出相似的临床病理相关性。这种肝细胞癌亚型多发生在非肝硬化中,特别是在乙型病毒性肝炎(HBV)中。这些肿瘤通常伴有较高的AFP水平、更大的体积、更频繁的血管浸润、更高的分期和分级、更高的复发率、更差的无复发生存率和总生存率。与肿瘤血管生成相关的独特基因标记,如血管生成素2、血管内皮生长因子A和内皮特异分子1(ESM1),已经在该亚型HCC中报道。
5、富淋巴细胞肝细胞癌
富含淋巴细胞(LR)-HCC,也称为淋巴上皮瘤样肝细胞癌,其特征是存在低分化癌细胞的片状或巢状,并伴有密集的淋巴细胞浸润(图2D)。尽管10个高倍视野中肿瘤浸润淋巴细胞的截断值超过100个,但WHO并没有建立明确的诊断指标,而是建议当大多数视野淋巴细胞数目超过肿瘤细胞时定义LR-HCC。尽管淋巴上皮瘤样胆管癌与EB病毒(EBV)有较强相关性,但EBV与LR-HCC相关性较少。估计LR-HCC仅占肝细胞癌的不到1%,与常规肝细胞癌相比,总的预后良好。最近的研究表明,LR-HCCs常显示染色体11q13.3的局灶性扩增,这与免疫检查点信号强相关。此外,LR-HCC显示肿瘤内炎症细胞PD-L1高表达。这些结果表明,LR-HCC可能对免疫检查点抑制剂治疗敏感。
6、富含中性粒细胞的肝细胞癌
一些HCCs有颗粒细胞集落刺激因子(G-CSF),吸引大量弥漫性中性粒细胞浸润肿瘤(图2E)。这种肿瘤是罕见的,除了肝脏外,在各种器官(肺、管状肠、甲状腺和胰腺)中都有描述。患者可表现为副肿瘤综合征,如白细胞增多、发热、凝血功能障碍和副肿瘤症状。血清G-CSF、CRP和IL-6水平可能升高。组织学表现为低分化肝细胞癌伴有局灶性或广泛性肉瘤分化以及大量中性粒细胞浸润。尽管关于肝细胞癌这一罕见亚型的资料有限,但与常规肝细胞癌相比,其总体预后似乎较差。
7、透明细胞型肝细胞癌
尽管在许多肝细胞癌和任何亚型中都可见到透明细胞,但必须有超过80%的透明细胞才能被定义为透明细胞(CC)-HCC(图2F)。这些肿瘤的胞浆清除是由于糖元积聚,而轻微的脂肪变性混合也是可接受的。CC-HCCs通常为高中度分化,并显示出肝细胞标记物的强染。基于现有的数据,与常规肝细胞癌相比,这些肝细胞癌预后较好或最终相似。在病变见于非肝硬化或小活检标本的情况下,应考虑和排除来自其他透明细胞肿瘤的转移,如肾脏和妇科来源。
8、嗜铬型肝细胞癌
嗜铬型(C)-HCC由具有轻度核特征和嗜酸性细胞质组成,以及突起的小群肿瘤细胞伴有明显的核间变性。这种亚型与正常的端粒维持网络的破坏有关,从而导致端粒的替代延长,这可以通过端粒荧光原位杂交检测到。虽然细节尚不清楚,但C-HCC的预后似乎与常规肝细胞癌相似。
9、拟肝硬化型肝细胞癌
拟肝硬化(CM)-HCC,也称为弥漫性肝硬化样肝细胞癌,由于其特征在大体检查最易被鉴别,因此需要宏观相关性。肿瘤形成多个小结节(通常是>20),与肝硬化的背景结节密切混合。在移植时的标本或尸检标本上常能诊断出,常未被X线或临床发现。在影像学上没有肝细胞癌的情况下,CM-HCC偶尔可能通过由于医学原因而进行的肝活检中发现。大多数患者无或仅有轻微的AFP升高,个别肿瘤结节显示高或中度分化的肝细胞癌。尽管结节可能代表广泛的肝内转移,但研究表明,该实体中的结节是同步的多克隆肝细胞癌。基于有限的数据,与常规肝细胞癌相比,这些肿瘤经导管动脉化疗栓塞后的完全病理坏死率更低,移植后的总生存率也较低。
10、纤维结节型肝细胞癌
与CM-HCC相比,纤维结节(FN)-HCC是一种新的肝细胞癌亚型,其特征为广泛的纤维化将,单个肿瘤分为多个不同的结节(图2G ) 。与SC-HCC不同,FN-HCC在单个肿瘤巢或单个肿瘤细胞之间没有表现出明显的纤维化。FN-HCC在对比成像上呈明显的“爆米花”外观,切面呈结节样外观。与SC-HCC和常规肝细胞癌相比,该肿瘤已显示出与非肝硬化、早期BCLC分期、较低的疾病进展率和更长的进展时间的相关性。
11、合并肝细胞-胆管癌
合并肝细胞胆管癌(cHCC-CCA)是一种罕见的原发性肝癌。cHCC-CCA的诊断需要在同一肿瘤中明确存在肝细胞和胆管细胞分化(图2H),而在同一肝脏中单独发生的HCC和iCCA的碰撞不应包括其中。根据HCC-CCA命名国际共识,当同时存在HCC和CCA时,可以诊断为cHCC-CCA。共识组还包括“中间细胞癌”作为cHCC-CCA的一种形式,其中肿瘤细胞不显示典型的HCC或iCCA形态特征,但免疫表型在细胞水平上显示不同的肝细胞和胆管细胞标记物。此外,2019年WHO分类将胆管细胞癌与以前没有相关肝细胞癌成分时具有干细胞特征的cHCC-CCA分开,现在将其归类为iCCA。值得注意的是,cHCC-CCA的诊断应基于HE染色。IHC可用于确定形态学成分,但不能仅用IHC诊断。混合肝胆癌、双表型(肝胆)原发性肝癌、肝细胞合并胆管癌、双表型HCC、干细胞/祖细胞HCC等曾用术语应放弃,不推荐使用。尽管分子研究表明这些癌具有干细胞特征,但已知这些特征并非这些联合癌所独有。cHCC-CC的人口统计学和临床特征是高度可变的。与肝细胞癌相比,cHCC-CCA患者往往预后更差,与iCCA更相似。cHCC-CCA肝移植患者的预后和潜在的靶向治疗的作用尚不清楚。
肝细胞癌的形态学-分子分类
在过去的十年中,肝细胞癌的分子分类有了巨大的进展。癌症基因组图谱研究网络的结果显示TERT启动子、TP53和CTNNB1在70%以上的肝细胞癌中可见。法国分类小组进一步推进了这项工作,不仅提供了分子分类,还引入了基于组织学和分子相关性的形态学分类。根据增殖活性将肝细胞癌分为6组(G1-G3高、G4-G6低),其分子改变与形态学模式和亚型密切相关。CTNNB1突变的肝细胞癌显示出一种高分化形态,微小梁,胆汁淤积,没有炎症,核表达β-catenin和强弥漫性GS阳性。非CTNNB1,非TP53(低增殖)分类包括较小的肿瘤,生物学侵袭性较低,脂肪性肝形态丰富,由于JAK/STAT通路的改变而显示出更高水平的CRP染色。TP53突变的肝细胞癌与低分化/肉瘤形态和侵袭性生物学行为相关。此外,新的粗梁亚型也与TP53突变和FGF19扩增以及参与血管生成的基因(ANGPT2和VEGFA)的额外标志性突变密切相关。该研究还证实了硬化亚型与干细胞标记物的相关性,以及与TSC1/TSC2突变和PIK3/AKT通路上调的相关性。同样,之前的一项研究表明,粗梁/致密组织与YAP和EpCAM/KRT19突变相关,而BMP4突变与假腺形成相关。进一步研究表明,TERT启动子突变是癌变的早期事件,可能在肿瘤和癌前病变的起始和恶性转化中发挥作用,而TP53突变见于晚期肿瘤(特别是G3粗梁组)。在晚期肝细胞癌中,已经发现了许多潜在的靶向突变,特别是在AKT/mTOR、MET通路和配体扩增基因中,如VEGFA和FGF19。尽管多重分子标记在肝细胞癌中是常见的,但筛选出具有最大预后和治疗价值的基因组标记是很重要的。5-基因评分是根据这个概念开发的,以识别预测的分子特征。5-基因组(TAF9,RAMP3,HN1, KRT19和RAN)在鉴别G3期MT-HCC和非G3期预后差的肿瘤方面很有前景。事实上,KRT19与IHC的CK19表达有关,已被证明与较差的预后相关。
总结
肝细胞癌的分子谱分析开创了肝细胞肿瘤病理学的新时代。形态分子相关性研究已经能够鉴定与特异性分子改变相关的组织学特征。病理学的作用已经从单纯的诊断转向预测预后和对靶向治疗的反应。除了指导外科医生,病理学现在也在指导肿瘤学专家在这个精准医学时代治疗病人。病理学的作用将随着我们对其复杂基础的了解,发现更多肝细胞癌分子改变的形态学相关性而继续演变,从而为患者提供更好的个性化治疗。
点此下载原文献
原文:
[1]Vyas M, Zhang X.Hepatocellular Carcinoma: Role of Pathology in the Era of Precision Medicine. Clin Liver Dis. 2020 Nov;24(4):591-610. doi: 10.1016/j.cld.2020.07.010. Epub 2020 Sep 3.
往期回顾:
肝细胞癌:病理学在精准医学时代的作用(一)
















共0条评论