[导读] 译者:菜菜喵
要点:
肝细胞癌(HCC)的精确诊断需要临床、影像学和组织学相关联;
在诊断肝细胞癌时应谨慎使用辅助检查;
肝细胞癌的某些亚型具有影响预后和治疗的分子相关性。
引言
我们对肝细胞癌(HCC)的认识在过去的几十年里有所发展。近年来,人们已经发现了几种新的肝细胞癌组织学变异,并发现了新的潜在分子改变。虽然我们前期对肝细胞癌组织学特征的研究是基于晚期肝细胞癌,但随着对早期肝细胞癌和癌前病变的认识越来越深入,使我们能够得以改进形态学诊断。免疫组化(IHC)是用于肝细胞癌的常规诊断,我们已经学会在解释免疫组化染色时增加对潜在缺陷的警惕。分子检测有时用于诊断目的(例如,在纤维板层型肝癌中),但更多用于寻找靶向治疗的分子改变。辅助检查在预测免疫治疗反应方面的作用也在评估中。所有这些进展都推动了病理学从诊断到患者管理和个性化治疗的作用。
肝细胞癌的诊断
对病理医生来说,临床和影像学的知识对肝细胞癌的诊断是至关重要的。临床信息,特别是年龄,在提示某些诊断方面是非常有帮助的。危险因素的存在,如代谢紊乱、非酒精性脂肪性肝炎(NASH)和病毒性肝炎,增加了在病理标本中发现异常的可能性。同样,影像学也很重要。在许多情况下,当影像学检查诊断有价值时,活检不是诊断和治疗所必需的。然而,在影像学上存在非典型特征时,应通过活检来确定诊断。肝硬化肝活检对肝癌的诊断具有挑战性,不仅因为组织受限,而且存在癌前改变。尽管组织学诊断被认为是诊断肝细胞癌的金标准,但因其是有创的,因此不适于对患者进行密切的监测。液体活检或cfDNA的出现是非常有前景的,不仅可用于监测早期肝细胞病变,而且用于治疗监测、复发性疾病的检测和检测肿瘤分子谱的变化以及指导靶向治疗。人们已经尝试分析循环肿瘤细胞、microRNA、cfDNA突变基因(如RAS、TP53、CTNNB1和TERT)和DNA甲基化模式。在液体活检发现肝细胞癌监测和治疗的实时应用之前,尚需要大规模的研究。
1、癌前病变
根据影像学表现,作为“非典型”结节的样本,在组织学检查中可代表多种病变。不同程度的肝细胞异型性已在肝硬化中被确认。这些病变范围从再生结节到肝细胞癌,伴有一系列中间病变,包括异常增生灶和异常增生结节。肝细胞瘤的诊断依赖于对组织结构和细胞学异型性的鉴别。正常的肝细胞结构由中心为肝静脉的多边形肝细胞小叶和肝细胞排列在1-2个细胞厚度的放射状细胞板中,由窦道和均匀间隔的门管区分开。肝细胞板破坏、板增厚(>3个细胞核厚)、腺泡排列和正常门静脉结构缺失提示肿瘤。此外,肝细胞肿瘤表现出新血管生成的特征,即肝小叶的窦状动脉和小叶的未配对小动脉。肝细胞发育不全的概念是识别癌前病变的核心。细胞异型性/发育不全可表现为小细胞改变或大细胞改变。由于细胞体积较小,小细胞改变被看作是核聚集的焦点,轻度核多形性与较高的核浆(N:C)比。大细胞改变称为肝细胞和肝细胞核的增大,并伴有N:C比的保留,核多形性,高色素症,或有时为多核。大细胞改变常与肝细胞再生有关,研究表明小细胞改变是一种真正的具有较高恶性潜能的发育不良形式。
异常增生的病灶通常小于1mm,在再生结节中偶然发现,由于病灶太小无独立的影像学异常。这些是肝细胞发育不全的病灶,不能达到肿瘤的临界点。发育不全的性质可类似于异常增生结节、小或大细胞改变或局灶性无铁区。关于这些偶然发现的发育异常病灶是否报告,目前尚无共识。然而,在慢性病毒性肝炎的血色素沉着或小细胞改变时,局部无铁区的鉴定往往提示发展为肝细胞癌的可能性较高。
异型增生结节(DN)在肝硬化结节中具有显著的特征,其特征是不同的颜色、质地、大小或隆起的切面。DN的大小通常为5-15mm,但并不总是在肝硬化中检测到。国际肝细胞瘤共识小组(ICGHN)将肝硬化的结节性病变分为大再生结节(MRN)、低度异型增生结节(LGDN)和高度异型增生结节(HGDN)。由于结节周围的纤维组织,LGDN通常与周围的肝脏不同。它们显示出细胞密度的轻度增加(<1.3倍),缺乏细胞学异型性(小细胞改变),尽管它们可能显示出大细胞改变。它们可能显示出铁或铜的积累。有时可见非配对动脉,提示病变的克隆性。LGDN与MRNs很难区分。MRNs代表大于5mm的肝硬化结节,在影像学或大体检查中表现突出。镜下显示,无任何细胞学或结构异型性。虽然尚未达到可重复性和广泛接受的标准,但任何显示未配对动脉、细胞学或结构异型性大于正常肝脏,不足以诊断HGDN或HCC的结节都被认为是DN。
HGDNs表现出较高的细胞学异型性(通常以小细胞改变的形式)和细胞密度增加(1.3-2倍),但这些特征不足以诊断HCC。在HGDN中可见更多的新血管生成特征(部分窦状小动脉化和少数非配对小动脉)。在HGDN中可见轻度的结构异型性,如增厚的细胞板和罕见的腺泡。其他铁质沉着结节中的铁丢失灶也可能代表HGDN。有时在HGDN内出现较高的细胞异型性病灶,引起“结节中的结节”,很可能代表HCC起源于HGDN。门静脉束或纤维间隔的任何间质浸润均属诊断肝细胞癌的范畴,然而,这些特征在活检标本中可能不被重视。HGDN有较高的恶变风险,因此,这一诊断比MRN/LGDN更为重要。最近的遗传学和分子学数据表明,LGDN、HGDN、“结节中的结节”早期HCC和HCC是肝细胞癌发生的可能的顺序。
2、肝细胞癌
如前所述,如果存在典型特征,大于2cm的HCC可以仅影像学上进行诊断。这个2厘米的界限也被用于将肝癌分为小肝细胞癌(≤2cm)和常规肝细胞癌(>2cm)。根据形态学特征,小肝细胞癌被进一步分为早期(模糊结节性)肝细胞癌和进展期(明显结节性)肝细胞癌。早期肝细胞癌的形态学分化良好,呈模糊的结节状外观,无明确的纤维囊。早期肝细胞癌镜下可能显示间质浸润,但不显示血管浸润。可有一些门静脉束和非配对动脉发育不良。肝细胞密度至少是邻近正常肝脏的两倍。进展期肝细胞癌有明显的恶性特征,有明显的结节结构、破坏性或推动性生长,有时伴血管浸润。尽管认为进展期肝细胞癌起源于早期肝细胞癌,但也可能起源于新发或HGDN。尽管早期肝细胞癌的诊断具有预后意义,但由于组织学的原因很少能区分。
与成熟正常肝细胞相比,常规肝细胞癌(大于2cm)根据形态学可为高分化、中度或低分化。高分化和中度分化肝细胞癌的肿瘤细胞具有明显的肝细胞性质,表现出明显的细胞异型性、核多形性、肝索厚(>3细胞板厚)、假腺泡和网状纤维丢失。细胞可有嗜酸性,脂肪变性,或有时为透明的细胞质。可见多种肝细胞内包涵体,包括Mallory-Denk小体、胆汁、过碘酸-希夫(PAS)阳性嗜酸性球和苍白小体。肝细胞癌可能表现出一些细胞结构模式和形态学亚型,如本文后面所述。通常,肝硬化背景下高分化或中度分化的肝细胞癌通常不需要任何IHC染色来确认其肝细胞分化,但可能需要IHC标记物来区分良性和恶性结节。网状纤维染色也有助于显示小梁和网状蛋白的丢失。低分化的肝细胞癌可能表现出具有明显细胞多形性的小梁或实体生长模式,通常不需要IHC;然而,可能需要IHC来证明肝细胞谱系以及与其他低分化上皮样肿瘤的区别。
3、肝细胞癌病理诊断中的辅助检查
辅助检查,如免疫组化染色,常用于肝细胞病变的诊断性检查(表1)。辅助检查在诊断中的作用包括鉴别良恶性、确认肝细胞谱系以及为治疗/预后目的的伴随诊断。
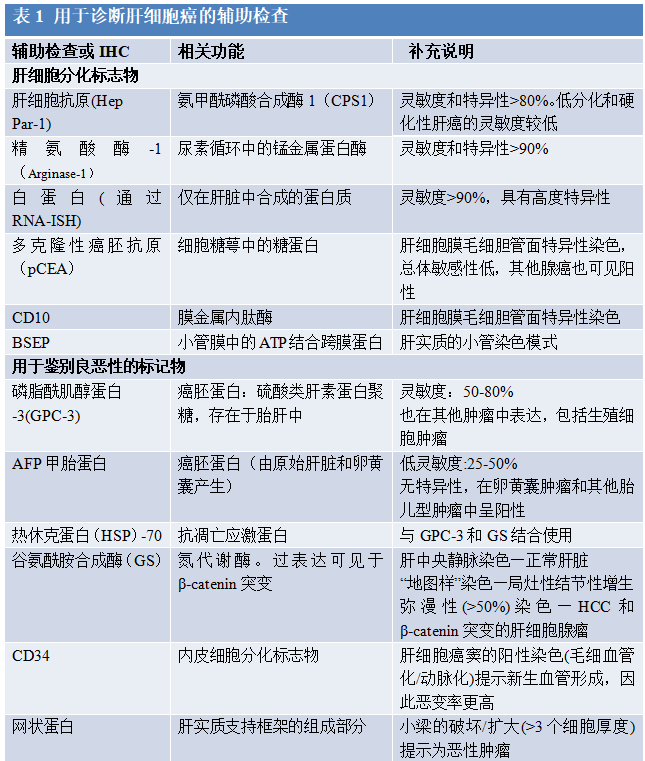
3.1 肝良恶性病变的鉴别
在某些病例中较难区分HDN和HCC,特别是在活检时。网状染色被认为是最有用的鉴别方法。尽管肝细胞板增厚或网状结构的缺失是可以诊断的,但这一特征在早期肝细胞癌中并不明显。尽管间质浸润是小肝细胞癌最可靠的特征,但并不总是明显的。在肝细胞癌中没有胆管反应,可以用CK7和/或CK19染色来突出显示,并有助于将其与MRNs和DNs区分开来。同样,新动脉形成可能是诊断肿瘤性肝细胞病变的一个有用的特征。CD34弥漫性内皮染色,表明窦状动脉的动脉化,提示肝细胞癌;然而,仅此特征可能不可靠,因为血管化有时可见于HDN、肝腺瘤甚至肝硬化结节。
3组免疫组化染色,即GPC3、谷氨酰胺合成酶(GS)和热休克蛋白70(HSP70),已被研究用来鉴别早期肝细胞癌和其他良性或发育异常的肝结节。GPC3是一种细胞表面硫酸肝素蛋白多糖,在肝细胞癌中以弥漫性胞质、膜性或高尔基体模式表达,但在正常肝脏或良性肝细胞病变如肝细胞腺瘤或局灶性结节性增生(FNH)中不表达。HSP70是一种抗细胞凋亡的应激蛋白,在细胞核和胞浆中表达。HSP70的表达在肝细胞癌中是上调的,因此可作为一种有用的标记物。GS是β-catenin的靶基因,不仅在β-catenin突变的肝细胞癌中,而且在肝腺瘤中也观察到其表达的增加。正常情况下,在非肿瘤性肝脏可观察到小静脉周围染色,因此,至少50%的肿瘤细胞的弥漫性染色是必要的。至少用3个标记物中的2个才能支持肝细胞癌的诊断;然而,3个标记物组合的灵敏度高达70%,特异性为100%。一些研究表明,通过添加第四种染色:网格蛋白重链,可以提高3个标志物(GPC3,GS和HSP70)的诊断准确性,特别是在小肝细胞癌的病例中。
3.2 确认肝细胞系
在高分化的肝细胞癌中,确认肝细胞表型通常不必要;然而,中度至低分化肝肿瘤的鉴别诊断是广泛的,包括许多表现出上皮样形态的肿瘤。在这种情况下有用的标记物是精氨酸酶、HepPar-1、多克隆癌胚抗原(pCEA)/CD10(管状型)、甲胎蛋白(AFP),以及最近的原位杂交(ISH)白蛋白RNA。
Aginase-1被认为是肝细胞分化最敏感和最特异性的标记物。它是一种参与尿素循环的酶,显示出具有可变核反应性的弥漫性细胞质染色。有趣的是,它在身体其他部位发现的肝样肿瘤中也呈阳性,或在胰腺、结肠直肠和乳腺来源的腺癌中也呈阳性。重要的是,在高分化的肝细胞癌亚型中它可以是阴性的。HepPar-1是一种识别氨基甲酰磷酸酶1(一种在尿素循环中的酶)的单克隆抗体。IHC染色通常表现为弥漫性胞质颗粒状染色。HepPar-1是诊断肝细胞癌的一个有用的标志物,在约80%的肝细胞癌中呈阳性。HepPar-1在低分化(50%–60%)和硬化亚型(20%–30%)肝癌中敏感性低。虽然大多数腺癌为阴性,但HepPar-1在肝类癌、食管癌、肺癌、胰腺癌、尿路上皮癌、肾上腺皮质癌、结直肠癌、十二指肠癌、前列腺癌和宫颈癌中均可呈阳性。多克隆CEA与胆道糖蛋白发生交叉反应,产生典型的管型,在80%-90%的高分化到中分化的肝癌中可见。然而,当小管或管腔染色微弱时,小管模式可被误解为腺癌,当小管染色强烈时,可与腺癌的管腔或膜性染色相混淆。在低分化的肝癌(25%-50%)和硬化肝癌(37%)中,pCEA的敏感性较低。CD10免疫组化显示与pCEA相似的小管染色模式。AFP,一种由肝脏产生的癌胚蛋白,是肝细胞分化的标志物,但其对肝细胞癌的敏感性低,为25%-50%,其染色呈斑片状,背景染色高。
白蛋白RNA原位杂交已被证明是肝细胞分化的高度敏感性标志物,敏感性接近100%。尽管敏感性高,但缺乏纯肝细胞来源的特异性,可以表达于表现为肝细胞分化的肿瘤,如各种类型的肝样癌器官,肝内胆管癌(iCCA),卵黄囊肿瘤,腺泡细胞癌,肺癌,胆囊癌,胰腺癌,乳腺癌。
3.3 用于治疗/预后目的的伴随诊断
与其他部位的肿瘤一样,对治疗药物反应的生物标志物的预测引起了对伴随诊断途径的探索。尽管微卫星不稳定性(MSI)状态被认为是所有实体瘤免疫治疗反应的预测因子,但越来越多的人关注评估DNA错配修复蛋白IHC作为预测治疗反应的替代物。此外,对PD-L1的免疫组化也正在为此而进行评估。对肿瘤突变负荷和肝细胞癌下一代测序的大规模研究表明,MSI不是肝细胞癌的标志,仅在3%的肝细胞癌中观察到。PD-L1 IHC在多个器官系统中被用作对免疫检查点阻断反应的预测因子;然而,在肝细胞癌中并没有表现出很大的前景。研究表明,富含淋巴细胞的肝细胞癌亚型显示出高表达PD-L1的炎症细胞,这可能为受益于免疫检查点阻断的潜在候选者。
另一个有希望的潜在治疗靶点是GPC3。一种新的抗GPC3抗体,codrituzumab,显示出良好的结果,通过IHC在肿瘤细胞上的表达可以作为预测治疗反应的生物标志物。这一应用不仅在肝细胞癌的治疗中受到关注,而且在其他GPC-3表达肿瘤,尤其是儿童胚胎肿瘤的治疗中受到关注。CK19的表达与侵袭性相关,而CK19和glypican-3的双重表达与较差的预后相关。
——未完待续——
点此下载原文献














共0条评论