导读
肺神经内分泌癌,是起源于支气管黏膜 kulchitgky(一种嗜银细胞)细胞肿瘤。它拥有独立的组织学、超微结构、免疫组化和分子生物学特征。2022年6月27日,美国马萨诸塞州波士顿布莱根医院病理科Jessica F Williams教授和Marina Vivero教授,在病理学知名期刊《Histopathology》上发表题为“Diagnostic criteria and evolving molecular characterisationof pulmonary neuroendocrine carcinomas”的综述性文章,详尽阐述了肺神经内分泌癌临床病理特点及分子遗传学改变。下面笔者将这篇综述全文编译如下,供相关医师参考。

摘要
目前,肺神经内分泌癌分为两类:小细胞肺癌和大细胞神经内分泌癌。小细胞和大细胞神经内分泌癌的诊断标准,仅基于肿瘤形态。然而,这两种癌症之间,组织学和免疫表型特征重叠,可能会使它们的分类诊断具有挑战性。肺神经内分泌癌的准确诊断,对于患者管理至关重要,且小细胞和大细胞神经内分泌癌的治疗方法不同。过去十年发表的分子遗传学、转录组学和蛋白质组学数据表明,小细胞和大细胞神经内分泌癌是包含多组独特特征的恶性肿瘤。小细胞肺癌的亚型,对不同化疗方案易感性具有差别性。大细胞神经内分泌癌中的靶向突变数据表明,辅助分子和蛋白质表达测试,可以指导神经内分泌癌的分类和治疗。本综述总结了当前的诊断标准、分类的预后指标,以及未被识别的小细胞和大细胞神经内分泌癌亚型。
简介
在世界卫生组织(WHO)胸部肿瘤分类(第5版)中,将肺神经内分泌肿瘤(NEN)分为四种类型:典型和非典型类癌(分别被视为低级别和中级别)、大细胞神经内分泌癌 (LCNEC)和小细胞肺癌(SCLC)。后两种肿瘤,被认为是高级别神经内分泌癌 (NEC),与类癌相比,具有不同的致癌分子改变、具有侵袭性的临床过程和较差的预后。在类癌和NEC中,都具有神经内分泌形态和神经内分泌标志物的表达。NEC的低级别和中级别神经内分泌肿瘤,以及LCNEC和SCLC之间的区别,取决于组织形态学特征的识别。NEC的准确诊断,对于预后和治疗指导都至关重要,因为NEC的治疗,不仅取决于临床分期,还取决于特定的肿瘤类型。了解诊断的临床意义、当前的病理分类,对疾病的治疗具有指导意义。
高级别神经内分泌癌的临床特征和治疗
小细胞癌是最常见的肺神经内分泌肿瘤类型,占所有原发性肺癌的15-20%,5年总生存率极差。SCLC 主要发生在有吸烟史的老年男性中,通常位于肺的中心部位,发现即晚期,通常使其在诊断时无法切除。一部分SCLC与非小细胞癌(腺癌、鳞状细胞癌、肉瘤样癌或LCNEC)混合存在。在EGFR突变的肺腺癌中, 3-14%的病例,可转化为SCLC,这些病例对酪氨酸激酶抑制剂治疗具有耐药性。由EGFR突变腺癌转化而来的SCLC遵循与新发SCLC相似的临床治疗方法。相比之下,LCNEC很少见,仅占所有原发性肺癌的2-3%,并且其侵袭性较SCLC较弱,平均5年总生存率约为35%。LCNEC通常也发生在老年男性吸烟者中,但主要发生在外周肺,手术切除是早期LCNEC的治疗方式。
LCNEC的治疗与SCLC的治疗显著不同。早期LCNEC可通过手术切除,但是辅助化疗的作用仍然存在争议。无法接受手术的早期患者,放化疗为主要治疗方法,但由于数据有限且相互矛盾,放射治疗在LCNEC 中的作用尚不清楚。基于有限的证据,目前全身化疗(铂类)和放疗,是指南推荐的治疗局部晚期、不可切除(III期)LCNEC方法。全身化疗(铂类)和放疗普遍用于转移性(IV期)LCNEC,NCCN指南建议使用基于铂和拓扑异构酶抑制剂(例如依托泊苷)联合化疗方案。无论如何,接受化疗的晚期LCNEC患者,临床预后很差,中位总生存期仅为8-12个月。与其他NSCLC相比,因为没有相应的临床试验数据及相关指南,免疫治疗和靶向治疗对LCNEC的作用尚未确定。
另一方面,SCLC的治疗方案还取决于临床分期。对于局限期SCLC,标准治疗包括全身化疗(顺铂加依托泊苷)和同步放疗。临床I-IIA期SCLC患者,可考虑肺叶切除术(全身治疗前),但是,早期SCLC的诊断率较低。根据多个临床试验的数据显示,在广泛转移的SCLC患者中,使用卡铂和依托泊苷的组合治疗,然后进行维持性抗PD-L1治疗(atezolizumab或durvalumab),可小幅提高患者的中位总生存期。
诊断标准和组织病理学分类
SCLC和LCNEC的组织学诊断标准重叠,两者之间的区别基于肿瘤细胞形态学。1根据定义,SCLC和 LCNEC的有丝分裂指数均大于10个/2mm2,并且显示出明显的肿瘤坏死。小细胞癌的特征是细胞体积小,细胞直径小于三个静息淋巴细胞的直径,染色质细颗粒,细胞质极少(图 1A)。核仁不存在或不明显。细胞形状可以是圆形、卵形、纺锤形或角形。多达四分之一的SCLC被描述为与非小细胞癌(“合并”SCLC)共存;任何数量的非小细胞、LCNEC成分都可以与SCLC混合,形成联合SCLC,而肿瘤必须至少存在10%的 LCNEC成分才能成为联合SCLC-LCNEC。诊断除了需要非小细胞细胞学特点,还具有以下一种或几种神经内分泌肿瘤特点:类器官或小梁生长模式、肿瘤巢中的外周栅栏和玫瑰花结(图 2A、B)。LCNEC细胞比SCLC 大,细胞质中等至丰富,染色质模式粗糙,核仁明显不同。

图1.小细胞癌的形态学和免疫表型。(A)小细胞癌:核成型、有丝分裂图和凋亡碎片(400×)。(B)胰岛素瘤相关蛋白1(INSM1)免疫染色显示,肿瘤细胞中弥漫性核染色(200×)。(C)Ki-67免疫染色,>90%的细胞核染色阳性(200×)。(D)RB免疫染色显示核蛋白表达缺失(200×)。
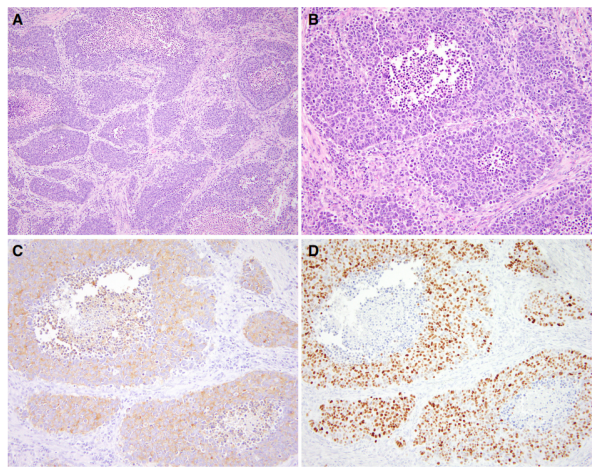
图2.大细胞神经内分泌癌的形态学和免疫组化。(A)特征性中央肿瘤坏死的大细胞神经内分泌癌(100×)。(B)大细胞神经内分泌癌 (200×)。(C)突触素免疫染色(200×)。(D)INSM1免疫染色显示肿瘤细胞中弥漫性核染色(200×)。
细胞大小、细胞核/细胞质比、细胞核成型和核仁突出,是SCLC和LCNEC之间最可靠的区分要点。光学显微镜显示,SCLC和LCNEC之间的细胞大小有一些重叠;然而,SCLC显示出更多的嗜酸性细胞质,和分散的多形性细胞。因此,肺神经内分泌肿瘤分类具有争议性,其中,焦点是SCLC和LCNEC分类之间的分歧。因此,有学者提议,将SCLC和LCNEC合并为“高级别神经内分泌癌”,但这在日常临床实践中具有局限性,因为SCLC和LCNEC的治疗方式不同。有一些证据表明,使用免疫组织化学方法,包括细胞增殖标志物 Ki-67 ,来区分类癌和NEC,可以消除形态学观察的变异性带来的影响。
被命名为LCNEC的肿瘤子集表现出类癌形态,可能代表细胞增殖升高的类癌,仅凭借有丝分裂指数大于10/2mm2,就可归于LCNEC类别(图 3A-D)。越来越多的研究表明,类癌肿瘤的增殖能力、临床行为和分子改变比,传统上定义的“类癌”范围更广。类癌LCNEC与常规NEC之间的生物学行为、潜在致癌过程以及关系尚未完全阐明,值得进一步研究。
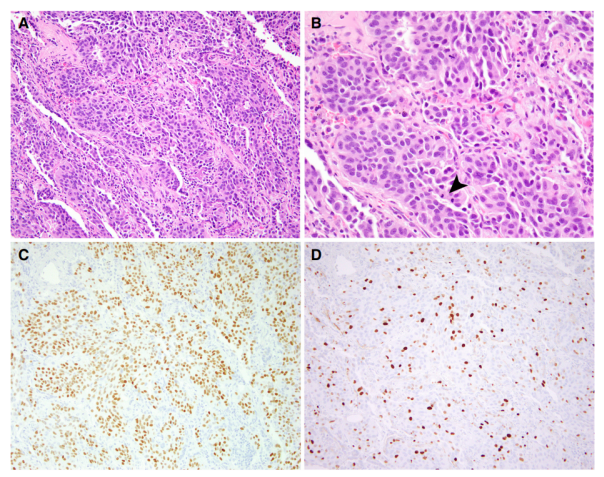
图3.具有类癌形态的大细胞神经内分泌癌。(A)具有类癌形态的大细胞神经内分泌癌(200×)。(B)类癌瘤的单形性、低级别形态特征,有丝分裂增加(箭头表示有丝分裂;400×)。(C)INSM1免疫染色显示肿瘤细胞中弥漫性核染色 (200×)。(D)Ki-67免疫染色显示Ki-67增殖指数升高 (200×)。
诊断性神经内分泌标志物
免疫组织化学是NEC形态学评估的有用辅助手段。根据定义,LCNEC必须表达至少一种神经内分泌标志物,尽管5-10%的SCLC,对所有三种传统的神经内分泌标志物均为阴性,但大多数可见标志物表达。EGFR突变腺癌转化而来的SCLC,以及联合SCLC的SCLC成分,均显示出与原发性SCLC相似的免疫组织化学特征。图4 -6显示,联合SCLC与非小细胞成分具有一些共同的免疫组化特征;然而,在其中,只有SCLC成分通常会显示神经内分泌标志物阳性。因此,免疫组织化学的使用,为大多数NEC提供了科学参考,并提高了诊断一致性。传统的神经内分泌标志物,包括CD56/NCAM、突触素和嗜铬粒蛋白A,所有标志物都具有一系列的敏感性和特异性(表 1)。胰岛素瘤相关蛋白1(INSM1)已成为一种高度敏感和特异的神经内分泌分化核标志物,具有96%以上的敏感性和99%的特异性,一些学者建议,将其用作独立的标记(表 1,图 1B和2D)。然而,一些非神经内分泌肿瘤,可以表达INSM1,因此诊断必须结合其它免疫组化结果。
表1.大细胞神经内分泌癌和小细胞肺癌中神经内分泌免疫组化标志物表达
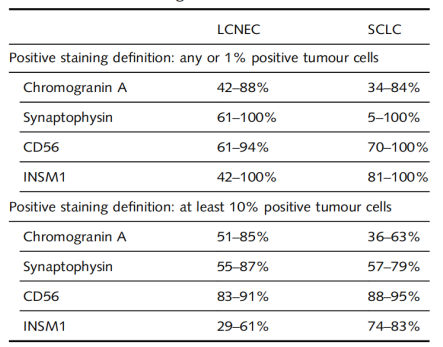
神经内分泌免疫组化标志物,可能在一些非神经内分泌肿瘤中表达。因此它们的诊断效用,特别是在考虑诊断LCNEC时,尤其是在存在神经内分泌形态时才需要。三分之一的NSCLC表达至少一种神经内分泌标志物,尽管在NSCLC中,存在神经内分泌分化,并不一定表示会转化为神经内分泌表型,这在小活检样本,是一个重要的考虑因素,因此不建议在小活检或细胞学标本中对LCNEC进行明确分类。如果在这种情况下,LCNEC是一个诊断考虑因素,对此,目前的指南建议使用“具有神经内分泌形态和阳性神经内分泌标志物的非小细胞癌,可能是大细胞神经内分泌癌”这一诊断术语。在小活检中,用于区分NEC和低级别NEN的潜在免疫组织化学标志物是RB,由于潜在的RB1基因改变导致核表达丧失,(图 1D)它在大多数SCLC和大约一半的LCNEC中表达阴性,然而,在类癌中呈阳性表达。
可用于区分NEC与其他胸部和胸外非神经内分泌肿瘤的免疫组织化学染色因子,包括①甲状腺转录因子-1(TTF-1)—在约50%的LCNEC和80%的SCLC中呈阳性,②NSCLC的细胞角蛋白和标志物,例如Napsin A和 p40或p63。然而,Napsin A在15%的LCNEC中表达,转录因子如p40可能在大约三分之一的SCLC中集中表达(高达10%的细胞);因此NSCLC染色对于区分NEC和NSCLC并不完全特异。
Ki-67免疫组化在神经内分泌癌分类中的作用
SCLC和LCNEC均表现出高Ki-67/MIB-1增殖指数,通常大于50%(图 1C)。 Ki-67表达在小活检和切除标本之间,具有良好的一致性,有助于区分小活检或细胞学标本中的类癌和NEC。然而,Ki-67增殖指数不是肺神经内分泌肿瘤的既定诊断标准,不能区分SCLC和LCNEC。然而,目前的2021年WHO诊断指南以及多个国家的临床学会指南,均建议将Ki-67免疫组织化学作为形态学评估的辅助手段,以提供有关潜在肿瘤行为的更多信息并指导特定病例的诊断。据一些研究发现,Ki-67表达范围,在SCLC和LCNEC之间有相当大的重叠,关于其在预后意义的研究很少。一项对159例广泛转移的SCLC患者研究显示,Ki-67增殖指数范围很广,从20%到99%不等,Ki-67增殖指数与预后之间,没有发现具有统计学意义的关联。一些较小的研究同样未能发现Ki-67与SCLC患者的生存率之间的关联。相比之下,评估Ki-67指数在LCNEC中的重要性的研究产生了不同的结果,但尚未确定Ki-67的预后作用。
预测性免疫组织化学
预测性ALK、ROS1和PD-L1免疫组织化学测定的应用,已成为NSCLC患者的治疗标准,但在肺神经内分泌肿瘤中,不常规推荐使用。在众多的临床实验中,没有显示在NEC中,ALK、ROS1或RET重排具有治疗或者预后价值。尽管在一些病例报道中显示,LCNEC和SCLC中的ALK重排患者,对酪氨酸激酶抑制剂治疗敏感。然而,鉴于应用LCNEC诊断标准的挑战,以及在小活检样本中无肿瘤成分的可能性,对于ALK重排的检测,应持有谨慎态度。LCNEC、SCLC中的PD-L1表达不如NSCLC中常见,但报告的阳性率因研究而异,很大原因是抗体克隆和指定为阳性的阈值不同。尽管免疫疗法似乎可以使少数晚期LCNEC和SCLC患者受益,但这种效果并不能通过PD-L1状态或肿瘤突变负荷来预测。因此,在NEC中,不建议进行PD-L1免疫组化。
高级别神经内分泌癌的分子特征
与肺类癌相比,LCNEC和SCLC都具有相对较高的突变负担,其主要特征是TP53和RB1基因的有突变,以及参与细胞周期进程的基因扩增。虽然这些遗传改变,可能对LCNEC和SCLC都具有共同性,但两种肿瘤类型都具有独特的基因组和转录组学特征,这表明未来可能会采用个体化方法,来区别治疗NEC患者。
——未完待续——
点击下载原文献


















共0条评论