[导读] 编译整理:强子
卵黄囊瘤
卵黄囊瘤是第二常见的恶性生殖细胞肿瘤。尽管该肿瘤发病年龄宽泛,7岁至86岁均有报道,但大部分患者较为年轻,年龄中位数19岁。对于50岁以上女性来说,卵黄囊瘤一般是混合性生殖细胞肿瘤中的组成部分,罕见表现为单纯性卵黄囊瘤。其临床表现一般是快速生长的肿物所致,三分之一的患者确诊时就已有卵巢外病变。
卵黄囊瘤一般为单侧性,外表面光滑。切面质软,黄色或灰色,伴坏死及出血。该肿瘤一般非常大,中位数为15cm。呈多泡卵黄囊型(polyvesicular-vitelline)表现的卵黄囊瘤大体可能会有蜂窝状表现。
卵黄囊瘤的组织学表现变化多样,最常见为微囊型/网状结构。这种表现为相互沟通的小腔隙形成疏松网状,衬覆胞质嗜酸性、原始表现的肿瘤细胞。部分病例中,瘤细胞可呈扁平表现。因此貌似形态温和。瘤细胞的染色质不规则,核仁显著,常见核分裂。
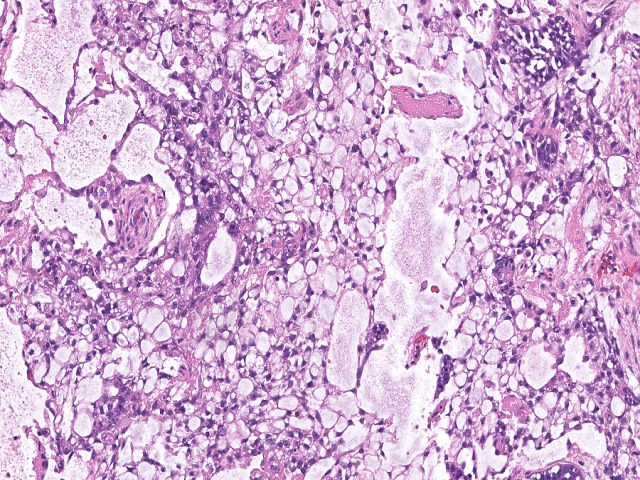
图1. 呈微囊型/网状结构的卵黄囊瘤。
卵黄囊瘤中的乳头状结构有时可伴Schiller-Duval小体,但后者并非诊断所必需。卵黄囊瘤中还可有大量PAS阳性、淀粉酶消化后PAS仍有着色的细胞内及细胞外透明小球。实性结构的卵黄囊瘤则表现为瘤细胞呈片状、无囊腔或腺体形成;这一结构的卵黄囊瘤可非常类似透明细胞癌、无性细胞瘤、胚胎性癌。卵黄囊瘤中的腺样结构则会出现核上及核下空泡,形成琴键样表现。肝样结构的卵黄囊瘤细胞为多边形大细胞,伴大量嗜酸性胞质,类似肝细胞。多泡卵黄囊型则表现为衬覆扁平、柱状、立方状细胞的囊腔,周围有大量间质。还需提一句的是伴体细胞性肿瘤的卵黄囊瘤,这种情况一般发生于绝经后女性,可见伴子宫内膜样癌、高级别浆液性癌、透明细胞癌、癌肉瘤。
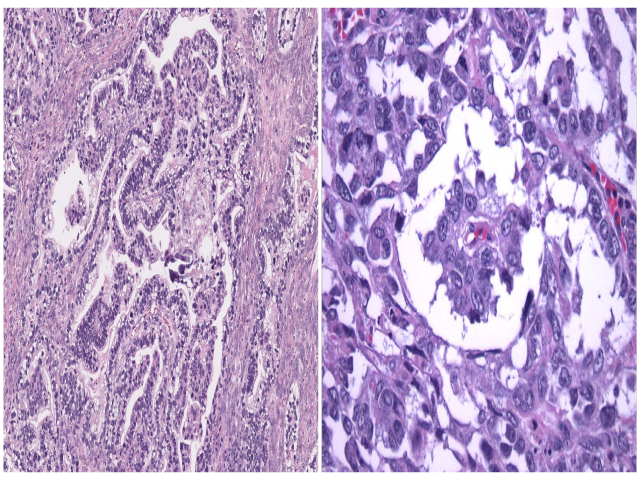
图2. (左)卵黄囊瘤中的乳头状结构;(右)卵黄囊瘤中的Schiller-Duval小体。
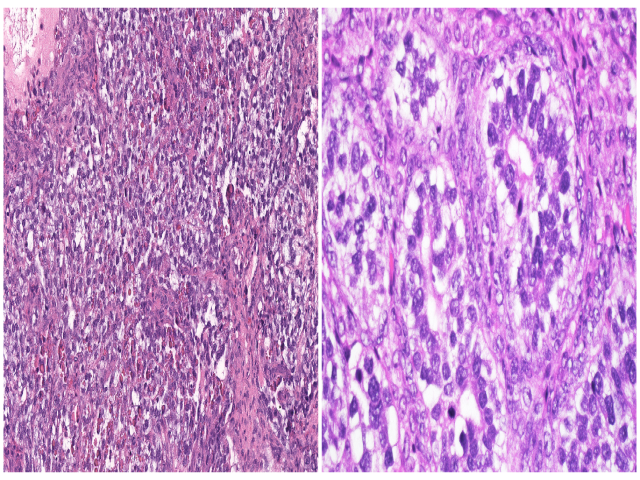
图3. (左)呈实性表现的卵黄囊瘤,伴大量透明小球;(右)呈腺样结构的卵黄囊瘤,核上及核下空泡导致呈琴键样表现。
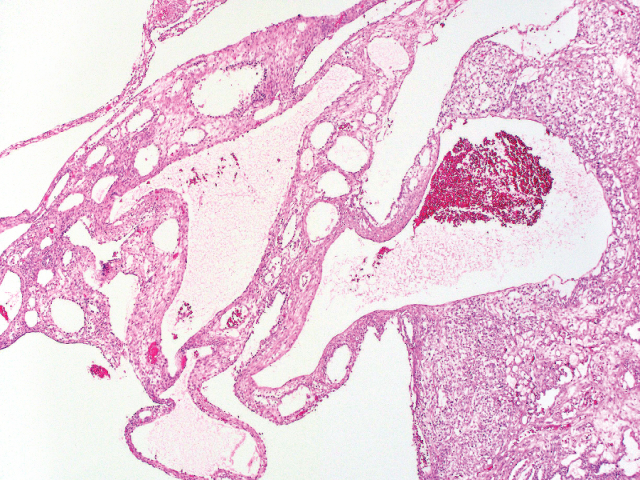
图4. 卵黄囊瘤中的多泡卵黄囊型表现,为衬覆扁平、柱状或立方状细胞的囊腔,周围有大量间质。
一般需要一组免疫组化标记来确诊卵黄囊瘤。基本所有生殖细胞肿瘤都表达SALL4,卵黄囊瘤也不例外,且是和癌鉴别时的最佳筛选标记。卵黄囊瘤中广谱CK为弥漫阳性,而CK7和EMA基本为阴性,或仅局灶阳性。
卵黄囊瘤中,glypican-3和AFP可为阳性,但glypican-3并不是非常特异,在透明细胞癌也可阳性;而AFP尽管相对特异,但其敏感性却低至60%。腺样卵黄囊瘤表达CDX2和villin,对于明确诊断非常有帮助,尤其和SALL4联合应用的情况下。此外,卵黄囊瘤中一般不表达PAX-8及激素受体。
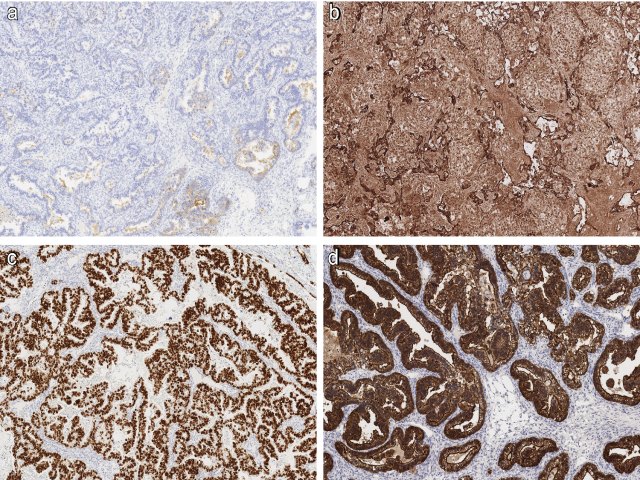
图5. 卵黄囊瘤免疫组化,AFP可局灶(A)或弥漫(B)阳性,CDX2(C)和villin(D)阳性。
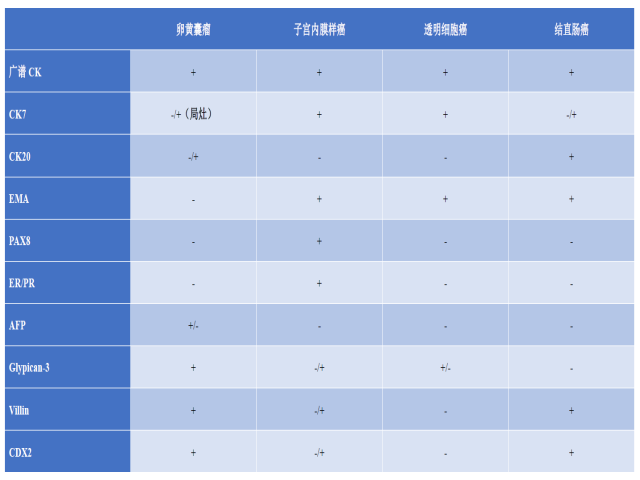
卵黄囊瘤需鉴别其他生殖细胞肿瘤或癌。从临床的角度来说,年龄轻、血清AFP水平高,有助于指导组织学诊断。更具挑战性的问题是卵黄囊瘤混有体细胞性肿瘤、或发生于年龄较大患者时。生殖细胞肿瘤与癌鉴别诊断的免疫组化指标,详见表2。腺样亚型卵黄囊瘤可类似子宫内膜样癌,但后者免疫组化表达PAX-8、ER和PR,不表达SALL4,这与卵黄囊瘤是相反的。透明细胞癌和卵黄囊瘤均可有实性及乳头状结构,但玻璃样变的纤维血管轴心、管状-囊性结构、无不成熟染色质及显著核仁,都多见于透明细胞癌。CK7弥漫阳性、PAX-8及napsin-A阳性,且SALL4阴性,支持透明细胞癌的诊断。
表2. 卵黄囊瘤与某些癌鉴别诊断时的免疫组化标记
需要注意的是,卵黄囊瘤是性腺外生殖细胞肿瘤中的最常见类型。了解有这种类型的病变,且有前述组织学特征(如伴核上及核下空泡的腺体、瘤细胞胞质透明、染色质不成熟)时高度警惕,才能更好的诊断出该肿瘤。考虑卵黄囊瘤时,进行前述免疫组化标记可做出明确诊断。不过,卵黄囊瘤与结肠腺癌鉴别时,一定要记得卵黄囊瘤会表达CDX2及villin,尤其有显著腺样结构的情况下。卵黄囊瘤与其他类型生殖细胞肿瘤的鉴别,详见无性细胞瘤和胚胎性癌部分。
卵黄囊瘤患者的5年生存率与肿瘤分期有关。I期和II期的5年生存率分别为96%、75%,但III期和IV期则显著降低至30%、20%。伴显著多泡卵黄囊结构的病例似乎生物学行为更加惰性。对于体细胞来源卵黄囊瘤,建议进行铂类为主的化疗,因为该组肿瘤对恶性生殖细胞肿瘤的标准化疗方案效果欠佳。
——未完待续——
往期回顾:
卵巢生殖细胞肿瘤简述(一)
卵巢生殖细胞肿瘤简述(二)
卵巢生殖细胞肿瘤简述(三)
卵巢生殖细胞肿瘤简述(四)



















共0条评论